Аритмии
Взаимодействие лекарственных средств в кардиологии
Зав. кафедрой клинической фармакологии и фармакотерапии Государственного учреждения "Крымский государственный медицинский университет им. С.И.Георгиевского", кандидат медицинских наук, доцент Коняева Елена Ивановна
На сегодняшний день в клинической практике широко распространено комбинированное применение лекарственных средств (ЛС), что связано с наличием у больного нескольких заболеваний и (или) недостаточной эффективностью ЛС в виде монотерапии. При комбинированной терапии может возникать взаимодействие ЛС. Взаимодействие, приводящее к повышению эффективности и безопасности фармакотерапии, лежит в основе рационального комбинирования ЛС. О нерациональных комбинациях ЛС говорят в случае, когда взаимодействие ЛС приводит и к снижению эффективности фармакотерапии. В основе потенциально опасных комбинаций ЛС лежат их взаимодействия, приводящие к снижению безопасности фармакотерапии.
Потенциально опасные комбинации лекарственных средств являются серьезной клинической проблемой. По данным разных авторов, от 17 до 23 % назначаемых врачами комбинаций ЛС являются потенциально опасными. Вместе с тем лишь у 6-8 % больных, получающих потенциально опасные комбинации ЛС, развиваются нежелательные лекарственные реакции. Однако только в США от нежелательных лекарственных реакций ежегодно умирают 160 тысяч больных, причинами смерти 30 % из них являются взаимодействия ЛС. Кроме того, нежелательные лекарственные реакции, возникающие при применении потенциально опасных комбинаций, также представляют собой серьезную экономическую проблему, так как расходы на их лечение составляют половину от затрат на терапию всех лекарственных осложнений.
Полифармация имеет место примерно у 56 % пациентов в возрасте до 65 лет и у 73 % пациентов старше 65 лет. Прием двух лекарственных препаратов приводит к их взаимодействию лишь у 6 % пациентов. Однако назначение 5 препаратов, что давно не редкость в современной кардиологии, повышает частоту лекарственных взаимодействий до 50 %. Неудивительно, что одновременный прием 10 лекарств не может не привести к возникновению реакций между ними (100 % пациентов!).
Два основных механизма, которые лежат в основе большинства лекарственных взаимодействий, — изменение фармакодинамики и изменение фармакокинетики препаратов. О фармакодинамическом взаимодействии речь идет в тех случаях, когда изменение эффекта препарата не связано с изменением концентрации лекарственного вещества на рецепторах-мишенях.
Только за последние несколько лет FDA сняло с регистрации четыре ЛС по причине их потенциально опасных взаимодействий с другими ЛС, приводивших к серьезным нежелательным лекарственным реакциям, в том числе и к летальным исходам.
Лекарственные средства, снятые с регистрации FDA из-за опасного взаимодействия

Все эти взаимодействия были фармакокинетическими. Поэтому общепринято, что наиболее важным видом взаимодействия ЛС является именно фармакокинетическое. Фармакокинетическое взаимодействие осуществляется путем изменения процессов всасывания, распределения, биотрансформации и выведения одного ЛС под действием другого. В результате изменяется концентрация ЛС в плазме крови, а следовательно, и на «молекулах-мишенях», изменяется при этом и фармакологический ответ.
Согласно современным представлениям, «точками приложения» фармакокинетического взаимодействия ЛС являются различные белковые структуры:
— ферменты метаболизма ЛС, участвующие в их биотрансформации, наибольшее значение из которых имеют изоферменты цитохрома Р-450;
— транспортеры ЛС, участвующие в процессах их всасывания, распределения и выведения, наиболее хорошо изученным из которых является гликопротеин Р.
Доклиническое и клиническое изучение фармакокинетического взаимодействия ЛС на уровне ферментов биотрансформации и транспортеров позволит прогнозировать потенциально опасные и нерациональные комбинации ЛС и таким образом повысит эффективность и безопасность их применения в клинической практике.
Фармакокинетическое взаимодействие подразумевает изменение концентрации одного препарата под действием другого. Именно этот механизм ответственен за большинство нежелательных лекарственных взаимодействий. Наиболее частой причиной изменения концентрации лекарственного вещества является изменение скорости его выведения из организма. Изменение элиминации лекарства может означать как замедление его выведения (концентрация препарата соответственно повышается, терапевтические и нежелательные эффекты препарата усиливаются), так и, напротив, ускорение метаболизма, в результате чего концентрация препарата и его действие уменьшаются. Более редкой причиной изменения концентрации препарата может быть изменение абсорбции препарата и его распределения в организме.
Следовательно, действие лекарственного препарата в большой степени зависит от его метаболизма и транспорта. В целом метаболизм большинства препаратов можно разделить на две фазы. Фаза 1 (окисление или восстановление) заключается в изменении молекулы лекарственного препарата, а фаза 2 (конъюгация) – в добавлении к молекуле препарата другой молекулы. Окисление препаратов ферментами системы цитохрома Р-450 является хорошо изученным процессом, ответственным за метаболизм и элиминацию большинства лекарственных средств.
Семейство цитохромов Р-450
Цитохром Р-450 – семейство ферментов, осуществляющих окислительную биотрансформацию лекарственных препаратов и ряда других эндогенных биоорганических веществ и, таким образом, выполняющих дезинтоксикационную функцию. Цитохром Р-450 представляет комплекс белка с гемом (металлопротеином), при этом гем обеспечивает присоединение кислорода. Цитохром Р-450 имеет несколько изоферментов, номенклатура которых определяется сходством аминокислотных последовательностей. Основными ферментами являются: CYP1A2, CYP2C9, CYP2C19, CYP2E1, CYP3A4 (Meyer U.A. 1996).
Биохимическим смыслом реакций, катализируемых ферментами семейства цитохрома Р-450, является увеличение полярности субстратов с целью облегчения их выведения. Метаболиты обладают пониженной способностью связываться с рецептором клетки-мишени и повышенной экскрецией почками, что означает прекращение эффекта препарата.
Существуют значительные отличия в механизмах лекарственных взаимодействий, опосредованных различными ферментами, семейства цитохрома Р-450 (Mihalets E.L. 1998). Эти отличия касаются в первую очередь субстратов лекарственных взаимодействий, опосредованных различными ферментами, т.е. лекарственных препаратов, действие которых меняется на фоне приема веществ, повышающих или понижающих активность разных групп цитохромов. Связано это с тем, что разные лекарственные препараты метаболизируются разными группами цитохромов.
Кроме того, необходимо отметить, что не все группы цитохромов одинаково подвержены воздействию индукторов или ингибиторов. Так, известно довольно много ингибиторов активности цитохрома CYP3A4, в то время как цитохром CYP2D6 считается неиндуцибельным.
Цитохром CYP3A4 – один из наиболее важных в организме человека. Около 60 % подвергающихся окислению лекарственных препаратов проходит биотрансформацию с участием этой ферментной системы.
Цитохром CYP3A4 локализуется в апикальной части энтероцитов тонкой кишки и гепатоцитов. Биотрансформация лекарственных препаратов и других веществ, поступающих в организм с пищей, осуществляется этим цитохромом до того, как препарат поступает в системный кровоток и реализует свое действие. Этот эффект получил название пресистемного метаболизма или метаболизма первого прохождения.
Типичным примером препарата с высоким пресистемным метаболизмом является блокатор кальциевых каналов (БКК) фелодипин полностью всасывается из кишечного тракта, он подвергается пресистемному метаболизму в энтероцитах и гепатоцитах с участием цитохрома Р-450. При этом только 15 % препарата поступает в кровоток и осуществляет его эффект.
Биодоступность и лекарственные взаимодействия
Биодоступность – доля активного вещества (процент от всей дозы), достигающая системного кровотока в неизменном виде и обеспечивающая эффект препарата. Для фелодипина биодоступность при приеме внутрь составляет всего 15 %.
Важно помнить, что если препарат имеет низкую биодоступность при приеме внутрь по причине высокого пресистемного метаболизма, это означает, что сопутствующее назначение лекарственных средств или других веществ, влияющих на пресистемный метаболизм (т.е. являющихся его индукторами или ингибиторами),может значительно изменить его биодоступность и соответственно его действие и нежелательные эффекты. Ингибиторы цитохрома CYP3A4 могут резко увеличить биодоступность препарата, повысить его концентрацию в крови и, таким образом, усилить эффект, что иногда сопоставимо с острой передозировкой.
И, напротив, лекарственный препарат с высокой биодоступностью при приеме внутрь будет менее подвержен риску подобного взаимодействия, поскольку его концентрация в крови в обычных условиях близка к максимальной. Хотя и у таких препаратов могут развиться лекарственные взаимодействия, например в результате уменьшения печеночной элиминации из организма вследствие длительного параллельного назначения ингибитора CYP3A4.
Только назначение лекарственного препарата внутривенно, обеспечивающее 100 % биодоступность, полностью решает эту проблему.
Лекарственные взаимодействия с участием цитохрома CYP3A4
Субстраты. биодоступность <10 % (ловастатин, симвастатин), биодоступность 10-30 % (аторвастатин, фелодипин), биодоступность 30-70 % (амиодарон, карбамазепин, диазепам, лозартан, дилтиазем, нифедипин, силденафил), биодоступность >70 % (амлодипин, дексаметазон, хинидин).
Индукторы. карбамазепин, дексаметазон, фенобарбитал, фенитоин, рифамицин.
Ингибиторы. амиодарон, кларитромицин, циклоспорин, эритромицин, ингибиторы ВИЧ-протеазы, кетоконазол.
Одним из наиболее опасных последствий нежелательных лекарственных взаимодействий может быть жизнеугрожающая желудочковая аритмия, известная под названием torsade de pointes («торсад де паунт», наиболее распространенный русский термин – пируэтная тахикардия). Данный вид желудочковой тахикардии наиболее часто встречается в условиях предшествующего удлинения интервала QT.
Развитие пируэтной тахикардии было зарегистрировано на фоне приема нескольких лекарственных препаратов, что привело к необходимости их отзыва с рынка. Среди таких лекарственных средств необходимо назвать широко использовавшиеся ранее антигистаминные препараты, не оказывающие снотворное действие, терфенадин и астемизол, а также желудочно-кишечный прокинетик цизаприд. Все указанные препараты проявляли дозозависимый эффект блокирования тока калия в клетках проводящих путей сердца, что приводило к отсроченной деполяризации желудочков и ЭКГ-феномену удлинения интервала QT. Результатом этого и было повышение риска развития тяжелых нарушений ритма.
Следует отметить, что для всех отозванных препаратов найдена относительно безопасная альтернатива – антигистаминные препараты цетиризин, фексофенадин (активный метаболит терфенадина) и лоратадин, также не оказывающие снотворного действия. Место цизаприда заняли метоклопрамид и домперидон, не удлиняющие интервал QT.
Другие нежелательные явления, возникающие как результат лекарственных взаимодействий, являются обычно усиленными прямыми или побочными эффектами препаратов (гипотония и отеки лодыжек в результате повышения биодоступности фелодипина, диффузная миалгия из-за снижения пресистемного метаболизма статинов).
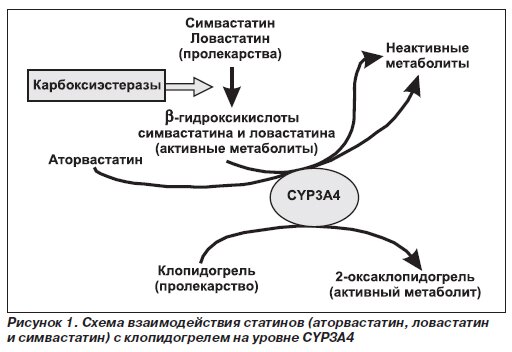
Лекарственные взаимодействия с участием статинов
Набирающие все большую популярность статины характеризуются низкими и очень низкими показателями биодоступности (менее 10 % — ловастатин и симвастатин, 10-30 % — аторвастатин и флувастатин). Следствием повышения биодоступности ловастатина, симвастатина и аторвастатина на фоне сопутствующего назначения ингибиторов CYP3A4 могут быть диффузная миалгия, повышение уровня креатинфосфокиназы, тяжелая дегенерация скелетных мышц (рабдомиолиз) и острая почечная недостаточность.
Описано 10-20 кратное повышение концентрации в крови ловастатина и симвастатина вследствие лекарственного взаимодействия препаратов с ингибиторами CYP3A4. Уровень аторвастатина, обладающего более высокой биодоступностью, повышается в меньшей степени – в 2-4 раза. В отличие от указанных препаратов правастатин минимально метаболизируется CYP3A4, серьезные лекарственные взаимодействия с его участием маловероятны. Флувастатин метаболизируется CYP2С9 и также может быть альтернативой у пациентов, получающих ингибиторы CYP3A4.
Например, макролидный антибиотик азитромицин не влияет на активность цитохрома CYP3A4 и может быть использован как альтернатива кларитромицину и эритромицину. Противогрибковый препарат флуконазол является достойной заменой ингибиторов CYP3A4 кетоконазола и итраконазола.
Лекарственные взаимодействия с участием цитохрома CYP2D6
Наиболее часто назначаемые лекарственные препараты, потенциально взаимодействующие с участием цитохрома CYP2D6 приведены в таблице, из которой следует, что метаболизации с участием CYP2D6 подвергаются многие ББ, трициклические антидепрессанты, ингибиторы обратного захвата серотонина, антипсихотические средства и опиоиды.
Субстраты: амитриптилин, метопролол, тимолол, кодеин, фенформин, рисперидон, сертралин, пароксетин, декстраметорфан, флуоксетин, оксикодон.
Индукторы: не известны.
Ингибиторы: амиодарон, хинидин, циталопрам, флуоксетин, пароксетин, сертралин, тербинафин.
Лекарственные взаимодействия с участием ББ
Метопролол и тимолол инактивируются CYP2D6. Как у медленных, так и у быстрых метаболизаторов сопутствующее назначение ингибиторов CYP2D6 может спровоцировать выраженную брадикардию с частотой сердечных сокращений менее 40 в минуту и глубокую летаргию на фоне обычной терапевтической дозы метопролола или тимолола. Это относится даже к офтальмологическому раствору тимолола, применяемому при глаукоме. Атенолол как ББ, не метаболизирующийся цитохромами и выводящийся из организма неизменным, может являться альтернативой метопрололу и тимололу, если есть опасения возможности лекарственных взаимодействий.
Лекарственные взаимодействия с участием цитохрома CYP2С9
В семейство ферментов CYP2С у человека входит четыре представителя CYP2С8, CYP2С9, CYP2С18 и CYP2С19. Из них CYP2С9 играет самую важную роль, представляя около 20 % белка цитохрома Р-450 в печени. Несмотря на то, что семейство этих ферментов ответственно за метаболизм намного меньшего числа лекарственных препаратов, чем например, CYP3А4 и CYP2D6, один из его представителей — CYP2С9 – имеет все же очень большое значение в кардиологии, поскольку опосредует метаболизм антикоагулянтного препарата варфарина.
Субстраты: варфарин, целекоксиб, флувастатин, ирбесартан, лозартан, кандесартан, нестероидные противовоспалительные средства (НПВС) – диклофенак, ибупрофен, напрокен, фенитоин .
Индукторы: этанол, карбамазепин, фенобарбитал, рифампицин.
Ингибиторы: амиодарон, аторвастатин, флувастатин, ловастатин, симвастатин, флуконазол, флуоксетин
CYP2С9 – полиморфный индуцируемый фермент. Частота встречаемости медленных метаболизаторов среди европейской популяции составляет порядка 1 %, среди африканской – около 0,1 % и в азиатской популяции – менее 0,1 %.
Лекарственные взаимодействия с участием варфарина
Как уже сказано, из всех лекарственных взаимодействий с участием CYP2С9 наибольшее клиническое значение имеет изменение метаболизма орального антикоагулянта варфарина, применяемого для профилактики системных и легочных эмболий. Суточная доза варфарина, которая подбирается индивидуально в каждом случае, варьирует в широком диапазоне – от 0,5 до 60 мг. В среднем суточная доза препарата составляет около 5 мг, однако ситуацию осложняет то, что варфарин относится к препаратам с узким терапевтическим интервалом. Это значит, что небольшое увеличение его дозы приводит к значительному увеличению эффекта. Кроме того, действие индукторов или ингибиторов препарата, приводящее к изменению его концентрации в крови, также может значительно снижать эффективность лечения и, что очевидно более опасно, увеличивать риск побочных действий – кровотечений.
Нарушение транспорта лекарственных препаратов
В настоящее время признается, что транспорт играет значительную роль в развитии лекарственных взаимодействий. Белки, осуществляющие транспорт, являются важными детерминантами распределения препарата. Одним из наиболее изученных белков-транспортеров является гликопротеин Р. Впервые этот белок был обнаружен в раковых клетках. Было показано, что он несет ответственность за поливалентную лекарственную резистентность опухоли. Гликопротеин Р – АТФ-зависимый насос, транспортирующий множество структурно и биохимически несвязанных веществ. Локализуясь в тонкой кишке, он располагается на обращенной в просвет поверхности эпителиоцита. Кроме того, гликопротеин Р находится на мембранах желчных канальцев печени, проксимальных канальцев почек и эндотелиоцитов, составляющих гематоэнцефалический и гематотестикулярный барьеры.
Гликопротеин Р влияет на распределение препарата, ограничивая всасывание лекарственного вещества из кишечника, облегчая его выведение посредством секреции в желчь и мочу и снижая его поступление в мозг и яички.
Субстраты: амиодарон, противоопухолевые препараты, ловастатин, хинидин, телмисартан, верапамил, циклоспорин, дигоксин, дилтиазем, эритромицин, ингибиторы ВИЧ-протеазы, лоперамид.
Индукторы: дексаметазон, рифампицин, трава зверобоя продырявленного.
Ингибиторы: амиодарон, кларитромицин, эритромицин, циклоспорин, интраконазол, кетоконазол, хинидин, ритонавир, верапамил.
Лекарственные взаимодействия с участием дигоксина
Дигоксин не метаболизируется в организме человека. Этот препарат экскретируется в неизменном виде почками и желчью. Несколько клинических исследований показали повышение уровня дигоксина в плазме на 50-300 %, связанное с сопутствующим назначением ингибиторов гликопротеина Р. Среди таких препаратов – часто используемые в кардиологии амиодарон, верапамил и хинидин. Взаимодействия могут быть следствием угнетения опосредованного гликопротеином Р выведения дигоксина через желудочно-кишечный тракт и/или системной элиминации через почки/с желчью. Результатом накопления дигоксина в организме могут быть симптомы дигиталисной интоксикации.
Лекарственные взаимодействия с участием препаратов растительного происхождения и пищевых добавок
Препараты растительного происхождения могут не только вызывать тяжелые побочные реакции, но и провоцировать нежелательные лекарственные взаимодействия с рецептурными лекарствами (De Smet PAGM, 2002). Не говоря уже о том, что прием растительного препарата с недоказанной эффективностью может заменить собой жизненно необходимую пациенту терапию традиционными фармакологическими препаратами.
Хорошо изучены по сравнению с другими растительными препаратами лекарственные взаимодействия зверобоя продырявленного. Экстракт зверобоя широко используется для лечения депрессии легкой и средней степени тяжести (объем продаж в США – 140 млн. долларов в год). В последние годы накопилось достаточно информации, позволяющей утверждать, что препараты зверобоя вступают в нежелательные лекарственные взаимодействия с теофиллином, дигоксином, циклоспорином, индинавиром, венлафаксином и невирапином. Зарегистрировано не менее 5 случаев отторжения трансплантированных органов, которые были связаны с началом терапии препаратами зверобоя у пациентов, получавших циклоспорин с целью иммуносупрессии.
Тщательно проведенные исследования показали, что зверобой снижает уровень назначаемых совместно препаратов, индуцируя цитохром CYP3А4 и гликопротеин Р. При назначении вместе со зверобоем препарата, являющегося субстратом CYP3А4 и гликопротеина Р, можно ожидать, что количество абсорбируемого препарата будет примерно в два раза меньше того, которое должно было поступать в организм с лечебной целью.
При лечении АГ у пациентов, получающих БКК (фелодипин, нифедипин, амлодипин и др.), лозартан или телмисартан (субстраты гликопротеина Р), под влиянием зверобоя может проявляться снижение эффективности перечисленных препаратов.
Многие из лекарственных растений влияют на эффект варфарина. Так, папайя, которая содержит повышающий международное нормализованное отношение (МНО) папаин, противопоказана пациентам, принимающим антикоагулянты.
Взаимодействия лекарственных средств растительного происхождения с препаратами, используемыми в кардиологии

Индивидуальные детерминанты потенциальных лекарственных взаимодействий
Следует отметить еще несколько моментов, от которых зависит – разовьется или не разовьется лекарственное взаимодействие у конкретного пациента. Фармакокинетическая реакция в большинстве случаев запускается непосредственно после приема двух взаимодействующих препаратов. Однако возможен и другой вариант – клиническое проявление лекарственного взаимодействия наблюдается только после длительного приема обоих препаратов. Так, только длительный прием ингибиторов CYP3А4 на фоне лечения статинами может привести к рабдомиолизу.
Снижение риска нежелательных взаимодействий при выборе препаратов в кардиологии
Информация о возможных взаимодействиях должна содержаться в прилагаемой к препарату инструкции. Признаками низкой вероятности развития нежелательных лекарственных взаимодействий являются: высокая биодоступность, широкий терапевтический интервал, экскреция в неизменном или в конъюгированном с глюкуроновой кислотой виде, наличие двух путей выведения.
Среди антигипертензивных препаратов одними из наиболее безопасных в отношении развития нежелательных лекарственных взаимодействий представляются блокаторы рецепторов ангиотензина II. Несмотря на то что в метаболизме некоторых из них определенную (чаще – несущественную) роль играют ферменты цитохрома Р-450, ни для одного из препаратов этого класса, за исключением телмисартана, не описано клинических проявлений нежелательных лекарственных взаимодействий. Лозартан метаболизируется CYP3А4 и CYP2С9, кандесартан и ирбесартан – CYP2С9. Флуконазол увеличивает показатель площади под кривой концентрации ирбесартана на 63 %, повышает пиковую концентрацию на 19 %. Телмисартан: элиминируется с желчью посредством связывания с гликопротеином Р, повышает пиковую и наименьшую концентрацию дигоксина в плазме на 49 и 20 %, соответственно. Поэтому необходим контроль концентрации дигоксина при начале терапии телмисартаном, подборе дозы и при отмене препарата. Эпросартан не метаболизируется, нежелательных лекарственных взаимодействий не описано.
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) – эналаприл, фозиноприл, рамиприл, хинаприл, лизиноприл, цилазаприл – относительно безопасный класс препаратов. Большинство представителей этого класса после попадания в организм конвертируется эстеразами в активную форму и элиминируется в неизменном виде. Однако при сочетании с некоторыми лекарственными препаратами возможно развитие чрезмерного снижения артериального давления (АД) (антидепрессанты, хлорпромазин, леводопа), гиперкалиемии (калийсберегающие диуретики, препараты калия, циклоспорин). ИАПФ также уменьшают экскрецию лития.
Терапия тиазидными диуретиками в некоторых случаях приводит к развитию гипокалиемии, что может способствовать проявлению нежелательных свойств некоторых лекарственных препаратов. Например, в условиях гипокалиемии возрастает проаритмогенная активность соталола, амиодарона, дизопирамида, хинидина, дигоксина.
Таким образом, представленные в лекции данные свидетельствуют, что для проведения безопасной комбинированной фармакотерапии врачу необходимо руководствоваться следующими положениями:
— выбор комбинации должен быть основан на фармакодинамических эффектах каждого ЛС в соответствии с целями фармакотерапии;
— для каждого ЛС из комбинации следует установить ферменты биотрансформации и транспортеры, а также выяснить, не являются ли эти ЛС их индукторами или ингибиторами;
— полученные данные необходимо учитывать при планировании режима дозирования лекарственных средств. а также методов контроля эффективности и безопасности их комбинации.
Знание «интимных» механизмов фармакокинетического взаимодействия лекарственных средств позволит повысить безопасность проводимой комбинированной фармакотерапии.
Лекарственные средства в кардиологии
Глава 20. Лекарственные средства в кардиологии (пп. I—XL)
Р. Лукаротти, М. Джонсон, М. Смайт, Х. Пиллен, М. Санчимино
В этой главе изложены основные сведения по клинической фармакологии сердечно-сосудистых средств. Описание каждого препарата включает сжатую информацию о показаниях и дозах, о коррекции доз, побочном действии, взаимодействии с другими лекарственными средствами и противопоказаниях. Аллергические реакции возможны при использовании любого лекарственного средства, и поэтому во многих случаях в разделах «Побочное действие» и «Противопоказания» аллергия не упоминается.
Для многих препаратов приведена коррекция дозы в зависимости от СКФ. Одна из формул для расчета: СКФ = [вес (кг)] ґ [140 – возраст (годы)] / [72 ґ креатинин сыворотки (мг%)] — для мужчин, и 85% расчетной величины — для женщин.
Ответственность за использование приведенной информации в клинической практике и за все вытекающие из этого последствия несет врач. Представленная информация не может считаться исчерпывающей, поэтому читателю следует также пользоваться другими справочниками и инструкциями фирм-производителей.
Описания препаратов расположены в алфавитном порядке по международным названиям.
Фармакологические группы