Септический эндокардит — Пороки сердца
Страница 5 из 46
Это тяжелое, весьма опасное заболевание, сопровождающееся изъязвлением клапанов (злокачественный язвенный эндокардит).
Этиология и патогенез.
Септический эндокардит вызывают микробы, которые при длительной или временной бактериемии оседают и размножаются на эндокарде. Образующиеся в местах повреждения тромбы из кровяных пластинок и фибрина защищают бактерий от бактерицидных факторов крови. Таким образом, на эндокарде возникает вторичный инфекционный (септический) очаг, из которого микробы опять попадают в кровь; отрывающиеся от пораженных клапанов тромботические частицы вызывают множественные эмболии сосудов различных органов.
Классические опыты В. К. Высоковича (1885) показали, что для возникновения экспериментального эндокардита необходимо повреждение эндокарда.
Септический (подострый) эндокардит чаще всего развивается па клапанах, измененных ревматическим процессом, а также при врожденных пороках сердца. Нарушения гемодинамики у больных с пороками сердца в течение длительного времени могут быть причиной повреждения эндотелия эндокарда и развития эндокардита (А. В. Вальтер, 1948; Г. А. Чекарева, 1964; В. X. Василенко, 1972).
При тяжелом митральном стенозе септический эндокардит возникает значительно реже, чем при аортальной недостаточности (В. X. Василенко, 1972).
Возбудителями инфекции при подостром эндокардите обычно являются микробы, сапрофитирующие в полости рта и верхних дыхательных путей, редко — пищеварительного тракта, а также в инфицированных зубах, миндалинах, придаточных полостях и т. п. Неоднократно отмечены случаи возникновения септического эндокардита после экстракции зубов или тонзиллэктомии (особенно у больных с ревматическим пороком сердца), после урологических операций, абортов, родов. Наконец, митральная комиссуротомия и другие операции на сердце могут осложниться септическим эндокардитом.
Нервно-психическое перенапряжение и нарушение питания обусловливают более частое возникновение подострого эндокардита.
В большинстве случаев в крови у больных септическим эндокардитом обнаруживаются стрептококки. Например, в клинике Н. Д. Стражеско (1925—1936) из 359 обследованных больных злокачественным септическим эндокардитом были высеяны из крови стрептококки при остром эндокардите у 94%, при подостром — у 81% (в эти же годы в клинике стрептококки были обнаружены в крови у 68% больных ревматическим эндокардитом). Зеленящий стрептококк — наиболее частый возбудитель подострого эндокардита.
По данным Friedberg (1967), септический эндокардит ь 95% случаев вызывается зеленящим стрептококком, энтерококком, белым или золотистым стафилококком. С увеличением числа резистентных штаммов стафилококков возрастает количество стафилококковых эндокардитов. Возбудителями эндокардита могут быть также гемолитические стрептококки, пневмококки, гонококки, менингококки, сальмонеллы, бруцеллы, палочка инфлюэнцы (палочка Пфейффера) и другие микробы. В отдельных случаях обнаруживаются как вирулентные гноеродные микробы, так и относительные сапрофиты и даже грибы и дрожжи. Острый септический эндокардит (endocarditis septica acuta) составляет менее 1% всех эндокардитов (В. Йонаш, 1960); из 1070 случаев эндокардита в клинике Н. Д. Стражеско эта форма наблюдалась в 67. Обычно острый септический эндокардит — одно из проявлений сепсиса, вызываемого вирулентными штаммами стренто-, стафилококков и других бактерий.
Клиническая картина и течение острого септического эндокардита соответствуют картине острого сепсиса. Как правило, у больных отмечается лихорадка неправильного типа с ознобом, повышением температуры до 39—40° и обильным потоотделением во время падения температуры. Лихорадка сопровождается резкой общей слабостью, головной болью, потерей аппетита, нередко одышкой, болями в области сердца. Кожные покровы бледные, на коже часто имеются мелкие кровоизлияния. Изменения со стороны сердечно-сосудистой системы обычно резко выражены. Пульс частый, малый, нередко аритмичный. Миокардит — постоянный спутник этого эндокардита, поэтому сердце всегда увеличено, верхушечный толчок смещен влево. При выслушивании обнаруживаются изменения звуковых явлений: тоны сердца, особенно I, ослабевают, иногда отмечается ритм галопа, появляются шумы — систолический на верхушке и области трехстворчатого клапана, систолический и диастолический на аорте и легочной артерии. Сердечные шумы, то мягкие, то жесткие, могут в течение дня значительно изменяться по своей силе и продолжительности вследствие наслоения или разрушения тромботических полипозных наложений на клапанах; иногда возникает музыкальный шум в связи с разрывом клапана или хорды. В течение болезни может наступить недостаточность кровообращения. Обычно селезенка и печень увеличены. Быстро прогрессирует анемия гипохромного типа. Нарастает лейкоцитоз (до 20 000 и более) с выраженным нейтрофилезом и сдвигом влево. Определяется эозинопения, могут быть обнаружены большие эпителиоидные клетки (типичные и атипичные гистиоциты). Выражена наклонность к эмболиям, часто наблюдаются повторные эмболии в кожу с образованием петехиальных пятен, в мозг, центральную артерию сетчатки, селезенку, почку, иногда крупную артерию конечностей и т. п. В связи с поражением всей сосудистой системы могут возникнуть флебит, септический артериит, явления геморрагического диатеза (петехиальная сыпь, носовые. кровотечения, гематурия).
Установление диагноза представляет большие затруднения. Положительный результат посева крови подтверждает наличие сепсиса. Основное диагностическое значение имеют изменяющиеся громкие сердечные шумы и возникновение признаков эмболии. Эндокардит часто не распознается у людей старческого возраста, у которых он проявляется незначительной лихорадкой, крайней слабостью и обычно приводит к смерти через 3—7 дней.
Течение болезни характеризуется прогрессирующим ухудшением общего состояния, нарастанием признаков поражения сердца, появлением новых симптомов со стороны различных органов в связи с эмболиями или интоксикацией. Смерть наступает либо от осложнения (эмболия в мозг, пневмония), либо вследствие истощения и интоксикации. Длительность болезни — от нескольких дней до 2 мес.
Прогноз. раньше исключительно неблагоприятный, в настоящее время улучшился в связи с возможностями химио- и антибиотикотерапии.
Лечение см. «Лечение подострого септического эндокардита».
Подострый септический эндокардит (endocarditis septica lenta). Обычно наблюдается в возрасте 20—40 лет, чаще болеют мужчины.
Клиническая картина и течение.
Начало заболевания почти всегда малозаметное, общее состояние больного постепенно ухудшается. Отмечаются легкая утомляемость, слабость, неприятные ощущения в области сердца. В редких случаях заболевание проявляется остро: озноб, резкое повышение температуры, сердцебиение, боли в какой-либо части тела. Эти симптомы зависят от внезапно наступивших эмболии при латентно протекавшем эндокардите.
Общие симптомы связаны с токсемией и бактериемией. Утомляемость, слабость, легкая одышка, потеря аппетита, иногда тошнота — самые частые жалобы, однако нередко обнаруживается эйфория, самочувствие не соответствует общему серьезному состоянию. Лихорадка—наиболее постоянный симптом, хотя как очень редкое исключение она может отсутствовать у лиц старческого возраста. Вначале бывает незначительное повышение температуры (типа субфебрилитета), в дальнейшем лихорадка становится высокой, неправильного типа, ремиттирующей или интермиттирующей. Нередко на фоне субфебрильной температуры нерегулярно появляются отдельные высокие температурные «свечи» до 39° и более (такого рода лихорадка весьма характерна для подострого эндокардита). При значительных колебаниях температуры бывают профузные поты, часто отмечается познабливание, реже — выраженный озноб. Наряду с лихорадкой всегда прогрессирует анемия гипохромного типа вследствие усиленного гемолиза и плохой регенерации эритроцитов. Кожа бледная, с желтоватым оттенком («кофе с молоком»), слизистые оболочки также бледные.
В большинстве случаев имеются признаки клапанного порока сердца или врожденного порока, предшествовавшего развитию эндокардита. Соответственно этому прослушиваются эндокардиальные шумы, но с возникновением эндокардита они изменяются; присоединяются функциональные шумы вследствие вторичного расширения сердца и анемии и новые органические шумы вследствие воспалительных вегетаций на клапанах или их перфорации. Систолический и диастолический шумы при септическом эндокардите имеют непостоянный характер, то есть в течение короткого периода то усиливаются, то исчезают. Музыкальный шум внезапно появляется при разрыве хорды или клапана. Аортальные клапаны наиболее часто поражаются эндокардитом, поэтому обнаруживаются признаки недостаточности клапанов аорты. Сердце увеличивается вследствие сопутствующего миокардита (М. И. Теодори, 1964). Нередко отмечается экстрасистолия. В части случаев можно обнаружить нарушения проводимости (удлинение Р—Q до 0,36 с), полная блокада наблюдается очень редко. Мерцательная аритмия бывает реже, чем при стенозе левого предсердно-желудочкового отверстия. Заслуживает внимания то, что подострый эндокардит обычно возникает у лиц с хорошо компенсированным пороком сердца. Эмболия венечной артерии частицами эндокардиальных разращений сопровождается внезапным появлением ангинозных болей и шоком; такая эмболия быстро приводит к смерти, реже развивается инфаркт миокарда.
Один из самых характерных симптомов септического эндокардита — эмболии в малые или большие сосуды почек, мозга, селезенки, кожи, конечностей или желудочно- кишечного тракта с образованием инфарктов внутренних органов. Они обусловливают обширную симптоматику внезапных осложнений болезни (потеря сознания, параличи конечностей, гемиплегия — при эмболии в сосуды мозга; внезапная слепота на один глаз — при закупорке сосуда сетчатки; острые боли в левом подреберье — при эмболии и инфаркте селезенки; резкие боли в пояснице и гематурия — при поражении почек и т. п.). Несмотря па длительную бактериемию и частые бактериальные эмболии, в организме не образуется вторичный инфекционный очаг или нагноение. Существенную роль при этом играет системное поражение сосудов (артериит и капиллярит). Почти во всех случаях можно обнаружить кровоизлияния в кожу, изолированные петехии и распространенные кровоизлияния. Нередко центр петехий белого цвета, они но возвышаются над уровнем кожи. Изредка кожные кровоизлияния бывают весьма распространенными, в некоторых случаях при этом наблюдаются тромбопения, удлинение времени кровотечения. Часто отмечаются кровоизлияния в конъюнктиву (признак Лукина), чаще нижнего века. Могут быть кровоизлияния в слизистую оболочку полости рта, особенно в мягкое и твердое нёбо. Диагностическое значение имеет появление болезненных поражений кожи — узелков Ослера; цианотично-красного цвета узелки величиной с булавочную головку и более появляются на пальцах, ладони или подошве. Их возникновение сопровождается острой болью, через 2—4 дня узелок рассасывается. Точечные кровоизлияния в кожу можно воспроизвести при повышении венозного и капиллярного давления путем наложения манжетки или жгута (признак Кончаловского — Румпеля — Лееде). Хрупкость капилляров обнаруживается также при легкой травме кожи (признак щипка). В большинстве случаев пальцы имеют вид барабанных палочек. Выраженные боли в суставах отмечаются редко, обычно они нерезкие и неопределенные.
Почти во всех случаях с развитием очагового гломерулонефрита при повторных анализах мочи обнаруживаются альбуминурия и гематурия. Кровянистая моча бывает при более или менее значительной эмболии в сосуды почек, но чаще имеются микрогематурия и наряду с ней цилиндрурия.
При пальпации живота почти всегда удается обнаружить увеличенную плотную селезенку, иногда значительно. Боли в области левого подреберья и шум трения брюшины бывают при инфаркте селезенки и перисплените. Очень часто определяется увеличение печени.
Поражение центральной нервной системы зависит от эмболий. Эмболии крупных сосудов вызывают параличи, потерю сознания, иногда наступает внезапная смерть.
Гипохромная анемия — постоянный признак эндокардита. В части случаев количество эритроцитов ниже 3 000 000, а при успешном лечении антибиотиками содержание их и гемоглобина нарастает. Количество лейкоцитов — в норме или у верхней границы нормы, после эмболий и образования инфарктов наступает лейкоцитоз (около 15 000—25 000) со сдвигом нейтрофилов влево. Нередко наблюдаются выраженный моноцитоз и появление в крови макрофагов или гистиоцитов (от 10 до 80 в диаметре). Для диагностики ценно обнаружение этих больших клеток или увеличение их количества после разминания мочки уха перед взятием крови (признак Битторфа — Тушинского). СОЭ всегда повышена. Очень часто положительны формоловая и тимоловая реакции; содержанию Y-глобулиновой фракции белка в сыворотке крови увеличено. Реакция Вассермана может быть положительной. В 80% случаев из крови высевается возбудитель болезни (чаще всего — зеленящий стрептококк).
Диагностика эндокардита опирается на следующие важнейшие симптомы: лихорадка, положительный посев крови (наиболее выгодным для взятия крови является момент познабливания больного), наличие порока сердца (чаще аортального), признаки эмболий.
У больных с пороками сердца следует дифференцировать подострый эндокардит и рецидив ревматизма или сопровождающиеся температурой осложнения (очаговая пневмония и т. п.).
Прогноз. Своевременное лечение антибиотиками позволяет достичь излечения у 55—80% больных подострым эндокардитом. Однако почти у 1/3 излеченных развивается недостаточность сердца, от которой они могут погибнуть. Рецидив болезни может наступить в течение первых 4 нед после прекращения лечения. Непосредственной причиной смерти чаще всего бывает недостаточность кровообращения, затем эмболии, разрыв микотической аневризмы мозга, недостаточность функции почек и уремия, блокада сердца.
Профилактика.
Больные с пороками сердца нуждаются в диспансерном наблюдении. Для предупреждения эндокардита необходимо лечение очаговых инфекций (зубы, миндалины). При всяких оперативных вмешательствах следует за день до операции и непосредственно после нее в течение не менее 2 сут вводить пенициллин и стрептомицин (например, около 1,5 млн. ЕД пенициллина и 0,75 г стрептомицина pro die).
Лечение. Рациональное лечение септического эндокардита возможно после выяснения (при посевах крови) возбудителя болезни и его чувствительности к антибиотикам (Н. С. Молчанов, 1950, и др.).
В случаях инфекции зеленящим или негемолитическим стрептококком проводят длительное лечение большими дозами пенициллина в комбинации со стрептомицином. Продолжительность первого и каждого повторных курсов — не менее 6 нед. Малые дозы пенициллина способствуют появлению резистентных к пенициллину штаммов.
В случаях энтерококковой и стафилококковой инфекции применяют, кроме пенициллина, антибиотики более широкого спектра действия: тетрациклин (около 4 г в сутки) и эритромицин (около 3 г в сутки) внутрь или капельно внутривенное вливание раствора сигмамицина, тетрациклина с олеандомицином. В случаях эндокардита невыясненной этиологии назначают комбинированные антибиотики в больших дозах (террамицин, тетрациклин, эритромицин, олеандомицин). Обязательно для всех больных полноценное питание (обильное количество белка и витаминов, препараты железа). В дальнейшем необходимы лечение в санатории и тщательное диспансерное наблюдение. Нередко следует проводить повторный курс антибиотикотерапии. Хирургическое вмешательство показано при инфекции артериовенозной аневризмы (ее резекции), а также при инфекции открытого артериального протока (лигатура и перерезка его).
Значение термина Септический Эндокардит в Энциклопедии Научной Библиотеки
Септический Эндокардит — Одним из наиболее тяжелых проявлений госпитальной инфекции после операций на сердце является септический эндокардит.
По данным Н. В. Путова с соавт. (1968), Т. Г. Блесткиной с соавт. (1969), Н. В. Смысловой, В. Т. Свирякина (1969), В. А. Бухарина с соавт. (1973), Б. А. Королева, И. К. Охотина (1973), Л. Н. Сидаренко, А. Ю. Спасокукоцкого (1975), Cohen с соавт. (1964), Sebening (1966), Amoury (1967), Jeh с соавт. (1967), Senning (1970) и др. послеоперационный эндокардит относится к числу частых причин летальных исходов.
Особенно высок процент госпитальной инфекции после протезирования клапанов сердца. Септические и тромбоэмболические осложнения у этих больных часто сочетаются и обусловливают друг друга. Нередко они служат конкурирующими причинами летальных исходов. Geraci (1968) из 230 больных после операций на сердце наблюдал септический эндокардит у 23 (10%). Эндокардит протекал с высокой лихорадкой, ознобами, но без спленомегалии. Однако микрогематурии, высокой СОЭ не было.
Основным возбудителем септического эндокардита является стафилококк, причем в половине случаев высевался белый коагулазонегативный стафилококк. В последние годы все чаще сообщают о синегнойной и грибковом эндокардитах у оперированных больных (Mono, 1974; Rosendorf с соавт. 1974, и др.).
Мы наблюдали острый послеоперационный септический эндокардит у 28 больных (0,2% оперированных, 1,9% инфекционных осложнений), 11 из которых оперировались по поводу врожденных, 17 — приобретенных пороков сердца. Возраст больных — от 7 до 51 года. Мужчин было 16, женщин — 12. Ни у одного из этих больных к моменту операции не было признаков эндокардита, активного ревмокардита или очагов эндогенной инфекции. Частота возникновения эндокардита не зависела от длительности операции или перфузии. Была отмечена сезонность заболеваний. Осложнение развивалось преимущественно в осенне-весенний период. Изолированный септический эндокардит без других проявлений госпитальной инфекции отмечен у 6 больных, у 2 — он развился после флебита и трахеобронхита, у остальных больных септическому эндокардиту предшествовали нагноение операционной раны (8), пневмония (5), другие осложнения (7).
Септический эндокардит развился в 2,7% операций с искусственным кровообращением, в 1% — под гипотермией и в 0,8% — при закрытых вмешательствах на сердце. Чаще эндокардит наблюдался у больных с приобретенными пороками сердца. Так, например, частота его после закрытых операций на митральном клапане — 1,7%, в то время как после закрытых операций при врожденных пороках — 0,1 %. Аналогичная тенденция отмечена и после открытых операций на сердце (соответственно — 3,1 и 2,5%, см табл. 12).
Хотя бактериальный эндокардит многими отождествляется с сепсисом или с одним из проявлений сепсиса, мы выделяем его в отдельную нозологическую единицу. К возникновению эндокардита предрасполагает имплантация различных инородных тел (протезов, прокладок, заплат и др.), на поверхности и вокруг которых микробы находят благоприятные условия для развития. Способствовать проникновению микробов и поддерживать инфекцию могут также электроды, подшиваемые к миокарду для временной электрокардиостимуляции.
Анализ наших наблюдений показал, что послеоперационный септический эндокардит возникает при наличии главным образом трех факторов: бактериального, местного и общего.
Бактериемия является обычной при септическом эндокардите. Только в одном случае, где эндокардит подтвержден на секции, нам не удалось получить гемокультуру. Эта больная оперировалась в 1964 г. когда недостаточно настойчиво производились исследования крови. Чтобы получить гемокультуру, необходимы повторные многократные посевы крови в утренние и вечерние часы. Вероятность определения возбудителя из крови возрастает, если посевы производятся до начала антибиотикотерапии, на пике подъема температуры (Washington, 1975).
Сама по себе бактериемия требует критической оценки; она часто бывает преходящей или выявляется в виде эпизода. После операций на сердце культура стафилококка высевалась из крови у 39 наших больных, но клиническая картина стафилококкового эндокардита отмечена лишь у 19 (из 28).
При посевах крови золотистый стафилококк получен у 19 больных, синегнойная палочка — у 4, кишечная палочка — у 2, дрожжевые грибы — у 2 и у 1 больного с клиникой эндокардита роста не было. При изучении секционного материала бактериологически в большинстве случаев обнаруживался золотистый стафилококк в сочетании с кишечной палочкой (на эндокарде, в срезах тромботических масс, на заплатах и протезах).
Williams (1970) считает, что наличие или отсутствие бактериемии должно быть доказано пятью или более посевами крови. Бактериемию мы чаще всего связывали с одномоментным массивным инфицированием в операционной. Аутоинфекция имела второстепенную роль. Роль микробов в развитии послеоперационного септического эндокардита очевидна, но их еще недостаточно для развития этого осложнения. Септический эндокардит возникал на фоне измененной реактивности организма. Не случайно также, что у большинства больных эндокардитом имелись выраженные изменения клапанного аппарата.
Из местных факторов, способствующих развитию эндокардита, наибольшее значение имеют, с одной стороны, поврежденный эндокард в области клапанов и дефектов, с другой — инородные тела, оставляемые в полостях сердца. Протезы клапанов, заплаты, шовный материал, катетеры легко инфицируются во время операции или при последующей бактериемии. Существенную роль в патогенезе послеоперационных эндокардитов отводят неизбежной во время вмешательства травме эндотелия и отложению тромботических масс.
Наличия инфекции и предрасполагающих местных факторов, по-видимому, еще недостаточно для развития септического эндокардита. Осложнение развивается при значительном нарушении иммунобиологических сил больного, снижении неспецифической резистентности и специфического противостафилококкового иммунитета.
Септический эндокардит развивался в различные сроки после операции, чаще всего на 14 — 30-й день. У 2 больных он возник очень поздно (через 1 и 3 года).
У больного С, 14 лет, 26/Х 1966 г. было произведено протезирование клапана легочной артерии шаровым протезом. Послеоперационный период осложнился нагноением операционной раны, флебитом, пневмонией. В последующем удовлетворительное течение. На 62-й день был выписан. Через 3 года после операции (в ноябре 1969 г.) септический стафилококковый эндокардит. Упорная антибактериальная терапия не эффективна. Стойкая бактериемия. Предложена операция — замена протеза, от которой родители отказались. 16 августа 1970 г. — смерть. На секции в области швов, фиксировавших протез, тромботические разрастания, содержавшие на поверхности и в глубине ткани стафилококк.
Несмотря на интенсивную терапию, 13 больных погибли в ближайшие 2,5 месяца и 3 — в отдаленные сроки. На вскрытии обнаруживались в области ушитых дефектов перегородок (на заплатах или швах), на створках клапанов или вблизи протезов бородавчатые, гроздевидные наложения в виде грязно-серых рыхлых вязких масс, из которых высевались стафилококк и синегнойная палочка. Постоянное присутствие пиогенной флоры объясняло причину бактериемии.
Диагностика послеоперационного септического эндокардита сопряжена с большими трудностями. В отличие от подострого септического эндокардита, для которого характерны лихорадка, озноб, спленомегалия, геморрагии (петехии), эмболические осложнения и изменяющиеся шумы сердца, он не имеет: четкой симптоматики. Перечисленные симптомы после операций на сердце могут объясняться другими причинами и поэтому требуют осторожного толкования.
Начальные проявления эндокардита при приобретенных пороках сердца нередко принимались за обострение ревматического процесса. С последним приходится встречаться довольно часто. По нашим данным, на первую тысячу оперированных больных обострение ревматизма наблюдалось в 25,6%.
Проблема взаимоотношения септического эндокардита и ревматизма до сих пор подвергается дискуссии. Общность их патогенетических черт и клинико-морфологических признаков затрудняет дифференциальную диагностику. Неспецифические аллергические реакции, повышенная сенсибилизация, поражение почек и печени сближают септический эндокардит и обострение ревмокардита.
Длительная лихорадка, постепенное ухудшение самочувствия и общего состояния, появление новых сердечных шумов, клиника эмболии, иногда катастрофически изменяющая положение больного, бактериемия служили основными признаками септического эндокардита. При наличии сопутствующих других инфекционных осложнений диагноз затруднен и часто запаздывал. Септический эндокардит не имеет классических черт и отличается своеобразием. Так, относительно редки гнойные метастазы, отсутствуют многие признаки эмболии: боли, гематурия, значительная альбуминурия, редко выявляется увеличение селезенки.
Трудность ранней диагностики видна из наблюдения.
Больная И. 38 лет, поступила в клинику 5 апреля 1967 г. Диагностирован комбинированный митральный порок со значительным преобладанием стеноза. Недостаточность кровообращения II — III степени. Клинико-лабораторные данные свидетельствовали о вялотекущем ревмокардите. 17 апреля закрытая митральная комиссуротомия из левостороннего доступа. Атриовентрикулярное отверстие около 1 см по диаметру. Створки клапана фиброзны, подтянуты. Первые 4 дня послеоперационное течение гладкое. На пятый день возникла мерцательная аритмия (тахисистолическая форма), температура поднялась до 39°. Появился лейкоцитоз (20 800 в 1 мкл). Ознобы, поты, частая рвота. Общее состояние значительно ухудшилось. На десятый день из левой плевральной полости удалено около 700 мл серозно-геморрагического экссудата (при бактериологическом исследовании жидкость оказалась стерильной). К девятому дню выявилось нагноение раны. Сняты швы, рана дренирована. В связи с тяжестью состояния высказано предположение о наличии добавочного гнойного очага (перикардит, холангит). Доза пенициллина увеличена до 30 млн. ЕД в сутки (внутривенно). Прямые переливания одногруппной крови по 250 мл. Спустя 3 суток температура стала субфебрильной. Через 5 дней, на фоне некоторого улучшения общего состояния обильные геморрагические высыпания, расцененные как аллергическая реакция на большие дозы антибиотиков. Последние отменены и назначена антиаллергическая терапия (антигистаминные препараты, нистатин). При бактериологическом исследовании кровь стерильна. Через два дня вновь резкое ухудшение, постоянные ознобы, температура до 40°, нарастает декомпенсация. При посеве крови от 16 мая высеян гемолитический золотистый стафилококк. Назначен внутривенно сигмамицин по 2 г в сутки, преднизолон (100 мг), салициловый натр внутривенно. Через несколько дней температура упала до нормы. Лейкоцитоз снизился до 11 000. В моче единичные эритроциты, альбуминурия (белок от 0,264 до 0,33%). На коже живота и внутренних поверхностей бедер появилась ярко-красная сливная сыпь, свидетельствовавшая о токсико-аллергическом васкулите. Несмотря на терапию, вновь высокая температура, гиперлейкоцитоз (32 700 в 1 мкл). Отмечено быстрое и глубокое расплавление ткани в области послеоперационной раны. Обнаружилось и некротизировалось ребро. На 30-е сутки после операции правосторонняя гемиплегия с моторной афазией. Смерть через 77 дней после операции. На аутопсии ограниченный гнойно-фибринозный перикардит, бородавчатый эндокардит, левосторонний плеврит, субарахноидальное кровоизлияние в правую теменную область.
Приведенный пример свидетельствует о позднем распознавании осложнения (на 30-й день послеоперационного периода). Общее клиническое течение позволило заподозрить гнойную инфекцию и, в частности, септический эндокардит, хотя сохранялась звучность тонов сердца, отсутствовали шумы, стабильным оставалось артериальное давление (100/60 — 110/70 мм рт. ст.), на электрокардиограммах, снятых в динамике, отмечалась лишь умеренная степень интоксикации и гипоксии миокарда. Появившаяся геморрагическая сыпь на фоне относительного улучшения общего состояния, снижения лейкоцитоза и температуры до субфебрильных цифр была расценена как аллергическая реакция на большие дозы антибиотиков. Лишь повторная волна ухудшения, сопровождавшаяся лейкемоидной реакцией, высокой лихорадкой, альбуминурией, повторным токсикоаллергическим васкулитом и, наконец, правосторонней гемиплегией, позволили распознать септический эндокардит, подтверждением которому служил рост золотистого стафилококка в посевах крови. Обращает внимание пестрота общих симптомов, связанных с интоксикацией, при скудных местных.
Клиническое течение послеоперационного эндокардита чаще имеет две формы: острую (септическую) и подострую, протекающую более благоприятно. У больных I группы процесс сразу приобретал выраженный септический характер. Подобное течение обычно наблюдалось у ослабленных больных, имевших другие тяжелые послеоперационные осложнения. Повышение температуры до 40° наступало на 8 — 10-й день. Она приобретала гектический характер, сопровождалась потрясающими ознобами и проливным потом. Больные становились нервозными, теряли сон и аппетит. Нередкими были психические расстройства (острые психозы). Кожные покровы приобретали землистый оттенок, склеры становились иктеричными.
Характерен нейтрофильный лейкоцитоз (20 000 — 30 000) со сдвигом формулы влево, исчезновением эозинофилов, лимфоци-топенией, ретикулярными и плазматическими клетками. СОЭ ускорялась до 20 — 25 мм в час и выше. Лишь у 1 больного из 4 наблюдалось увеличение селезенки. В моче белок, гиалиновые и зернистые цилиндры. Иногда из мочи высевался стафилококк. Появление сердечных шумов отмечалось у половины больных с приобретенными пороками и у Д — с врожденными, что было результатом перфорации створки клапана или прорезывания швов.
Дренирование и широкое разведение нагноившихся ран не приводило к улучшению состояния. Больных продолжали изнурять высокая температура, ознобы, обильные поты. Быстро нарастали анемия и истощение. Нередко отмечались петехиальные кровоизлияния на коже и слизистых, тромбоэмболии. Несмотря на интенсивную антибактериальную терапию (до 100 млн. ЕД пенициллина внутривенно в сутки), через 1 — 2 недели наступал возврат лихорадки. Очень типичным было раннее развитие правожелудочковой недостаточности, плохо поддававшейся медикаментозной терапии. У одного больного развился диффузный гломерулонефрит и у 2 — очаговый.
У больных II группы, с подострым течением, осложнение развивалось постепенно, медленно, носило волнообразный характер. В первые дни после операции состояние больных не вызывало тревог. Только спустя 2 — 3 недели заметно повышалась температура (до 38 — 39°С), появлялись ознобы, одышка, тахикардия, иногда чувство тяжести за грудиной, боли в мышцах и суставах. Через несколько часов температура снижалась, что сопровождалось обильным потоотделением. Дальнейшее течение с повторными приступами ознобов и лихорадки, со светлыми промежутками, длившимися по нескольку суток.
Синегнойный эндокардит протекал наиболее тяжело. У двух больных с синегнойный сепсисом, развившимся после протезирования митрального клапана сердца, на секции обнаружен септический эндокардит. В одном случае были грубые бородавчатые наслоения вокруг протеза, в другом, помимо зеленовато-серых бородавчатых наслоений у швов, — обезображенный аортальный клапан. Две его створки перфорированы. В посевах — синегнойная палочка. Приводим выписку из истории болезни.
43-летней больной Ф. 1 декабря 1971 г. произведена полная замена митрального клапана шариковым протезом. На 10-е сутки послеоперационного периода отмечено повышение температуры, озноб. В посеве крови, взятой в этот же день — синегнойная палочка и стафилококк. Через 4 дня нагноение раны на всю глубину, эмпиема и медиастинит. Из ран груди и бедра — зеленоватый гной, флюоресцирующий в ультрафиолетовых лучах. На 10-й день больная стала откашливать ржаво-зеленую мокроту. Рентгенологически — правосторонняя субтотальная пневмония. Состояние прогрессивно ухудшалось. Диагностирован сепсис .
Лечение внутривенным введением больших доз метициллина, левомицетин-сукцината натрия, солафура. На 21-й день появился диастолический шум на аорте.
Артериальное давление 110/20 мм рт. ст. Дальнейшее лечение неэффективно. 27/XII 1971 г. больная скончалась.
На аутопсии: сепсис с гнойничками в почках, печени, гнойный трахеобронхит, правосторонняя субтотальная пневмония, эмпиема плевры, нагноение раны, гнойный медиастинит. Вокруг швов, укрепляющих протез, зеленовато-серые бородавчатые наслоения. Аортальный клапан обезображен, две его створки перфорированы. При посевах, взятых из крови и сердца — синегнойная палочка.
Септический эндокардит, вызванный кишечной палочкой, протекает более доброкачественно. При длительной антибиотикотерапии следует иметь в виду возможность развития грибкового эндокардита. Диагноз его особенно труден из-за сложности обнаружения в крови дрожжевых грибов типа кандида. Мы наблюдали 2 случая грибкового эндокардита, которые закончились выздоровлением.
Клиническая диагностика септического эндокардита по типу возбудителя весьма трудна и без помощи бактериологической лаборатории никогда не может быть точной. Многие симптомы и данные исследований широко варьируют по сравнению с описанной картиной. Кроме того, выделение возбудителя из раны или крови еще не свидетельствует о том, что он является причиной септического эндокардита.
Ранняя диагностика послеоперационного септического эндокардита по клиническому течению не всегда возможна, в связи с чем большую ценность приобретают лабораторные методы исследования: бактериологические, иммунологические и биохимические. В частности, привлекают внимание некоторые ферменты, участвующие в окислительно-восстановительных процессах. Одним из таких ферментов является карбоангидраза, активность которой заметно снижается при септических состояниях, что может быть использовано в диагностике септического эндокардита. Снижение активности карбоангидразы обусловлено, по-видимому, интоксикацией бактерийными ядами и инактивацией фермента. Направленность изменений биохимических реакций, а также степень их отклонения от нормы имели у наших больных однотипный характер и зависели от тяжести состояния. Отчетливо изменялись в соответствии с тяжестью и стадией процесса, а также применяемой терапией содержание общего белка крови, белковых фракций, тимоловая проба, т. е. показатели, отражающие состояние белкового обмена.
При выраженном септическом эндокардите повышалось содержание гамма-глобулинов и снижался уровень альбуминов.
Эти данные свидетельствуют о том, что послеоперационному эндокардиту свойственна диспротеинемия и, в частности, относительная гипергаммаглобулинемия, которой мы придаем большое значение, считая устойчивое повышение количества гамма-глобулинов при длительном лечении эндокардита важным не только диагностическим, но и прогностическим критерием.
Таким образом, симптоматика послеоперационного эндокардита обусловлена главным образом интоксикацией, деструкцией ткани клапанов и эмболией. Поэтому многие симптомы неспецифичны. Наиболее ценным признаком является бактериемия. Забор крови на посев следует производить не менее 5 — 7 раз, с максимальной осторожностью, избегая случайного загрязнения пробы.
Сердечные шумы могут отсутствовать или быть незначительными. Но появление шума вместе с необъяснимой лихорадкой, особенно с клиникой периферической эмболии, должно вызывать подозрение на эндокардит. Выявление признаков эмболии имеет большое значение для дифференциации эндокардита и транзиторной бактериемии другого происхождения. Следует специально искать признаки эмболии в селезенку, почку, мозг, легкие, а также петехии на коже и слизистых.
Перечисленные формы госпитальной инфекции — нагноение операционной раны, пневмония, сепсис, септический шок, септический эндокардит — являются не только частыми, но и наиболее универсальными, типичными для хирургических клиник любого профиля.
В некоторых случаях возникновение этих форм госпитальной инфекции можно было связать с «входными воротами» инфекции: инфицирование верхних дыхательных путей во время искусственной вентиляции легких приводило к трахеобронхиту и пневмонии, операционной раны — к нагноению, внутривенное инфицирование (катетеры, инфузионная терапия) — к сепсису, септическому эндокардиту. Но чаще такую связь не удавалось установить. Сепсис обычно был следствием генерализации инфекции при других инфекционных осложнениях.
Клинические наблюдения свидетельствуют о том, что иммунологическая недостаточность создавала благоприятные условия для развития инфекции. К той или иной степени иммунологической недостаточности ведут тяжелая травма, в том числе и операционная, обширные или глубокие ожоги, некоторые диагностические и лечебные мероприятия, стероидные гормоны, иммунодепрессивные препараты и другие. Инфекционное осложнение, значительно ослабляя защитные силы, также может создать иммунологическую неполноценность, что приводит к утяжелению процесса или смене микрофлоры (например, нередко синегнойные осложнения развиваются на фоне стафилококковых и т. п.). Было подмечено, что осложнения, вызванные грамотрицательной микрофлорой, особенно синегнойной палочкой, развиваются у наиболее ослабленных (вмешательством или осложнением) больных. Иногда складывалось впечатление, что стафилококковое осложнение «прокладывало дорогу» синегнойному, отмечалась смена возбудителя. При сочетании нескольких возбудителей в инфекционном очаге применение антибиотиков способствовало преобладанию синегнойной палочки, к которой большинство антибиотиков устойчиво. Использование антибиотиков для санации стафилококковых бациллоносителей или в профилактических целях также всегда приводило к смене микрофлоры — кокковой на палочковую.
При посевах в качестве основного возбудителя определялся «госпитальный» штамм стафилококка, на втором месте синегнойная или кишечная палочка, а также клебсиелла, энтеробактерий, эшерихия коли, протей, дрожжевые грибки и другие микроорганизмы. Течение и особенности этих осложнений определялись тем, что они возникали, как правило, у наиболее тяжелых больных и сочетались друг с другом или следовали одно после другого.
У некоторых больных с момента операции в течение 7 — 10 дней отмечалась так называемая «послеоперационная лихорадка». Температурная реакция имела вечерние подъемы, колебания в 1 — 1,5°. Лихорадка не сопровождалась никакими проявлениями инфекционного осложнения. Она не была связана с медикаментозной идиосинкразией, аллергией или пирогенными реакциями другого происхождения. Причину этих гипертермии выяснить не удалось. Подобные лихорадки мы относили к псевдоинфекционным.
Среди других проявлений госпитальной инфекции (в каждой клинике они могут быть специфичны) наиболее часто встречались перитониты, тромбофлебиты, паротиты, постинъекционные абсцессы, септический менингит, артрит и др. Нередко отмечались асептические флебиты и тромбофлебиты. Они были связаны с погрешностями техники инфузионной терапии и ведения больных. Подобные осложнения к проявлениям госпитальной инфекции не следует относить, хотя разграничить их бывает довольно сложно.
В больничных условиях отмечаются случаи госпитальной инфекции, не связанные с хирургическими вмешательствами. Некоторые из них следуют за теми или иными диагностическими или лечебными процедурами, при которых возможна травма. Таковы септические осложнения различных инъекций, трансфузий, катетеризации и др. В хирургических и терапевтических отделениях у больных могут развиваться такие проявления госпитальной инфекции, как пневмония, фурункулез, энтероколиты и др. Опубликовано много сообщений о вспышках фурункулеза в терапевтических и хирургических, а также акушерских и психиатрических клиниках. Это одно из тех стафилококковых заболеваний, которое в равной мере поражает больных и персонал, при этом всегда обнаруживается госпитальный штамм золотистого стафилококка.
Энтероколит также может вызываться госпитальным штаммом стафилококка. Заболевание характеризуется внезапным появлением профузного поноса и циркуляторного коллапса у больного, получавшего антибиотики. Чаще всего такой энтероколит наблюдается после лечения тетрациклином и неомицином. При этом в просвете кишечника начинают размножаться стафилококки. Возбудитель, как правило, устойчив к тому антибиотику, который получал больной.
Синегнойные энтероколиты могут быть проявлением пище- вой токсикоинфекции или результатом дисбактериоза при лечении антибиотиками. Синегнойная палочка размножается в просвете кишечника и вызывает воспалительные изменения, интенсивность которых нарастает от катарального (в желудке и тощей кишке) до фибринозно-гнойного (в подвздошной и толстой кишках). В слизистой оболочке могут возникать очаги некроза циркуляторного характера с последующим образованием эрозий и поверхностных язв.
Таким образом, проявления госпитальной инфекции весьма многообразны. Все они, как правило, результат экзогенного инфицирования и связаны единым возбудителем, так называемым «госпитальным штаммом», вегетирующим в данном лечебном учреждении. Мы представили краткую характеристику клиники и диагностики основных проявлений госпитальной инфекции. Нам представлялось целесообразным, обобщая опыт диагностики этих осложнений, остановиться лишь на некоторых принципиальных вопросах.
Септический (бактериальный) эндокардит
Септический (бактериальный) эндокардит — особая форма сепсиса, для которой характерно наличие септического очага на клапанах сердца и гиперергии, поэтому ее рассматривают как бактериальную септицемию.
Этиология и патогенез. Наиболее частые возбудители — белый и золотистый стафилококк, зеленящий стрептококк (его L-формы и мутанты), энтерококки. В последние годы возросла этиологическая роль грамотрицательных бактерий — кишечной и синегнойной палочек, протея, клебсиеллы, а также патогенных грибов. В ответ на антигены всех перечисленных возбудителей образуются антитела, и в кровь больных поступают циркулирующие токсические иммунные комплексы. В связи с воздействием циркулирующих токсических иммунных комплексов развиваются реакции гиперчувствительности, которые и составляют сущность гиперергии при бактериальном эндокардите.
Классификация. Септический (бактериальный) эндокардит разделяют по характеру течения и по наличию (или отсутствию) фонового заболевания.
По характеру течения выделяют острый, подострый и затяжной (хронический) бактериальный эндокардит. Острый эндокардит в настоящее время практически не встречается, продолжительность его около 2 нед. Продолжительность подострого — около 3 мес и затяжного (хронического) — несколько месяцев, а иногда и несколько лет.
В зависимости от наличия или отсутствия фонового заболевания различают 2 вида септического эндокардита:
1) первичный септический эндокардит, или болезнь Черногубова. Эта форма сепсиса характеризуется тем, что развивается на неизмененных клапанах. Она составляет 20—30 % случаев септического эндокардита и в последние годы эта цифра увеличивается;
2) вторичный септический (бактериальный) эндокардит. Эта форма сепсиса встречается гораздо чаще (70—80 % всех случаев септического эндокардита) и характеризуется тем, что развивается на фоне порока сердца чаще всего при ревматизме, реже при атеросклерозе, сифилисе и еще реже — на фоне врожденного порока сердца. Особое место занимает эндокардит, который развивается на протезированных клапанах.
Патологическая анатомия. Складывается из местных и общих изменений.
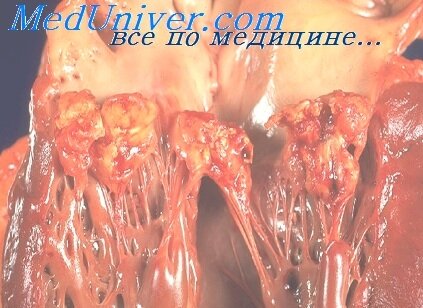
Местные изменения — это изменения в септическом очаге, т.е. на клапанах. Обычно поражены клапаны аорты, реже — левый предсердно-желудочковый (митральный) клапан или оба эти клапана вместе. Процесс на неизмененных и на склерозированных клапанах носит название полипозно-язвенного эндокардита. На клапанах появляются обширные изъязвления, иногда часть створки клапана отрывается или же возникают отверстия в створках (фенестры) в связи с перфорацией их; на язвах появляются крупные в виде полипов тромботические наложения, которые легко крошатся и пропитываются известью. В ряде случаев тромботические наложения располагаются не только на клапанах, но и на пристеночном эндокарде, а при поражении аортальных клапанов — распространяются на внутреннюю оболочку аорты.
При микроскопическом исследовании в створках клапанов выявляются обширные очаги некроза, вокруг которых наблюдается лимфогистиоцитарная инфильтрация, при этом среди клеток инфильтрата видны колонии бактерий. В участках некроза выявляются массивные старые организованные тромбы, иногда с отложениями кальция.
Описанные морфологические изменения характерны для первичного септического эндокардита. При вторичном септическом эндокардите отличие заключается лишь в том, что макро- и микроскопически выявляется, в дополнение к описанному, яркая морфология порока — склероз, гиалиноз, обызвествление и выраженная деформация створок клапана.
Общие изменения характеризуются поражением внутренних органов. Селезенка при септическом эндокардите увеличена, с резко напряженной капсулой. Пульпа ее малинового цвета, дает обильный соскоб. Гистологически выявляется выраженная гиперплазия лимфоидной ткани и полнокровие красной пульпы — септическая селезенка. Часто в ней обнаруживают инфаркты разной давности.
В связи с циркуляцией иммунных комплексов отмечается генерализованное поражение сосудов, в них развивается альтеративно-продуктивный васкулит, при этом воспалительные изменения отмечают прежде всего в сосудах микроциркуляторного русла в виде эндо- или периваскулита. В результате диффузного поражения возможно развитие аневризм в сосудах мелкого и среднего калибра, разрыв которых в жизненно важных органах (например, в головном мозге) может оказаться смертельным. В стенках сосудов нередко развивается фибриноидный некроз, что приводит к резкому повышению сосудистой проницаемости, развивается плазморрагия и появляются многочисленные диапедезные кровоизлияния. Множественные петехиальные кровоизлияния появляются на коже, слизистых и серозных оболочках, в конъюнктиве глаза развивается геморрагический синдром.
В почках при септическом эндокардите развивается иммунокомплексный диффузный гломерулонефрит, а также нередко возникают инфаркты и рубцы после них.
В связи с наличием массивных тромботических наложений на клапанах при септическом эндокардите неизбежно развиваются тромбоэмболические осложнения, а так как источником тромбоэмболии являются аортальный и/или митральный клапаны, то развиваются многочисленные инфаркты в органах большого круга кровообращения — в почках, селезенке, головном мозге, т.е. речь идет о тромбоэмболическом синдроме.
Циркулирующие иммунные комплексы нередко оседают на синовиальных оболочках, поэтому при септическом эндокардите развиваются артриты.
Очень характерны периферические признаки септического эндокардита. Среди них выделяют:
1) пятна Лукина—Либмана — петехиальные кровоизлияния в конъюнктиве глаз нижнего века у внутреннего угла;
2) узелки Ослера — узелковые утолщения на ладонных поверхностях кистей;
3) пальцы в виде барабанных палочек;
4) очаги некроза в подкожной клетчатке;
5) пятна Джейнуэя — кровоизлияния в кожу и подкожную клетчатку.
Патоморфоз. За последние десятилетия значительно изменились и клиническая, и морфологическая картины септического эндокардита. В частности, на фоне массивной антибактериальной терапии клиницисты успешно ликвидируют септический очаг на клапанах сердца, в связи с чем резко снизилась летальность. Практически исчезли острые формы течения бактериального эндокардита. Однако массивная противовоспалительная терапия усиливает и ускоряет развитие и созревание вегетации на створках и в створках клапанов. Это приводит к значительному склерозу и деформации створок клапанов. В результате у людей с первичным септическим эндокардитом после "успешного" лечения сепсиса происходит формирование порока сердца, а у лиц с уже имеющимся пороком последний после излечения сепсиса становится значительно тяжелее, более выраженным — усиливаются склероз, гиалиноз и резкая деформация клапанов. Все это в очень короткие сроки приводит к инвалидизации больных.
Патоморфоз бактериального эндокардита коснулся не только морфологии — изменилась этиология (раньше был только зеленящий стрептококк), клинические проявления и исходы заболевания.