Дайджест » Современные рекомендации » Обновлены рекомендации по лечению мерцательной аритмии
 Американские кардиологи обновили рекомендации по ведению пациентов с мерцательной аритмией. Предыдущий документ 2006 года не изменялся с 2011 года.
Американские кардиологи обновили рекомендации по ведению пациентов с мерцательной аритмией. Предыдущий документ 2006 года не изменялся с 2011 года.
Специалисты Американской ассоциации сердца (American Heart Association), Американского колледжа кардиологии (American College of Cardiology) и Общества сердечного ритма (Heart Rhythm Society)выпустиликонсолидированное руководство по ведению пациентов с мерцательной аритмией.
Эксперты предложили включить в стандарт лечения оральные антикоагулянты нового поколения, при этом они не рекомендуют какое-либо конкретное лекарственное средство, так как нет прямых сравнительных исследований. Лечащий врач может прописать один из следующих препаратов: дабигатран (Прадакса) производства компании Boehringer Ingelheim, ривароксабан (Ксарелто) производства фармацевтических компаний Bayer и Johnson&Johnson, апиксабан (Эликвис) фармацевтических компаний Bristol-Myers Squibb и Pfizer либо варфарин. Данное лечение должно назначаться пациентам с мерцательной аритмией неклапанной природы, если МНО у них не может стабильно поддерживаться на уровне 2,0-3,0.
При выборе препарата необходимо учитывать, что дабигратан противопоказан пациентам с механическим клапаном сердца, а дабигатран и ривароксабан не следует применять при конечных стадиях болезни почек или при гемодиализе.
Среди новых рекомендаций следует отметить расширение показаний радиочастотной абляции для лечения неклапанной формы мерцания предсердий, так как доказано ее преимущество перед терапией лекарственными средствами.
Также эксперты предлагают заменить традиционную шкалу оценки риска инсульта CHADS2 на более развернутую CHA2DS2-VASc. Новая шкала помимо сердечной недостаточности, гипертензии, инсульта в анамнезе, диабета, учитывает также пол, возраст пациента с 65 по 74 лет, а также болезни сосудов.
Авторы рекомендаций обращают внимание, что при назначении лечения пациентам с мерцательной аритмией необходимо подбирать наилучшую терапию с минимальными рисками, а также особое внимание уделять лечению пожилых пациентов.
Современные стратегии лечения и выявление предикторов рецидива мерцательной аритмии
Номер журнала: апрель 2012
О.С.Ваниева, Б.А.Сидоренко
ФГУ «Учебно-научный медицинский центр» УД Президента РФ, Москва
Мерцательная аритмия (МА) остается одним из самых распространенных видов нарушения ритма сердца. Наиболее грозным осложнением МА являются артериальные тромбоэмболические события с высоким риском инвалидизации и смертности. При этом взвешенный и обоснованный выбор терапевтической стратегии, а также профилактика тромбоэмболических событий определяют прогноз пациентов с МА. В настоящей статье обсуждаются преимущества и недостатки удержания синусового ритма; разные подходы к восстановлению синусового ритма; вопросы профилактики тромбоэмболических осложнений; возможные предикторы рецидива МА.
Ключевые слова: мерцательная аритмия, стратегия лечения, кардиоверсия, предикторы рецидива.
Current strategies of treatment and prediction of recurrence of atrial fibrillation
O.S.Vanieva, B.A.Sidorenko
Educational and Scientific Centre of the Executive Office of President of the Russian Federation, Moscow
Atrial fibrillation (AF) remained one of the most widespread cardiac arrhythmia. Most unfavorable consequence of AF is arterial (systemic) thromboembolysm. Advantages and shortcomings of rhythm and rate control, different approaches to cardioversion, prevention of thromboembolic complications and possible predictors of recurrence of AF are discussed.
Key words: atrial fibrillation, strategy of treatment, cardioversion, predictors of recurrence.
Сведения об авторе:
Ваниева Ольга Сергеевна – к.м.н. ФГУ «УНМЦ» Управления Делами Президента РФ
Сидоренко Борис Алексеевич – д.м.н. профессор, зав. кафедрой кардиологии и общей терапии ФГУ «УНМЦ»
Управления Делами Президента РФ
Основным источником данных по распространенности и заболеваемости мерцательной аритмией (МА) остается Фремингемское исследование, согласно которому МА является одним из наиболее частых предсердных нарушений ритма сердца [55]. В РФ МА ответственна за 1/3 всех госпитализаций по поводу нарушения ритма [3]. МА вызывает снижение или потерю трудоспособности, ухудшение качества жизни и уменьшение ее продолжительности в связи со значительной частотой развития осложнений [9, 38, 52]. По данным Фремингемского исследования, ежегодный риск инсульта у больных с МА составляет 2,5% и увеличивается с возрастом: от 1,5% в год у лиц 50–59 лет, до 23,5% в год у лиц 80–89 лет [55]. Все это определяет необходимость своевременного лечения МА, одной из важнейших составляющих которого является восстановление синусового ритма (СР). Однако даже с учетом большого опыта, накопленного клинической медициной, более сложной и многоплановой задачей является поддержание синусового ритма после его восстановления.
Несмотря на большое число исследований, публикаций и рекомендаций на сегодняшний день отсутствуют гарантии полной адекватности проводимой противорецидивной медикаментозной терапии у больных с МА, что в ряде случаев не позволяет своевременно провести коррекцию схемы лечения и предотвратить возможные осложнения. Поэтому понятен интерес кардиологов во всем мире к поиску прогностических факторов рецидивирования МА. Настоящая статья является литературным обзором, в котором обсуждаются преимущества и недостатки удержания синусового ритма; разные подходы к восстановлению синусового ритма; вопросы профилактики тромбоэмболических осложнений; возможные предикторы рецидива МА.
К основным вариантам клинического течения мерцательной аритмии относят пароксизмальную и постоянную формы мерцательной аритмии. American College of Cardiology, American Heart Association и European Society of Cardiology предложили считать пароксизмальной мерцательной аритмией случаи, когда аритмия прекращается самостоятельно. Если синусовый ритм восстанавливается с помощью лечебных мероприятий (медикаментозная или электрическая кардиоверсия), такой вариант предложено называть персистирующей мерцательной аритмией, а постоянной мерцательной аритмией считают случаи, когда синусовый ритм восстановить не удается (или такие попытки не предпринимались) [ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation, 2010, 2011 ACCF/ AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation].
Несовершенность существующей классификации МА подчеркивает значительное разнообразие больных, клинические проявления у которых отличаются по частоте приступов, длительности, варианту окончания, выраженности симптомов.
В этой связи, чаще используют разделение МА на пароксизмальную и постоянную формы [16]. Различаются они только по продолжительности аритмии независимо от эффективности лечебных мероприятий.
Благодаря рекомендациям ЕОК, ААС и АКК [ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation, 2010; 2011 ACCF/AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation] минимальные обследования при МА хорошо известны и стали рутинными в повседневной практике кардиолога. Гораздо сложнее дать жесткие рекомендации по терапии МА, с помощью которых можно было бы уверенно назначать тот или иной вид лечения.
Современные лечебные стратегии при МА
Согласно современным представлениям существуют четыре основные стратегических направления при лечении МА: восстановление СР, его удержание, контроль ЧСС при сохраняющейся МА и профилактика тромбоэмболических осложнений [ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation, 2010, 2011 ACCF/AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation]. При этом под стратегией понимается четкое осознание врачом тех способов, посредством которых он может улучшить пациенту качество жизни и увеличить ее продолжительность [14].
Восстановление и удержание синусового ритма: за и против
В последние десятилетия проведено несколько широкомасштабных исследований, результаты которых существенно повлияли на тактику лечения больных с МА [EAFT, 1993; Atriаl fibrillation investigators, 1995; J. Waktare, 1998; PIAF, 2002]. Прежде всего, установлено, что во многих случаях МА является всего лишь симптомом определенных заболеваний, а не отдельной нозологической формой, и часто не нуждается в экстренном лечении.
В ряде исследований (PIAF, 2002, и др.) было показано, что контроль частоты сокращений сердца (ЧСС) более важен, чем контроль и удержание синусового ритма. В течение длительного (более 3 лет) лечения больных с пароксизмальной МА установлено отсутствие различий по уровню смертности и частоте возникновения других исходов (инфаркт миокарда, инсульт) между группами пациентов с поддержкой синусового ритма и больными с контролем ЧСС и профилактикой тромбоэмболии. Также, по данным M.A. Allessie [18] и M.J. Mihlm [45], активное восстановление и медикаментозная поддержка синусового ритма способствуют возникновению частых побочных действий или проаритмогенных эффектов.
Тем не менее, тактика восстановления и удержания синусового ритма при МА имеет много сторонников и по-прежнему содержится в рекомендациях Европейского Общества Кардиологов по диагностике и лечению МА. Доказана высокая смертность у больных с постоянной формой МА (16,7 % в течение ближайших 3 лет [AFFIRM, 2002] и увеличение риска развития инсультов в 5–7 раз.
Сохранение и поддержка синусового ритма имеют определенные преимущества [1, 2]:
при синусовом ритме:
• сохраняется наиболее оптимальный контроль ЧСС;
• регуляция ритма сердца происходит физиологически;
• происходит восстановление насосной функции предсердий;
• улучшается кардиогемодинамика;
• сохраняется нормальная электрофизиология сердца;
• предупреждается дилатация левого предсердия и уменьшается вероятность дисфункции левого желудочка;
• уменьшается вероятность тромбоэмболических осложнений;
• улучшается качество жизни в связи с отсутствием симптоматики аритмии.
Cледует помнить, что до 38% приступов МА могут быть купированы применением плацебо [21]. Кроме того известно, что асимптомная (малосимптомная) МА давностью до 48 часов не является угрожающим для жизни состоянием, и по данным разных авторов в 30–70% случаев склонна к конверсии в синусовый ритм в течение первых двух суток от ее возникновения [26, 30, 53].
Таким образом, при «привычных», не очень частых, но и не очень редких приступах вопрос об их устранении приходится каждый раз разрешать индивидуально [A.B. Недоступ, 2001]. Длительность МА является наиболее важным фактором, определяющим возможность спонтанного восстановления синусового ритма, причем тенденция к спонтанному восстановлению уменьшается с увеличением длительности МА [15, П.Х. Джанашия, 2005].
Контроль частоты сердечных сокращений
На фоне МА могут возникать ситуации, когда необходимо осуществить контроль частоты сердечных сокращений (ЧСС). Вариабельность сердечного ритма при МА дает дополнительную информацию о вегетативной нервной системе, которая может иметь независимые прогностические показания. Пациенты, у которых присутствуют частые желудочковые ответы в течение эпизода МА, могут иметь массу симптомов. Если частый желудочковый ответ сопряжен с гипотонией, стенокардией или застойной ХСН, рекомендована отрицательная хронотропная терапия, при необходимости – проведение кардиоверсии.
При длительном сохранении частого желудочкового ритма возможно ухудшение желудочковой функции (вызванная тахикардией кардиомиопатия). Последняя обратима, если ЧСС становится контролируемой. Также контроль ЧСЖ важен, когда у пациентов с МА восстановление синусового ритма невозможно или не предпринималось.
Кардиоверсия
Несмотря на то что медикаментозная кардиоверсия стала стандартной процедурой в лечении пароксизмальной МА, а разработка и внедрение фармакологических препаратов способствовали ее популярности, существуют и отрицательные стороны методики: большая длительность процедуры сравнению с ЭИТ; меньшая эффективность по результатам контролируемых исследований, возможность возникновения проаритмогенных эффектов, большее количество осложнений и меньшая экономичность [A.B. Недоступ, 2001].
По данным многоцентровых рандомизированных плацебо-контролируемых исследований, доказана высокая эффективность ЭИТ – 85% и выше, тогда как медикаментозная конверсия результативна в 15–80 % случаев [33, PIAF, 2002].
Электроимпульсная терапия или электрическая кардиоверсия представляет собой электрический разряд прямым током, синхронизированный с деятельностью сердца, обычно по R-волне кардиограммы (вне уязвимой стадии сердечного цикла: 60–80 мс до и 20–30 мс после вершины T-волны). Для электрической кардиоверсии при МА рекомендуется начальная энергия 200 Дж или выше.
Существуют устройства, которые вырабатывают ток с двухфазной формой волны; они достигают кардиоверсии при более низких уровнях энергии, чем те, которые используют монофазную форму волны [13].
Наиболее распространенным вариантом ЭИТ является наружная или трансторакальная дефибрилляция, при которой электроды располагают на поверхности грудной клетки (один из них – над областью сердца). Альтернативой наружной дефибрилляции может служить трансвенозная предсердная дефибрилляция, при которой синхронизированный с волной R двухфазный электрический импульс при помощи специального катетера наносится между правым предсердием и коронарным синусом или же между правым предсердием и левой легочной артерией [41; Boriani, 1999]. Проведенное E.Alt [19] проспективное перекрестное исследование, в которое были включены 187 пациентов с постоянной МА, показало, что по сравнению с наружной внутрисердечная кардиоверсия достоверно чаще восстанавливает синусовый ритм (в 93 и 79% случаев соответственно), особенно у тучных пациентов и пациентов с хроническими обструктивными заболеваниями легких, требует значительно меньшей энергии и обеспечивает лучшее сохранение синусового ритма. При этом безопасность указанных методов восстановления синусового ритма была практически одинаковой. Внутренняя кардиоверсия с низкой энергией не требует общей анестезии, но выполняется под седацией пациента.
Показания к внутренней кардиоверсии могут включать имплантацию ЭКС, дефибрилляторов или насосов для вливания препаратов [17].
Противопоказаниями для ЭИТ являются [7, 8]:
1. Частые, кратковременные пароксизмы МА, купирующиеся самостоятельно или медикаментозно.
2. Постоянная форма мерцательной аритмии при:
• давности свыше 3 лет;
• неизвестной давности;
• кардиомегалии;
• синдроме Фредерика;
• гликозидной интоксикации;
• ТЭЛА до 3 мес;
• активном ревматическом процессе.
Следует подчеркнуть, что задача безопасности процедуры ЭИТ решается путем соблюдения стандартных правил медикаментозной подготовки, правильного отбора больных, использования у больных с худшим состоянием миокарда кардиосинхронизированного нанесения разряда, а сведение к минимуму угрозы ТЭО достигается назначением непрямых антикоагулянтов за 3 нед до и 4 нед после ЭИТ или проведением чреспищеводной эхокардиографии с возможным сокращением срока подготовки антикоагулянтами [A.B. Недоступ, 2001].
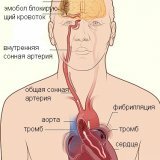
Развитие тромбоэмболических осложнений
Согласно международным рекомендациям по ведению больных с МА, даже отсутствие тромба при ЧПЭхоКГ не исключает развитие ТЭО (так называемых «нормализационных» тромбоэмболий) после восстановления синусового ритма [17].
Причиной развития данного осложнения считается транзиторная механическая дисфункция ЛП и его ушка (так называемая «станация»), которая может наблюдаться после спонтанной, фармакологической или электрической кардиоверсии, а также радиочастотной катетерной аблации [12, 46]. Парадоксальное угнетение механической функции ЛП и УЛП после успешной кардиоверсии зарегистрировано многими авторами [31, 46, 47]. Станирование предсердий встречается в 38-80% случаев и увеличивает вероятность формирования тромба в УЛП уже после кардиоверсии [11, 34]. Наиболее часто используемый для диагностики станирования предсердий параметр – феномен спонтанного контрастирования (ФСК) [4].
Возможными механизмами станирования предсердий считают индуцированную тахикардией миопатию предсердий и состояние длительной гибернации предсердий на фоне МА [51].
Восстановление механической функции может задерживаться на несколько недель. Длительность этого периода зависит от продолжительности МА до кардиоверсии, размеров предсердия, сопутствующей кардиальной патологии [6, 39, 51].
Согласно рекомендациям Американской коллегии кардиологов, Американской Ассоциации сердца и Европейского кардиологического общества по ведению больных с МА, к клиническим предикторам тромбоэмболических осложнений относят: пол, возраст, артериальную гипертензию, застойную сердечную недостаточность, сахарный диабет, перенесенный инсульт или ТИА, наличие сосудистых заболеваний (табл. 1).
Кроме того, большинство авторов относят к группе низкого риска развития ТЭО больных, у которых с помощью ЧПЭхоКГ не выявлено тромба, ФСК, а скорость выброса из УЛП больше 0,25 м/с. Ранее считалось, что у таких больных можно проводить кардиоверсию без предварительной терапии антикоагулянтами [A.Roijer, 1999]. Однако с учетом современных представлений, всем больным с длительностью МА более 48 часов рекомендовано проведение антикоагулянтной терапии как до, так и после кардиоверсии [ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation, 2010, 2011 ACCF/AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial Fibrillation].
Хорошо известно, что адекватная терапия непрямыми антикоагулянтами у больных с МА может реально улучшить результаты лечения. Проведено большое число исследований, доказавших эффективность приема варфарина у больных с МА. К сожалению, в реальной клинической практике антикоагулянтному лечению больных с МА уделяется крайне малое значение. В одной из наших работ мы обследовали больных с МА, поступающих для восстановления ритма в обычную городскую больницу г. Москвы. Из 144 больных, имевших показания для применения непрямых антикоагулянтов, ни один (!!) до поступления не получал эти препараты. При этом больные не имели противопоказаний и в последующем были успешно лечены варфарином. Обследование выявило тромбоз левого предсердия у каждого четвертого больного из этой группы.
В соответствие с действующими сегодня рекомендациями для определения показаний к назначению варфарина у пациентов с фибрилляцией предсердий необходимо использовать критерии оценки риска по шкале CHA2DS2-VASc (табл. 2). Известно, что показанием к применению пероральных антикоагулянтов при МА является 2 и более баллов по шкале CHA2DS2-VASc.
Кроме этого, в новой редакции европейских рекомендаций приведена шкала стратификации риска геморрагических осложнений HAS-BLED (табл. 3).
Контроль МНО является обязательным условием при использовании варфарина, так как позитивное действие препарата лежит в узких значениях МНО от 2 до 3. МНО менее двух означает, что лекарство не оказывает должного антикоагулянтного эффекта. При МНО более 3 – значительно возрастает риск геморрагических осложнений.
Однако даже при соблюдении всех правил контроля за пациентами, получающими варфарин, не всегда удается удерживать больного в целевом диапазоне МНО.
На эффективность препарата может оказывать влияние большое количество факторов: нарушение функции щитовидной железы, сопутствующая медикаментозная терапия, генетические факторы, прием алкоголя. От количества поступающего с пищей витамина К также может зависеть эффективность варфаринотерапии.
Среди продуктов питания наиболее высокое содержание витамина К в зеленом чае – 712 мкг/100 г, шпинате – 415 мкг/100 г, соевом масле – 193 мкг/
100 г, салате – 123/100 г, печени – 93 мкг/100 г. Достаточно много витамина К и в кофе, сливочном масле, сыре, яйцах. Все эти продукты могут влиять на МНО, понижая эффективность препарата при увеличении потребления витамин К-содержащих продуктов или, наоборот, усиливая действие при резком отказе от подобных продуктов.
Поэтому при наличие такого количества факторов, способных повлиять на эффективность варфаринотерапии, использование этого препарата требует большого внимания со стороны врачей и медицинского персонала, а также особого поведения самих больных. Организация мониторного контроля за антикоагулянтной терапией, в этой связи, является важнейшей частью практической работы, а степень приверженности пациентов лечению в большой степени определяет эффективность и безопасность терапии.
Рецидив мерцательной аритмии
После успешной кардиоверсии возможен рецидив МА вне зависимости от методики восстановления синусового ритма [48, 50]. У 56% больных МА рецидивирует в первые 4 нед после кардиоверсии, а риск рецидива в первый год после кардиоверсии варьирует, по разным сведениям, от 20 до 80% [23, 28, 48].
При отсутствии профилактической антиаритмической терапии МА рецидивирует с частотой 44–85% через 12 мес после кардиоверсии. Если проводится профилактическая антиаритмическая терапия, то риск рецидива снижается, и повторный приступ МА возникает преимущественно в течение первого месяца после кардиоверсии [40, 42].
Прогностические факторы рецидива МА
Несмотря на большое число исследований, публикаций и рекомендаций на сегодняшний день отсутствуют гарантии сохранения синусового ритма при МА, что в ряде случаев не позволяет своевременно провести коррекцию схемы лечения и предотвратить возможные осложнения. Поэтому понятен интерес, кардиологов во всем мире к поиску независимых критериев или предикторов риска рецидива у пациентов с МА.
O.T.Gurevitz [2006], обследовав 773 больных МА после ЭИТ, установил, что риск рецидива аритмии у женщин достоверно выше, чем у мужчин (50,0 и 43,4% соответственно в течение 1 года и 75,8% и 67,0% соответственно в течение 2 лет). Однако в выборке больных – женщины были старше и характеризовались большим количеством фоновых СС заболеваний. Несмотря на это, автор предлагает учитывать пол пациентов в качестве предиктора течения МА после ЭИТ.
Противоположные результаты получены A.EIhendy [27] в исследовании с участием 692 больных, в котором успех ЭИТ при МА не зависел от возраста, пола, присутствия системной гипертензии, ИБС или клапанных заболеваний сердца. Клиническими переменными, ассоциированными с рецидивом МА, были большая масса тела, продолжительность МА и присутствие идиопатической ДКМП. По мнению авторов, связь неудачной ЭИТ с большей массой тела и индексом массы тела может отражать зависимое от массы увеличение электрического импеданса, который нарушает проведение разряда к предсердиям. Связь неудачной ЭИТ с длительностью МА может указывать на электрическое и механическое ремоделирование, что косвенно подтверждает концепцию о природе МА. В исследовании также были подтверждены структурные изменения миоцитов ЛП, которые могут быть адаптивными (де-дифференциация кардиомиоцитов) или прогрессирующими (дегенерация клеток с заместительным фиброзом). Эти изменения были более выражены у пациентов с длительной МА, однако, учитывая высокий процент положительных результатов, эти изменения нельзя считать ключевыми факторами неудержания синусового ритма. Единственным заболеванием, ассоциированным с высоким процентом неудачных ЭИТ была идиопатическая ДКМП.
Известно, что снижение систолической функции при ДКМП и последующее повышение давления наполнения ЛП может влиять на электрическую активность предсердия. Систолическая дисфункция ЛП, не объясняемая перегрузкой, расценивается, как идиопатическая ДКМП, подразумевая вовлечение ЛП в миопатический процесс. Считается, что эти изменения могут независимо влиять на ответ на ЭИТ у пациентов с ДКМП [9]. Однако в результате исследования A.EIhendy не было получено значимых различий в размерах ЛП, толщине МЖП и ЗС или систолического давления в ЛА между пациентами с удачной и неудачной кардиоверсиями. Пациенты с безуспешной кардиоверсией имели меньшую фракцию выброса ЛЖ.
По B.Amasyali [20], риск рецидива особенно высок у пожилых людей с дилатацией ЛП, которую H.Jiang [37] называет единственным независимым предиктором рецидива МА. Однако в том же году в исследовании L.A.Geddes [32] с использованием имплантированных дефибрилляторов у 6 взрослых овец отметил, что минимальные требования по заряду для успешной кардиоверсии значимо не отличались при продолжающейся дилатации ЛП.
I.A.Paraskevaidis и соавт. [49] обследовав группу из 78 пациентов (средний возраст 59 лет) с первым эпизодом идиопатической МА длительностью от 48 ч до 6 мес, проспективно оценивали прогностическое значение эхокардиографических предикторов успешности электрической кардиоверсии и последующего удержания синусового ритма. Два предиктора наиболее сильно предсказывали эффективность кардиоверсии: степень переднезаднего укорочения левого желудочка (>30%) и скорость кровотока в области ушка левого предсердия (>20 см/с), по данным импульсного допплеровского режима чрезпищеводной ЭхоКГ. Сохранение синусового ритма в течение года после кардиоверсии успешно прогнозировала исходная комбинация чрезпищеводных ЭхоКГ-предикторов: отсутствие раннего систолического движения митрального кольца в М-режиме (т.н. «зазубрины») и скорость кровотока в области ушка левого предсердия >20 см/с.
Таким образом, проведенные исследования в отношении выделения определенных структурно-функциональных параметров в качестве критерия рецидива МА противоречивы и недостаточны, что требует их дальнейшего изучения.
Установлено, что системное воспаление с повышенным уровнем циркулирующего СРБ может вызывать МА у пациентов, имеющих триггерные очаги в предсердиях или легочных венах, однако проведенные исследования, направленные на установление ассоциации уровня СРБ и МА, единичны и несистематизированы [44]. Более подробно изучена связь воспалительных маркеров и протромботических нарушений при МА [24, 25]. Так, на большой группе больных с мерцательной аритмией (исследование Stroke Prevention in Atrial Fibrillation (SPAF) III) было показано, что уровень СРБ является независимым предиктором инсульта, что согласуется с данными H. Jiang [37], установившего корреляцию уровня СРБ с увеличением риска инсульта по критериям CHADS2 и NICE.
В ряде исследований отмечена корреляция уровня СРБ и частоты удержания СР после ЭИТ. Так, в исследовании М.Hammwohner [35] через 5 нед после успешной кардиоверсии отмечалось снижение уровня СРБ, при этом уровни протромботических маркеров ICAM-1, VCAM-1, МХФ-1 и СД40 оставались высокими, что, возможно, является одним из механизмов тромбоэмболических осложнений после кардиоверсии. Сходные данные получены в исследовании C.J. Boos [22].
По результатам метаанализа Т.Liu и соавт. [43] с участием 420 пациентов установлено, что у пациентов с рецидивом МА после ЭИТ достоверно отмечался исходно низкий уровень СРБ.
По мнению A.H. Madrid [44], дальнейшее изучение взаимосвязи МА и воспаления является перспективным направлением поиска предиктора удержания синусового ритма.
Заключение
Таким образом, в отсутствие адекватной терапии МА имеет крайне неблагоприятный прогноз и высокий риск развития осложнений. Практикуемая в настоящее время лечебная тактика в ряде случаев демонстрирует свою недостаточную эффективность. Наиболее актуальной задачей на современном этапе является выявление групп риска рецидива МА, с целью коррекции схемы лечения и предотвращения осложнений. Результаты многочисленных клинических исследований доказали диагностическую и прогностическую ценность ряда структурно-функциональных и лабораторных предикторов рецидива у больных с МА. Однако налицо значительная разрозненность и противоречивость данных. Учитывая изложенное, представляет интерес дальнейшее изучение возможности прогнозирования течения МА для оптимизации тактики ведения таких пациентов.
Литература
1. Батушкин В.В. Науменко Е.В. Эффективная фармакологическая поддержка синусового ритма у больных с персистирующей формой фибрилляции предсердий. Укр. кардіол. журн. 2005; 2: 65–70.
2. Бунин Ю.А. Лечение фибрилляции и трепетания предсердий. Лечащий Врач. 2002; 7–8: 22–25.
3. Горбась И.М. Соловьян А.Н. Сычов О.С. и соавт. Эпидемиологическая оценка распространенности различных форм фибрилляции-трепетания предсердий и клиническое исследование факторов их возникновения. «Порушення ритму серця: сучасні підходи до лікування», Пленум правління асоціації кардіологів України. – К. Європа принт, 2005; 28–29.
4. Зотова И.В. Затейщиков Д.А. Сидоренко Б.A. Выявление и морфофункциональные предикторы тромбоза в ушке левого предсердия у больных с мерцательной аритмией. Кардиология. 2004; 6: 60–65.
5. Джанашия П. Х. Назаренко В. А. Николенко С. А. Мерцательная аритмия: современные концепции и тактика лечения. М. РГМУ, 2001; 567.
6. Канорский С.Г. Зингилевский К.Б. Мироненко М.Ю. Восстановление функции левого предсердия после кардиоверсии мерцательной аритмии: роль некоторых клинических и эхокардиографических факторов. Кардиология. 2002; 2: 46–51.
7. Кушаковский М.С. Аритмии сердца. Нарушение сердечного ритма и проводимости. СПб: Фолиант; Издание 3-е, 2004; 672.
8. Кушаковский М.С. Фибрилляция предсердий (причины, механизмы, клинические формы, лечение и профилактика). СПб. Фолиант, 1999; 454.
9. Мазур Н.А. Пароксизмальные тахикардии. М. ИД Медпрактика-М, 2005; 252.
10. Мазур Н.А. Фибрилляция предсердий.Справочник поликлинического врача. 2002; 4: 10–15.
11. Панченко Е.П. Добровольский А.Б. Тромбозы в кардиологии. Механизмы развития и возможности терапии. М. 1999; 217.
12. Сыркин А.Л. Добровольский А.В. Тактика лечения больных с постоянной формой мерцательной аритмии: современное состояние проблемы. 2001; 1: 27–29.
13. Сыркин А.Л. Недоступ А.В. Маевская И.В. Электроимпульсное лечение аритмий сердца в терапевтической клинике. М. Медицина, 1970; 128.
14. Тавровская Т.В. Тимофеев А.В. Селезнева И.П. и соавт. Восстановление синусового ритма при фибрилляции предсердий: опыт кардиологического отделения. Вестник аритмологии. 2005; 1: 5–13.
15. Фомина И.Г, Ветлужский А.В. Некоторые вопросы классификации, диагностики и лечения мерцательной аритмии (по рекомендациям Европейского общества кардиологов).Consillium medicum. 2001; 2: 5: 39–46.
16. Шевченко Н. М. Рациональная кардиология. М. 2001; 400.
17. ACC/AHA/ESC 2006 Guidelines for the Management of Patients With AtrialFibrillation. Eur Heart J. 2006; 27: 1979–2030.
18. Allessie M.A. Boyden P.A. Camm J.A. et al. Pathophysiology and prevention of atrial fibrillation.Circulation. 2001; 103: 769–777.
19. Alt E. Ammer R. SchmittC. A comparison of treatment of atrial fibrillation with low-energy intracardiac cardioversion and conventional external cardioversion. European Heart Journal. 1997; 18: 11: 1796–1804.
20. Amasyali B. Kose S. Aytemir K. et al Wave dispersion predicts recurrence of paroxysmal atrial fibrillation in patients with atrioventricular nodal reentrant tachycardia treated with radiofrequency catheter ablation. Ann Noninvasive Electrocardiol. 2006; 11: 3: 263–70.
21. Boriani G. Biffi M. Capussi A. et al. Oral propafenon to convent recent–oncet atrial fibrillation in patients with and without underlying heart disease. A randomized, controlled trial. Ann. Intern. Med. 1997; 126: 621–625.
22. Boos C.J. Anderson R.A. Lip G.Y. Is atrial fibrillation an inflammatory disorder? Eur. Heart .J. 2006; 27: 136–149.
23. Capucci A. Rosi A. Tiberti G. Tarantino F. Persistent atrial fibrillation: prevention of recurrence. Cardiologia. 1999; 44: 1: 915–918.
24. Conway D.S. Buggins P. Hughes E. et al. Predictive value of indexes of inflammation and hypercoagulability on success of cardioversion of persistent atrialfibrillation. Am. J. Cardiol. 2004; 94: 508–510.
25. Conway D.S. Buggins P. Hughes E. et al. Relationship of interleukin-6 and C-reactive protein to the prothrombotic state in chronic atrialfibrillation. J. Am. Coll. Cardiol. 2004; 43. 2075–2082.
26. Danias P.G. Coulfield T.A. Weigner M.J. et al. Likelihood of spontaneous conversion of atrial fibrillation to sinus rhythm. J. Am. Coll. Cardiol. 1998; 31: 588–592.
27. Elhendy A. Thromboembolic complications after electrical cardioversion in patients with atrial flutter. Am. J. Med. 2001; 111: 433–438.
28. Fauchier J.P. Babuty D. Fauchier L. et al. Preventive drug therapy of recurrence of atrial fibrillation.Article in French. Ann Cardiol Angeiol. 1992; 41: 9: 497–507.
29. Valentin Fuster, Lars E. Rydén et al. 2011 ACCF/AHA/HRS Focused Updates Incorporated Into the ACC/AHA/ESC 2006 Guidelines for the Management of Patients With Atrial FibrillationJ. Am. Coll. Cardiol. 2011; 57; e101-e198 doi:10.1016/j.jacc.2010.09.013.
30. Fumeaux T. Cornuz J. Polikar R. et al. Guidelines for the clinical management of atrial fibrillation: a practical perspective. Swiss Med Wkly. 2004; 134: 235–247.
31. Zapolski T. Wysokinski A. Stunning of the left atrium after pharmacological cardioversion of atrial fibrillation. Kardiol. Pol. 2005; 63: 3: 254–62.
32. Geddes L.A. Hings M. Babes C.F. Maintenance of Atrial Fibrillation in Anesthetized and Unanesthetized Sheep Using Cholinergic Drive. Electrophysiology. 2006; 19: 2: 165–175.
33. Godtfredsen J. Physiology and pathophysiology of the atria: its role in atrial fibrillation. J. Thrombos. Thrombolys. 1999; 7: 13–19.
34. Grimm R.A. Stewart W.J. Maloney J.D. et al. Impact of electrical cardioversion for atrial fibrillation on left atrial appendage function and spontaneous echo contrast: characterization by simultaneous transesophageal echocardiography. J. Am. Coll. Cardiol. 1993; 22: 5: 1359–1366.
35. Hammwohner M. Ittenson A.,Dierkes J. et al. Platelet expression of CD40/CD40 ligand and its relation to inflammatory markers and adhesion molecules in patients with atrial fibrillation. Exp Biol Med (Maywood). 2007; 232: 4: 581–589.
36. Hohnloser S.H. Kuck K.N. Lilienthal J. for the PIAF investigators. Rhythm or control in atrial fibrillation – pharmacological intervention atrial fibrillation (PIAF): a randomized trial. Lancet. 2000; 356; 1789–1794.
37. Jiang H. Lu Z. Lei H. et al. Predictors of early recurrence and delayed cure after segmental pulmonary vein isolation for paroxysmal atrial fibrillation without structural heart disease. J. Interv. Card. Electrophysiol. 2006; l: 15: 3: 157–163.
38. Kannel W.B. D’Agostino R.B. Wilson P.R. Diabetes, fibrinogen, and risk of cardiovascular disease. The Framingham experience. Am. Heart. J. 1990; 120: 672–676.
39. Khan I.A. Transient atrial mechanical dysfunction. Am Heart J. 2002; 144: 1: 11–22.
40. Klein A.L. Grimm R.A. et al. Cardioversion guided by transesophageal echocardiography: the ACUTE pilot study. A randomized, controlled trial. Ann intern Med. 1997; 126: 200–209.
41. Lau C.P. Tse H.F. Electrical remodelling of chronic atrial fibrillation. Clin. Exp. Pharmacol. Physiol. 1997; 24: 12: 982–983.
42. Levy S. Lauribe P. Dolla E. et al. randomized comparison of external and internal cardioversion of chronic atrial fibrillation. Circulation.–1992.–Vol. 86.– Р.1415–1420.
43. Liu T. Li G. Is atrial fibrillation an inflammatory disease. Med. Hypotheses.– 2005.–Vol.64.– P.1237–1238.
44. Madrid A.H. Moro C. Atrial Fibrillation and C-Reactive Protein Searching for Local Inflammation. J. Am. Coll. Cardiol. 2007; 49: 1649–1650.
45. Mihlm M.J. Yu F. Carnes C.A. et al. Impaired myofibrillar energetics and oxidative injury during human atrial fibrillation. Circulation. 2001; 104: 174–180.
46. Okcun B. Yigit Z. Arat A. Baran T. Kucukoglu M.S. Stunning of the left atrium after conversion of atrial fibrillation: predictor for maintenance of sinus rhythm? Echocardiography. 2005; 22. 5. 402.
47. Omran H. Jung W. Rabahieh R. et al. Left atrial chamber and appendage function after internal atrial defibrillation: a prospective and serial transesophageal echocardiographic study. J Am Coll Cardiol. 1997; 29: 1: 131.
48. Ozaydin M. Varol E. Aslan S.M. et al. Effect of atorvastatin on the recurrence rates of atrial fibrillation after electrical cardioversion. Am. J. Cardiol. 2006; 97: 10: 1490–1493.
49. Paraskevaidis I.A. et al. Prediction of Successful Cardioversion and Maintenance of Sinus Rhythm in Patients With Lone Atrial Fibrillation. CHEST. 2005; 127: 488–494.
50. Perez F.J. Lung T.H. Ellenbogen K.A. et al. Is time to first recurren ce of atrial fibrillation correlated with atrial fibrillation burden? Am. J. Cardiol. 2006; 97: 9: 1343–1345.
51. Roijer A. Meurling C.J. Eskilsson J. et al. Left atrial appendage outflow velocity index is superior to conventional criteria for prediction of maintenance of sinus rhythm after cardioversion. An echocardiographic study in patients with atrial fibrillation of a few months’ duration. Scand. Cardiovasc. J. 2001; 35: 2: 119–124.
52. Sandercock P. Bamford J. Dennis M. et al. Atrial fibrillation and stroke: prevalence in different types of stroke and influence on early and long term prognosis (Oxfordshire Community Stroke Project). BMJ. 1992; 305: 1460–1465.
53. Slavik R.S. Tisdale J.E. Borzak S. Pharmacologic conversion of atrial fibrillation: A systematic review of available evidence. Progress in Cardiovascular Diseases. 2001; 44: 2: 121–152.
54. Waktare J.E.P. Camm A.J. Acute treatment of atrial fibrillation: why and when to maintain sinus rhythm. Amer. J. Cardiology. 1992; 5: 3–15.
55. Wolf P.A. Abbott R.D. Kannel W.B. Atrial fibrillation as independent risk factor for stroke: The Framingham study. Stroke. 1991; 22; 983–988.
Лечение впервые выявленной мерцательной аритмии
КАРДИОЛОГИЯ
Лечение впервые выявленной мерцательной аритмии
Практические рекомендации Американской академии семейной медицины
и Американской коллегии терапевтов
2003
Настоящие рекомендации разработаны Объединенной группой Американской академии семейной медицины и Американской коллегии терапевтов при участии специалистов Центра доказательной медицины при Университете Джонса Хопкинса на основании систематического анализа имеющихся данных. Рекомендации предназначены для лечения впервые выявленной мерцательной аритмии (МА) у взрослых и не распространяются на тех, у кого она возникла в послеоперационном периоде или при инфаркте миокарда, а также на больных с сердечной недостаточностью IV функционального класса, пороками сердца и на лиц, уже принимающих антиаритмические средства. Рекомендации адресованы терапевтам и врачам общей практики.
Рекомендация 1. В большинстве случаев показано снижение частоты сердечных сокращений (ЧСС) с постоянной антикоагулянтной терапией. Для улучшения самочувствия и повышения выживаемости это, по имеющимся данным, ничутьне хуже поддержания синусового ритма (СР), а иногда даже лучше. Восстановление СР показано, если оно заведомо приведет к уменьшению жалоб, повысит переносимость физической нагрузки и если на этом настаивает сам больной. Класс 2A.
Рекомендация 2. Больные с мерцательной аритмией должны постоянно приниматьварфарин в дозе, поддерживающей международное нормализованное отношение (МНО) на нужном уровне, кроме случаев, когда риск инсульта оченьмал либо естьпротивопоказания к антикоагулянтам (тромбоцитопения, недавняя травма или операция, алкоголизм). Класс 1A.
Рекомендация 3. Лучшие препараты для снижения ЧСС в покое и при нагрузке у больных с МА — атено-ол, верапамил, дилтиазем и метопролол (перечислены в алфавитном порядке). Дигоксин снижает ЧСС только в покое, поэтому относится к средствам второго ряда. Класс 1B.
Рекомендация 4. Для восстановления СР годится как электрическая (класс 1С+), так и медикаментозная кардиоверсия (класс 2А).
Рекомендация 5. Существует два равноценных способа ведения больных с мерцательной аритмией перед восстановлением СР: 1) кратковременная антикоагулянтная терапия — чреспищеводная эхокардиография (ЭхоКГ) — кар-диоверсия (если нет тромбов) — антикоагулянтная терапия; 2) длительная антикоагулянтная терапия — кардиоверсия — антикоагулянтная терапия. Класс 2А.
Рекомендация 6. После восстановления СР большинство больных не нуждаются в антиаритмической терапии для поддержания СР, поскольку риск ее побочных эффектов перевешивает пользу. Тем, кто очень плохо переносит МА, с профилактической целью назначают амиодарон, дизопирамид, пропафе-нон или соталол (перечислены в алфавитном порядке). Выбор того или иного препарата в основном зависит от вероятности его побочного действия в каждом случае. Класс 2А.
Мерцательная аритмия — самая частая аритмия у взрослых. Распро-страненностьее увеличивается с возрастом: у людей до 60 лет — 1%, после 80 лет — более 8%. Во всех возрастных группах преобладают мужчины. Основные сердечно-сосудистые заболевания, вызывающие МА — артериальная гипертония, ревматические митральные пороки сердца, ишемическая болезнь сердца (ИБС) и сердечная недостаточность, внесердечные — тиреотоксикоз, ХОЗЛ (гипоксия), хирургические вмешательства, острая алкогольная интоксикация.
Мерцательная аритмия проявляется сердцебиением, головокружением, слабостью, но может протекать и бессимптомно. Основная опасность МА — тромбоэмболии.
Цель рекомендаций — дать врачам первичной помощи руководство по медикаментозному лечению взрослых с впервые выявленной (клинически или на ЭКГ) МА. В рекомендациях Американской коллегии кардиологов и Американской кардиологической ассоциации впервые выявленная МА рассматривается независимо от тяжести ее проявлений и продолжительности аритмии; при этом составители рекомендаций отдают себе отчет в том, что давность текущего пароксизма и наличие предшествовавших пароксизмов часто установить невозможно [1]. Данные рекомендации не годятся для лечения мерцательной аритмии в послеоперационном периоде, в остром периоде инфаркта миокарда, при сердечной недостаточности IV функционального класса, при пороках сердца. Больным, уже принимающим антиаритмические препараты, они также не подходят. Рекомендации адресованы терапевтам и врачам общей практики.
В основу данных рекомендаций положены работа McNamara и соавт. [2] и отчет «Лечение впервые выявленной мерцательной аритмии » [3], подготовленный Центром доказательной медицины при Университете Джонса Хоп-кинса по заказу Управления медицинских исследований, Роквилл, Мэриленд. Данное руководство создано Американской академией семейной медицины и Американской коллегией терапевтов. Совместная группа этих организаций изучила клинические данные и классифицировала рекомендации (табл. 1).
Рекомендации касаются следующих вопросов:
1. Выбор между снижением ЧСС и восстановлением СР.
2. Антикоагулянтная терапия и профилактика инсульта.
3. Сравнение электрической и медикаментозной кардиоверсии.
4. Рольчреспищеводной ЭхоКГ в определении тактики лечения мерцательной аритмии.
5. Поддержание СР.
1. Снижение ЧСС или восстановление СР?
Основной вопрос в лечении мерцательной аритмии — нужно ли восстанавливать СР. Ответ на этот вопрос зависит от того, что важнее для повышения выживаемости, профилактики тромбоэмболий, улучшения самочувствия больных и качества жизни: снижение ЧСС или восстановление СР? Еще один важный вопрос — выбор способа лечения для особых групп больных: молодых больных без других заболеваний сердца, женщин, а также больных, страдающих артериальной гипертонией или сердечной недостаточностью. Снижение ЧСС и восстановление СР сравнивалось в четырех исследованиях. Правда, в этих исследованиях представлены в основном мужчины старше 65 лет, тогда как молодые больные без других заболеваний сердца и женщины представлены мало [5].
В исследовании AFFIRM (The Atrial Fibrillation Follow-up Investigation of Rhythm Management — Отдаленные результаты лечения МА) сравнивалось снижение ЧСС и поддержание СР при МА (антикоагулянтная терапия рекомендоваласьв обеих группах) [6]. В течение 3,5 лет наблюдали более 4000 больных,
Таблица 1. Классификация рекомендаций по Guyatt с соавт. [4]
Класс Польза Обоснованность Настоятельность