ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
Инфекционный эндокардит — микробное поражение внутрисердечного эндотелия,
приводящее к структурным изменениям эндокарда (прежде всего клапанного), крупных сосудов (аорта,
артериовенозные шунты, открытый артериальный проток) и инородных внутрисердечных образований
(искусственные клапаны сердца). Результатом подобных изменений становится нарушение
внутрисердечной гемодинамики с появлением соответствующей клинической симптоматики.
Заболевание регистрируется во всех странах мира и в различных климатогеографических зонах.
Заболеваемость, по данным разных авторов, составляет от 1.7 до 11,6 случаев на 100000 населения в год.
Среди госпитализированных пациентов на долю инфекционного эндокардита приходится 0,17-0,26%.
Мужчины заболевают в 1,5-3 раза чаще женщины, а в возрастной популяции старше 60 лет это
соотношение достигает 8:1. Средний возраст заболевших составляет 43-50 лет. В последнее время
отмечается четкая тенденция к нарастанию частоты заболевания у лиц пожилого и старческого возраста.
Это объясняется, с одной стороны, «постарением» населения в развитых странах, в том числе и в России. С
другой стороны, в этой группе пациентов значительно чаще отмечаются факторы, предрасполагающие к
развитию данного заболевания.
Как и при любом другом инфекционном заболевании, этиологическим фактором эндокардита
являются разнообразные микроорганизмы. До начала массового применения антибиотиков чаще всего
инфекционный эндокардит вызывался зеленящим стрептококком (Streptococcus viridans), на долю которых
приходилось до 90% случаев заболевания. Но во второй половине XX века в этиологии эндокардита
произошли существенные изменения, выразившиеся в расширении спектра микроорганизмов, могущих
быть его причиной. Это связано с широким внедрением в клиническую практику антибиотиков,
нарастанием числа инвазивных диагностических и лечебных манипуляций, интенсивным развитием
кардиохирургии. С другой стороны, распространение инъекционной наркомании способствовало росту
числа больных с эндокардитом.
В связи с тем, что инфекционный эндокардит может вызываться практически любым видом
бактерий, в настоящее выделяют три формы заболевания, отличающиеся по своей этиологии.
Инфекционный эндокардит естественных клапанов. Возбудителем его в 55% случаев
являются стрептококки. Как и ранее около 70% этой формы вызывается зеленящим стрептококком
(Streptococcus viridans), 20% — бычьим стрептококком (Streptococcus bovis) и около 5% другими видами
стрептококка. В 30% случаев инфекционный эндокардит вызывается стафилококками. В основном это
золотистый стафилококк (Staphylococcus aureus), который приводит к эндокардиту в 5-10 раз чаще, чем
коагулазонегативный Staphylococcus epidermidis. Примерно в 6% случаев встречаются энтерококки
(Enterococcus faecium, Enterococcus faecalis). У ряда больных причиной поражения клапанов являются
бактерии группы НАСЕК (#aemophilus spp. ^ctinobacillus spp. Cardiobacterim spp. fikeneila spp, Alngella
spp.). Из других микроорганизмов следует выделить пневмококки, грибы, спирохеты, риккетсии.
Инфекционный эндокардит протезированных клапанов. Возбудителями заболевания в 30-
50% случаев являются стафилококки, причем чаще Staphylococcus epidermidis, чем Staphylococcus aureus. У
15% больных обнаруживаются грамотрицательные бактерии, у 10% — грибы (в основном рода Candida).
При поздних эндокардитах, возникающих через два месяца после операции, могут высеваться
стрептококки.
Инфекционный эндокардит у инъекционных наркоманов. Его причиной служат
Staphylococcus aureus (более 50%), стрептококки и энтерококки (около 20%), грибы (6%). В ряде случаев
развивается псевдомонадный эндокардит (Pseudomonas aeruginosa). Довольно часто обнаруживается
полимикробная ассоциация.
Из вышеотмеченного видно, что в большинстве случаев, микроорганизмы, служащие причиной
развития инфекционного эндокардита, относятся к условнопатогенным. Поэтому одного лишь
инфицирования и бактериемии для поражения клапанов сердца недостаточно. Необходимо наличие
предрасполагающих условий, способствующих формированию инфекционного эндокардита. Их можно
разделить на две основные группы.
Во-первых, это различные состояния, сопровождающиеся изменениями внутрисердечной
гемодинамики.
Во-вторых, факторы, предрасполагающие к развитию бактериемии, не связанные с
поражением сердца и сосудов.
В соответствии с характером гемодинамических нарушений можно выделить три группы риска
развития инфекционного эндокардита.
Пациенты с высоким риском:
— протезированные клапаны сердца (самый высокий риск!).
— инфекционный эндокардит в анамнезе;
— синие комбинированные врожденные пороки сердца (единственный желудочек сердца,
декстрапозиция магистральных артерий, тетрада Фалло);
— открытый артериальный проток;
— двустворчатый аортальный клапан со стенозом или с недостаточностью;
— ревматические аортальные пороки;
— митральная недостаточность, в том числе в сочетании со стенозом;
— дефекты межжелудочковой перегородки;
— коарктация аорты;
— остаточные явления после операции на сердце (клапанные стенозы и недостаточность,
внутрисердечный сброс крови);
— искусственные аортолегочные шунты (кондуиты). Пациенты с умеренным риском:
— пролапс митрального клапана с митральной регургитацией или утолщением створок;
— митральный стеноз без недостаточности;
— пороки трехстворчатого клапана;
— стеноз клапана легочной артерии;
— гипертрофическая кардиомиопатия;
— двустворчатый аортальный клапан без гемодинамических нарушений;
— обызвествление аортального клапана, митрального кольца;
— первые полгода после операции на сердце по поводу порока без остаточных явлений.
Пациенты с таким риском:
— пролапс митрального клапана без митральной регургитации и утолщения створок;
— незначительная клапанная регургитация в отсутствие органического заболевания сердца;
— изолированный дефект межпредсердной перегородки типа ostium secundum;
— атеросклероз аорты, коронарных артерий;
— состояние спустя полгода и более после операции на сердце по поводу порока без
остаточных явлений;
— имплантированные электрокардиостимуляторы и дефибрилляторы;
— состояние после аортокоронарного шунтирования;
— перенесенная болезнь Кавасаки или ревматизм без поражения клапанов.
К группе повышенного риска развития бактериемии относят, прежде всего, инъекционных
наркоманов. При этом инфицирование самого раствора наркотика редко бывает причиной заболевания,
чаще возбудитель проникает с кожи при ее проколе.
Другая категория — лица пожилого и старческого возраста. У них чаще встречаются
инфицированные кожные язвы, необходимость медицинских манипуляций на мочевыводящих путях и
толстом кишечнике, длительно стоящие катетеры ценгральных вен. Примерно в 1/3 случаев инфекционный
эндокардиту пожилых имеет нозокомиальный (госпитальный) генез.
Отдельно следует выделить группы больных получающих программный гемодиализ, а также
страдающих сахарным диабетом.
Патогенез инфекционного эндокардита представляет собой последовательную цепь событий,
начиная с формирования асептического пристеночного тромба в месте повреждения эндокарда и кончая
воспалительной бактериальной деструкцией клапана в результате присоединения инфекции и
формированием порока сердца.
Предпосылкой заболевания служит повреждение эндокарда турбулентным током крови у лиц,
имеющих факторы риска. В результате адгезии тромбоцитов и последующего отложения фибрина
образуются стерильные вегетации, представляющие по своей сути пристеночные тромбы. Излюбленным
местом их появления являются области высокого давления в левых отделах сердца, а также
физиологические сужения в местах нахождения клапанов сердца. При наличии аномалий, таких как
дефекты межжелудочковой перегородки, двустворчатый аортальный клапан, риск повреждения эндокарда
увеличивается. Экспериментальные исследования показали, что повреждение эндокарда является
непременным условием развития инфекционного эндокардита, так как на интактном эндокарде агрегации
тромбоцитов не происходит.
Вторым непременным условием возникновения заболевания следует считать наличие в крови
бактерий, способных заселять эндокард. При наличии в бактериальной оболочке поверхностных
полисахаридов и белков из класса адгезинов облегчается связывание бактерий с образовавшимися на
поврежденном эндокарде стерильными тромбами.
В итоге развивается классический воспалительный процесс, приводящий к деструкции
клапанов с формированием порока сердца.
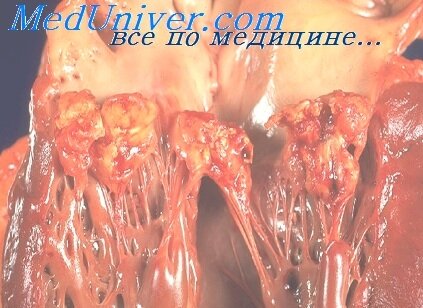
Ранним морфологическим проявлением инфекционного эндокардита является появление
характерных вегетации, содержащих тромбоциты, фибрин, клетки воспаления и эритроциты. Впоследствии
возможно наступление деструкция эндокарда, изъязвления и абсцедирования.
В соответствие с МКБ-10 инфекционный эндокардит относится к рубрике 133. Из этой
классификации исключается эндокардит ревматической природы.
133 — Острый и подострый эндокардит.
133.0 — Острый и подострый инфекционный эндокардит.
133.9 — Острый эндокардит неуточненный.
В соответствии со старыми классификациями выделяли острый, подострый и хронический
инфекционный (бактериальный) эндокардит.
Современные классификации предусматривают бактериологическую: клиническую,
активностную и морфологическую характеристику.
При положительных результатах бактериологических, иммунологических, морфологических
методов в диагнозе обязательно должна отмечаться этиологическая характеристика заболевания. Если же с
помощью всех доступных методов определить вид возбудителя не удается, то в диагнозе следует
охарактеризовать ИЭ как «микробиологически неуточненный».
Эндокардит считается активным при наличии положительных результатах посева,
сопровождающихся лихорадкой, а также признаками активности, подтвержденными морфологически во
время операции. В остальных случаях эндокардит считается неактивным.
Если эрадикация не была проведена в полном объеме, возможно развитие возвратного
инфекционного эндокардита с появлением характерных признаков активности.
Клиническая симптоматика развивается в течение первых двух недель после эпизода,
вызвавшего бактериемию. Заболевание начинается с недомогания и лихорадки. Последняя может быть
незначительной, однако при высоковирулентных возбудителях заболевание начинается остро с подъема
температуры до 39°С и выше. Характерны артралгии, боли в мышцах и пояснице.
Кожные покровы бледные, желтоватого оттенка (цвет «кофе с молоком»). Объективно
отмечаются петехиальные высыпания на коже, конъюктивах, слизистой полости рта. Отмечаются пятна
Рота — овальные кровоизлияния в сетчатку с белой точкой в центре и пятна Джейнуэя — мелкие
геморрагические пятна на ладонях и стопах, слегка напоминающие узелки. При длительном течении
заболевания развивается симптом «барабанных палочек».
Аускультативно отмечается шум в сердце, свидетельствующий о формировании порока сердца.
При пальпации и перкуссии живота можно выявить увеличение селезенки.
Тяжелое течение заболевания характеризуется тромбоэмболиче-скими осложнениями,
формированием септических аневризм.
Дополнительные методы предусматривают, прежде всего, проведение бактериологического
исследования крови, которое дает положительные результаты в 95% случаев. Посевы проводятся двукратно
через 12 часов. В тех случаях, когда антибиотикотерапия не может быть отсрочена, заборы крови
осуществляют с интервалом 30-60 минут из разных вен в течение 3-6 часов, предшествующих началу
лечения. Результаты считаются положительными при наличии бактерий в двух посевах, взятых с 12-
часовым интервалом, или в большинстве посевов, взятых трех- или четырехкратно.
Из других лабораторных данных характерно ускорение СОЭ, нормо — или гипохромная анемия.
Лейкоцитоз и изменения в лейкоцитарной формуле в основном определяются при остром эндокардите. В
анализе мочи выявляются протеинурия и микрогематурия.
Из инструментальных методов ведущим диагностическим исследованием является
эхокардиография. Следует определить характер и размеры вегетации, их локализацию, наличие и
выраженность регургитации. На ранних стадиях информативность трансторакальной ЭхоКГ может быть
низкой. (45% положительных результатов). В то же время применение чреспищеводного датчика позволяет
повысить чувствительность метода до 90-93%.
Суммируя все вышесказанное можно определить следующие диагностические критерии
инфекционного эндокардита, предложенные Durack D. et al (1994):
Основные критерии:
— положительные результаты гемокультуры с выделением типичных возбудителей;
— эхокардиографические признаки ИЭ (вегетации, абсцессы, вновь появившаяся
околоклапанная или клапанная регурги-тация).
Дополнительные критерии:
— предрасполагающие к ИЭ поражения сердца или инъекционная наркомания;
— повышение температуры > 38°с;
— сосудистые изменения (эмболии крупных артерий, инфаркты легких, внутричерепные
кровоизлияния, субконъюктиваль-ные кровоизлияния, пятна Джсйнуэя);
— иммунологические изменения (гломерулонефриты, узелки Ослера, пятна Рота,
ревматоидный фактор);
— выделение возбудителя, не удовлетворяющее основному критерию или серологические
признаки инфицирования типичным возбудителем;
— эхокардиографические признаки эндокардита, не удовлетворяющие основному критерию.
Несомненный инфекционный эндокардит выявляется при наличии двух основных критериев
или одного основного и трех дополнительных, или же при наличии пяти дополнительных критериев.
Диагноз вероятного ИЭ ставится при наличии одного основного и одного дополнительного
критерия, или только трех дополнительных.
Диагноз считается отвергнутым при отсутствии достаточного числа критериев для
подтверждения «возможного» эндокардита, наличии у больного другого заболевания, или при полном
исчезновении симптомов болезни при краткосрочной (менее четырех дней) антибиотикотерапии.
Примеры формулировки диагноза
1. Стрептококковый инфекционный эндокардит. Активная фаза. Сочетанный аортальный
порок сердца (стеноз устья аорты, недостаточность аортальных клапанов). Хроническая сердечная
недостаточность. Стадия ПА. ФКЗ.
2. Инфекционный эндокардит неуточненной этиологии с комбинированным митрально-
аортальным пороком сердца (недостаточность митрального клапана, стеноз устья аорты). Неактивная фаза.
Хроническая сердечная недостаточность. Стадия I. ФКЗ. Дифференциальная диагностика проводится во
всех случаях
лихорадки, причину которой не удается быстро установить, так как типичная клиническая
картина с формированием клапанного порока может развиваться не с первых дней заболевания.
Прежде всего, это поражения сердца ревматической природы. В случае, если речь идет об
острой ревматической лихорадке, диагноз, как правило, не вызывает затруднений в связи с наличием
типичных диагностических критериев ревматизма (см. Часть I, стр. 128).
Большую трудность представляет выявление вторичного инфекционного эндокардита на фоне
уже имеющегося порока сердца. В этом случае важную роль играет сбор анамнеза, тщательное
отслеживание аускультативной симптоматики, наличие других клинических признаков эндокардита.
Решающим в диагностике следует считать отсутствие эффекта от НПВС и положительные результаты
исследования на гемокультуру.
Поражение клапанов сердца часто сопровождает системные заболевания соединительной
ткани, такие как системная красная волчанка, узелковый полиартериит, антифосфолипидный синдром,
неспецифический аортоарериит (болезнь Такаясу),
Лихорадка неясного генеза может встречаться при злокачественных новообразованиях,
особенно у лиц пожилого возраста, обострении не диагностированного ранее хронического пиелонефрита.
Лечение инфекционного эндокардита направлено в первую очередь на эрадикацию
бактериальной флоры, вызвавшей заболевание. Следует сказать, что. несмотря на наличие в настоящее
время достаточно широкого спектра антибактериальных препаратов, терапия данной категории больных
по-прежнему остается трудной задачей.
Основным принципом терапии инфекционного эндокардита является как можно более раннее
начало антибиотикотералии. При этом срок лечения составляет 4-6 недель. Выбор препарата определяется
результатами посева, но в большинстве случаев следует использовать бактерицидные препараты. Чаще
всего применяют пе-нициллины, цефалоспорины и ванкомицин. При определении дозы антибиотика
оценивают минимальные подавляющую и бактерицидную концентрации.
До получения результатов посева у больных с иодострым инфекционным эндокардитом
непротезированных клапанов назначают антибиотики, эффективные в отношении энтерококков, так как
последние более устойчивы по сравнению со стрептококками (ампициллин 12 г/сутки, иногда в сочетании с
гентамицином 3 мг/кг/сугки).
Терапию острого инфекционного эндокардита начинают с эффективного в отношении
золотистого стафилококка ванкомицина (30 мг/кг/сутки). У инъекционных наркоманов добавляю! гентами-
цин в стандартных дозировках.
При наличии результатов гсмокультуры выбор препарата уточняют. Поскольку основным
микроорганизмом, вызывающим поражение клапанов у пациентов, не являющихся наркоманами, является
чувствительный к пенициллшгу зеленящий С1рептококк (МПК≤0,1 мкг/мл), то терапию начинают
назначением бензилпенициллина в дозе 16-20 млн. ед/сутки, цефтриаксона в суточной дозе 2 г. Добавление
гентамицина в суточной дозе 3 мг/кг/сутки потенцирует эффект. При аллергии к этим препаратом лечение
начинают с ванкомицина.
В случае умеренной чувствительности стрептококков к пенициллину (МПК≥0,1 мкг/мл, но <
0,5 мкг/мл) дозировку бензилпенициллина увеличивают до 20-30 млн. ед/сутки, или назначают цефазолин
8-10 г/сутки. Одновременно больные получают гентамицин.
Если возбудителем является чувствительный к метициллину золотистый стафилококк
целесообразно использование полусинтетических пенициллинов (нафициллин или оксациллин 8-12
г/сутки). При резистентности к метициллину применяют ваикомицин, иногда в сочетании с рифампицином.
Если инфекционный эндокардит вызван микроорганизмами, относящимися к НАСЕК группе
препаратами выбора считаются це-фалоспорины III поколения (цефтриаксон 2 г/сутки или цефотаксим 6-8
г/сутки). При лечении грибкового эндокардита применяют амфотерицин или флуцитозин.
При выраженных иммунологических нарушениях и активности процесса оправдано назначение
глюкокортикоидов (преднизолон в дозе 15-30 мг/сутки). Следует, однако, отметить, что эффективность их
не подтверждена многоцентровыми исследованиями.
Лечение развившейся вследствие формирования клапанного поражения сердечной
недостаточности проводится в соответствии с существующими стандартами.
Отдельно следует остановиться на вопросе оперативного лечения инфекционного эндокардита.
Прежде всего, следует отметить, что активный инфекционный эндокардит не является противопоказанием
для хирургической коррекции порока. В большинстве случаев проводится протезирование клапанов, после
которых состояние больных существенно улучшается.
Можно выделить следующие показания для операции:
• Нарастающая сердечная недостаточность, не поддающаяся медикаментозной коррекции
• Эхокардиографические признаки прогрессирующей деструкции клапана, не поддающиеся
антибиотикотерапии
• Повторные эпизоды тромбоэмболии
• Метастатические очаги абсцедирования в клапанном кольце, миокарде, аорте и т.д.
• Грибковая этиология заболевания
• Ранний (до 2 месяцев) эндокардит протезированных клапанов.
Профилактика инфекционного эндокардита является важнейшей задачей врачей первичного
звена. Для ее решения следует ответить на три главных вопроса. Во-первых, необходимо оценить степень
риска развития инфекционного эндокардита у конкретного человека, о чем говорилось выше. Во-вторых,
следует уточнить, при каких обстоятельствах (как правило, это медицинские манипуляции) повышается
вероятность возникновения бактериемии. В-третьих, нужно определить^ какая схема антибактериальной
профилактики показана при этих условиях.
Пациентам с низким риском профилактика инфекционного эндокардита не показана вовсе.
Далее следует остановиться на тех ситуациях, которые делают обязательной профилактику инфекционного
эндокардита:
• Зубоврачебные вмешательства с повреждением десны и кровотечением (в том числе
экстракция зуба и удаление зубных камней. )
• Тонзиллэктомия, аденотомия
• Операции на желудочно-кишечном тракте и верхних дыхательных путях
• Бронхоскопия жестким бронхоскопом
• Склеротерапия варикозных вен пищевода
• Бужирование пищевода
• Эндоскопическая ретроградная холангиопанкреатография
• Операции на желчном пузыре
• Цистоскопия, дилатация мочеиспускательного канала
• Операции на мочевых путях и предстательной железе
• Иссечение инфицированных тканей, дренирование инфицированных полостей.
Во всех остальных случаях антибактериальная профилактика инфекционного эндокардита не
проводится. Сюда относят такие манипуляции как кесарево сечение, интубация трахеи, чрез пищеводные
манипуляции, обрезание крайней плоти и прочее.
При стоматологических манипуляциях и операциях на пищеводе и верхних дыхательных путях
показано назначение амоксициллина в дозе 2 г внутрь за 1 час до операции. При непереносимости или
иных условиях препаратами второго ряда могут быть клиндамицин (600 мг внутрь), цефалексин (2 г
внутрь), либо азитромицин (500 мг внутрь).
При операциях на желудочно-кишечном тракте и мочеполовой системе схема
антибактериальной профилактики определяется степенью риска. При умеренном риске за 1 час до
операции назначают амоксициллии (2 г внутрь), или за 30 минут до операции ампициллин (2 г внутривенно
или внутримышечно).
Пациентам высокого риска рекомендовано за 30 минут до операции введение ампициллина (2 г
внутривенно или внутримышечно) вместе с гентамицином (1,5 мг/кг внутривенно). Через 6 часов после
окончания операции: ампициллин (1 г внутривенно), либо амоксициллии (1 г внутрь).
Другие схемы одинаковы для пациентов, независимо от риска и предусматривают
внутривенное медленное ведение ванкомицина (1 г в течение часа) в сочетании с гентамицином (1,5 мг/кг
внутримышечно или внутривенно медленно). Введение завершить за 30 минут до операции.
Что происходит в глубине сердца
Воспаление эндокарда вызывается проникновением микробов или токсинов. Как показали экспериментальные исследования, также важна индивидуальная реакция организма на чужеродный белок.
Выделено три фактора поражения:
- Действие инфекционного микроорганизма — источник может находиться в любых хронических очагах или поступить извне во время хирургического вмешательства, эндоскопических процедур (фиброгастроскопия, бронхоскопия, катетеризация подключичной вены). При удалении зуба риск составляет один на 500 случаев, а при сопровождении кровотечением доходит до 100%. Наибольшей силой поражения обладает золотистый стафилококк, затем стрептококк и пневмококк.
- Травматизация эндокарда — имеет основное значение при поражении правых отделов сердца в связи с механическим воздействием катетера, поставленного в подключичную вену, инфицировании и повреждении стенок вен при внутривенном введении препаратов. Поэтому у наркоманов повреждается трикуспидальный клапан, расположенный между правым предсердием и желудочком.
- Значительное снижение иммунитета — доказано снижение как местных защитных реакций, так и общего иммунного статуса. Течение болезни усугубляется, если пациент лечился цитостатическими препаратами.
Поражению подвергается чаще всего митральный клапан, реже — аортальный, еще реже — трехстворчатый. Изменения в клапанах легочной артерии находят в единичных случаях.
При острых инфекциях эндокардиты являются лишь местным проявлением заболевания. Небольшие признаки отодвигаются на второй план.
Точно не установлен путь внедрения микроорганизмов в эндокард. Ведь в клапанах отсутствуют свои сосуды. Поэтому основным предполагается воздействие непосредственно из протекающей крови. Внедрение инфекции облегчается наличием у пациента порока сердца, протезов клапанов.
Вопросы классификации
Классификация инфекционного эндокардита предусматривает выделение по происхождению двух форм заболевания:
- первичный эндокардит появляется на здоровом клапанном аппарате;
- вторичный возникает на фоне имеющихся пороков сердца врожденного характера, а также ревматических, сифилитических, туберкулезных, в результате атеросклероза и травм сердца.
Ко второй группе относят постинфарктный эндокардит, болезнь, вызванную опухолью сердца, операцией протезирования клапанов.
В качестве осложнения замены клапанов эндокардит возможен:
- в ранние сроки (в течении месяца после операции);
- позднее проявление (через два месяца и до полугода).
По клиническому течению существует подразделение форм на:
- острый инфекционный эндокардит — возникает в результате септического состояния;
- подострая форма — как разновидность сепсиса, связанного с внутрисердечным инфекционным очагом на фоне ревматизма, воспаления почек (гломерулонефрита). Развивается путем эмболии бактерий, обладающих не слишком сильной способностью к заражению тканей. При этой форме недостаточно для острого поражения снижен уровень иммунитета.
Существуют разногласия по поводу термина «хронический инфекционный эндокардит». Многие ученые считают его результатом длительного неправильного лечения, поздней диагностики.
Клинические проявления острого септического эндокардита
Острый сепсис может возникнуть в результате местного гнойного очага, инфицированной раны, стрептококковой ангины, послеродового послеабортного эндометрита. В ряде случаев первичный очаг обнаружить не удается.
В месте внедрения инфекционного агента собираются эндотелиальные клетки, скапливаются тромбоциты, образуются тромбы. Они носят бородавчатый характер разрастания (в виде полипов) или размягчаются и отрываются, оставляя на своем месте язвы. Из продуктов распада тромбов образуются эмболы, которые разносятся из сердца в различные органы.
В клинике различают общие симптомы сепсиса и непосредственные симптомы, указывающие на критерии инфекционного эндокардита.
Характерно резкое повышение температуры 2-3 раза в день
Общие симптомы
- повышение температуры тела с резким падением и ознобами;
- резкая слабость;
- в начале тошнота, рвота;
- спутанное сознание, бред;
- желтушность кожи;
- малокровие;
- геморрагическая сыпь на теле.
Профилактика инфекционного эндокардита у детей. Ситуация и современные протоколы
Несмотря на лечение антибиотиками и успехи хирургии сердца, инфекционный эндокардит остается серьезной патологией, потенциально летальной, частота которого может возрастать в связи с улучшением выживаемости пациентов носителей врожденных кардиопатий. Частота составляет 1,35 случая на 1000 населения в год, она несколько больше среди детей носителей сложных пороков сердца; она составляет от 0,95 до 1,65 в год в случаях врожденных некорригированных ВПС и снижается до 0,2 в год после коррекции. Общая смертность составляет от 11 до 27% в зависимости от серий. Его тяжесть, так же как и затраты на лечение, значительны, начиная с диагностики и терапии (протезирование клапанов бывает необходимым в 25% случаев, внутривенная антибиотикотерапия минимум 4 недели), оправдывает проведение тщательной профилактики.
Экспериментальные модели
Рекомендации по антибиотикопрофилактике инфекционного эндокардита всегда являются объектом тщательного рассмотрения. В то же время не существует ни одного контролированного проспективного, которое трудно реализуемо по этическим причинам. Исследования касающиеся частоты инфекционного эндокардита у леченных не леченных пациентов дают различные результаты, возможно по причине разницы антибиотических протоколов. Хотя экспериментальные модели осуществимы у крыс. Риск бактериального вмешательства кажется зависит от объема введенной бактериальной массы, вирулентности вида и основного состояния (кардиопатия sous-jacent, иммуносупрессия). Локальная бактериальная продлиферация начинается на 2 часу после бактериемии.
Эффективность антибиотикопрофилактики связана с бактерицидным действием повышенным уровнем в сыворотке на момент бактериемии и в течение 6 часов после нее, что позволяет разом элиминировать микроорганизмы циркулирующие в крови и микроорганизмы, фиксированные на клапанах. Чем больше инокулировано бактерий, тем более длительной должна быть высокая ингибирующая концентрация антибиотика.
Также в зависимости от типа процедуры связанной с риском бактериемии, профилактика должна проводится или одной единственной дозой или многими дозами. И наконец, максимальный пик в сыворотке должен достигаться на 2 час после бактериемии, необходимо вводить антибиотик незадолго до geste, на практике за час до.
Основное заболевание и факторы риска
Инфекционный эндокардит может развиться на фоне известной кардиjпатии, но также и на фоне небольшой нераспознанной кардиопатии и на здоровом сердце.
Таблица 1. Врожденные кардиопатии и риск инфекционного эндокардита
Высокий риск
Обструктивные миокардиопатии с IM
Интракардиальный инородный материал для окклюзии (CAP, CIA)
Коарктация аорты
CIA
Пульмональный стеноз
Пролапс митрального клапана без недостаточности
Оперированные лево-правосторонние шунты
Дилатационная миокардиопатия
Пересадка сердца
CAP- проходимый артериальный проток; CAV — атриовентрикулярный проток; CIA — межпредсердная коммуникация; CIV — межжелудочковая коммуникация; EI — инфекционный эндокардит; IM — недостаточность митрального клапана; RAA — острый суставной ревматизм
Известная патология сердца
Риск бактериального пораждения различен в зависимости от аномалии сердца. Обычно он более значителен в случае поражения с током крови с высокой скоростью или в присутствии ин-тракардиальная материала.
Кардиопатии с высоким риском
Антецедент инфекционного эндокардита вызывает риск рецидива значительно более высокий (50%) и оправдывает хирургическую коррекцию кардиопатии, если это возможно, после излечения эпизода инфекции.
Клапанный протез какой бы не была его локализация, прежде всего механический, а также как любой другой интракардиальный материал (анастомотические трубки системо-пульмональные, клапанные трубки) являются точками притяжения инфекции.
Среди врожденных кардиопатий сложные кардиопатии с хроническим цианозом, прежде всего, в случае предшествующего паллиативного хирургического вмешательства, представляют собой более благоприятную среду. Максимальная частота наблюдается при тетральгии Фалло, но мероприятия по профилактике должны также тщательно проводится и в случае цианогенных сложных кардиопатий, не поддающихся коррекции, и при синдроме Eisenmenger, для которых риск не может быть уменьшен проведением коррекционной хируругии. Кроме того, интракардиальный шунт справа-налево исключает пульмональную бактериальную фильтрацию бактерий и предрасполагает к церебральным метастазам и абсцессам мозга.
Среди врожденных патологий клапанов митрального и/или аортального аортальное сужение кажется представляет больший риск (тем более значительный, чем более выражен стеноз); обычно аортальный клапан поражается более часто, чем митральный клапан.
Ревматические вальвулопатии стали редки во Франции и не составляют более чем 10% случаев инфекционного эндокардита. Все вальвулопатии поражаются (митральные или аортальные, стенозирующие или связанные с недостаточностью).
Недавнее хирургическое вмешательство на сердце (менее чем 2 месяца назад) также представляет собой значительный риск.
Кардиопатии с умеренным риском
Врожденные кардиопати не связанные с цианозом менее часто являются причиной. Межжелудочковая коммуникация наиболее часто поражаемая среди кардиопатий с лево-правосторонним шунтом, затем следует проходимый артериальный канал и атривентрикулярный канал.
Пролапс митрального клапана связан с умеренным риском когда он сопровождается недоста-точностью митрального клапана также как и гипертрофическая обструктивная гипертрофия. Риск связанный с пролапсусом митрального клапана связан с его частотой и прежде всего из-за недиагносцирования среди общей популяции.
Соврменные методы интервенционной катетеризации создали новую группу риска, как таковая кардиопатий корригированных эндолюминально с применением окллюзирующего интракарди-ального материала (артериального протока, межпредсердной коммуникации).
Кардиопатии с небольшим или нулевым риском
Риск раценивается как нулевой при межпредсердных коммуникациях, стенозе легочного клапна, лево-прово шунтах оперированных без остаточного шунта, пролапсусе митрального клапана без недостаточности его и дилатирующей миокардиопатии. В то же время наличие бляшки закрытия шунта (межжелудочковой коммуникации или межпредсердной) требуют проведения антибактериальной профилактики.
Вмешательство на сердце или наличие интракардиального пайсмейкера являются чрезвычайно редкими причинами.
Нераспознанная патология сердца
Некоторые асимптоматические субъекты являются носителями не прошедшего экспертизы шума, который может быть связан с небольшой аномалией сердца: небольшим стенозом пульмонального клапана, аортальной бикуспидией, маленькой межжелудочковой коммуникацией, пролапсом митрального клапана с его недостаточностью. Наличие шума не не сотвествующего критериям типичных разнообразий анорганического шума требует однако провдения исследования для исключения риска бактериальной контаминации.
Экстракардиальные причины
Частота инфекционного эндокардита вариирует с возрастом создавая более высокий риск у детей в возрасте до 2 лет, в частности у недоношенных с нозокомикальными заболеваниями.
Развитию инфекционного эндокардита благоприятствует состояние подавления иммунитета (пациенты получающие иммуносупрессоры, с различными иммунными дефицитами, аспленией).
Развитию инфекционного эндокардита правого сердца благоприятствует наличие центрального венозного катетера, вентрикулоатриальное отведение при гидроцефалии и атриовенозная фистула (диализ) и у подростков токсикомания.
Здоровое сердце
Существует не малый процент (10%) инфекционных эндокардитом развившихся на здоровом сердце в контексте нозокомикальной инфекции с введением центрального катетера.
Эволюция этиологий: собственный опыт
Сравнение этиологий инфекционных эндокардитов 70 и 80 лет нашего личного опыта показывает персистенцию явного преобладания бактериальных поражений при врожденных кардиопатиях, в основном это межжелудочковые коммуникации, тетрада Fallot и сложные кардиопатии. В любом случае 80 годы были отмечены с одной стороны значительным снижением инфекционных эндокардитов на фоне тетрады Fallot в связи с ранней хирургическойц коррекцией и, с другой стороны, увеличением инфекционных эндокардитов в связи с улучшением выживаемости этих пациентов.
Входные ворота и ситуации риска
Входные ворота выявляются только в 70% случаев. Во всех случаях это слизистая effraction вызывающая бактериемию. Наиболее частыми входными воротами это зубы (25%).
Стевен, 13 лет носитель врожденной цианогенной кардиопатии, перенес две хирургические паллиативные операции и был госпитализирован по поводу лихорадки сохраняющейся 8 дней, с головными болями и люмбальгиями. Лечился амоксициллином орально в течение 3 дней до поступления. После отмены антибиотиков, он оставался апиритичным; данные биологических исследоваий были нормальны, гемокультуры негативны, эходоплер сердца не изменен и было назначен на выписку после 2 дней наблюдения. Он поступил снова спустя 8 дней по поводу фебрильного рецидива с температурой 40,4оС c ознобом, ломотой в теле и нарушением общего со-стояния. При исследования выявлена спленомегалия и повышение С-реактивного белка (97G/L) и полинуклеоз (83%). Две гемокультуры оказались положительными на Streptococcus oralis чувствительный к пенициллину, опосредовано к аминозидам. Вегетаций при эхокардиографии не обнаружено и баланс растяжения отрицателен. Входными воротами оказались зубы в связи с выпадением двух молочных зубов за 10 дней до первого эпизода фебрилитета, оборванного оральным амоксициллином. Внутривенная антибиотикотерапия состояла из цефтриаксона и нетромицина в течение 6 дней, затем только цефтриаксон в течение 6 недель. Апирексии удалось добиться на 2 день, а биологическая нормализация наступила на 3 день. Много позднее Стевен снова поступл в госпиталь по поводу гипертермии с ухудшением общего состояния, с увеличением С-реактивного протеина (61 mg/L), гиперлейкоцитозом с полинуклеозом, микроскопической гематурией с умеренной протеинурией. На эхокардиографии утолщение митрального клапана, без признаков недостаточности. Гемокультура положительная на Strptococcus чувствительных к пенициллину, опосредовано к аминозидам. Входными воротами кажется было афтозное пора-жение щеки развившеся на 10 дней раньше. Внутривенная терапия продолжалась 4 недели (амоксиллин и амикацин в течение 5 дней, затем один цефтриаксон), с разрешением клинических и биологических признаков.
Это наблюдение позволяет настаивать на частом нераспознании входных ворот, на запаздывание диагностики связанной с приемом оральных антибиотиков, предписанных «вслепую», и на подостром характере септического синдрома.
Дентарные входные ворота
Все виды лечения зубов могут оказаться причиной если они вызывают кровоточивость из десен, основным риском является удаление зубов. Выпадение молочных зубов не представляет значительного риска. Различные патологии зубов часто недиагносцированные и пренебрегаемые в частности девитализированных зубов (кариес, парадонтальная и периапикальная инфекция, пульпиты, абсцессы) также могут оказаться причиной. Важно отметить, что патология десен представляет собой риск аналогичный зубной; ортодонтные аппараты, источники повторных ранений десен также могут оказаться причиной.
Входные ворота в области уха-горла-носа
Амигдалиты, синуситы, отиты и мастоидиты являются потенциальными входными воротами и должны систематически лечиться антибиотиками направленных против стерптококков у субъектов с повышенным риском. Профилактические предостаорожности также обязательны в случае хирургического вмешательства на инфицированном органе: амигадлектомия, аденоидектомия, парацентез. То же самое относится и к эндоскопическим процедурам уха-горла-носа способным вызвать ранение слизистой (биопсии).
Установка транстимпанического дренажа не требует профилактических мероприятий так как осуществляется только при отсутствии развивающейся инфекции.
Кожные входные ворота
Кожные поражения вероятно остаются наиболее часто нераспознаваемыми причинами. Основными поражениями связанными с риском это. панарции, импетиго, инфицированные акне и все ранки даже поверхностные не леченные.
Другие входные ворота
Причины пищеварительные и урологические более редки у ребенка чем у взрослого: острая инфекция, эндоскопическая процедура, хирургическое вмешательство. Интервенционная катетеризация сердца с установкой внутрисердечного материала для окклюзии персистирующего артериального протока или межпредсердной коммуникации, а также центральные катетеры являются факторами риска; и наоборот, редко причиной является сердечный pacemaker.
Диагностические критерии инфекционного эндокардита
Крупные критерии
Положительные гемокультуры
Типичные микроорганизмы для инфекционного эндокардита (Streptococcus viridans, Staphylococcus, Enterococcus)
Персистирующая бактериемия: две гемокультуры полученные с интервалом более 12 часов или три гемокультуры (или больше) полученные по меньшей мере с 1 часовым интервалом
Признаки эндокардиального поражения
Изменения или появления шума
Эхокардиографические признаки: вегетации на клапанах или протезах клапанов, абсцессы, недавнее dehiscence протеза.
Малые критерии
Фон. кардиопатии или внутривенный катетер
Лихорадка. больше 38оС
Васкулярные феномены: системные артериальные эмболии, септический инфоркт легких, микотьические аневризмы, кровоизлияние в мозг или в коньюнктивы, поражение Janeway.
Иммунологические фоеномены: гломерулонефрит, faux pnaris d’Osler, ретинальные узелки Roth, ревматоидный фактор.
Микробиологические: положительная гемокультура не соотвествующая крупному критерию или серологическое подтверждение развивающиейся инфекции соотвествующей эндокардиальному поражению.
Эхографические: поражения соотвествующеие инфекционному эндокардиту, но не соотвествующие крупному критерию.
Диагноз инфекционного эндокардита может иметь место при наличии двух крупных критериев и трех малых критериев или пяти малых критериев.
Причинные микроорганизмы
Гемокультуры оказываются положительными в 80-90% случаев, но в 10-20% случаях инфекционного эндокардита гемокультуры остаются негативными и причинный микроорганизм неизвестен. иногда вследствие предшествующей плохо адаптированной антибиотикотерапии (табл. II).
Стрептококки
Обвинямые в 50-60% случаев они чаще всего дентарного происхождения (Streptococcus mitis, mutans, salivarius или Streptococcus «viridans» не группируемые). Обычные виды чувствительны к пенициллину G (минимальная ингибиторная концентрация [CMI] ниже 0,1 mg/L). В то же время в последние годы отмечается появление резистентных к пенициллину (CMI более 0,1 mg/l) видов и некоторых к большим концентрациям аминозидов, что обхясняет иногда неудачи антибиотикопрофилактики.
Стафиллококки
Их частота увеличивается; в настоящее время они являются причиной от 20 до 40% инфекционных эндокардитов в заивисимости от серий: Staphylococcus aureus et staphylocoques coagulase negatifs. Входными воротами могут быть кожные, ятрогенные (центральный катетер) с нозокомикальными микроорганизмами часто метициллин-резистентными. Стафилококки коагулазонегативные (Staphylococcus epidermidis) мультирезистеные также встречаются у токсикоманов.
Инфекционный эндокардит вызванный золотистым стафиллококком особенно тяжел по причине вирулетности микроорганизма, который быстро вызывает обширные и разрушительные пораже-ния,несмотря на даптированную антибиотикотерапию, со значительным риском эмболизации; поражение клапанных протезов является официальным показанием для хирургического вмеша-тельства. Прогноз инфекционных эндокардитов вызванных стафилококками резистентными или чувствительными к метицеллину идентичен. Тяжесть этих поражений стафилококками оправдывает строгое наблюдение и проведение эффективного лечения кожных поражений.
Энтерококки
Они являются причиной 10% случаев. Это микрорганизмы происходящие из пищеварительного тракта часто резистентные к пенициллину, к цефалоспринам и иногда к гликопептидам (ванкомицину, тейкопланину); некоторые мультирезистеные штаммы ставят сложные терапевтические задачи.
Причинные микроорганизмы прежде всего это Streptococcus mutans, Enterococcus faecalis et Enterococcus faecium.
Другие микроорганизмы
Друге многочисленные виды встречаются значительно реже. пневмококки, Haemophilus influenzae, грам-отрицательные бациллы использующие в качестве входных ворот пищевариетльный или моевой тракты, грибковые инфекции (Candida, Aspergillus) по происхождению нозокомикальные прогноз при которых весьма неблагоприятен несмотря на ранее хирургическое лечение совместно с антифунгальной терапией.
Профилактическое лечение
Профилактика проводится всем пациентам со значительным риском оказавшихся в ситуации потенциального риска. Назначаемые антибиотики имеют антистрептококковую направленностью Важно указать, что пенициллинотерапия длинными курсами применяемая для предупреждения рецидивов ревматизма или при асплении не эффективна в отношении резистентных стрептококков и, что обычные мероприятия антибиотикопрофилактики в этих случаях должны прово-диться с применением различных антибиотиков отличающихся от пенициллина G.
Антибиопрофилактика
Обычные протоколы