МЕТАБОЛІЧНА КАРДІОМІОПАТІЯ
Визначення
Метаболічна кардіоміопатія (раніше її визначали як дистрофію міокарда, міокардіодистрофії) — незапальне ураження міокарда різної етіології, в основі якого лежить порушення обміну речовин, процесу утворення енергії та / або порушення її перетворення в механічну роботу, що приводить до дистрофії міокарда і недостатності скоротливої. та інших функцій серця.
Етіологія
Метаболічна кардіоміопатія розвивається в результаті впливу патогенних факторів при різних захворюваннях і станах (схема 8.1).
Серед фізичних факторів можуть розглядатися радіація, вібрація, перегрівання, переохолодження, гіперінсоляція.
До хімічних факторів відносяться лікарські засоби, токсичний вплив побутових і промислових отрут.
Схема 8.1.
Захворювання і стани, що призводять до розвитку метаболічної кардіоміопатії
Патогенез
У виникненні та розвитку метаболічних уражень міокарда при різних захворюваннях істотне значення має порушення іннервації, транспорту та утилізації енергії в кардіоміоцитах, тобто їх енергозабезпечення.
Напруга регулюючих систем, функції міокарда і метаболічних процесів в кардіоміоцитах обмежує резервні можливості серця. Тривала гіперфункція сама по собі, а особливо в несприятливих умовах на тлі основного захворювання, може призвести до виникнення енергетичного дефіциту і порушення пристосувальних змін в міокарді.
Механізми зниження продукції енергії в ушкодженому серці включають зниження щільності капілярів, збільшення межкапіллярние відстані, а також більший діаметр гіпертрофованих кардіоміоцитів, що погіршує дифузію кисню і обумовлює виникнення гіпоксії міокарда. Один з механізмів пов’язаний також з порушенням функції мітохондрій, яке викликане зредукованим синтезом окислювальних ензимів внаслідок порушення проліферативної реакції, яка частково опосередкована експресією рецепторів PPARa, що грають ключову роль в біогенезі мітохондрій. Ці рецептори регулюють транскрипцію багатьох ензимів і переносників (транспортерів), які беруть участь у транспорті і окисленні жирних кислот. Також знижується здатність серця відновлювати запаси макроергічних фосфатів. Зменшення окислення жирних кислот викликає накопичення ліпідів і вносить вклад в некроз пошкоджених мембран, при цьому вивільнення реактивних молекул (цитохромів, радикалів кисню) призводить до апоптозу. Прискорений гліколіз, викликаний порушенням окисного фосфорилювання, призводить до ацидозу, який інгібує багато процесів, включені в процес скорочення — розслаблення. З останніх найважливішим є підвищення концентрації кальцію в цитозолі, який ініціює безліч хибних кіл, що призводять до некрозу міоцитів.
У прогресуванні метаболічної кардіоміопатії провідну роль відіграє посилення реакцій вільнорадикального перекисного окислення ліпідів клітинних мембран. Ушкоджуючи мембрани, гидроперекиси і вільні радикали знижують активність ліпідозавісімих ферментативних реакцій (до яких належать основні життєво важливі ферменти іонного транспорту і дихального ланцюга мітохондрій). змінюють мембранорецепторние системи клітини з розвитком медиаторного дисбалансу, активують протеолітичні і лізосомальні ферменти.
Патологічна анатомія
Метаболічні ураження міокарда охоплюють всі стадії порушення обміну серцевого м’яза — від функціональних розладів до грубих структурних змін.
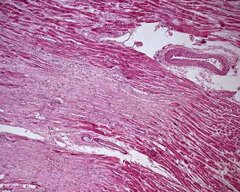
Морфологічні зміни відбуваються всередині клітин міокарда і не супроводжуються збільшенням їх кількості. Найбільш чутливі до патогенних впливів мітохондрії і ендоплазматична мережа. Для дегенеративних змін міокарда характерно мозаїчне порушення структури кардіоміоцитів: в одній і тій же клітині серед набряклих мітохондрій з частково або повністю зруйнованими внутрішніми перегородками можуть бути мітохондрії з нормальною будовою.
Як правило, усунення патогенної причини призводить до поступової нормалізації ультраструктур кардиомиоцита, що обумовлено внутрішньоклітинними регенераторні процесами. Пошкоджені міофібрили відновлюються в результаті активної діяльності рибосом: поступово усувається внутрішньоклітинний набряк, з’являються зерна глікогену, зменшується кількість жирових включень. При тривалому і інтенсивному впливі факторів на міокард дистрофічні зміни можуть призводити до глибоких морфологічних змін, що закінчується розвитком міокардіофіброз.
Загибель частини міокарда заповнюється збільшенням маси специфічних структур в непошкоджених клітинах, відбувається гіперплазія мітохондрій, саркоплазматичного ретикулума, рибосом. В результаті розвивається гіпертрофія міокарда, що представляє собою компенсаторну регенераторно-гіперпластичних реакцію, характерну для міокарда. Біохімічні процеси частіше порушуються в ЛШ.
Клінічна картінa
Клінічні прояви різноманітні і не є специфічними. Початкові стадії можуть протікати безсимптомно, з часом зниження скорочувальної здатності міокарда може привести до важкої СН.
Нерідко на тлі проявів основного захворювання відзначають кардиалгию (частіше в області верхівки серця (92%), рідше за грудиною (15%)), розширення меж серця, приглушеність тонів, невеликий систолічний шум на верхівці серця, порушення ритму (в основному Екстрасистолічна аритмію).
Діагностика
ЕКГ є провідним методом в розпізнаванні дистрофічних змін в міокарді, які стосуються в основному процесу реполяризації і виявляються найчастіше змінами кінцевої частини шлуночкового комплексу: відзначається депресія сегмента SТ, яка має висхідний характер до позитивного зубцю Т. Зубець ттакже може бути деформованим, низькоамплітудними, згладженим або негативним.
Також може визначатися зниження вольтажу комплексу ОКБ, особливо виражене при ожирінні і мікседемі, при тиреотоксикозі амплітуда зубців частіше збільшена. В деяких випадках можуть виникати уповільнення внутрипредсердной провідності, збільшення інтервалу Q-Т, порушення внутрішньошлуночкової провідності. З порушень ритму найбільш часто відзначають синусовую тахікардію і Екстрасистолічна аритмію.
При формулюванні діагнозу слід перш за все вказати основне захворювання або етіологічний фактор, характер перебігу кардіоміопатії та основні клінічні прояви (наявність порушень ритму і провідності, стадію СН).
У диференціальної діагностики метаболічної кардіоміопатії можуть мати значення навантажувальні і медикаментозні проби, у разі необхідності — проведення коронарографії.
Лікування
Незалежно від шкідливого чинника принциповими для метаболічної кардіоміопатії можуть бути наступні положення:
— порушення метаболізму міокарда при своєчасному лікуванні оборотні;
— виражена СН розвивається порівняно рідко, в основному в кінцевій стадії захворювання, але виникла СН резистентна до серцевих глікозидів і успіх терапії цілком залежить від ступеня відновлення порушеного обміну речовин в міокарді.
Допомога хворим слід починати з усунення причини розвитку дистрофії міокарда. Важливе значення має відмова від куріння і зловживання алкоголем, виключення фізичного та психоемоційного перенапруження.
Поряд з лікуванням основного захворювання необхідне відновлення адекватного енергетичного обміну. На перший план виступає застосування комплексу лікарських засобів, спрямованих на поліпшення транспорту кисню в тканини і його утилізації.
На обмін речовин в клітині можуть впливати дві групи лікарських засобів: регулятори екстрацелюлярної природи (гормональні препарати, блокатори та стимулятори центральної і периферичної нервової системи) і регулятори метаболізму інтрацеллюлярной природи (ферменти і антиферменти, вітаміни, кофактори, різноманітні метаболіти), які надають дію на різні шляхи обміну речовин.
При порушенні процесів окисного фосфорилювання застосовують комплекс вітамінів, що включає вітаміни В1, В2, пантотенову та липоевую кислоти. Вітаміни групи В впливають на білковий, ліпідний, вуглеводно-енергетичний обмін, синтез амінокислот, нуклеотидів.
Серед препаратів з антиоксидантними властивостями широко застосовують токоферолу ацетат, його поєднання з вітаміном РР (нікотиновою кислотою) сприяє поліпшенню енергетичного забезпечення скорочувальної функції міокарда. Активним антиоксидантом, який бере участь в окисно-відновних процесах, є вітамін С.
Велике значення для нормалізації метаболізму міокарда має достатнє надходження в організм незамінних амінокислот; в тому числі метіоніну, лейцину, аланіну, валіну, лізину, тріоніна, триптофану, які є пластичним матеріалом для синтезу білка, ферментів, коферментів. Для поліпшення їх засвоєння рекомендується призначати їх у комплексі з анаболічними стероїдами (метандієнон, нандролон).
При прогресуванні дистрофічного процесу показано застосування всередину калію хлориду, калію і магнію аспарагината для усунення закономірного дефіциту внутрішньоклітинного калію, порушення балансу кальцію і магнію, що призводить до відновлення регуляції збудливості і провідності міокарда, його автоматизму і скоротливості.
Для активації синтезу білків і нуклеїнових кислот застосовують солі оротової кислоти (оротат калію / магнію).
Проведена терапія повинна бути спрямована на підвищення генерації енергії та підвищення стійкості міокарда до гіпоксії. Останнім часом велику увагу приділяють ролі серотонинергической системи в регуляції стрессорной реакції. Специфічною особливістю нікотинаміду є його здатність стимулювати процеси аеробного окислення і обмін глікогену, тим самим підвищуючи стійкість кардіоміоцитів до гіпоксії.
Пряме цито-і мембранопротекторное на кардіоміоцити в умовах гіпоксичних станів надає триметазидин.
Тривалість інтенсивної метаболічної терапії на ранніх стадіях у хворих з переважно функціональними порушеннями становить 2-3 тижнів. При прогресуванні дистрофії міокарда та виявленні органічного ураження серця курс терапії слід повторювати кілька разів на рік.
Діабетична кардіоміопатія
#image.jpg
Об’єднана група захворювань, які умовно відносять до некоронарогенних, є найбільш неуточненою та маловивченою. На сьогодні, згідно з МКБ-10, термін «міокардіодистрофія» рекомендовано замінити терміном «метаболічна кардіоміопатія».
Метаболічна кардіоміопатія – це незапальне ураження міокарда різноманітної етіології, базисом якого є порушення обміну речовин, процесів утворення енергії або порушення її перетворення в механічну роботу, що призводить до дистрофії міокарда та недостатності скоротливої та інших функцій міокарда.
Ураження серця у хворих на цукровий діабет (ЦД) може бути спричинене діабетичною мікроангіопатією, міокардіодистрофією, вегетативною діабетичною нейропатією, а також коронарним атеросклерозом. Існують різні терміни, які вказують на ураження серця при цукровому діабеті (ЦД): міокардіодистрофія, діабетична вегетативна міокардіодистрофія, автономна кардіальна нейропатія, діабетична автономна нейропатія та інші. Очевидно, що необхідно дотримуватись єдиного терміну, рекомендованого експертами ВООЗ, а саме діабетична „кардіоміопатія” (ДКМП), яка є специфічним метаболічним захворюванням серцевого м’язу, що належить до вторинних метаболічних ендокринних кардіопатій.
Цукровий діабет. насамперед 2-го типу, є третьою (після артеріальної гіпертензії (АГ) і хронічної ішемічної хвороби серця (ІХС) за значенням причиною розвитку вираженої хронічної серцевої недостатності (ХСН). Щодо цього ЦД превалює над інфарктом міокарда (ІМ), вадами серця і дилятаційною кардіоміопатією. Ризик виникнення серцевої недостатності при цукровому діабеті зумовлений поєднанням діабетичної кардіоміопатії, ІХС та АГ – так званої „кардіотоксичної тріади”. Патогенез приєднання і/або прогресування уражень міокарда при цукровому діабеті (ЦД) 2-го типу, а також в осіб старших вікових груп з цукровому діабеті 1-го типу є досить складним і пов’язаний з впливом традиційних факторів ризику ішемічної хвороби серця (ІХС) [вік, есенціальна артеріальна гіпертензія (АГ), дисліпопротеїнемія і гіперхолестеринемія, ожиріння, інсулінова резистентність (ІР), порушення гемореологічних властивостей крові] і розвитком специфічних змін при цукровому діабеті (ендо і/або екзогенна інсулінрезистентності, порушення ліпідного обміну, нефропатія з вторинною артеріальною гіпертензією (АГ), макро- і мікроангіопатії, ранній розвиток атеросклерозу).
Сучасна медицина не володіє достатньо ефективними методами профілактики і лікування діабетичної кардіоміопатії. Однією з основних причин цього є незнання механізмів їх розвитку. Таким чином, дослідження і з’ясування патогенетичних механізмів діабетичної кардіоміопатії (ДКМП), рання діагностика і профілактика, пошук шляхів і методів їх лікування є одними із провідних у сучасній діабетології. Особливо актуальною є проблема профілактики й лікування діабетичної кардіоміопатії (ДКМП). Існуючі на сьогодні фармакологічні агенти не дозволяють отримати стійку нормалізацію порушень метаболізму при цукровому діабету (ЦД) без суттєвого ризику погіршення загального стану хворих при багаторічному їх використанні.
Пошук ефективних і безпечних засобів, які б забезпечили фізіологічний статус антитромботичної системи і сприятливо впливали на інші показники метаболізму, тісно пов’язаний з включенням в раціон харчування хворих на цукровий діабет (ЦД) препаратів, що вміщують ω-3 поліненасичені жирні кислоти (довголанцюжкові поліненасичені жирні кислоти, отримані із риб’ячого жиру, ω-3 ПНЖК), що сприяє зменшенню вмісту триацилгліцеринів (ТГ), ліпопротеїнів дуже низької густини (ЛПДНГ); позитивно впливає на гемореологічні показники.
Використання дієт з підвищеним вмістом ω-3 ПНЖК, які знаходяться в ліпідах морських риб, пропонується як сучасна антитромботична і антисклеротична терапія. Основний ефект подібних раціонів, збагачених ω-3 ПНЖК, пов’язаний з їх впливом на ліпідний склад мембран клітин, систему ейкозаноїдів, які в значній мірі впливають на систему мікроциркуляції. Особливу цікавість в плані впливу на ліпідний обмін, гемореологічні параметри при цукровому діабеті (ЦД) викликає використання дієт з підвишеним вмістом ейкозапентаєнової кислоти (ЕПК) лінолевої серії, а також докозагексаєнової кислоти (ДГК), що відкриває нові шляхи й перспективи в практичній діабетології. Метою методичних рекомендацій є опрацювання чітких вказівок із раньої діагностики, лікування та профілактики ДКМП, які частково доповнюють і видаються замість методичних рекомендацій „Сучасні методи діагностики і лікування діабетичних макроангіопатій” (автори: Єфімов А.С. Сергієнко О.О. Сергієнко Л.М. Нестерович М.Р. Вендзилович Ю.М.) Київ, 1993. – 10 с.
Епіопатогенез діабетичної кардіоміопатії
Хронічні прояви цукрового діабету (ЦД) є результатом взаємодії багаточисленних метаболічних, генетичних факторів, а також ряду факторів зовнішнього середовища, серед яких чільне місце належить хронічній гіперглікемії. Розвиток діабетичної кардіоміопатії (ДКМП) може зумовлюватись метаболічними факторами, порушенням нервової регуляції, судинних і/або гемореологічних, а у випадку цукрового діабету 1-го типу, також імунологічних порушень. Під терміном не коронарна „діабетична кардіопатія” розуміють ураження серця, яке розвивається внаслідок порушення метаболізму, нейропатії та мікроангіопатії.
На сьогодні існує принаймі чотири основні патогенетичні моделі порушень при цукровому діабеті (ЦД):
- сорбітолова;
- міоінозитолова;
- гіпотеза, яка постулює перевагу процесів гіперглікозилювання;
- гемореологічна модель,
існування яких, у принципі, самостійно можливе, однак, цілком ймовірно, що розвиток і прояви порушень метаболізму зумовлені сумарним впливом цих чинників.
Широко розповсюдженою є „осмотична гіпотеза”, згідно якій накопичення осмотично активного сорбітолу в клітинах супроводжується їх набуханням, набряком і, відповідно, порушенням структури та функції. Хронічна гіперглікемія, маніфестація цукрового діабету (ЦД) супроводжується посиленням метаболізму глюкози по сорбітоловому шляху ≈ на 7–8%).
Тривале зменшення концентрації внутрішньоклітинного міоінозитолу (МІ) при цукровому діабеті (ЦД) призводить до зменшення фосфоінозитидів в мембрані й пригнічення активності Nа +. К + -АТРази. Одним з основних шляхів метаболізму МІ є зворотнє його включення у фосфоінозитоли – унікальний клас мембранних фосфоліпідів, які локалізуються на люмінальній поверхні ендоплазматичного ретикулуму. Функція фосфоінозитолів в регуляції активності ферментів і транспортних процесів реалізується специфічною взаємодією між цими фосфоліпідами й білками. Зокрема, фосфоінозитол є ендогенним активатором Na +. К+-залежної ATPази. Включення МІ в фосфоінозитоли є одним із ключових факторів у регуляції метаболізму клітини, включаючи мобілізацію кальцію, регуляцію активності Na +. K + -ATPази, протеїнкінази С і метаболізм простагландинів. В умовах гіпоксії, паралельно зі змінами енергетичного обміну, спостерігається порушення електролітного балансу в тканинах, що супроводжується цілим рядом деструктивних змін клітинних елементів, дезорієнтацією мембранних структур, набуханням мітохондрій, дезорієнтацією молекулярної гетерогенності протоплазми. Пригнічення Na +. K + -ATPази і натрій-калієвої помпи призводить до множинних, Na + -залежних порушень транспорту субстратів через клітинну мембрану. Збільшена проникність мембран для Na +. K + і Ca 2+ зумовлює розвиток компенсаторних механізмів, скерованих на збільшення колоїдного осмотичного тиску, зокрема, на збільшення капілярної фільтрації рідини. Хронічне збільшення об’єму екстрацелюлярної та внутрішньоклітинної рідини при цукровому діабеті (ЦД) сприяє виникненню системної вазодилятації, яка зумовлює і/або посилює гіпоксію тканин.
Хронічна гіперглікемія посилює неферментативне глікозилювання білків, що призводить до порушення їх функції. В останній час особлива увага в патогенезі діабетичної кардіоміопатії (ДКМП) приділяється аутоімунним механізмам. Особливе значення надається також антитілам до інсуліну, які мають перехрестну реакцію до фактора росту нервів.
Цукровий діабет супроводжується порушенням метаболізму ряду водо- і жиророзчинних вітамінів. Для підтримання достатньої швидкості біохімічних процесів необхідний комплекс вітамінів групи В, зокрема, тіамін і піридоксин. Гіповітаміноз вітамінів групи В і С сприяє не тільки порушенню метаболізму вуглеводів, але і накопиченню вільних радикалів і продуктів перекисного окислення ліпідів (ПОЛ).
Однією з перших гіпотез розвитку діабетичних макроангіопатій була судинна теорія, згідно з якою мікроангіопатія судин vasa nervorum є основною причиною порушень морфо-функціонального стану клітин при цукровому діабеті (ЦД). Суттєве значення у виникненні та розвитку метаболічних уражень міокарда (МК) при різноманітних захворюваннях належить порушенню іннервації, транспорта та утилізації глюкози в кардіоміоцитах (КМЦ), тобто їх енергозабезпечення. Стабільність гіперфункції міокарда (МК) в умовах негативного впливу ряду етіологічних чинників, збільшеної потреби міокарда (МК) в енергії забезпечується пристосовувальною перебудовую екстракардіальної нервової регуляції серця, що супроводжується зміною аферентних впливів на кардіовазомоторний центр внаслідок подразнення відповідних рецепторних апаратів. Ці зміни регуляції в умовах гіпоксії скеровані на формування адекватної реакції міокарда (МК), а також на економію його енергозатрат, що досягається адекватністю відповіді на ступінь гіпоксії шляхом посилення симпатичного впливу та гіперфункції МК. Посилення симпатикоадреналових впливів викликає порушення балансу між симпатичною і парасимпатичною частинами вегетативної нервової системи (ВНС), який встановлюється рефлекторно на рівні кардіовазомоторного центру. Гіперсимпатикотонія призводить до активації катехоламінів, а симпатичні нейрогормони посилюють ліполіз. Активовані ліпази сприяють надлишковому утворенню жирних кислот, β-окислення, утилізація в циклі трикарбонових кислот яких, в умовах гіпоксії, пригнічена, що сприяє надлишковому накопиченню останніх в кардіоміоцитах (КМЦ). Це є основною причиною значення ліпідного ураження міокарда (МК).
Порушення біологічного окислення і енергетичний дефіцит сприяють зміні ультраструктури кардіоміоцитів (КМЦ). Найбільш чутливими до патогенного впливу є мітохондрії та ендоплазматична сітка. Однак, навіть при виражених порушеннях структура кардіоміоцитів (КМЦ) змінюється незначно. В одній і тій же клітині, серед набухших кардіоміоцитів (КМЦ) з частково чи повністю зруйнованими внутрішніми перегородками можуть спостерігатись інтактні кардіоміоцити (КМЦ).
У процесах розвитку діабетичної кардіоміопатії (ДКМП) беруть участь також тріозофосфати, простациклін і оксид азоту (NO). Останні є потужними вазодилятаторами і порушення їх синтезу супроводжується посиленням ішемії, як прояву дифузної діабетичної мікроангіопатії. Установлено, що агрегація тромбоцитів (ТЦ) при цукровому діабеті (ЦД) значно посилена в другій, незворотній фазі, яка залежить від перетворення арахідонової кислоти (АА) в лабільні простацикліни й тромбоксани. Таким чином, гіперактивний стан ТЦ при цукровому діабеті (ЦД) може бути опосередкований порушенням метаболізму АА в кров’яних пластинках. Ймовірними механізмами підвищеної функції ТЦ при цукровому діабеті (ЦД) є наступні:
- збільшення кількості глікопротеїнових (GP) рецепторів (GPIB,GPIIB/IIIA) на поверхні ТЦ;
- зменшення плинності мембран;
- збільшення швидкості обміну фосфоінозитидів;
- збільшення утворення інозитолтрифосфату;
- збільшення мобілізації Ca 2+ ;
- зростання рівня фосфорилювання білків;
- інтенсифікація мобілізації АА;
- збільшення біосинтезу тромбоксану А2;
- підвищення рівня зв’язування фібриногену;
- інтенсифікація процесів ПОЛ.
Структурно-метаболічна перебудова тромбоцитів (ТЦ) та інших формених елементів крові при цукровому діабеті (ЦД) може приводити до порушень реологічних здатностей крові. Зв’язуючим ланцюгом між реологічними властивостями крові й системою гемостазу є протеїни крові з великою молекулярною масою, зокрема, фібриноген, α2 -макроглобулін, фібронектин і апопротеїн В. Фіксація фібриногену на поверхні тромбоцитів (ТЦ), еритроцитів, а також лейкоцитів, в тому числі, поліморфно-ядерних, сприяє зміні фізико-хімічних властивостей цих клітин, тенденції до посиленої агрегації з розвитком синдрому дисемінованого внутрішньосудинного згортування крові.
На сьогодні накопичується все більше доказів на користь того, що вільно-радикальний стрес займає одне із провідних місць у патогенетичних механізмах розвитку діабетична кардіоміопатія (ДКМП). Зокрема, гіперглікемія сприяє порушенню метаболізму ω-6 жирних кислот, що супроводжується активацією поліольного шляху обміну глюкози, її аутооксидацією, посиленням неферментативного глікозилювання і, в кінці кінців, посиленням оксидативного стресу (ОС). Порушення метаболізму ω-6 жирних кислот, активація ОС супроводжуються збільшенням продукції ендотеліну I, ангіотензину II, пригніченням активності NO-синтази, продукції простагландину I2 і сприяє дисфункції ендотелію, що, у свою чергу, призводить до посилення вазоконстрикції та розвитку артеріо-венозного шунтування. Ці процеси посилюються також під впливом екзогенного інсуліну. Наступним етапом є зменшення кровоплину в капілярах і насичення тканин киснем, що призводить до потовщення базальної мембрани. Це сприяє реперфузійній ішемії і, що найголовніше, дисфункції клітин, посилює резистентність до гіпоксії.
Посилення оксидативного стресу (ОС) при цукровому діабеті (ЦД) є результатом збільшеної генерації токсичних похідних кисню і зменшеної ефективності системи антиоксидантів. Токсичні похідні кисню і кінцеві продукти гіперглікозилювання білків спричиняють порушення спочатку функції, а потім структури ендотелію, підтвердженням дисфункції якого може бути неадекватна продукція простацикліну й NO.
Як відомо, провокуючими й пусковими факторами розвитку діабетичних ангіопатій є генетичні дефекти судинної стінки. В патогенезі діабетичної кардіоміопатії (ДКМП) провідне місце, по всій імовірності, належить гіперінсулінемії (ендо-, екзогенній), ІР, гіперглікемії, які ведуть до порушення метаболізму МІ, активації сорбітолового шляху, посилення неферментативного глікозилювання білків, гіпоксії тканин, гіперпродукції інсуліноподібних факторів росту на фоні порушень вуглеводного, ліпідного, білкового обміну, гемодинамічних та інших властивостей крові.
Спеціально для порталу «Страна врачей»
за матеріалами авторів: Сергієнко О.О. Сергієнко В.О.
Львівський національний медичний університет ім. Данила Галицького

Одним з найбільш древніх, і тим не менш, найефективніших способів схуднення є застосування насіння льону.

Початкове положення — стоячи ноги на ширині плечей, гімнастична палиця лежить на лопатках, плечі розправлені.
#image.jpg
Якщо ви знаходитесь в пошуках найбільш ефективної дієти для схуднення, рекомендуємо спробувати вам дієту, розроблену медиками з клініки Майо в Мінессоті.
Будь яка подружня пара, що проходить програму ЕКЗ, знає, що дуже важливо не просто завагітніти, але й благополучно виносити малюка.