Диагностика и лечение метаболических кардиомиопатий, возникающих при нарушениях обмена жирных кислот, у детей
РЕКЛАМА
Кардиомиопатии (КМП) — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. В большинстве случаев диагностика КМП основывается на клинических симптомах и данных функционального обследования, в первую очередь эхокардиографии [1–3]. При этом истинная этиология КМП не всегда устанавливается. По данным наиболее крупного регистра КМП у детей США и Канады среди группы, в которой причина КМП была установлена, в 29,1% был диагностирован миокардит, в 24,2% — семейная изолированная КМП, в 22,2% — нейромышечные заболевания, в 15,4% — врожденные нарушения метаболизма и в 8,8% — различные генетические синдромы [3–6].
Причинами метаболических КМП являются врожденные нарушения обмена веществ или нарушения функции органелл клетки. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП. По данным педиатрического регистра при гипертрофических КМП в 20% случаев выявлены нарушения транспорта карнитина или дефекты окисления жирных кислот, нарушения окислительного фосфорилирования [7]. При дилатационных КМП дефекты транспорта карнитина/нарушения оксидации жирных кислот встречаются в 40% [8]. Наследственные дефекты обмена жирных кислот являются причиной не менее 5% случаев внезапной детской смерти [9].
Нарушения метаболизма жирных кислот могут возникать вследствие дефицита карнитина, нарушения транспорта карнитина при недостаточности ферментов, обеспечивающих перенос соединений карнитина, а также при дефектах оксидации жирных кислот [10].
Дефицит карнитина можно определить как дефицит внутриклеточного содержания карнитина, при котором концентрация карнитина в плазме менее 20 мкмоль/л, а содержание карнитина в тканях менее 20% от нормы. В зависимости от причины дефицита карнитина выделяют первичный дефицит карнитина, возникающий при генетически детерминированных дефектах метаболизма карнитина, и вторичный дефицит карнитина, связанный с нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ, дефектами в цепи дыхательных ферментов митохондрий, рядом соматических заболеваний и патологических состояний [11].
Первичный дефицит карнитина может проявляться в двух формах: системной [13, 14] и мышечной [11, 16]. Системный дефицит карнитина обусловлен мутацией гена SLC22A5, локализованного на длинном плече 5-й хромосомы (5q319), продуктом которого является белок, переносящий карнитин (OCTN2). Результатом этой мутации является дефицит карнитина в тканях. Заболевание наследуется по аутосомно-рецессивному типу [13–14]. При гомозиготной форме сроки манифестации заболевания варьируют от 1 месяца до 7 лет, в среднем 2 года. При гетерозиготной форме манифестация заболевания возникает в подростковом возрасте [14–16].
При раннем дебюте заболевания первыми признаками являются отказ от кормления, раздражительность, низкая прибавка в весе, отставание в физическом и психомоторном развитии. Характерным признаком является гипокетотическая гипогликемическая энцефалопатия (вялость, сонливость, повторная рвота), имеющая приступообразное течение. Во время гипогликемического криза возникают общая слабость, тахикардия, церебральная дисфункция (повышенная возбудимость, раздражительность). В дальнейшем развиваются гепатомегалия, стеатоз печени, нарушения желудочно-кишечного тракта (боли в животе, диарея), скелетная миопатия (мышечная слабость, гипотония), синдром Рейе. Как правило, дети часто болеют интеркуррентными заболеваниями: инфекционные заболевания верхних дыхательных путей и острый гастроэнтерит. У ряда пациентов возникает гипохромная анемия. Тяжесть заболевания варьирует от легких до крайне тяжелых вариантов. При легком течении отставание в физическом и психомоторном развитии может быть единственным проявлением заболевания [14–16].
КМП развивается в 30–40% случаев системного дефицита карнитина. Она может быть изолированной или сочетаться с другими симптомами, обычно миопатией или печеночной энцефалопатией [15–19]. Первые признаки КМП появляются в 3–5 месяцев и, при отсутствии заместительной терапии, имеют плохой прогноз. Границы сердца резко расширены, аускультативно определяется глухость сердечных тонов, ритм галопа, систолический шум относительной недостаточности митрального и трикуспидального клапанов, реже диастолический шум, акцент II тона над легочной артерией, тахипноэ. Признаки сердечной недостаточности (СН) проявляются рано и быстро прогрессируют: нарастает тахикардия, одышка, гепатомегалия, выслушиваются застойные хрипы в легких, возникают отеки, возможно развитие асцита, накопление жидкости в перикарде и плевральных полостях [19]. Тромбоэмболические осложнения возникают у 20–25%. Симптомы СН могут маскировать мышечную гипотонию. Традиционное лечение СН малоэффективно [20]. Часто возникают нарушения сердечного ритма, предсердные или желудочковые аритмии, причиной которых является отложение липидных депозитов в миокарде [21]. На фоне гипогликемии в 10–20% случаев возникает выраженная транзиторная брадикардия, вплоть до асистолии, что может привести к внезапной смерть ребенка [10, 21].
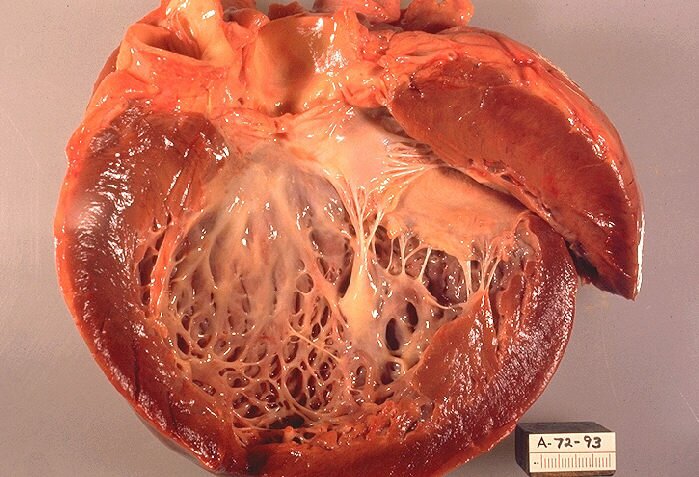
На ЭКГ определяется высокий вольтаж комплексов QRS за счет компенсаторной гипертрофии субэпикардиальных слоев миокарда. Обязательным признаком являются смещение сегмента ST ниже изолинии в стандартных и левых грудных отведениях, отрицательный зубец Т в этих отведениях, однако могут быть «гигантские» зубцы Т, превышающие по величине зубец R желудочкового комплекса (специфичный признак карнитиновой КМП); признаки гипертрофии левого желудочка, левого предсердия. Рентгенологически определяется кардиомегалия преимущественно за счет увеличения левого желудочка и левого предсердия. Данные эхокардиографии (ЭХО-КГ) выявляют резкое снижение фракции выброса, значительную дилатацию левого желудочка и левого предсердия, гипокинезию межжелудочковой перегородки, смещение митрального клапана к задней стенке левого желудочка, уплотнение эхосигнала от эндокарда.
У гетерозиготных носителей мутации гена SLC22 A5 карнитиновая недостаточность может проявиться в более старшем возрасте в виде гипертрофической КМП [16].
Лабораторные признаки системного дефицита карнитина: низкий уровень карнитина в тканях (печени, мышцах); приступы гипогликемии, не сопровождающиеся кетозом; повышение активности трансаминаз, уровня аммиака в крови; гипохромная анемия. Уровень свободного карнитина в крови обычно резко снижен. При исследовании методом тандемной масс-спектрометрии содержание свободного карнитина (С0 ) < 10 мкмоль/л, суммарных ацилкарнитинов < 5 мкмоль/л. В лейкоцитах, фибробластах и клетках других тканей снижен захват карнитина (около 3% от нормы). Характерна повышенная почечная экскреция карнитина, нормальное содержание дикарбоксильных кислот в моче, что служит критерием дифференциальной диагностики системного дефицита карнитина от дефектов бета-окисления жирных кислот.
Реже даже системный дефицит карнитина может протекать относительно благоприятно и проявляться только умеренной задержкой физического развития, частыми интеркуррентными заболеваниями, транзиторными поражениями сердца в виде расширения полостей и снижения сократительной способности миокарда, что затрудняет своевременную диагностику.
При мышечной форме дефицита карнитина заболевание обычно манифестирует на 2–3 декаде жизни, но иногда и на первом году жизни. Патология характеризуется медленно прогрессирующей мышечной слабостью, развитием гипертрофической КМП и СН на поздних стадиях заболевания [10, 11, 16]. Лабораторные признаки заболевания: низкое содержание карнитина в мышечной ткани при нормальном уровне в крови и других органах [10].
Нарушение транспорта карнитина возникает при дефиците ферментов, осуществляющих транспорт карнитина и его соединений через митохондриальные мембраны. В этих случаях очень часто заболевание возникает у нескольких членов семьи: дети–родители или сибсы. К сожалению, данная патология очень часто диагностируется слишком поздно, что приводит к драматическим последствиям, часто с развитием летального исхода. Дефицит карнитинпальмитоилтрансфераз нарушает транспортировку длинноцепочечных жирных кислот в комплексе с карнитином через митохондриальные мембраны, возникает дефицит ацетил-КоА, что уменьшает активность цикла Кребса [10, 14, 22].
Дефицит карнитинпальмитоилтрансферазы I. Манифестация заболевания происходит в возрасте до 2 лет, иногда у новорожденных. Основные признаки заболевания: нарушение общего состояния, мышечная гипотония, летаргия, нередко кома, судороги, гепатомегалия, нарушение стула, Рейе-подобный синдром. Реже возникает скелетная миопатия, КМП [23, 24].
Лабораторные признаки: гипокетотическая гипогликемия, повышение активности трансаминаз в крови, увеличение почечной экскреции электролитов, бикарбонатов. Иногда отмечается ацидоз, увеличение активности креатинфосфокиназы в крови. Свободный карнитин в крови может быть повышен (иногда нормальный или сниженный) при неизмененном спектре ацилкарнитинов или снижении уровня гексадеканоилкарнитина (С16 ) и стеароилкарнитина (С18 ). Нарушено соотношение свободного карнитина и длинноцепочечных жирных кислот: С0 /(С16 + С18 ) > 70–100. В фибробластах снижена активность карнитинпальмитоилтрансферазы I (около 10% от нормы), окисление пальмитата составляет около 5% от нормы [23, 24].
Дефицит карнитинпальмитоилтрасферазы II. Наследование аутосомно-рецессивное, вызывается мутациями в гене карнитинпальмитоилтрансферазы II. Заболевание может протекать в трех формах: неонатальной (летальной), детской (инфантильной) и поздней (форма взрослых).
Неонатальная (летальная) форма характеризуется манифестацией с первых дней жизни, прогрессирующим течением, очень тяжелым состоянием детей и плохим прогнозом. Заболевание проявляется полиорганным поражением. У новорожденных развиваются гипотермия, летаргия, судороги, гипотония, гиперрефлексия и гепатомегалия, почечная недостаточность. Характерны дисморфии лица, контрактуры коленей и локтей, длинные сужающиеся пальцы рук и ног, гепатомегалия (макровезикулярный стеатоз), поликистоз почек, дисплазия почечной паренхимы, гидронефроз, тубулярные расстройства (проксимальный и дистальный канальциевый ацидоз), грубые изменения ЦНС (вентрикуломегалия, кальцификаты, дисплазия мозолистого тела, полимикрогирии, кисты паравентрикулярные и базальных ядер) [25].
Поражение сердца проявляется с рождения в виде гипертрофии левого желудочка или бивентрикулярной гипертрофии, реже возможно развитие кардиомегалии с низкой сократительной способностью сердца. В большинстве случаев регистрируются нарушения ритма сердца, возникновение желудочковой тахиакардии часто является причиной внезапной смерти [25].
Лабораторные признаки: некетотическая гипогликемия, увеличение в сыворотке, моче и тканях длинноцепочечных ацилкарнитинов (С16. С18 ), снижение плазменного общего и свободного карнитина, длинноцепочечная дикарбоновая ацидурия, гипераммониемия, увеличение общего билирубина, трансаминаз печени, кретинфосфокиназы, высокое содержание дикарбоксильных кислот в моче. Заболевание верифицируется выраженным снижением активности (менее 10% от нормы) карнитинпалмитоилтрансферазы II в большинстве тканей, отсутствием белка CPT II [24, 25].
При морфологическом исследовании обнаруживается накопление липидов в ткани печени, почек, скелетных мышц, легких, надпочечников и др.
Инфантильная форма манифестирует с 3 месяцев, провоцируется лихорадочными состояниями и нарушениями питания. Характерны гепатомегалия, миопатический синдром, судороги. Поражение сердца — по типу дилатационной КМП. Миопатическая форма (поздняя) протекает благоприятно, может дебютировать как в детском возрасте, так и у взрослых. Основные проявления: боли в мышцах, обычно сопровождающиеся миоглобинурией. Характерна высокая активность креатинфосфокиназы в крови, при голодании может возникать умеренный кетоз. Изменения со стороны сердца минимальны [24].
Дефицит карнитинацилкарнитинтранслоказы — редкое аутосомно-рецессивное заболевание, приводящее к нарушению утилизации длинноцепочечных жирных кислот [24]. Выделяют две формы заболевания: неонатальная и инфальтильная. Неонатальная форма характеризуется высокой летальностью вследствие сердечно-легочной недостаточности. Основные проявления: нарушение общего состояния и психомоторного развития, расстройства дыхания, изменения со стороны ЦНС в виде мышечной слабости, судорог, возможно развитие комы на фоне голодания, гепатомегалия с нарушением функции печени.
Поражение сердца встречается чаще по типу дилатационной КМП, характерно снижение систолической функции, возможны нарушения ритма: брадикардия, атриовентрикулярная блокада, желудочковая экстрасистолия, тахикардия. На ЭКГ — признаки гипертрофии левого желудочка. У новорожденных описаны случаи внезапной смерти вследствие апноэ, кардиореспираторного ареста. Если заболевание возникает в более позднем возрасте, то КМП протекает на фоне мышечной слабости и энцефалопатии [10, 26].
Отклонения в лабораторных показателях включают гипогликемию при отсутствии кетоза, увеличение в крови уровня аммиака, иногда калия и мочевой кислоты, высокую активность креатинфосфокиназы, трансаминаз, дикарбоксильную и гидроксидикарбоксильную ацидурию, а также увеличение уровня ацилкарнитинов в крови (С16 –С18 ) в сочетании с низким уровень свободного карнитина (С0 ). Патология верифицируется низкой активностью карнитин-ацилкарнитин-транслоказы.
Дефекты окисления жирных кислот. Карнитин-ацилтрансферазы осуществляют перенос карнитина к ацильным компонентам коротких, средних и длинных цепей. Ацил-КоА-дегидрогеназы длинных цепей обеспечивают внутримитохондриальную бета-оксидацию жирных кислот с длинными карбоновыми цепями. Ацил-КоА-дегидрогеназы средних цепей регулируют внутримитохондриальное окисление жирных кислот средней длины карбоновых цепей. Ацил-КоА-дегидрогеназы коротких цепей обуславливают внутримитохондриальное окисление жирных кислот с короткой длиной карбоновых цепей, являются буфером ацильных групп, регулируя их поступление в цикл Кребса [27–29].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью возникает в результате мутации гена дегидрогеназы очень длинной цепи ацил-КоА, наследование аутосомно-рецессивное. Мультисистемная патология: поражаются печень (гепатомегалия, стеатоз печени, гепатоцеллюлярный некроз), мышцы. Симптомами поражения мышц являются гипотония, мышечная слабость, связанная с голоданием или инфекцией, боль в мышцах при физической нагрузке, ригидность мышц, рабдомиолиз при физической нагрузке. Миопатические эпизоды вызваны физическими упражнениями, голоданием, инфекцией, воздействием низких температур. По срокам появления первых признаков выделяют 3 формы заболевания: неонатальную, детскую и позднюю [27–29].
Неонатальная форма характеризуется ранней манифестацией, в течение первых дней жизни, с развитием КМП и ранней смерти. Поражение сердца по типу гипертрофической КМП в сочетании со сниженной контрактильной способностью, часто возникают жизнеугрожающие нарушения сердечного ритма. Во время гипогликемической комы возможно развитие асистолии и внезапной смерти [30].
При детской форме (около 40% больных) начальные симптомы обычно появляются на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, манифестирует в подростковом возрасте, клинически проявляется болями в мышцах, как правило, сердце не вовлекается в патологический процесс.
Лабораторные признаки: некетоновая гипогликемия, дикарбоновая ацидурия, повышение концентрации лактата в крови. Диагностический маркер — снижение свободного карнитина при увеличении ацилкарнитинов (С14:1 и С14. С16 OH), повышение активности креатинфосфокиназы, ацидурия дикарбоксильных кислот с длинной углеродной цепью (С14 –С18 ) [23]. Специфична низкая активность дегидрогеназы очень длинной цепи ацил-КоА в фибробластах или мононуклеарных лейкоцитах.
Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи возникает в результате мутации гена средней цепи ацил-КоА-дегидрогеназы, наследования аутосомно-рецессивное. Наиболее распространенное нарушение окисления жирных кислот [27, 29].
Клиническая картина варьирует от бессимптомной до молниеносной. Заболеванию свойственна острая манифестация. Провоцирующими факторами обычно служат сопутствующие болезни: острые респираторные заболевания, детские инфекционные болезни, желудочно-кишечные расстройства, оперативные вмешательства. Возраст появления первых признаков различный, чаще от 3 до 15 месяцев. Характерно приступообразное течение заболевания, обусловленное гипогликемическими кризами. Приступы протекают тяжело и могут заканчиваться летально, в 5% случаев смерть детей происходит в первые дни жизни, около 20% пациентов умирает до установления диагноза. Межприступный период протекает благоприятно, у 80% детей отмечается нормальное нервно-психическое развитие с полным отсутствием других признаков патологии. Клиническая симптоматика полиорганна: в процесс вовлекается желудочно-кишечный тракт (частая рвота, нарушение стула), гепатомегалия (стеатоз печени), ЦНС (задержка умственного развития, генерализованные тонико-клонические судороги, прогрессирующие вялость, сонливость, нарушение сознания вплоть до комы, отек головного мозга).
Характер поражения сердца аналогичен таковому при карнитиновой КМП. Часто возникают тяжелые нарушения сердечного ритма, остановка синусового узла, желудочковая тахикардия (по типу приступов пируэтной тахикардии (torsades de pointes)) [10, 30]. Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи является в 1–3% причиной внезапной смерти у детей раннего возраста [10].
Лабораторные признаки: гипогликемия, метаболический ацидоз, дикарбоновая ацидурия средних цепей, ацилглицинурия, низкое содержание плазменного карнитина. Может отмечаться умеренная кетонурия. В крови повышен уровень среднецепочечных ацилкарнитинов (С6 –С10 ). В моче определяется специфическая органическая ацидурия с преобладанием среднецепочечных дикарбоновых кислот, глициновых конъюгатов [27–28].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с короткой длиной углеродной цепи. Возникает в результате мутации гена короткой цепи ацил-КоА-дегидрогеназы, наследование аутосомно-рецессивное.
Генерализованная форма может проявиться у новорожденных или детей первого года жизни, течение неблагоприятное, возможен летальный исход. Характерны судороги, задержка развития, микроцефалия, повторные приступы рвоты, прогрессирующая мышечная слабость, вялость, сонливость. Поражение сердца характеризуются дилатационной КМП, осложненной тяжелой СН. При мышечной форме первые признаки болезни появляются в старшем возрасте. В клинической картине на первый план выступают миопатические расстройства, низкая толерантность к физической нагрузке. Поражение сердца по типу дилатационной КМП протекает субклинически и выявляется обычно у подростков [29, 30].
Множественный дефицит ацил-КоА-дегидрогеназ описан как глутаровая ацидурия 2-го типа, наследование аутосомно-рецессивное. Патология обусловлена дефектом электронно-транспортного флавопротеина и дефицитом нескольких флавопротеин-содержащих дегидрогеназ, что значительно снижает эффективность митохондриального бета-окисления. Нарушены функции изовалерил-, изобутирил-, метилбутирил-, глутарил-КоА-дегидрогеназ, участвующих в метаболизме ряда аминокислот и холина.
Выделяют несколько клинических форм: неонатальную форму с врожденными аномалиями (летальную), неонатальную форму без врожденных аномалий, позднюю форму.
Метаболические проявления включают тяжелый метаболический ацидоз, гипогликемию, гипераммониемию. Кетоз выражен умеренно или отсутствует, гиперлактат- и гиперпируватемия с увеличением их соотношения до 20 и выше (норма < 15). В крови повышен уровень ацилкарнитинов (С4 –С18 ). Характерна органическая ацидурия: глутаровая, изовалериановая, этилмалоновая, адипиновая, пробковая, себациновая, их гидроксилированные формы, метилянтарная, масляная, 2-метилмасляная, изомасляная кислоты, непредельные дикарбоксильные кислоты (С8:1 –С10:1 ).
Для подтверждения диагноза осуществляется исследование электронно-транспортного флавопротеина или активности флавопротеин-содержащих ацил-КоА-дегидрогеназ в фибробластах, биоптатах мышцы или печени [27–29].
Алгоритм диагностики метаболических КМП на фоне нарушений обмена карнитина и митохондриальной оксидации жирных кислот базируется на сочетании характерных клинических кардиальных и экстракардиальных симптомов и лабораторных данных.
Экстракардиальными критериями диагностики метаболических КМП, возникающих на фоне нарушений обмена жирных кислот, являются:
1) ранний дебют заболевания;
2) полиорганность поражения;
3) приступообразное течение заболевания;
4) повторные рвоты, часто на фоне гипогликемии;
5) мышечная гипотония;
6) изменения ЦНС (микроцефалия, судороги, задержка умственного и моторного развития, вялость, сонливость, летаргия);
7) задержка физического развития;
8) изменения со стороны желудочно-кишечного тракта (рвота, боли в животе, гепатомегалия, стеатоз печени, нарушения стула);
9) изменения со стороны почек (тубулопатии, поликистоз, почечная недостаточность);
10) лицевой дисморфизм.
Кардиальными критериями диагностики метаболических КМП являются:
1) дилатация полостей сердца, снижение сократительной способности миокарда;
2) симметричная гипертрофия миокарда;
3) сочетание гипертрофии и дилатации миокарда;
4) рефрактерность стандартной терапии СН;
5) нарушения сердечного ритма (желудочковая тахикардия), нарушения проведения (синдром слабости синусового узла, атриовентрикулярные блокады);
6) гигантские T-зубцы на электрокардиограмме;
7) случаи внезапной сердечной смерти в семье (аритмогенной).
Лабораторными критериями, позволяющими предположить нарушение обмена жирных кислот как причины развития КМП, являются:
1) гипогликемия без кетоза;
2) метаболический ацидоз;
3) гиперлактат- и гиперпируватемия;
4) повышение креатинфосфокиназы;
5) увеличение активности трансаминаз печени.
Для уточнения причины нарушений обмена карнитина и органических жирных кислот наиболее важной отправной точкой является определение уровня общего, свободного карнитина и ацилкарнитинов в комбинации с оценкой наличия или отсутствия дикарбоксильной ацидурии [6, 27]. Для верификации диагноза требуется молекулярно-генетическая диагностика.
Снижение свободного карнитина (< 10 мкмоль/л) и ацилкарнитинов (< 5 мкмоль/л) и нормальное содержание дикарбоксильных кислот в моче свидетельствуют о системном дефиците карнитина.
Низкие значения общего и свободного карнитина, повышение значений ацилкарнитинов: длинных (С16–18 ), средних (С10–14 ) или коротких цепей (С4–8 ) в сочетании с дикарбоксильной ацидурией указывают на дефицит дегидрогеназ, обеспечивающих внутримитохондриальную бета-оксидацию жирных кислот с различной длиной карбоновых цепей [6].
Низкий уровень свободного карнитина в сочетании с высокими значениями длинноцепочечных ацилкарнитинов, некетотическая гипогликемия, отсутствие дикарбоксильной ацидурии свидетельствуют о нарушении транспорта карнитина, дефиците карнитинпальмитоилтранферазы II [27].
Увеличение недлинноцепочечных ацилкарнитинов в сочетании с низким уровнем свободного карнитина свидетельствует о дефекте потребления карнитина.
Лечение
Лечение метаболических КМП, возникающих на фоне нарушений обмена жирных кислот, включает назначение комбинации препаратов, применяемых для коррекции симптомов СН: ингибиторов ангиотензинпревращающего фермента, диуретиков, антиаритмических средств (при выявлении желудочковых нарушений сердечного ритма) и патогенетической метаболической терапии, направленной на коррекцию нарушений обмена веществ.
Своевременная терапия левокарнитином КМП, развивающихся на фоне первичного дефицита карнитина, предотвращает развитие СН, позволяет избежать неблагоприятного течения заболевания. На фоне лечения заболевания высокими дозами левокарнитина (100 мг/кг/сут) возможно полное исчезновение симптоматики, если лечение начато до необратимых повреждений органов [10–12, 15].
Лечение пациентов с дефектами окисления жирных кислот включает диетотерапию и медикаментозное лечение. Основные принципы диетотерапии: исключение голодания, предупреждение гипогликемии, обогащение рациона углеводами при ограничении содержания липидов, исключение из диеты продуктов, которые не метаболизируются. Назначают частое дробное питание, не допускаются длительные промежутки между приемами пищи. Содержание липидов в суточном наборе продуктов снижают до 10–20% (по калорийности). В рацион дополнительно вводят продукты, богатые углеводами (60–75% по калорийности). Для предупреждения развития ночной и утренней гипогликемии вечером, непосредственно перед сном, детям рекомендуют прием пищевых продуктов, содержащих кукурузный крахмал, из расчета 2 г/кг [27]. В питании детей с глутаровой ацидемией 2?го типа ограничивают поступления белка до 1,5 г/кг в сутки, или < 20% по калорийности рациона.
Медикаментозная терапия болезней окисления жирных кислот включает применение коэнзима Q10. левокарнитина, глицина и витаминов. Витаминотерапия (рибофлавин, витамины группы В) способствует повышению резидуальной активности ферментов. Рибофлавин назначают в высоких дозах (25 мг/кг, до 300 мг/сут) для повышения активности ацил-КоА-дегидрогеназ. Левокарнитин необходим для коррекции недостаточности общего и свободного карнитина, усиления конъюгации токсичных дериватов жирных кислот и их выведения из организма. Левокарнитин (Элькар®) используют в высокой дозе 50–100 мг/кг/сут за 2–3 приема. У больных с дефектами транспорта и окисления длинноцепочечных жирных кислот (дефицит карнитинпальмитоилтрансфераз I и II, карнитин-ацилкарнитин-транслоказы, трифункционального белка, ацил-КоА-дегидрогеназы жирных кислот с очень длинной и длинной углеродной цепью), особенно в периоде метаболической декомпенсации, левокарнитин следует использовать с осторожностью, начиная с небольших доз. Глицин (до 0,6 г/сут) способствует связыванию и выведению с мочой токсичных ацилрадикалов [27].
Заключение
КМП — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. Важным является ранняя диагностика этиологии заболевания. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП.
Выделены экстракардиальные и кардиальные критерии диагностики метаболических КМП, возникающих на фоне нарушений обмена жирных кислот. Комбинация кардиальных и экстракардиальных симптомов метаболических КМП является показанием для углубленного обследования карнитинового обмена и метаболизма жирных кислот. Усовершенствованию лабораторной диагностики метаболических КМП будет способствовать более широкое внедрение в клиническую практику специализированных методов: тандемной масс-спектрометрии с оценкой спектра карнитинов, газовой хроматографии (хроматомасс-спектрометрии) для диагностики дикарбоксильной ацидурии.
В настоящее время для ранней диагностики врожденных нарушений обмена жирных кислот применяют неонатальный скрининг новорожденных, позволяющий с помощью масс-спектрометрии выявлять нарушения ацилкарнитинового и аминокислотного профиля. Однако даже негативный результат этого теста не исключает возможность их возникновения в последующей жизни.
Особенностью метаболических КМП, связанных с нарушением клеточной энергетики, является острое возникновение СН, вызванной метаболической декомпенсацией на фоне энергетического стресса. В качестве энергетического стресса могут выступать интеркуррентные инфекции, операция, голодание или чрезмерная физическая активность. Возникновение таких ситуаций затрудняет диагностику и нередко является причиной диагностических ошибок. Так, в этих случаях нередко диагностируют миокардит. Необходимо повторное проведение лабораторных исследований на фоне ситуаций, ассоциированных с повышенными требованиями к метаболическим процессам, что позволит выявить скрытые метаболические дефекты обмена карнитина и органических жирных кислот.
Ранняя диагностика метаболических КМП дает возможность своевременно к традиционной терапии СН добавить специфическое лечение, направленное на коррекцию метаболических нарушений, что позволяет не только оптимизировать коррекцию симптомов СН, но и добиться регресса изменений в сердце, что значительно улучшает прогноз течения заболевания.
- Кушаковский М. С. Метаболические болезни сердца. CПб: Фолиант, 2000: 128.
- Леонтьева И. В. Лекции по детской кардиологии. М. Медпрактика-М, 2005. С. 535.
- Cox G. F. Sleeper L. A. Lowe A. M. et al. Factors associated with establishing a causal diagnosis for children with cardiomyopathy // Pediatrics. 2006; 118: 1519–1531.
- Lipshultz S. E. Sleeper L. A. Towbin J. A. et al. The incidence of pediatric cardiomyopathy in two regions of the United States // N Engl J Med. 2003; 348: 1647–1655.
- Nugent A. W. Daubeney P. E. Chondros P. E. et al. The epidemiology of childhood cardiomyopathy in Australia // N Engl J Med. 2003; 348: 1639–1646.
- Cox G. F. Diagnostic Approaches to Pediatric Cardiomyopathy of Metabolic Genetic Etiologies and Their Relation to Therapy // Prog Pediatr Cardiol. 2007; 24 (1): 15–25.
- Colan S. D. Lipshultz S. E. Lowe A. M. et al. Epidemiology and cause-specific outcome of hypertrophiccardiomyopathy in children. Findings from the Pediatric Cardiomyopathy Registry // Circulation. 2007; 13: 115 (6): 773–781.
- Towbin J. A. Lowe A. M. Colan S. D. et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children // JAMA. 2006; 296: 1867–1876.
- Bonnet D. Martin D. de Lonlay P. et al. Arrhythmias and conduction defects as presenting symptoms of fatty acid oxidation disorders in children // Circulation. 1999; 100: 2248–2253.
- Sharma S. Black S. M. Сarnitine homeostasis, mitochondrial function, and cardiovascular disease // Drug Discov Today Dis Mech. 2009; 6: 1–4: e31–e39.
За остальным списком литературы обращайтесь в редакцию.
И. В. Леонтьева, доктор медицинских наук, профессор
Ю. М. Белозеров, доктор медицинских наук, профессор
ФГБУ НИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва
Контактная информация об авторах для переписки: [email protected]u
Причины и лечение метаболической кардиомиопатии
Содержание:
Главным органом человеческого организма является сердце. Поэтому при первых признаках нарушения его функционирования стоит обращаться к кардиологу. Особенно стоит внимательно изучать детские проблемы с сердцем, так как они могут привести к серьезным осложнениям, а также несвоевременному развитию других органов. Одной из таких болезней является метаболическая кардиомиопатия, которая представляет собой поражение в структуре миокарда безвоспалительных процессов, связанное с нарушением обмена веществ, энергообмена организма, что ведет сердечную мышцу к дистрофии, а также провоцирует неполноценное функционирование сердца.
Характеристика заболевания
При этом заболевании изменения на морфологическом уровне проходят достаточно глубоко, поэтому нужно ориентироваться именно по симптомам, что даст точное понятие наличия проблемы.
Если сказать более конкретно об изменениях, то они происходят внутри клеток сердечной мышцы. В то же время внешне особо ничего не указывает на возникновение проблемы. Количество клеток не меняется, они не увеличиваются в размерах. Кроме этого, даже внутриклеточная среда имеет как поврежденные митохондрии, так и здоровые. Но выявленное вовремя заболевание может предупредить негативные осложнения.
Длительный период нарушений в клетках миокарда приводит к его дистрофии, что является изначальной причиной более сложного заболевания, миокардиофиброза. Также может случиться отмирание части сердечной мышцы, которая восстанавливается за счет других типов тканей, что ведет к гипертрофии миокарда. Но своевременное влияние, направленное на усиление регенеративных процессов клеток, может привести к полному избавлению от проблемы и поврежденных митохондрий.

Причины метаболической кардиомиопатии
Причинами, которые могут спровоцировать развитие болезни, являются такие:
- алкогольные отравления;
- сбои в жировом и белковом обмене;
- заболевания щитовидной железы;
- авитаминозы;
- вредные факторы влияния, а именно температуры, радиации, медпрепаратов и т.д.;
- большие физические нагрузки;
- разного рода инфекционные болезни;
- нарушения функций печени и почек;
- анемии.
Своевременное определить заболевание поможет очная консультация у врача-кардиолога. Специалист проведет ряд обследований, которые смогут точно подтвердить или опровергнуть наличие заболевания.
Также существует вероятность того, что нарушения метаболического обмена может быть связана с врожденными дефектами. Наиболее частой причиной возникновений кардиомиопатий данного типа являются нарушения обмена жирных кислот. Такая ситуация приводит к тому, что часто это заболевание проявляется у детей.
Сбои в обмене жирных кислот могут быть спровоцированы из-за недостачи карнитина, либо нарушений в его распределении по организму вследствие нехватки необходимых ферментов.
Кардиомиопатия у детей
Данное заболевание очень часто встречается у новорожденных. Даже доктора не всегда могут точно определить нарушения в метаболических обменных процессах новорожденного. Но со временем кардиомиопатия проявляется более обширными симптомами. Это проявляется через отказ от пищи, кормления у самых маленьких, отставание в развитии, как физическом, так и психомоторных функций, раздражительности, плохом сне и других аналогичных признаках.
Есть и другие симптомы, которые указывают на нарушение метаболических процессов у детей:
- Рвотные рефлексы;
- гиподинамия мышц;
- несвоевременное развитие всей центральной нервной системы;
- проблемы с желудочно-кишечным трактом;
- проблемы с почками;
- дисформизм лицевых мышц;
Кардиологи проводят полное исследование малыша с проявлениями болезни, чтобы подтвердить диагноз и компенсировать недостачу веществ, вызывающую проблему. Это стоит делать как можно раньше, чтобы не допустить критического отставания ребенка в развитии и полной дистрофии миокарда.
Стадии болезни и клинические проявления
Принято различать три основные этапы проявления метаболической кардиомиопатии. Каждый из них определяется клинической симптоматикой, которая указывает на сложность болезни:
- нейрофункциональный этап;
- обменно-структурный;
- этап сердечной недостаточности в метаболической форме.
С самого начала заболевание не имеет проявления абсолютно никакими признаками. Но со временем появляются первые симптомы. В основном начальная стадия имеет нарушения вегетативной системы и проявления ее дисфункции.
На второй стадии происходят более глубокие органические изменения. Данный этап еще принято разделять на два периода:
- компенсации;
- декомпенсации.
Они характеризуются проявлением недостаточности кровообращения уже по хронических стадиях, второй А и Б соответственно периодам.
Третий этап метаболической кардиомиопатии уже свидетельствует о переходе к третьей стадии нарушения кровотока в организме.
Кроме данных периодов заболевания еще принято различать типы дистрофических поражений миокарда на такие подвиды в зависимости от сложности:
- острые;
- хронические;
- кардиосклероз миодистрофического типа.
Еще одна классификация определяет дистрофию сердечной мышцы по месту возникновения:
- диффузную;
- очаговую.

Уже на данных этапах проявляется клиническая симптоматика заболевания, которая во многом схожа с другими болезнями сердечно-сосудистой системы. но все же стоит ее выделить:
- быстрая утомляемость, слабость;
- боли в левой части груди;
- нарушения нервной регуляции.
После обращения к специалисту можно увидеть и другие признаки метаболической кардиомиопатии, а именно:
- происходит увеличение сердца;
- тоны сердечного ритма прослушиваются достаточно глухо;
- в верхних отделах сердца слышны систолические шумы;
- часто наблюдается экстрасистолическая аритмия;
- наступает сердечная недостаточность.
Кардиолог, определив указанную выше картину заболевания, в любом случае назначает более глубокое исследование, которое уже точно подтверждает диагноз. В основном все можно увидеть на ленте ЭКГ, зубцы которой имеют характерные для метаболической кардиомиопатии направления.

Лечение метаболической кардиомиопатии
Кардиомиопатия является вторичным заболеванием, которое вызывается наличием других проблем со здоровьем. Поэтому изначально стоит определить основную причину, которая вызывает осложнения. Именно с устранения патологии, которая и вызывает дистрофические процессы в сердечной мышце и должно начинаться лечения.
Вместе с избавлением от основной причины кардиологи назначают курс для уменьшения последствий дистрофии миокарда и регенерация разбухших внутриклеточных частиц. Изначально прописывают метаболическую терапию, которая предполагает назначение медикаментов, которые улучшают и ускоряют транспортировку кислорода по органам, а также его быструю утилизацию. Также имеет место принятия ряда витаминов. Из разных групп выбирают те, которые приостанавливают процессы окислительного фосфорилирования. Также кардиолог предписывают и другие группы лекарств, которые способны приостановить дистрофию сердечной мышцы:
- аминокислоты, среди которых основные метионин, триптофан, серин и другие;
- анаболические стероиды, которые, вместе с аминокислотами, улучшают метаболизм в миокарде;
- хлорид калия, который используют в основном, если независимо от лечения дистрофические процессы продолжают прогресс;
- калия оротат, который имеет более общеукрепляющее действие, а также способствует переработке белков, а вместе с ними и нуклеиновых кислот;
- растительные компоненты, среди которых плоды лимонника китайского, корень женьшеня, элеутерококк и другие, что имеют антиоксидантные функции, регулируют обмен веществ в клетках, улучшают устойчивость клеток к гипоксии;
- пирацетам, который характеризуется способностями повышать эффективность процессов нервной системы;
- никотинамил, который способен активизировать анаэробное окисление, а также обмен гликогена, что повышает устойчивость клеток к гипоксии;
- триметазидин, который повышает энергообмен, что способствует устойчивости сердечной мышцы к гипокиксии.
Своевременное начало лечения метаболической кардиомиопатии имеет шансы на полное избавление от ее симптомов и следствий для организма. Конечно, обязательно нужно избавиться от паталогии, которая вызвала дистрофию миокарда, либо уменьшить ее влияние на другие органы.
Кардиомиопатия является достаточно серьезным нарушением процессов обмена, а также провоцирующая перестройку миокарда, что имеет очень неблагоприяные перспективы в случае отсутствия реакции на болезнь. Поэтому в случае выявления нарушений метаболизма в миокарде, стоит пройти полный курс лечения, который не только избавит от существующей проблемы, но и поможет активизировать регенерацию поврежденных митохондрий и обеспечить полноценное функционирование сердечной мышцы.
Метаболическая кардиомиопатия
Метаболическая кардиомиопатия — синдром невоспалительного поражения миокарда, развивающийся при различных заболеваниях и состояниях известной этиологии, характеризующийся скрытой или клинически выраженной дисфункцией миокарда вследствие нарушений метаболизма, образования и превращения энергии в миокарде.
Термин «метаболическая кардиомиопатия» идентичен термину «миокардиодистрофия», предложенному Г. Ф. Лангом в 1936 г. Следует подчеркнуть, что метаболическая кардиомиопатия не является самостоятельным заболеванием, а развивается при ряде заболеваний и состояний известной этиологии.
Этиология
Известны следующие этиологические факторы метаболической кардиомиопатии:
Анемии различного генеза.
Недостаточное питание.
Ожирение любого генеза.
Заболевания желудочно-кишечного тракта, протекающие с синдромом мальабсорбции и мальдигестии; заболевания печени и поджелудочной железы с нарушением их функциональной способности.
Гиповитаминозы.
Заболевания эндокринной системы (диффузный токсический зоб, гипотиреоз, сахарный диабет, акромегалия, болезнь и синдром Иценко-Кушинга, надпочечниковая недостаточность).
Климакс у женщин и мужчин (дисгормонально-вегетативная или климактерическая кардиопатия).
Острые и хронические инфекции (в том числе при хроническом тонзиллите — тонзилогенная кардиомиопатия или миокардиодистрофия).
Острые и хронические интоксикации (экзогенные — бытовыми, промышленными ядами, лекарственными веществами, алкоголем — алкогольная кардиомиопатия*; эндогенные — при печеночной, почечной недостаточности).
Воздействие различных физических факторов (ионизирующая радиация, вибрация, переохлаждение, перегревание, невесомость, ожоги и др.).
Острое и хроническое физическое перенапряжение («спортивное сердце»).
* Алкогольная кардиомиопатия изложена в главе «Кардиомиопатии».
Нарушения обмена электролитов (калия, кальция, магния, натрия).
Заболевания, приводящие к гипоксемии (хронический обструктивний бронхит, альвеолит и др.).
Системные заболевания крови и соединительной ткани.
Нейрогенные дисфункции, в том числе вегетативные, нейроциркуляторная дистония.
Болезни накопления гликогена*.
Патогенез
Патогенетические механизмы метаболической кардиомиопатии многообразны и во многом обусловлены основным заболеванием. Однако существуют определенные закономерности развития метаболической кардиомиопатии (миокардиодистрофии), именно они обсуждаются в этом разделе.
Нейровегетативная дисфункция, активация симпатоадреналовой системы
Нейровегетативная дисфункция и активация симпатоадреналовой системы участвуют в развитии большинства метаболических кардиомиопатии. Особенно это выражено при синдроме тиреотоксикоза, различных интоксикациях (в том числе алкогольной), при физическом перенапряжении, нейроциркуляторной дистонии, климактерической кардиомиопатии, воздействии ионизирующей радиации. Известно, что оптимальное функционирование симпатической нервной системы оказывает положительное трофическое влияние на миокард. Гиперфункционирование симпатоадренало-вой системы и связанная с этим гиперкатехоламинемия оказывают негативное воздействие на миокард, связанное с:
ингибированием тканевого дыхания, уменьшением утилизации кислорода, снижением образования макроэргических соединений;
усилением перекисного окисления липидов в кардиомиоци-тах, избыточным образованием перекисей и свободных радикалов, что дестабилизирует лизосомальные мембраны и ведет к выходу из лизосом кислых гидролаз, повреждающих кардио-миоциты;
избыточным поступлением ионов кальция в кардиомиоциты и угнетением его удаления из цитоплазмы в саркоплазматичес-кий ретикулум, что приводит к чрезмерному накоплению кальция в цитоплазме, митохондриях, развитию контрактур и очаговому лизису миофибрилл, нарушению функционирования митохондрий и снижению синтеза макроэргов;
* Поражение миокарда при болезнях накопления гликогена изложено в главе «Кардиомиопатии».
повышением потребности миокарда в энергии;
проаритмогенным эффектом.
Нарушение обмена липидов и активация перекисного окисления липидов
В патогенезе метаболической кардиомиопатии большая роль принадлежит нарушениям липидного обмена в миокарде, характеризующимся усиленным распадом липидов и фосфолипидов и нарушением утилизации продуктов их распада. Это наблюдается при ряде заболеваний, в первую очередь при сахарном диабете, диффузном токсическом зобе, гипоксемических состояниях, алкогольной интоксикации. Под влиянием избытка катехоламинов и ионов Са++ в цитоплазме происходит чрезмерная активация липаз в миокарде, вследствие чего интенсивно расщепляются нейтральные жиры, при этом в избыточном количестве образуются свободные жирные кислоты. Накопление свободных жирных кислот в миокарде, с одной стороны, наряду с катехоламинами и ионами кальция активизирует фосфолипазы и распад фосфолипидов мембран органелл, с другой стороны, активирует перекисное окисление липидов.
Распад фосфолипидов мембран приводит к снижению активности К+/Иа+-зависимой АТФазы сарколеммы и Са++/Г^++-зависимой АТФазы саркоплазматического ретикулума. Вследствие этих процессов кардиомиоциты теряют ионы К+ и одновременно в цитоплазме кардиомиоцитов увеличивается содержание ионов Са++, что способствует электрической нестабильности миокарда, появлению аритмий, возрастанию степени энергетического дефицита, контрактурам мио-фибрилл, нарушению сократительной функции миокарда.
Накопившиеся в большом количестве свободные жирные кислоты подвергаются свободнорадикальному или перекисному окислению липидов (ПОЛ) с образованием преимущественно в митохондриях и микросомах гидроперекисей и свободных радикалов: супероксидного анион-радикала (02
), перекиси водорода (Н202), гидроксильного радикала (ОН).
Под влиянием этих веществ значительно нарушается физико-химическая и ультраструктурная организация мембран клеточных органелл, резко снижается активность ферментов, локализованных в мембранах саркоплазматического ретикулума и сарколемме (К+/Иа+-зависимой и Са++/^++-зависимой АТФаз), что, как уже указывалось ранее, усугубляет дефицит калия и избыток кальция в цитоплазме кардиомиоцитов.
Активация ПОЛ может приводить к разрыву митохондрий, ли-зосом, саркоплазматического ретикулума, и способствует развитию энергетического дефицита в миокарде. Отрицательным эффектам ПОЛ противодействует антиоксидантная система, представленная витамином Е, ферментами супероксиддисмутазой, каталазой, глю-татионом. Взаимоотношение активности антиоксидантной системы и перекисното окисления липидов определяют выраженность повреждающих эффектов перекисей и свободных радикалов кислорода на миокард.
Нарушение кальциевого обмена в миокарде
Известна важная роль ионов Са++ в процессах возбуждения и сопряжения возбуждения с сокращением миокарда.
В регуляции транспорта Са++ принимают участие три субклеточные структуры: цитоплазматическая мембрана, саркоплазмати-ческий ретикулум (СИР) и митохондрии. Деполяризация мембраны ведет к открытию кальциевых каналов в плазматической мембране, по этим каналам ионы Са++ поступают в миокардиоцит.
Внутриклеточная концентрация Са++ регулируется СИР. Са++ высвобождается из цистерн СИР, связывается с тропонином, что приводит к соединению актина и миозина, сокращению клетки. Сила сокращения миокарда пропорциональна концентрации Са++ внутри клетки. В фазу расслабления миокарда СПР вновь связывает внутриклеточный Са++ при участии Са++/1^++-зависимой АТФазы. Следовательно, ритмичная смена систолы и диастолы обеспечивается на клеточном уровне челночным движением ионов Са++ из СПР к миофибриллам и обратно.
При метаболической кардиомиопатии снижается активность-Са++/Л^++-АТФазы мембраны цитоплазмы и СПР, в результате повышается проницаемость мембраны для Са++, избыточно открываются кальциевые каналы, концентрация Са++ в саркоплазме повышается.
Это имеет следующие последствия («кальциевая триада» по Ф. 3. Меерсону):
нарушение расслабления миофибрилл;
увеличение поглощения Са++ митохондриями, что приводит к разобщению окислительного фосфорилирования и тканевого дыхания, угнетает образование АТФ, уменьшает использование кислорода;
активация Са++-зависимых протеаз, которые разрушают мио-фибриллы и активируют фосфолипазы в митохондриях, а это ведет к разрушению липидов в мембранах митохондрий и их дестабилизации.
В зависимости от выраженности «кальциевой триады» может возникать либо умеренное, обратимое нарушение функции, метаболизма и структуры миокарда, либо формирование в нем очагов некробиоза, которые в дальнейшем подвергаются рубцеванию и становятся основой некоронарогенного кардиосклероза.
Повреждения лизосом
В развитии метаболической кардиомиопатии определенная роль принадлежит повреждению лизосомальных мембран и выходу ли-зосомальных ферментов в цитоплазму кардиомиоцита.
Работами Wells (1984) и других исследователей установлено, что активация лизосом (как в норме, так и в условиях патологии) связана с фосфорилированием белка липопротеиновых мембран лизосом, что осуществляется Са++-зависимой и цАМФ-зависимой протеинкиназами. Усиление активности этих ферментов вызывает дестабилизацию лизосомальной мембраны. Активность Са++-зави-симой и цАМФ-зависимой протеинкиназ повышают следующие факторы:
угнетение транспорта ионов Са++ в саркоплазматический рети-кулум и увеличение его содержания в цитоплазме кардиомио-цита;
• повышенная концентрация в крови катехоламинов, глюкагона, кортикостероидов;
повышенная активностьперекисного окисления липидов в миокарде, увеличение содержания гидроперекисей, свободных радикалов кислорода.
В результате дестабилизации лизосомальных мембран происходит выход из лизосом и поступление в цитоплазму кардиомиоци-тов лизосомальных ферментов — кислых гидролаз, которые оказывают повреждающее влияние на миокард, угнетая многие ферментные системы, усугубляя тем самым нарушения электролитного баланса и энергетический дефицит. Кроме того, лизосомальные ферменты способствуют лизису мембран саркоплазматического ретикулума и митохондрий.
Приведенные патогенетические факторы метаболической кар-диомиопатии являются, конечно, неспецифическими и участвуют в патогенезе многих заболеваний, приводящих к развитию метаболической кардиомиопатии (миокардиодистрофии). Прогрессирова-ние указанных патогенетических факторов приводит к нарушению процессов биологического окисления и развитию энергетического дефицита в миокарде.
Патоморфология миокарда при метаболической кардиомиопа-тии определяется основным заболеванием (этиологическим фактором) и характеризуется отсутствием воспалительных и некротических изменений. Основные морфологические изменения происходят на ультраструктурном уровне, что описано подробно далее в разделе «Эндомиокардиальная биопсия».
Клиническая картина
признаков метаболической кардиомиопатии не существует. Ее клиническая картина в первую очередь определяется симптоматикой основного заболевания, симптоматика самой метаболической кардиомиопатии неспецифична.
Начальные стадии метаболической кардиомиопатии протекают бессимптомно (распознаются только с помощью инструментальных методов исследования) или с незначительной клинической симптоматикой.
Субъективные проявления
Выраженность субъективных проявлений метаболической кардиомиопатии на начальных стадиях невелика, в покое больные не предъявляют жалоб со стороны сердечно-сосудистой системы, но при физической нагрузке, ходьбе больных беспокоят утомляемость, одышка, сердцебиения, неприятные ощущения в области сердца, нередко боли, полностью соответствующие критериями кардиалгии (см. главу «Миокардиты»). Одновременно больные могут жаловаться на головные боли, плохой сон, снижение физической й умственной работоспособности. На последующих, более выраженных стадиях метаболической кардиомиопатии указанные жалобы отмечаются не только при нагрузке, но и в покое. С развитием метаболической сердечной недостаточности могут появиться жалобы на отечность голеней и стоп.
Объективные данные
Объективные данные обусловлены прежде всего основным заболеванием. Для самой метаболической кардиомиопатии характерны следующие данные физикального исследования сердечно-сосудистой системы (выраженность проявлений зависит от стадии метаболической кардиомиопатии):
границы сердца на ранних стадиях нормальные, в последующих стадиях расширяются, преимущественно влево;
тоны сердца при аускультации приглушены или даже глухие, часто прослушивается негромкий систолический шум в области верхушки сердца; в тяжелых случаях, при развитии метаболической сердечной недостаточности появляется патологический трехчленный ритм — протодиастолический ритм галопа; при декомпенсации часто определяется мерцательная аритмия;
пульс нормальных свойств, при развитии сердечной недостаточности — слабого наполнения, часто аритмичный;
артериальное давление нормальное, но при выраженной сердечной недостаточности может быть снижено.
При исследовании остальных органов и систем могут выявляться изменения, обусловленные заболеванием, которое привело к развитию метаболической кардиомиопатии.
Заканчивая обсуждение клинической картины метаболической кардиомиопатии, целесообразно подчеркнуть ее характерные особенности (В. X. Василенко и соавт. 1989), что поможет практическому врачу в диагностике метаболической кардиомиопатии: а) нарушения обменных процессов в миокарде обратимы при своевременном лечении;
б) начальные проявления миокардиодистрофии (метаболической
кардиомиопатии) могут отражаться на ЭКГ;
в) выраженная сердечная недостаточность развивается редко и в
конечной стадии заболевания;
г) успех лечения сердечной недостаточности во многом зависит
от того, насколько успешно будет устранена причина метабо-
лической кардиомиопатии (этот пункт нами несколько изме-
нен в соответствии с современными представлениями о лече-
нии сердечной недостаточности сердечными гликозидами).
Лабораторные данные и инструментальные исследования
Специфических, патогномоничных для метаболической кардиомиопатии, изменений лабораторных данных нет. Результаты лабораторных исследований полностью определяются основным заболеванием или состоянием, которое привело к развитию метаболической кардиомиопатии.
Электрокардиография
Электрокардиография является важнейшим методом инструментального исследования, который позволяет оценить состояние миокарда и помогает диагностировать метаболическую кардиомиопа-тию. Она имеет также большое значение в оценке эффективности проводимых лечебных мероприятий. Положительная динамика электрокардиограммы свидетельствует об улучшении метаболических процессов в миокарде при метаболической кардиомиопатии.
При метаболической кардиомиопатии может наблюдаться ряд электрокардиографических изменений, которые являются неспецифичными. Выявление этих изменений очень существенно, так как они отражают метаболические нарушения, предшествующие сократительной дисфункции миокарда.
Одним из важных электрокардиографических нарушений является увеличение продолжительности электрической систолы, т. е. длительность интервала (ЗИ^Т ((>—Т). Продолжительность интервала ОД8Т зависит от частоты сердечных сокращений. Для определения нормальной продолжительности интервала ((КЗТ при определенной частоте сердечного ритма применяется формула Базетта:
О-Т = К х Я-Я, где:
К = 0.37 для мужчин,
К = 0.40 для женщин.
Можно воспользоваться таблицей В. Л. Дощицына (1987), в которой представлены минимальная и максимальная длительность интервала ((К£>Т в норме при различной частоте сердечных сокращений (табл. 34). Интервал ((К£>Т находится в пределах нормы, если он не отклоняется более чем на 15% от средних значений для соответствующей частоты сердечных сокращений. Если его длительность превышает норму на 15% и более, он считается удлиненным.
 Оценка продолжительности электрической систолы может производиться и по систолическому показателю (СП). СП — это отношение длительности интервала ОЫБТ к продолжительности всего сердечного цикла в процентах:
Оценка продолжительности электрической систолы может производиться и по систолическому показателю (СП). СП — это отношение длительности интервала ОЫБТ к продолжительности всего сердечного цикла в процентах:
СП = хіоо%
Систолический показатель также сопоставляется с должной табличной величиной. Отклонение от нормы у здоровых лиц не должно превышать 5%.
При метаболической кардиомиопатии СП увеличивается больше, чем на 5% по сравнению с нормой.
Удлинение интервала ОК5Т или синдром замедленной реполя-ризации наблюдается при значительно выраженной метаболической кардиомиопатии, особенно при развитии сердечной недостаточности.
Оценивая величину интервала ОТ следует помнить, что его удлинение бывает врожденным (синдром Ервела-Ланге-Нельсена — удлиненный ОТ с глухонемотой; синдром Романо-Уорда — удлиненный ОТ без глухонемоты) и приобретенным (при гипокальцие-мии, ишемии миокарда, различных видах кардиомиопатии, в том числе при метаболической кардиомиопатии, при лечении антиаритмическими препаратами I класса и кордароном, а также при других состояниях). Следует отметить, что при удлинении интервала ОТ часто наблюдаются пароксизмальные желудочковые тахикардии.
Характерным, но неспецифическим признаком метаболической кардиомиопатии являются изменения сегмента ST и зубиа Т, отражающих процесс реполяризации клеточных мембран желудочков сердца. Изменения интервала ST обычно характеризуются его смещением книзу от изолинии (смещение неишемического типа, то есть не строго горизонтальное, а чаще косовосходящее или косо-нисходящее), иногда деформацией, увеличением его продолжительности. Изменения зубца Т заключаются в уплощении или снижении амплитуды, иногда инверсии, но отрицательный зубец Т несимметричный в отличие от ишемической болезни. Описанные изменения интервала ST и зубца Т обычно регистрируются не в одном, а во многих отведениях (чаще в грудных), а иногда во всех отведениях. Часто отмечается синдром TV1 > TV6 (т. е. амплитуда зубца Т в V, превышает амплитуду Т в V6), в норме, наоборот TV1 < Tv6.
Изменения конечной части желудочкового комплекса электрокардиограммы при метаболической кардиомиопатии обусловлены тремя основными факторами:
а) снижением концентрации ионов калия в кардиомиоцитах;
б) избыточным воздействием катехоламинов на рецепторы мемб-
ран кардиомиоцитов, регулирующие прохождение ионов каль-
ция через медленные кальциевые каналы;
в) истощением запасов норадреналина в окончаниях симпатичес-
ких нервов в миокарде (В. X. Василенко, 1985).
При изменениях электрокардиограммы, обусловленных дефицитом калия в кардиомиоцитах, после приема внутрь калия хлорида электрокардиограмма может нормализоваться временно или даже постоянно.
Если изменения электрокардиограммы при метаболической кар-диомиопатии обусловлены избыточным воздействием на миокард катехоламинов, то прием Я-адреноблокаторов может нормализовать электрокардиограмму.
В случае нарушения реполяризации, связанного с истощением запасов норадреналина в окончаниях симпатических нервов сердца, можно получить положительную динамику электрокардиограммы после приема изадрина.
Указанные патогенетические особенности нарушения репо-ляризации послужили предпосылкой для применения электрокардиографических проб с калия хлоридом, Я-адреноблокатора-ми и изадрином.
Проба с калия хлоридом выполняется следующим образом. Больному записывают электрокардиограмму, затем он принимает внутрь 4—8 г калия хлорида (40—80 мл 10% раствора) в томатном или фруктовом соке, после чего электрокардиограмма регистрируется каждые 30 минут в течение 2 ч. Проба считается положительной, если отрицательные зубцы Т становятся положительными или имеется тенденция к их нормализации.
Проба с р-адреноблокаторами. Электрокардиограмма регистрируется до и через 30 и 60 минут после приема 40—60 мг про-пранолола. Результаты пробы считаются положительными, если после приема обзидана отрицательные зубцы Т становятся положительными.
Положительные результаты проб с нагрузкой калием и в-адре-ноблокаторами указывают на целесообразность применения этих препаратов в комплексном лечении метаболической кардиомиопа-тии (при отсутствии противопоказаний).
Проба с изадрином применяется реже, она субъективно плохо переносится в связи с тем, что изадрин стимулирует в-адреноре-цепторы миокарда и вызывает тахикардию. Больному записывают электрокардиограмму, затем больной принимает под язык 5—10 мг изадрина и электрокардиограмма записывается через 10—30 мин (в период увеличения числа сердечных сокращений). Результаты пробы оцениваются так же, как в пробе с калием и в-адреноблокаторами.
Следует подчеркнуть неспецифичность этих проб, в частности, иногда пробы с калием и в-адреноблокаторами могут оказаться положительными при ишемической болезни сердца и миокардите (редко).
Велоэргометрия выявляет при метаболической кардиомиопа-тии снижение толерантности к физической нагрузке, что выражается в уменьшении пороговой нагрузки и общего объема выполненной работы.
Кроме вышеописанных изменений электрокардиограммы, у больных метаболической кардиомиопатией часто регистрируются нарушения сердечного ритма (преимущественно экстрасистолическая аритмия, реже — пароксизмальная тахикардия, при тяжелом поражении миокарда, например, при тиреотоксикозе, развивается мерцательная аритмия), возможны нарушения атриовентрикуляр-ной и внутрижелудочковой проводимости.
Эхокардиография
Ультразвуковое исследование сердца широко применяется при обследовании больных с метаболической кардиомиопатией. Метод эхокардиографии позволяет исключить пороки сердца, перикардит, гипертрофическую, дилатационную и рестриктивную кардио-миопатии и другие заболевания, которые в начальной стадии могут проявляться неспецифической клинической и электрокардиографической симптоматикой, сходной с симптоматикой метаболической кардиомиопатии. Однако следует подчеркнуть, что эхокарди-ографическое исследование в ряде случаев позволяет судить обычно только о наличии, но не о характере поражения миокарда, так как изменения электрокардиограммы неспецифичны.
На ранних стадиях метаболической кардиомиопатии может определяться снижение скорости расслабления миокарда, свидетельствующее о повышении его ригидности. При выраженной метаболической кардиомиопатии может определяться дилатация полостей сердца, преимущественно левого желудочка. В последующем, по мере прогрессирования основного заболевания и, соответственно, метаболической кардиомиопатии отмечается снижение фракции выброса — признак нарушения сократительной функции миокарда левого желудочка. При некоторых видах метаболической кардиомиопатии (например, при акромегалии, болезни Иценко-Кушинга, сердце атлета и др.) могут появиться признаки гипертрофии миокарда, утолщение межжелудочковой перегородки (характерен ее отек при микседеме).
Рентгеноскопия сердца
Данные рентгенологического исследования определяются, конечно, основным заболеванием. Для синдрома выраженной метаболической кардиомиопатии характерно расширение границ сердца, снижение силы пульсации сердца, что особенно выражено при прогрессирующем течении метаболической кардиомиопатии и нарушении сократительной функции миокарда.
Фонокардиография
В настоящее время, в связи с внедрением в клиническую практику доступного и высокоинформативного метода эхокардиографии, фонокардиография стала применяться значительно реже. При метаболической кардиомиопатии при фонокардиографическом исследовании обычно выявляется снижение амплитуды I тона в области верхушки сердца, а также неинтенсивный систолический шум над верхушкой сердца и вдоль левого края грудины (обычно на среднечастотных каналах, в большинстве случаев низко- или средне-амплитудный, отстоящий от сниженного I тона, напоминающий по форме веретено). Систолический шум связан со снижением тонуса папиллярных мышц из-за дистрофических изменений, а также с ускорением кровотока (в начальных стадиях метаболической кардио-миопатии повышен тонус симпатической нервной системы и ускорен кровоток из желудочков). При значительном снижении сократительной способности миокарда появляется патологический III тон (через 0.11—0.18 с после II тона) и протодиастолический ритм галопа.
При синхронной записи электрокардиограммы и фонокардиог-раммы можно зарегистрировать синдром энергетически-динамической недостаточности Хегглина.
Он считается характерным для метаболической кардиомиопатии и заключается в удлинении электрической систолы (т. е. удлинении интервала Q-T) с одновременным уменьшением механической систолы (т. е. уменьшением интервала между I и II тонами фонокардиог-раммы). В норме при синхронной записи электрокардиограммы и фонокардиограммы окончание механической и электрической систол происходит одновременно или расхождение между ними не превышает 0.02 с. Хегтлин указывает, что интервал II тон — зубец Т, равный или превьппающий 0.04 с, является патологическим и свидетельствует об энергетически-динамической недостаточности миокарда (рис. 15). По Хегглину энергетически-динамическая недостаточность миокарда характеризуется удлинением интервала ОТ на электрокардиограмме и преждевременным появлением II тона на фонокардиограмме, т. е. ненормально быстрым временем опорожнения сердца.
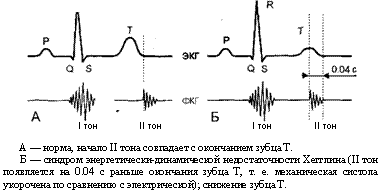 Механизм возникновения этого синдрома заключается в умень-пении образования энергии и нарупении использования ее миокардом. Клинических признаков недостаточности кровообращения при синдроме Хегглина еще может не быть.
Механизм возникновения этого синдрома заключается в умень-пении образования энергии и нарупении использования ее миокардом. Клинических признаков недостаточности кровообращения при синдроме Хегглина еще может не быть.
Рис. 15. Синхронная запись ЭКГ и ФКГ.
Эндомиокардиальнаябиопсия
Биопсия миокарда не является рутинным методом исследования и применяется только в диагностически трудных случаях для выяснения характера поражения миокарда, когда это невозможно сделать с помощью неинвазивных методов исследования. Биоптат миокарда характеризуется отсутствием признаков воспаления и наличием явлений дистрофии миокарда (белковой, жировой) в зависимости от этиологии метаболической кардиомиопатии. При электронно-микроскопическом исследовании биоптата миокарда независимо от причины метаболической кардиомиопатии выявляются ультраструктурные изменения: увеличение ядер кардиомио-цитов; набухание митохондрий, просветление их матрикса и разрушение внутренней мембраны; очаговый распад миофибрилл; уменьшение количества рибосом; расширение саркоплазматического ретикулума.
Стадии метаболической кардиомиопатии
В. X. Василенко и соавт. (1989) выделяют 3 стадии метаболической кардиомиопатии (миокардиодистрофии), что имеет большое практическое значение для оценки тяжести состояния больного и прогноза (табл. 35).
Табл. 35. Классификация клинических стадий миокардиодистрофии (метаболической кардиомиопатии)
Стадия
I — нейро-функциональная
Клинические симптомы Изменения ЭКГ Тип циркуляции
Гипердинамический
Укороченный интервал P-Q, удлиненный Q-T, косовосходящий сегмент ST, остроконечный зубец Т
Субъективные. транзиторные, беспричинные, колющие или тянущие боли в области сердца, сердцебиения, ощущения нехватки воздуха, слабость, головные боли, плохой сон, раздражительность, потливость
Объективные: влажные, холодные ладони, нормальные границы сердца, звучные тоны, слабый систолический шум на верхушке сердца, тахикардия, умеренное повышение АД