Метаболическая Кардиомиопатия У Детей
Моему ребенку(2,2 года)поставили этот диагноз.Расскажите,пожалуйста,все,что мне необходимо знать об этой болезни,и как ее лечить.
Кардио миокардит. Возможности кардио-метаболической терапии инфекционных миокардитов и кардиомиопатий у детей
Опубликовано в журнале:
«Практика педиатра», октябрь 2012, с. 50-55
Возможности кардио-метаболической терапии инфекционных миокардитов и кардиомиопатий у детей
Т.А. Руженцова, А.В. Горелов, ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
В настоящее время большинством специалистов, занимающихся вопросами некоронарогенной патологии сердца, признается, что частота инфекционных миокардитов очень высока и многие из них остаются недиагностированными [1].
Однако даже легкие и латентно протекающие процессы могут проявиться жизнеугрожающими нарушениями ритма и острой сердечной недостаточностью. По данным российских и зарубежных исследователей, до 2% всех случаев острых респираторных заболеваний, включая грипп, сопровождаются развитием миокардита. Примерно у 10% из всех умерших от инфекционных заболеваний в ходе аутопсий обнаруживают воспалительную инфильтрацию в миокарде [2].
Трудности диагностики связаны с многообразием клинической симптоматики, отсутствием специфичных клинических признаков [3]. Легкие и стертые формы не сопровождаются четкими, типичными для поражений миокарда проявлениями [4, 5]. Отмечаются признаки хронической интоксикации и симптомы левожелудочковой и/или правожелудочковой сердечной недостаточности.
Физические нагрузки и отсутствие своевременно начатой терапии при неустановленном вовремя диагнозе ведут к распространению поражения миокарда, прогрессирующему снижению фракции выброса, а затем – к формированию очагов кардиосклероза. Основной терапией инфекционных миокардитов и кардиомиопатий, без сомнений, можно считать этиотропную, в зависимости от выявленного возбудителя. Однако, против ряда вирусов, на которые приходится наибольшее число миокардитов, в частности против цитомегаловирусной инфекции, вируса Эпштейна – Барр, энтеровирусов, нет препаратов с высокой надежной эффективностью. Противовоспалительные средства назначаются по показаниям. Так, кортикостероиды необходимы при аутоиммунных и аллергических миокардитах. В ситуациях с активной репликацией вирусов эта группа препаратов может приводить к затяжному течению с последующим формированием дилатационной кардиомиопатии, что было доказано в зарубежных исследованиях. НПВС не рекомендуется назначать при легких и среднетяжелых процессах вирусной этиологии, поскольку они задерживают элиминацию вируса. В лечении этих пациентов показаны иммуноглобулины, но в части случаев они не приводят к ликвидации возбудителя и могут стать причиной аллергической реакции. Применение цитостатиков часто влечет за собой подавление различных звеньев иммунной системы и может быть оправдано только при тяжелых формах с выраженным аутоиммунным механизмом. По соответствующим показаниям, безусловно, необходимы коррекция водно-электролитного баланса, дезинтоксикационная терапия, назначение иммуномодуляторов, инотропных, антиаритмических, вазодилатирующих и диуретических препаратов.
Однако из всех вышеперечисленных лекарственных средств нет ни одного достаточно эффективного и безопасного, которое могло бы быть показано любому ребенку с диагнозом «инфекционный миокардит» или «кардиомиопатия».
В условиях инфекционно-воспалительного процесса в миокарде основными задачами терапии, помимо элиминации возбудителя, являются ограничение зоны повреждения и поддержание адекватного функционирования кардиомиоцитов. Любое инфекционное заболевание сопровождается активацией перекисного окисления липидов, что приводит к разрушению мембран, выходу различных веществ из клетки и увеличению зоны повреждения. Естественная антиоксидантная система организма: альфа-токоферол (витамин А), аскорбиновая кислота, бета-каротин (провитамин А) и убихинон (коэнзим Q10) [6–11]. Наибольший интерес из них представляет коэнзим Q10, так как помимо того, что он является сильным антиоксидантом, восстанавливающим не только свою активность, но и активность альфа-токоферола, он обязательный участник аэробного синтеза АТФ в клетках. Также коэнзим Q10 улучшает эндотелиальную функцию. Иммуномодулирующее действие убихинона, выражается в способности активизировать макрофаги в крови [12]. При инфекционных заболеваниях, особенно при тяжелых и среднетяжелых формах, сердечно-сосудистая система работает в условиях повышенного энергопотребления с увеличением образования свободных радикалов, что является теоретической предпосылкой эффективности применения коэнзима Q10.
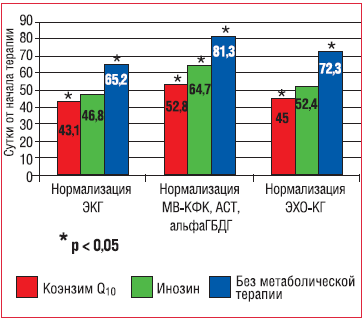
Недавно появился новый лекарственный препарат, содержащий 30 мг коэнзима Q10 и 4,5 мг витамина Е в 1 мл, – Кудесан. В ряде исследований, проведенных в группах пациентов с вегетососудистой дистонией, нарушениями ритма, иммунодефицитными состояниями, была показана его эффективность [13–17]. Однако эффективность его у детей с поражениями миокарда при инфекционных заболеваниях оценена не была.
Цель настоящего исследования – оценить эффективность Кудесанапри лечении инфекционных миокардитов и кардиомиопатий у детей.
Пациенты и методы.
В исследование было включено 97 детей, госпитализированных в детскую инфекционную больницу № 5 СВАО г. Москвы с различными острыми инфекционными заболеваниями, при которых на различных сроках от начала были выявлены признаки миокардита, миоперикардита или инфекционной кардиомиопатии. Все дети были в возрасте от 1 года до 10 лет, среди них 76 мальчиков и 33 девочки. Больных рандомизировали на 3 группы. В основную вошло 30 пациентов, которым дополнительно к базисной терапии был назначен Кудесанв дозе 1 мг/кг/сут. В группу сравнения («А») включили 30 пациентов, получивших инозин (Рибоксин), в среднем 10 мг/кг/сут. Группа сравнения «В» (37 детей), в которой дополнительная метаболическая терапия не назначалась, была сформирована ретроспективно.
Возрастной состав групп представлен в таблице 1. Все заболевшие были госпитализированы с 1-х по 4-е сутки от момента начала основного заболевания. Преобладали дети со средне-тяжелой формой (таблица 2), преимущественно с сочетанием симптомов острого респираторного заболевания (ОРЗ) и острой кишечной инфекции (ОКИ). Почти у 50% детей была выявлена пневмония, преимущественно односторонняя. ОКИ у большинства пациентов проявлялась в виде гастроэнтерита, значительно реже – в виде гастроэнтероколита. Клинические формы представлены в таблице 3.
Этиологическая структура сравниваемых групп показана в таблице 4.
Таблица 1
Распределение по возрасту в группах детей, включенных в исследование
ВозрастОсновная группа
Кудесан), n = 30 (100%)Группа сравнения «А»
Автореферат и диссертация по медицине (14.01.08) на тему: Диабетическая кардиомиопатия у детей: клинико-функциональная характеристика, обоснование метаболической терапии
Автореферат диссертации по медицине на тему Диабетическая кардиомиопатия у детей: клинико-функциональная характеристика, обоснование метаболической терапии
На правах рукописи
Иванов Дмитрий Анатольевич
ДИАБЕТИЧЕСКАЯ КАРДИОМИОПАТИЯ У ДЕТЕЙ: КЛИНИКО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА, ОБОСНОВАНИЕ МЕТАБОЛИЧЕСКОЙ ТЕРАПИИ
1 ^ -г Ь 7013
АВТОРЕФЕРАТ диссертации на соискание ученой степени доктора медицинских наук
005049565
Москва — 2013 г.
005049565
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Тверская государственная медицинская академия» Министерства здравоохранения Российской Федерации.
Научный консультант:
доктор медицинских наук, профессор
Официальные оппоненты:
доктор медицинских наук, профессор заведующий кафедрой эндокринологии педиатрического факультета ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздрава России
доктор медицинских паук, профессор заведующая кафедрой поликлинической педиатрии с основами формирования здоровья ГБОУ ВПО Тверская ГМА Минздрава России
доктор медицинских наук, профессор заведующий отделением детской кардиологии ФГБУ «НИИ кардиологии» СО РАМН
Гнусаев Сергей Федорович
Логачев Михаил Федорович
Алексеева Юлия Александровна
Ковалев Игорь Александрович
Ведущая организация:
ГБОУ ВПО «Смоленская государственная медицинская академия» Министерства здравоохранения Российской Федерации.
Защита состоится «. ». 2013 года в. часов на заседании диссертационного совета Д 208.072.03 на базе ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздрава России по адресу: 117997, г. Москва, ул. Островитянова, д. 1.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздрава России по адресу: 117997, г. Москва, ул. Островитянова, д. 1.
Автореферат разослан «_»_____2013 года.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор: Н. П. Котлукова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Поздние осложнения сахарного диабета 1 типа (СД) являются основной причиной ранней инвалидизации и высокой летальности больных, что обуславливает его медицинскую и социальную значимость (Алимова И. Л. 2004, Аметов А. С. и соавт. 2005). Ведущей причиной смертности у больных СД являются сердечно-сосудистые катастрофы (Шестакова М. В. и соавт. 2005). Прогрессирование СД приводит к развитию диабетической кардиомиопатии (ДКП), миокардиосклероза, сердечной недостаточности, жизнеугрожающих нарушений сердечного ритма и внезапной сердечной смерти (Дедов И. И. и соавт. 2002, Оруджева С. А. и соавт. 2006, Ковалев И. А. и соавт. 2009, Ong J. at al. 1993, Yotsukura M. at al. 1996).
В основе развития ДКП лежат три основных патогенетических механизма: метаболические нарушения, диабетическая микроангиопатия и диабетическая автономная кардиоваскулярная нейропатия (ДАКН) (Созыкина М. А. и соавт. 2005, Соколов Е. И. 2002). Они вызывают энергетический дефицит миокардиоцитов и клеток проводящей системы сердца, который проявляется тахикардией с нарушением релаксационной способности миокарда и способствует развитию в нем ультраструктурных изменений (Соколов Е. И. 2002, Raev D. С. 1994).
На развитие дефицита энергии в миокардиоцитах и клетках проводящей системы сердца значительное влияние оказывают нарушения обмена магния, низкий уровень которого определяется в эритроцитах и биоптатах шоковых тканей при ряде соматических заболеваний, в том числе и при СД (Верткин A.JL, 2005, Громова O.A. 2010). Это связано с непосредственным участием магния в формировании более 300 ферментов, участвующих в поддержании разнообразных энергетических и пластических процессов, осуществлении антиоксидантных функций нейронов и глиальных элементов и непосредственной защите рецепторов на постсинаптической мембране нейронов от по-
вреждения свободными радикалами, токсическими веществами и лекарствами (Рычкова Т. И. 2011, Коровина Н. А. 2006, Громова О. А. 2004).
ДКП, как правило, не выявляется на ранних стадиях развития из-за отсутствия специфических жалоб, минимальных клинических и электрокардиографических проявлений (Домрачева Э. Г. и соавт. 2000, Касаткина Э. П. 1996). Именно поэтому для раннего выявления ДКП применяются более информативные методы диагностики, такие как, эхокардиография (ЭхоКГ) и холтеровское мониторирование ритма сердца (ХМ) (Иванов Г. Г. и соавт. 2001, Логачев М. Ф. 2006, РиНпШшппП Т. гЛ а1, 2006). Однако, несмотря на многочисленные исследования, посвященные раннему выявлению осложнений со стороны сердечно-сосудистой системы (ССС) у больных СД, имеются разные мнения по поводу изменений у них внутрисердечной гемодинамики, диастолической функции левого желудочка (ЛЖ) и нарушений в вегетативной регуляции ритма сердца. Соответственно, отсутствуют четкие эхокар-диографические и функциональные критерии диагностики ДКП у детей, что затрудняет ее раннее выявление и является предпосылкой Для дальнейших исследований.
Основой профилактики развития поздних осложнений СД, в том числе и ДКП, является регулярный контроль гликемических показателей для достижения компенсации основного заболевания (Дедов И.И. и соавт. 2010). Вместе с тем известно, что достижение компенсации СД у детей с ДКП не всегда сопровождается положительной динамикой показателей функционального состояния ССС (Алимова И. Л. 2004). Поэтому, для коррекции метаболических сдвигов, приводящих к развитию поражения миокарда при СД, помимо основного лечения заболевания (диета, инсулииотерапия, физические нагрузки), применяются средства, улучшающие микроциркуляцию, антиок-сиданты, ингибиторы ангиотензин превращающего фермента, аптагонисты кальция (Кураева Т. Л. 2005, Малярова М. Ш. 2004, Шестакова М. В. и соавт. 2005, Каи1 N. а! а1. 1995, Ро§а1за в. 1997). Имеющиеся в литературе
данные об использовании различных терапевтических подходов к профилактике и лечению ДКП у детей позволяют лишь предположить положительный эффект от применения препаратов указанных групп в связи с отсутствием доказательности причинно-следственных связей между улучшением показателей функционального состояния ССС и биохимических показателей, характеризующих различные звенья патогенеза ДКП.
Все вышеизложенное обусловило цель настоящего исследования и определило его задачи.
Цель исследования
На основании комплексного исследования клинико-функционального состояния сердечно-сосудистой системы и магниевого обмена у детей с сахарным диабетом 1 типа выявить патогенетические закономерности формирования диабетической кардиомиопатии для определения критериев ее диагностики, оптимизации лечения и профилактики.
Задачи исследования
1. Оценить диагностические возможности клинических и функциональных методов обследования сердечно-сосудистой системы для выявления кардиомиопатии у детей с сахарным диабетом 1 типа.
2. Разработать критерии ранней диагностики автономной кардиоваску-лярной нейропатии и кардиомиопатии у детей с сахарным диабетом 1 типа на основании комплексной оценки показателей холтеровского мониторирования ритма сердца, суточного мониторирования артериального давления и эхокар-диографии.
3. Определить патогенетическую роль автономной кардиоваскулярной нейропатии в формировании кардиомиопатии у детей с сахарным диабетом 1 типа.
4. Установить стадии развития диабетической кардиомиопатии у детей на основании изменений функциональных и эхокардиографических показа-
телей, характеризующих состояние вегетативной регуляции ритма сердца, сосудистого тонуса и релаксационной способности миокарда.
5. Выявить наличие и степень выраженности дефицита магния у детей, больных сахарным диабетом 1 типа, в зависимости от длительности заболевания и наличия его поздних осложнений.
6. Определить роль магниевого дефицита в формировании кардиомио-патии у детей с сахарным диабетом 1 типа.
7. Провести сравнительную оценку эффективности препаратов магния с различной биодоступностью в лечении детей с диабетической кардиомиопа-тией.
Научная новизна
Впервые установлены критерии ранней диагностики диабетической автономной кардиоваскулярной нейропатии у детей с использованием метода бифункционального мониторирования ритма сердца и артериального давления.
Доказана патогенетическая роль диабетической автономной кардиоваскулярной нейропатии в формировании концентрического ремоделирования и диастолической дисфункции левого желудочка у детей с сахарным диабетом 1 типа.
Впервые установлены эхокардиографические критерии диагностики кардиомиопатии у детей, больных сахарным диабетом 1 типа, основанные на комплексной оценке показателей эхокардиометрии, центральной гемодинамики и параметров трансмитралыюго диастолического потока, характеризующих концентрическое ремоделирование левого желудочка и его диасто-лическую функцию. —
Впервые у детей с диабетической кардиомиопатией определены стадии ее развития, позволяющие классифицировать данное осложнение сахарного диабета 1 типа с позиций континуума переходных состояний и проводить своевременную диагностику, лечение и профилактику прогрессирования.
Впервые установлена роль магниевого дефицита в формировании диабетической кардиомиопатии у детей, обоснована необходимость и доказана эффективность применения комплексной метаболической терапии, включающей магния оротат, для лечения детей с диабетической кардиомиопатией.
Практическая значимость
Наличие поздних осложнений сахарного диабета 1 типа у детей, симпа-тикотонической направленности вегетативной регуляции ритма сердца и сосудистого тонуса, а также электрокардиографических признаков дистрофии миокарда, установленных при клинико-анамнестическом и функциональном обследовании, позволяет выделить группу детей повышенного впимания для проведения углубленного эхокардиографического, функционального и лабораторного обследования с целью раннего выявления диабетической кардиомиопатии.
Суточное мониторирование ритма сердца и артериального давления с комплексной оцепкой показателей временного и спектрального анализов вариабельности ритма сердца, параметров тренда частоты сердечных сокращений в период ночного сна и циркадной динамики артериального давления позволяет у детей с сахарным диабетом 1 типа диагностировать автономную кардиоваскулярную нейропатию, являющуюся одним из основных звеньев патогенеза диабетической кардиомиопатии. Разработанные эхокардиографи-ческие критерии диагностики диабетической кардиомиопатии позволяют выявлять ее у детей с сахарным диабетом 1 типа на ранней стадии развития.
Комплексный подход к оценке показателей эхокардиографии, бифункционального мониторирования ритма сердца и артериального давления, а также магниевого обмена позволяет определять стадии развития диабетической кардиомиопатии у детей, проводить ее диагностику и лечение по предложенной схеме диспансерного наблюдения.
Установленные нами корреляционные связи между лабораторными методами определения магниевого дефицита в эритроцитах периферической
крови и в секрете слюнных желез у детей с сахарным диабетом 1 типа позволяют наряду с инвазивными (венепупкция) методами лабораторной диагностики рекомендовать к использованию в педиатрической практике неинва-зивный метод. Включение магния оротата в состав комплексной метаболической терапии повышает эффективность лечения детей с диабетической кар-диомиопатией.
Положения, выносимые на защиту
1. Симпатикотоническая направленность вегетативной регуляции ритма сердца и артериального давления, а также электрокардиографические признаки дистрофии миокарда (снижение вольтажа комплекса <^118, нарушения процессов реполяризации, замедление проведения возбуждения по системе пучка Гиса, увеличение дисперсии интервала С?Т и признаки перегрузки левых отделов сердца) являются показаниями к использованию бифункционального мониторирования и эхокардиографии для выявления кардиомиопа-тии у детей с сахарным диабетом 1 типа и определения стадии ее формирования.
2. Одним из основных звеньев патогенеза кардиомиопатии у детей, больных сахарным диабетом 1 типа, является автономная кардиоваскулярная нейропатия, которая способствует развитию концентрического ремоделиро-вания и диастолической дисфункции левого желудочка I типа. Критериями ранней диагностики диабетической автономной кардиоваскулярной нейропа-тии у детей, по данным бифункционального мониторирования, являются: показатели временного анализа (рЬГМ50, гМЗББ) и спектрального анализа (Ы% НБ) вариабельности ритма сердца ниже возрастных нормативов; увеличение соотношения (ЬР/НР) более 1,6; нестабильность ритма сердца в период ночного сна и ригидность циркадного профиля диастолического артериального давления. Установленные критерии отражают снижение регуляторной активности обоих отделов вегетативной первной системы с нарушением вагосим-
патического баланса, проявляющимся преобладанием симпатических влияний на ритм сердца и сосудистый тонус.
3. Динамическая эхокардиографическая оценка параметров центральной гемодинамики и диастолической функции левого желудочка позволяет диагностировать кардиомиопатию у детей с сахарным диабетом 1 типа па ранних стадиях ее развития. Критериями ранней диагностики диабетической кар-диомиопатии у детей по результатам эхокардиографии являются: гипокинетический тип центральной гемодинамики, сочетающийся с концентрическим ремоделированием левого желудочка и развитием его диастолической дисфункции I типа, проявляющейся уменьшением индекса податливости миокарда менее 1.
4. Диабетическая кардиомиопатия у детей имеет 3 стадии развития:
1 стадия — напряжения адаптации сердечно-сосудистой системы, характерная для детей с манифестацией сахарного диабета (наличие гиперкинетического типа центральной гемодинамики и уменьшения предсердного вклада в диастолическос наполнение левого желудочка по данным эхокардиографии; отсутствие признаков автономной кардиоваскулярной нейропатии по данным бифупкционального мониторирования);
2 стадия — начальной дезадаптации сердечно-сосудистой системы, характерная для детей с длительностью сахарного диабета от 1 до 5 лет (эуки-нетический тип центральной гемодинамики, гиперкинез задней стенки левого желудочка, нормальные скоростные и временные показатели трансмитрального диастолического потока по данным эхокардиографии; наличие признаков автономной кардиоваскулярной нейропатии по данным бифункционального мониторирования);
3 стадия — дезадаптации сердечно-сосудистой системы, характерная для детей с длительностью сахарного диабета более 5 лет (гипокинетический тип центральной гемодинамики, концентрическое ремоделирование левого желудочка, увеличение предсердного вклада в его диастолическое наполнение,
индекс податливости миокарда менее 1 по данным эхокардиографии; наличие признаков автономной кардиоваскулярной нейропатии по данным бифункционального мониторирования).
5. У большинства детей с сахарным диабетом 1 типа определяется дефицит магния в эритроцитах периферической крови (68,9%) и в секрете слюнных желез (61,1%), распространенность и степень выраженности которого напрямую зависят от длительности заболевания и наличия его поздних осложнений. Магниевый дефицит у детей с сахарным диабетом 1 типа участвует в формировании диабетической кардиомиопатии, оказывая непосредственное влияние на развитие автономной кардиоваскулярной нейропатии и концентрического ремоделирования левого желудочка с его диастолической дисфункцией I типа.
6. Применение магния оротата в составе метаболической терапии у детей с сахарным диабетом 1 типа и дефицитом магния является эффективным способом лечения детей с диабетической кардиомиопатией, который обеспечивает восстановление вагосимпатических взаимоотношений в вегетативной регуляции ритма сердца и релаксационной способности миокарда левого желудочка, устраняя его концентрическое ремоделирование.
Внедрение результатов исследования
Результаты исследования внедрены в работу детского эндокринологического отделения ГБУЗ «КДБ №2» г. Твери, эндокринологического центра для детей Тверской области ГБУЗ «КДБ №2» г. Твери, поликлиники ГБУЗ детской областной клинической больницы г. Твери, эндокринологического отделения МБУЗ ДГКБ № 8 г. Челябинска, эндокринологического отделения ГБУЗ РМ «ДРКБ» г. Саранска, ГАУЗ «ДРКБ» Министерства здравоохранения Республики Татарстан, используются в учебном процессе па кафедре педиатрии педиатрического факультета ГБОУ ВПО Тверская ГМА Минздрава России, кафедре педиатрии ГБОУ ВПО «Мордовский МГУ им. Н. П. Огарева».
Апробация работы. Основные положения диссертации представлены и обсуждены на Всероссийских конгрессах «Детская кардиология» (Москва, 2004, 2006, 2008, 2010, 2012); II, IV, V и VIII Российских конгрессах «Современные технологии в педиатрии и детской хирургии» (Москва, 2003, 2005, 2006, 2009); IX и XI Российских конгрессах «Инновационные технологии в педиатрии и детской хирургии» (Москва, 2010, 2012); IV съезде Российской ассоциации специалистов ультразвуковой диагностики в медицине (Москва, 2003); Всероссийских национальных конгрессах кардиологов (Томск, 2004; Москва, 2005, 2011); III Всероссийской научно-практической конференции «Достижения науки — в практику детского эндокринолога» (Москва, 2005); научно-практической конференция для педиатров Тверской области «Метаболическая терапия заболеваний у детей и подростков» (Тверь, 2005); международном конгрессе по артериальной гипертензии «От Короткова до сегодняшних дней» (Санкт-Петербург, 2005); Всероссийском научно-практическом совещании-семинаре детских кардиологов, посвященном памяти Н. А. Бело-конь, (Томск, 2005); межрегиональной научно-практической конференции «Актуальные проблемы кардиологии детей и взрослых — 2006», (Астрахань, 2006); Всероссийской научной конференции «Здоровье молодежи и будущее России» (Тверь, 2006); III Московской городской научно-практической конференции «Эндокринологические аспекты в педиатрии» (Москва, 2008); научно-практических конференциях Тверского отделения Союза педиатров России (Тверь, 2010, 2011); 14th Congress of the International Society for Holter and Noninvasive Electrocardiology (Moscow, 2011); VI Всероссийском педиатрическом форуме (Санкт-Петербург, 2012).
Результаты исследований по теме диссертации опубликованы в 41 печатных работах, из них 12 статей в журналах, рекомендованных ВАК для докторских диссертаций, в том числе 6 в журналах, включенных в международные базы цитирования, 3 патента на изобретение.
Объем и структура диссертации. Диссертация изложена на 244 страницах машинописного текста и состоит из введения, семи глав, обсуждения результатов и заключения, выводов, практических рекомендаций и списка литературы, содержащего 150 работ отечественных и 101 работу зарубежных авторов. Работа иллюстрирована 31 таблицами, 15 рисунками и 3 выписками из историй болезни.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В основу работы легли результаты комплексного обследования 185 детей, больных СД, в возрасте от 8 до 17 лет и длительностью заболевания от 1 месяца до 14,5 лет. Критериями исключения детей с СД из исследования были наличие клинико-лабораторных признаков кетоацидоза и гипогликемии, острых заболеваний и обострения хронических, органических заболеваний ССС, а также одновременный прием метаболических препаратов, не входящих в состав планируемой метаболической терапии. Контрольную группу составили 30 здоровых детей, соответствующего возраста и пола.
Все дети были разделены на 5 групп в зависимости от длительности заболевания. Первую группу составил 31 ребенок с длительностью СД до 1 года (16,8%), вторую группу — 35 детей с длительностью СД от 1 года до 3 лет (18,9%), третью группу — 45 детей с длительностью СД от 3 до 5 лет (24,3%), четвертую группу — 31 ребенок с длительностью СД от 5 до 7 лет (16,8%), в пятую группу вошли 43 ребенка с длительностью СД более 7 лет (23,2%).
Для решения поставленных в работе задач помимо таких методов обследования, как клинико-анамнестический, кардиоинтервалография (КИГ), кардиоваскулярные тесты по Ewing, электрокардиография (ЭКГ), применялись современные методы диагностики: ЭхоКГ с оценкой параметров центральной гемодинамики и диастолической функции ЛЖ, суточное монитори-рование ритма сердца с оценкой параметров временного и спектрального анализов его вариабельности (ВРС), циркадного индекса и тренда частоты
сердечных сокращений (ЧСС) в период ночного сна, а так же суточное мони-торирование артериального давления (СМАД).
Степень компенсации заболевания оценивалась по уровню гликирован-ного гемоглобина (HbAlc), определенного методом боратного аффинного анализа с помощью анализатора «NycoCard Reader II». Признаки тканевой гипоксии с нарушением процессов аэробного окисления в митохондриях и компенсаторным усилением анаэробного гликолиза выявлялись при анализе уровня лактата периферической крови по методу Баркера и Саммерсона в безбелковом фильтрате крови. Концентрацию магния определяли одновременно в эритроцитах периферической крови и секрете слюнных желез колориметрическим методом с использованием реагентов компании «RANDOX». Нормальные значения концентрации магния в эритроцитах периферической крови были определены у детей контрольной группы в пределах 1,7-2,0 ммоль/л, в секрете слюнных желез — в пределах 0,05-0,10 ммоль/л, что соответствовало одному стандартному отклонению от средней величины.
Статистическая обработка материала проводилась на персональном компьютере с использованием программ «Microsoft Office Excel 2003», «Cards» и «Mikrostat, версия 1.1», позволяющих определять основные статистические параметры. В случае нормального распределения изучаемого признака оценка разности средних величин (М) между двумя группами проводилась по параметрическому критерию Стьюдента (t). В случае ненормального распределения признака оцепка статистической значимости разности средних (ц) проводилась по непараметрическому критерию Манна-Уитни (Т). При множественных сравнениях изучаемых групп детей, соответствующих нормальному распределению признака, использовался однофакторпый дисперсионный анализ с использованием критерия Фишера (F), В случаях ненормального распределения признака — дисперсионный анализ с использованием критерия Крускала-Уоллиса (Н). Статистическая значимость разности средних оценивалась по критериям Ньюмена-Кейлса (q) и Дана (Q). Оценка
статистической значимости разности выборочных долей при анализе качественных признаков у детей исследуемых групп проводилась с использованием метода угловой трансформации (ф-преобразования) Фишера. Множественное сравнение долей в исследуемых группах детей проводилось при помощи критерия Стьюдента (I) с поправкой Бонферрони. Для оценки корреляционной связи между изучаемыми признаками использовались коэффициенты корреляции Пирсона (г) и Спирмана (г5). Анализ повторных измерений при сравнительной оценке эффективности различной метаболической терапии в двух группах детей с ДКП проводился при помощи критериев Стьюдента ((:) и Уилкоксона (У). Для всех видов анализа статистически достоверными считали значения при р<0,05.
Результаты исследования и их обсуждение
В основе развития поздних осложнений СД у детей лежат метаболические нарушения, связанные с неудовлетворительной компенсацией заболевания, которая, по нашим данным, выходит из под контроля при длительности СД более 5 лет, что подтверждалось прямой корреляционной связью уровня НЬА1с с длительностью заболевания (г = 0,20, р<0,05). Доказательством влияния метаболических нарушений при СД на ССС у детей являлось отсутствие у них перинатальных факторов риска развития сердечно-сосудистой патологии, отягощенного генеалогического анамнеза по заболеваниям ССС, а также отягощенного биологического анамнеза.
Клипико-функциональная характеристика детей с СД.
Результаты клинического и электрокардиографического обследования детей с СД имели отличия не только по сравнению с контрольной группой, но и в зависимости от длительности заболевания. Однако, несмотря на их многообразие, они оказались неспецифическими, малоинформативными и позволяли лишь предположить начинающееся развитие ДКП у детей.
У части детей с СД выявлялись жалобы со стороны ССС на боли в области сердца (11,4%), сердцебиения (12,4%), перебои в работе сердца (7,6%)
и головокружения (8,6%). Чаще жалобы предъявляли дети с длительностью заболевания более 5 лет в отличие от детей с меньшей длительностью СД (р<0,01), что, по нашему мнению, связано с недостаточной экспозицией у них метаболических нарушений.
Установлено, что ЧСС у детей, больных СД, была достоверно больше, чем у детей контрольной группы (р<0,001). Склонность к более частому ритму сердца проявлялась у детей с СД уже через 3 года после манифестации заболевания с постепенным нарастанием ЧСС, что подтверждалось прямой корреляционной связью между ЧСС и длительностью СД (р<0,01). Систолическое и диастолическое АД у детей с СД также начинали нарастать спустя 3 года после манифестации заболевания с последующей стабилизацией у детей с длительностью СД более 5 лет на уровне показателей, достоверно превышающих показатели детей контрольной группы (р<0,001). При этом уровень АД напрямую коррелировал с длительностью СД (р<0,01) и количеством его поздних осложнений (р<0,01).
Ослабление тонов сердца при аускультации определялось в 6,5% случаев и преимущественно у детей с длительностью СД более 7 лет (6 детей, 13,9%). При этом для них была характерна ригидность ритма сердца, что указывает на возможное нарушение его вегетативной регуляции.
Поздние осложнения СД были выявлены у 113 детей (61,1%) и были представлены ретииопатией (40,0%), нефропатией (18,9%), периферической сенсорно-моторной полинейропатией (34,1%), синдромами Мориака (1,6%) и Нобекура (1,6%), хайропатией (13,5%). Сочетание трех и более осложнений встречалось исключительно у детей с длительностью СД более 7 лет (1,6%). Установленное нами прогрессирующее нарастание встречаемости и тяжести поздних осложнений СД по мере увеличения длительности заболевания, свидетельствовало о наличии у больных детей метаболических нарушений, микроангиопатий и ДАКН, которые являются основными звеньями патогенеза ДКП.
Нами установлено, что по мере прогрессировать СД в вегетативном статусе больных детей отмечалось доминирование симпатического отдела вегетативной нервной системы. Достоверное увеличение симпатикотонии у детей с СД по сравнению с детьми контрольной группы наблюдалось уже после 3 лет заболевания с наибольшей частотой встречаемости у детей с длительностью СД более 7 лет (82,1%). При этом симпатикотония у детей с длительностью СД более 7 лет в 41% случаев сочеталась с асимпатикотони-ческой вегетативной реактивностью, что свидетельствует о дезадаптацион-ном характере вегетативной регуляции функционирования у них ССС.
Симпатикотоническую направленность вегетативного статуса у детей с СД можно расценивать как проявление компенсаторного напряжения симпатического отдела вегетативной нервной системы в ответ на хроническую гипоксию и клеточный энергодефицит и/или как следствие ослабления парасимпатических влияний, характеризующее ДАКН на ранних этапах формирования.
Вегетативное обеспечение деятельности у детей с СД оценивалось по результатам кардиоваскулярного тестирования (тесты с глубоким дыханием, 30:15 и Шелонга). Результаты тестирования показали отсутствие диагностической значимости теста Шелонга, по данным которого ни у одного ребенка с СД не выявлялось нарушений вегетативной иннервации, и низкую чувствительность остальных тестов, позволяющих выявлять нарушения вегетативной иннервации преимущественно у детей с длительностью СД более 7 лет. Комплексная оценка всех трех кардиоваскулярных тестов позволила установить начальное поражение вегетативной нервной системы у половины детей с СД (52,3%), что было достоверно больше по сравнению с контрольной группой (23,3%, р<0,01). При этом несомненное поражение вегетативной нервной системы было установлено всего лишь у 6 детей с СД (7,0%) и также преимущественно с длительностью заболевания более 7 лёт.
Следовательно, результаты клинической и функциональной (КИГ, кар-диоваскулярное тестирование) оценки вегетативной регуляции деятельности ССС не дают четкой диагностической информации, позволяющей выявлять ДАКН у детей на ранней стадии развития, и могут иметь лишь вспомогательное значение при диспансерном обследовании данного контингента больных.
Преобладание симпатических влияний в вегетативной регуляции дея-
тельности сердца у детей с СД нашло свое отражение и при электрокардиографическом обследовании. Установлено преобладание синусовой тахикардии среди детей с СД в отличие от детей контрольной группы, для которых характерным являлся правильный синусовый ритм (р<0,001).
Метаболические изменения в клетках проводящей системы сердца были представлены на ЭКГ больных детей смещением пейсмейкерной активности в миокард предсердий, неполной блокадой левой ножки пучка Гиса и полной блокадой правой ножки пучка Гиса в отличие от детей контрольной группы, у которых не встречались данные ЭКГ-феномены (р<0,01, р<0,01 и р<0,01, соответственно). Электрокардиографическими проявлениями метаболических изменений в миокардиоцитах у детей с СД были: снижение вольтажа комплекса (^ЛБ, нарушения процесса реполяризации в виде изменения формы, амплитуды, полярности зубца Т и альтернация зубца Я, которые чаще выявлялись у больных детей, чем у детей контрольной группы (р<0,001, р<0,001 и р<0,001, соответственно). Обнаруженные ЭКГ-феномены у детей с СД, свидетельствуют о колебаниях автоматизма синусового узла, нарушениях внутрижелудочкового проведения импульса и функции ионных каналов мембран миокардиоцитов, основной причиной которых является гипоксия, развивающаяся при СД и вызывающая электролитные нарушения в миокардиоцитах и клетках проводящей системы сердца.
Изменения на ЭКГ у детей с СД имели различную степень выраженности в зависимости от длительности заболевания. Так, нарушения процесса реполяризации в миокарде регистрировались уже у детей с манифестацией
СД (28,6%) с неуклонным нарастанием встречаемости до 59,5% случаев среди детей с длительностью СД более 7 лет. Снижение вольтажа комплекса (ЗЯБ регистрировалось у 15,2% детей с длительностью СД 1-3 года с увеличением встречаемости до 40,5% случаев у детей с длительностью СД более 7 лет. У детей с длительностью СД 5-7 лет достоверно чаще по сравнению с детьми контрольной группы выявлялась перегрузка ЛЖ (р<0,05), а у детей с длительностью СД более 7 лет — перегрузка ЛЖ (р<0,001), левого предсердия (р<0,05) и альтернация зубца Я (р<0,01).
У детей всех исследуемых групп, за исключением детей с манифестацией СД, были установлены электрокардиографические проявления электрической нестабильности миокарда в виде увеличения дисперсии интервала С»Т (<КЗТ) и дисперсии корригированного интервала С^Т (сК^Тс), наибольшая выраженность которой определялась у детей с длительностью СД более 5 лет, что, на наш взгляд, может свидетельствовать о влиянии метаболических нарушений на формирование ДКП у детей. Подтверждением этому является прямая корреляционная связь с1<ЗТ и <1(2Тс с длительностью СД (г = 0,44, г = 0,48, соответственно, р<0,01) и количеством его поздних осложнений (г = 0,27, г = 0,31, соответственно, р<0,01).
Таким образом, прогрессирующее нарастание встречаемости и тяжести микроангиопатий и ДАКН, а также клинических и электрокардиографических признаков изменения функционального состояния сердечно-сосудистой и вегетативной нервной систем у детей с СД 1 типа указывают на высокую вероятность развития у них ДКП при длительности заболевания более 5 лет. По мере увеличения длительности СД у детей прослеживается стадийность формирования ДКП, характеризующаяся на ранней стадии развития гиперактивацией компенсаторных механизмов со стороны сердечно-сосудистой и вегетативной нервной систем с последующей их астенизацией и дезадаптацией у детей с длительным течением СД. Однако данных клинического и функционального обследования оказалось недостаточно для уточнения диагноза, что
потребовало применения современных методов обследования ССС для раннего выявления признаков ДКП у детей.
Функциональное состояние ССС у детей с СД по данным суточного мо-ниторирования ритма сердца и артериального давления.
Для выявления ранних признаков ДАКН у 127 детей с СД применялось ХМ и у 80 детей — СМАД, которые позволили установить зависимость выраженности нарушений вегетативной регуляции ритма сердца и сосудистого тонуса от длительности заболевания и количества его поздних осложнений.
Нарушения вегетативной регуляции ритма сердца у детей с СД нашли свое отражение в ночном тренде ЧСС, показатели которого свидетельствовали об усилении нестабильности ритма сердца во время ночного сна, нарастающей по мере увеличения длительности заболевания. Наиболее информативными в структуре ночного сна были показатель процентной представленности периодов повышенной дисперсии более 50% и характер пробуждения из периода стабильного ритма с резким подъемом ЧСС, встречаемость которых возрастала по мере прогрессирования СД и составила у детей с длительностью заболевания более 7 лет 37,0%. Нестабильность ритма сердца в период ночного сна у детей с длительностью СД более 3 лет свидетельствует о выраженной вегетативной дизрегуляции деятельности сердца и, на наш взгляд, может рассматриваться как один из ранних признаков ДАКН.
Преобладание симпатических влияний на регуляцию ритма сердца у детей с СД по мере прогрессирования заболевания также было установлено в результате временного анализа ВРС (табл. 1).
Циркадные показатели р№>[50 и гМБЗБ, отражающие чувствительность синусового узла к парасимпатическим влияниям и функцию концентрации ритма, у детей с длительностью СД более 3 лет были достоверно ниже по сравнению с показателями детей с меньшей длительностью заболевания, что свидетельствует о постепенном развитии у них ригидности ритма сердца в результате снижения чувствительности синусового узла к парасимпатиче-
ским влияниям и указывает на наличие ДАКН. Вместе с тем установлена достоверная обратная корреляционная связь всех показателей временного анализа ВРС с длительностью СД и количеством его поздних осложнений.
Таблица 1
Показатели временного анализа вариабельности ритма сердца у детей с ' сахарным диабетом 1 типа в зависимости от длительности заболевания, М+гп
Показатель Дети с сахарным диабетом (п=127)
1 группа (п-26) 2 группа (п=26) 3 группа (п=32) 4 группа (п=16) 5 группа (п=27)
р№Ы50 (общий средний), (%) 29,0±2,74 р2>0,05, р3<0,05, р4<0,05, р5<0,01 27,0+2,09 р3<0,05, р4>0,05, р5<0,01 20,8+2,17 р4>0,05, р5>0,05 21,8+2,59 Р,>0,05 15,9+1,89
рКГШО (средний днем), (%) 19,4+2,69 р->0,05, рз>0,05, р4<0,05, р5<0,0] 18,6+2,14 Рз<0,05, р4<0,01, р5<0,01 13,3+1,85 р4>0,05, р5<0,05 11,9+1,78 р5>0,05 8,3+1,11
рТЧг50 (средний ночью), (%) 44,5±3,28 р2>0,05, рз<0,01, р4<0,01,р5<0,01 39,2+3,54 р3Х),05, Р4>0,05, р5<0,05 32,0+3,31 р4>0,05,р5>0,05 33,4+3,92 Рз>0,05 29,8+3,16
гМ5БО (общий средний), (шэ) 58,1+4,80 р2>0,05, рз<0,05, р4>0,05, р5<0,01 53,3+3,43 рз<0,001,р4>0,05, Р;>0,05 45,1+3,72 р4>0,05, р5>0,05 48,2+4,32 р5<0,05 36,3+3,25
гМ55Э (средний днем), (шэ). 45,6±4,57 р2Х),05, р3<0,05, р4<0,05, р5<0,01 41,6±3,55 Рз>0,05, р4>0,05, р5<0,01 34,4+3,35 р4>0,05, р5<0,05 35,6+3,38 Р5<0,05 25,3+2,29
гМЗББ (средний ночью), (те) 79,8+6,90 р2>0,05, р3<0,05, р4>0,05, р;<0.05 70,1+6,75 р3>0,05, р4>0,05, р<>0,05 59,2+5,19 р4>0,05, р5>0,05 67,8+7,14 р5>0,05 57,7+5,54
Примечание. Достоверность различий: рг — по сравнению со 2 группой, рз — по сравнению с 3 группой, р4 — по сравнению с 4 группой, р5 — по сравнению с 5 группой.
Для объективизации оценки вагосимпатических взаимоотношений и выявления абсолютйого снижения парасимпатических влияний на ритм сердца у детей с СД мы использовали спектральный анализ ВРС.
Установлено, что начиная со второго года заболевания, по мере его про-грессирования, у детей наблюдалось снижение показателей как низкочастотного волнового спектра (1Л7), отражающего симпатические влияния, так и высокочастотного (ЯР), отражающего парасимпатические влияния. При этом показатель вагосимпатического баланса (ЬР/НБ) достоверно увеличивался с Длительностью заболевания, что свидетельствует об абсолютном снижении парасимпатических влияний на ритм сердца у детей с СД и является отраже-
нием начальных проявлений у них вагусной «денервации» — ведущего признака ДАКН (табл. 2).
Таблица 2
Показатели спектрального анализов вариабельности ритма сердца у детей с сахарным диабетом 1 типа в зависимости от длительности заболевания, М+ш
Показатель Дети с сахарным диабетом (п=127)
1 группа (п=26) 2 фуппа (п=2б) 3 группа (п=32) 4 группа (п=16) 5 группа (п=27)
1Л7 общий средний, (мс2) 750+71,0 Р2>0,05, рз<0,05, р4<0,01, р,<0,01 592+57,6 Рз>0,05, р4<0,05, р<<0,05 558+67,1 р4>0,05, р5>0,05 558+56,4 р5>0,05 442+45,5
и средний дней, (мс2) 677+70,8 1>2>0,05, РЗ>0,05, р4<0,05, р,<0,01 555+57,7 рз>0,05, Рі<0,05, р,<0,01 505+64,1 р4>0,05, р<>0,05 493+53,3 р5>0,05 360+42,6
и средний ночью, (мс2) 83 5+107,1 р2<0,01,рз>0,05, р4Х>,05, р5<0,05 497+73,3 Рз>0,05, р4>0,05, р5>0,05 597+72,5 Р4>0,05, РІ>0,05 643±73,0 р5>0,05 541+66,6
да общий средний, (мс2) 488+49,8 р2<0,01,рз<0,01, р4<0,05, р,<0,01 321+35,3 рз>0,05, Р4>0,05, р5>0,05 283+37,8 Р4>0,05, РЗ>0,05 385+58,7 р,>0,05 287+45,1
ОТ средний днем, (мс2) 335+44,2 р2<0,05,р3<0,05, р4<0,05, р5<0,01 230±29,2 рз>0,05, р4>0,05, р<<0,05 202+35,6 р4>0,05, р5>0,05 234+32,5 р,Х),05 151+20,6
НК средний ночью, (мс2) 720+101,3 р2<0,01, Рз<0,01, р4>0,05, р,Х),05 407+62,8 р3>0,05, р4>0,05, р5>0,05 399+51,2 р4>0,05, рз>0,05 594+107,9 р5Х>,05 472+82,5
1ЛУНР общий средний, (мс2) 1,7+0,12 р2<0,05, рз<0,01, р4Х>,05, р5<0,01 2,1+0,14 Рз>0,05, Р4>0,05, р5>0,05 2,4+0,16 р4>0,05, р;>0,05 2,1+0,19 р5>0,05 2,4+0,21
ЫТНР средний днем, (мс2) 2,3+0,13 р2<0,05, р3<0,01, р4>0,05, р5<0,01 2,8+0,17 р3<0,05, р4>0,05, р5>0.05 3,4+0,26 р4<0,05, р,>0,05 2,7+0,21 р5Х>,05 3,1+0,23
ЬРЛ№ средний ночью, (мс2) 1,4+0,13 р2>0,05, рз>0,05, р4>0,05, р5<0,05 1,5+0,15 Рз>0,05, р4>0,05, р<>0,05 1,8+0,12 р4>0,05, р5>0,05 1,7+0,18 р5>0,05 1,8+0,18
Примечание. Достоверность различий: р2 — по сравнению со 2 группой, рэ — по сравнению с 3 группой, р4 — по сравнению с 4 группой, р5 — по сравнению с 5 группой.
Подтверждением этому являются результаты корреляционного анализа, который установил достоверную обратную корреляционную связь показателей спектрального анализа ВРС (ЬР средний суточный, ІЛ7 средний дневной, ОТ средний суточный, НР средний дневной) и прямую корреляционную связь индекса вагосимпатического баланса (ІЛТШ7 средний суточный, и/НР средний дневной) с длительностью СД и количеством его поздних осложнений.
Сравнительная оценка показателей спектрального анализа ВРС в двух группах детей с нормальными значениями показателей временного анализа р>ГМ50, гМЗББ и с низкими значениями этих показателей позволила установить диагностический уровень индекса вагосимпатического баланса, который составил 1,6. Увеличение данного показателя свидетельствует об абсолютном снижении парасимпатических влияний на регуляцию работы синусового узла и является критерием диагностики ДАКН.
Таким образом, спектральный анализ ВРС по сравнению с временным, по данным суточного мопиторировапкя ЭКГ, имеет существенные диагностические преимущества и расширяет возможности дифференцированной оценки состояния вегетативной регуляции ритма сердца для выявления ДАКН у детей с СД.
Снижение парасимпатических влияний со стороны вегетативной нервной системы у детей с СД отражалось и в регуляции сосудистого тонуса, что проявлялось по данным СМАД достоверным преобладанием среднего систолического АД днем, среднего диастолического АД днем и ночью и снижением суточного индекса диастолического АД у детей с длительностью СД более 5 лет по сравнению с детьми с меньшей длительностью заболевания (р<0,05). Установленные особенности циркадного профиля ДАД, отражающие его ригидность, па наш взгляд, свидетельствуют о снижении парасимпатических влияний на регуляцию сосудистого тонуса, что является одним из ранних проявлений ДАКН.
Состояние центральной гемодинамики и диастолической функции левого желудочка у детей с СД по данным эхокардиографии.
Анализ эхокардиометрических и эхокардиографических показателей центральной гемодинамики у детей с СД позволил установить характерные структурно-функциональные особенности ЛЖ в зависимости от длительности заболевания, отражающие динамику развития патологического процесса в миокарде и характеризующие стадии формирования ДКП.
У детей с длительностью СД до 1 года определялся гиперкипетический тип центральной гемодинамики, характеризующийся по сравнению с контрольной группой увеличением конечно-диастолического индекса (КДИ, р<0,01), ударного индекса (УИ, р<0,01) и снижением общего периферического сопротивления сосудов (ОПСС, р<0,05). Гиперкинез ЛЖ у детей с манифестацией СД осуществлялся преимущественно за счет увеличения экскурсии задней стенки ЛЖ (ЗСЛЖ), которая была достоверно больше по сравнению с контрольной группой (р<0,01). При этом показатели толщины межжелудочковой перегородки (МЖП) и ее экскурсия у детей с манифестацией СД не отличались от показателей детей контрольной группы. Эхокардиометри-ческий индекс (ЭКМИ), отражающий взаимоотношение толщины миокарда ЛЖ к его объему и соответственно наличие концентрического ремоделиро-вания ЛЖ, у детей с манифестацией СД также не имел существенных отличий от детей группы контроля. Такое сочетание изменений эхокардиометри-ческих и гемодинамических показателей у детей с манифестацией СД, на наш взгляд, может быть расценено как напряжение адаптации ССС в условиях измененного метаболизма.
Для детей с длительностью заболевания от 1 года до 5 лет был характерен эукинетический тип центральной гемодинамики, при котором показатели КДИ, УИ и ОПСС не имели достоверных различий по сравнению с показателями контрольной группы. Однако у детей с длительностью СД от 3 до 5 лет установлено достоверное по сравнению с контрольной группой преобладание толщины МЖП как в диастолу (р<0,05), так и в систолу (р<0,01) на фоне неизмененного ЭКМИ, что свидетельствует об отсутствии проявлений ремоде-лирования ЛЖ у детей с длительностью СД до 5 лет и соответствует периоду адаптации ССС к новым условиям функционирования.
У детей с длительностью СД 5-7 лет начинал формироваться гипокинетический тип центральной гемодинамики, что проявлялось уменьшением по сравнению с детьми контрольной группы КДИ (р<0,05) и КСИ (р<0,001) при
нормальных показателях УИ (р>0,05) и ОПСС (р>0,05). При этом отмечалось достоверное по сравнению с детьми с меньшей длительностью заболевания и детьми контрольной группы увеличение толщины МЖП, ЗСЛЖ и ЭКМИ, что свидетельствует о наличии гипертрофии миокарда ЛЖ при уменьшении его объема, характеризуя начало дезадаптационных процессов в миокарде.
Прогрессирование гемодинамических изменений в направлении гипокинезии миокарда ЛЖ установлено у детей с длительностью СД более 7 лет и проявлялось достоверным уменьшением по сравнению с детьми контрольной группы КДИ (р<0,01), КСИ (р<0,001) и УИ (р<0,05) при неизмененном ОПСС (р>0,05). При этом гипокинетический тип гемодинамики сочетался с гипертрофией миокарда ЛЖ и его концентрическим ремоделированием (увеличение толщины МЖП, ЗСЛЖ и ЭКМИ), что является отражением дезадаптации ССС к измененным условиям функционирования и характеризуют ДКП на ранних стадиях ее формирования.
С помощью корреляционного анализа нами установлена обратная связь КДИ (г = -0,31, р<0,01), КСИ (г = -0,22, р<0,05), УИ (г = -0,29, р<0,01) и прямая связь толщины МЖП в диастолу (г = 0,35, р<0,01), ЗСЛЖ в диастолу (г = 0,38, р<0,01), ЭКМИ (г = 0,41, р<0,01) с длительностью СД у детей. Кроме того, отмечалась обратная корреляционная связь КДИ (г = -0,26, р<0,01), КСИ (г = -0,20, р<0,05), УИ (г = -0,22, р<0,05) и прямая корреляционная связь толщины МЖП в диастолу (г = 0,39, р<0,01), ЗСЛЖ в диастолу (г = 0,40, р<0,01), ЭКМИ (г = 0,41, р<0,01) с количеством поздних осложнений заболевания. Следовательно, по мере прогрессирования СД у детей формируется гипокинетический тип центральной гемодинамики с концентрическим ремоделированием ЛЖ, которые указывают на нарушение его диастолической функции.
Для выявления типа диастолической дисфункции ЛЖ у детей с СД проводилось исследование трансмитралыюго диастолического потока, в результате которого выявлены > различные варианты диастолического наполнения
ЛЖ, зависящие от длительности заболевания и соответствующего типа центральной гемодинамики (табл. 3).
Гиперкинетическому типу центральной гемодинамики у детей с манифестацией СД соответствовал профиль трансмитрального потока, характеризующийся уменьшением по сравнению с детьми контрольной группы вклада предсердия в диастолическое наполнение ЛЖ (Уа, р<0,05) без изменения скорости потока в фазу раннего диастолического наполнения (Уе, р>0,05) и увеличением соотношения этих показателей (Уе/Уа, р<0,001), что, на наш взгляд, свидетельствует о напряжении компенсаторно-приспособительных механизмов ССС. Сочетание подобного профиля трансмитрального диастолического потока с эукинетическим типом центральной гемодинамики, характерное для детей с длительностью СД от 1 до 3 лет, может расцениваться как переходный этап от напряжения адаптации ССС у детей с СД к ее дезадаптации.
В группах детей с длительностью СД 3-5 лет и 5-7 лет скоростные показатели трансмитрального потока не имели достоверного отличия от показателей детей контрольной группы, что позволяет предположить дальнейшее развитие компенсаторно-приспособительных реакций ССС и характеризовать сочетание данного профиля трансмитралыюго диастолического потока с эукинетическим типом центральной гемодинамики у детей с длительностью СД 3-5 лет как период начальной дезадаптации, а сочетание с гипокинетическим типом центральной гемодинамики у детей с длительностью СД 5-7 лет как период дезадаптации.
Таблица 3
Показатели трансмитрального диастолнческого потока по данным эхокардиографии у детей с сахарным диабетом 1 типа в зависимости от длительности заболевания, М+т
Показатель Дети с сахарным диабетом (п=185) Контроль (п=30)
1 группа (п=31) 2 группа (п=35) 3 группа (п=45) 4 группа (п=31) 5 группа (п=43)
Уе (м/с) 0,82+0,023л р2>0,05, р3>0,05, р4>0,05, р5<0,01 0,83+0,026л Рз>0,05, Р4>0,05, р,<0,05 0,84+0,027" Р4>0,05, р5<0,05 0,80+0,024л р5<0,01 0,92+0,029* 0,85+0,016
Уа (м/с) 0,37+0,015* р,>0,05, р3<0,01, р4>0,05, р5<0,01 0,40+0,021* р,>0,05, р4<0,05; р;<0,01 0,44+0,022л р4>0,05, р5<0,01 0,47+0,026л Р5<0,01 0,57+0,026*** 0,46+0,015
Уе/Уа 2,34+0,106*** р,>0,05, р3>0,05, р1>0,05, р5<0,01 2,20+0,095** Рз>0,05, р4>0,05, р5<0,01 2,07+0,115л Р4>0,05, р5<0,05 1,87+0,129л р<>0,05 1,74+0,093л 1,89+0,038
ЛТе (с) 0,09+0,004л р.>0,05, Р)>0,05, р4>0,05, р,>0,05 0,09+0,003л р3>0,05, р4>0,05, р5>0,05 0,09+0,003л р4>0,05, р5>0,05 0,09+0,003л р5>0,05 0,08+0,002л 0,08+0,004
тт (с) 0,07±0,004л р,>0,05, р3>0,05, р<>0,05, р,<0,05 0,08+0,013л Рз>0,05, р4>0,05, р,Х),05 0,08+0,010л р4>0,05, р5>0,05 0,07+0,004л р,<0,05 0,09+0,004*** 0,07+0,002
ИПМ (ед.) 1,32+0,099л р?>0,05, Рз>0,05, р+>0,05, р,<0,05 1,38+0,088л рг>0,05, Р4>0,05, р5<0,01 1,32+0,077л р4>0,05, Р5<0,01 1,29+0,067л р5<0,01 '>05+0,057* 1,26+0,060
1УЯТ (с) 0,07+0,003л р-)>0,05, рз>0,05, р4>0,05, р5>0,05 0,06+0,002** Рз>0,05, Р4>0,05, р;>0,05 0,06+0,001*** р4>0,05, Рз>0,05 0,06+0,002** р5>0,05 0,06+0,002** 0,07+0,003
[УСТ (с) 0,06+0,002л р->>0,05, Рз<0,05, р<>0,05, р(>0,05 0,06+0,002л р,<0,05, р4>0,05, р,>0,05 0,05+0,002л р4>0,05, р5>0,05 0,06+0,002л Р5>0,05 0,06+0,002л 0,06+0,001
ЕТ(с) 0,52+0,027л р2<0,01, Рз<0,01, р4>0,05, Р5<0,01 0,35+0,024*** Рз>0,05, р4>0,05, р5>0,05 0,34+0,024*** Р4>0,05, р5>0,05 0,31+0,025*** р,Х),05 0,31+0,018*** 0,47+0,019
Примечание. Достоверность различий: * -р<0,05, ** — р<0,01, *** — р<0,001, л — р>0,05 — по сравнению С контрольной группой; р2 — по сравнению со 2 группой; рз — по сравнению с 3 группой; р4 — по сравнению с 4 группой; Р5 — по сравнению с 5 группой.
Наиболее выраженные проявления дезадаптации ССС отмечались у детей с длительностью СД более 7 лет, у которых на фоне гипокинетического типа центральной гемодинамики и концентрического ремоделирования ЛЖ определялось увеличение по сравнению с детьми контрольной группы Va (р<0,001), являющееся результатом снижения податливости миокарда ЛЖ в фазу диастолы. Подтверждением этому являлась тесная корреляционная связь показателей центральной гемодинамики и эхокардиометрии с показателем Ve/Va и достоверное снижение у детей с длительностью СД более 7 лет по сравнению с контрольной группой индекса податливости миокарда (ИПМ) до 1,05±0,057 (р<0,05) — признака диастолической дисфункции ЛЖ I типа. Показатели трансмитрального диастолического потока у детей с СД коррелировали с длительностью и количеством поздних осложнений заболевания. У детей с СД была установлена прямая корреляционная связь Ve (г = 0,20, р<0,05), Va (г = 0,51, р<0,01) и обратная корреляционная связь времени изгнания (ЕТ, г = -0,40, р<0,01), Ve/Va (г = -0,34, р<0,01) с длительностью СД, а также прямая корреляционная связь Va (г = 0,50, р<0,01) и обратная связь ЕТ (г = -0,40, р<0,01), Ve/Va (г = -0,34, р<0,01) с количеством поздних осложнений заболевания. При этом ИПМ имел отрицательную корреляционную связь с длительностью заболевания исключительно среди детей с длительностью СД более 7 лет (г = -0,33, р<0,01), что свидетельствует о преимущественном формировании у них диастолической дисфункции ЛЖ I типа.
Установленная последовательность смены вариаптов трансмитрального диастолического наполнения ЛЖ по данным ЭхоКГ, напрямую зависящая от типа гемодинамики, длительности СД и количества его поздних осложнений, отражает стадийность формирования ДКП и позволяет систематизировать имеющиеся в литературе данные о формировании диастолической дисфункции ЛЖ у детей с СД.
Исследование трансмитрального диастолического потока с проведением пробы Вальсальвы позволило нам убедиться в диагностической ценности ис-
пользования ИПМ для раннего выявления диастолической дисфункции ЛЖ I типа у детей с СД. Установлено, что у детей с ИПМ < 1 на фоне обычного дыхания в 100,0% случаев при проведении пробы Вальсальвы значение ИПМ оставалось меньше 1, подтверждая наличие у них ригидности миокарда в фазу диастолы. При этом у 10 детей (22,7%) со значениями ИПМ > 1 на фоне обычного дыхания при проведении пробы Вальсальвы установлен ИПМ < 1, что указывает на наличие у них скрытой диастолической ригидности миокарда и является предиктором диастолической дисфункции ЛЖ I типа.
Таким образом, дети с длительностью СД более 5 лет имеют высокий риск развития ДКП, эхокардиографическими критериями диагностики, которой являются: гипокинетический тип центральной гемодинамики в сочетании с концентрическим ремоделированием ЛЖ; диастолическая дисфункция ЛЖ I типа, проявляющаяся уменьшением ИПМ мепее 1 как при обычном дыхании, так и при проведении пробы Вальсальвы.
Дневные показатели временного анализа ВРС (р№150, гМББО) имели достоверную корреляционную связь как с эхокардиометрическими показателями (КДИ, УИ), так и со скоростными показателями трансмитрального диа-столического потока (Vа, Уе/Уа) у детей с СД. Корреляционные связи между показателями ЭхоКГ и спектрального анализа ВРС свидетельствовали о том, что снижение активности парасимпатического (Ш7) и симпатического (ЬБ) отделов вегетативной регуляции ритма сердца у детей с СД способствует развитию гипокинезии миокарда ЛЖ и его диастолической дисфункции. При этом установлена прямая корреляционная связь между показателем вагосим-патического баланса (и/Ш7) в дневное время и ЭКМИ (1=0,38, р<0,001), увеличение которого свидетельствует о концентрическом ремоделировании ЛЖ, что также подтверждает влияние ДАКН на формирование ДКП у детей.
Роль нарушений обмена магния у детей с СД в формировании кардио-миопатии и способ ее метаболической коррекции.
Развитию ДКП помимо метаболических нарушений, микроангиопатий и ДАКН способствует клеточный энергетический дефицит, возникающий в миокардиоцитах, клетках и волокнах вегетативной нервной системы. Учитывая имеющиеся в литературе данные, мы предположили, что нарушение обмена магния у детей с СД может оказывать влияние на развитие клеточного энергодефицита в условиях низкой антиоксидантной активности.
Поэтому с целью установления дефицита магния, его роли в патогенезе ДКП у детей и разработки способа ее метаболической коррекции мы провели исследование, в которое были включены 90 детей с СД 1 типа в возрасте от 8 до 17 лет и длительностью заболевания от 1 до 14,5 лет. На период обследования ни у одного из детей не отмечалось кетоацидотических и гипоглике-мических состояний. Все дети с СД были разделены на 4 группы в зависимости от длительности заболевания. Первую группу составили 18 детей с длительностью СД 1-3 года, вторую группу — 26 детей с длительностью СД 3-5 лет, третью группу — 19 детей с длительностью СД 5-7 лет, четвертую группу — 27 детей с длительностью СД более 7 лет. Контрольную группу составили 30 здоровых детей, сопоставимых с больными по полу и возрасту.
Дефицит магния в эритроцитах периферической крови и в секрете слюнных желез установлен у большинства детей с СД (68,9% и 61,1%, соответственно). По мере увеличения длительности заболевания отмечалось прогрессивное увеличение частоты встречаемости магниевого дефицита у детей с СД от 50% при длительности заболевания 1-3 года до 88,9% при длительности СД более 7 лет. Степень выраженности магниевого дефицита также возрастала по мере увеличения длительности СД. Так, у детей с длительностью СД 1-3 года концентрация магния в эритроцитах периферической крови (1,6+0,04 ммоль/л) и в секрете слюнных желез (0,05+0,004 ммоль/л) была достоверно больше по сравнению с детьми с длительностью заболевания более 7 лет (1,1±0,07 ммоль/л и 0,02±0,003 ммоль/л, соответственно; р<0,01). У детей контрольной группы концентрация внутриклеточного магния (1,9+0,02
ммоль/л) и магния секрета слюнных желез (0,07+0,003 ммоль/л) была достоверно выше по сравнению с концентрацией магния во всех исследуемых группах детей с СД (р<0,001). В результате корреляционного анализа была установлена обратная связь содержания магния в секрете слюнных желез и эритроцитах периферической крови с длительностью СД (г = -0,47 и г = -0,46, соответственно, р<0,001) и количеством его поздних осложнений (г = -0,40 и г = -0,35, соответственно, р<0,001), что подтверждает влияние магниевого дефицита на формирование поздних осложнений СД у детей.
Одновременное исследование концентрации магния в секрете слюнных желез и эритроцитах периферической крови позволило нам провести корреляционный анализ этих показателей, в результате которого была установлена прямая их взаимосвязь у детей, больных СД (г=0,69, р<0,01) и у детей контрольной группы (г=0,56, р<0,01). Следовательно, оба применяемых нами лабораторных метода диагностики дефицита магния у детей с СД являются информативными, что позволяет рекомендовать преимущественно неинвазив-ную методику его определения в секрете слюнных желез у детей с СД.
Концентрация магния в эритроцитах периферической крови и секрете слюнных желез у детей с СД имела достоверную корреляционную связь с показателями ЭхоКГ, характеризующими диастолическую функцию ЛЖ (обратную с ЭКМИ, Уе, Уа, ИПМ, IVЯТ, 1УСТ и прямую с Уе/Уа). Полученные данные свидетельствуют о непосредственном влиянии магниевого дефицита на формирование диастолической дисфункции ЛЖ I типа с соответствующим его ремоделированием и определяют его роль в формировании ДКП у детей.
Показатели временного анализа ВРС у детей с СД имели достоверную прямую корреляционную связь с показателями концентрации магния в эритроцитах периферической крови и в секрете слюнных желез, что указывает на повышение ригидности ритма и снижение чувствительности синусового узла к парасимпатическим влияниям у детей с СД по мере нарастания у них магниевого дефицита. Показатели спектрального анализа ВРС имели достовер-
ную прямую корреляционную связь с дефицитом магния только в Ш-спектре и преимущественно в дневное время, что подтверждает его роль в развитии вагусной «денервации» сердца и соответственно ДАКН у детей с СД.
Дефицит внутриклеточного магния у детей с СД, вероятно, приводит также к нарушениям регуляции сосудистого тонуса, что способствует поддержанию повышенного уровня АД. Подтверждением этому является установленная достоверная обратная корреляционная связь показателей СМАД (систолическое и диастолическое АД среднее, максимальное, минимальное в дневное и ночное время) и прямая корреляционная связь суточного индекса систолического и диастолического АД с концентрацией магния в эритроцитах периферической крови и секрете слюнных желез (р<0,02). Следовательно, по мере увеличения дефицита магния возрастает не только уровень АД, по и ригидность циркадного профиля АД, отражающие снижение парасимпатических влияний на регуляцию сосудистого тонуса у детей, больных СД.
Подтверждением влияния дефицита магпйя на формирование ДКП у детей являются результаты сравнительного анализа концентрации магния в эритроцитах крови и секрете слюнных желез в двух группах детей с СД, различающихся между собой по наличию ДКП. Установлено, что концентрация магния в эритроцитах периферической крови у детей с ДКП была достоверно ниже по сравнению с детьми без ДКП (12,9+0,69 ммоль/л и 15,1+0,59 ммоль/л, соответственно; р<0,05). Концентрация магния в секрете слюнных желез у детей с ДКП также была достоверно ниже по сравнению с детьми без ДКП (0,32+0,037 ммоль/л и 0,44±0,044 ммоль/л, соответственно; р<0,05).
Таким образом, у детей с СД по мере прогрессирования заболевания развиваются нарушения обмена магния, проявляющиеся его внутриклеточным дефицитом, который оказывает непосредственное влияние на формирование ДКП и является обоснованием к включению в комплекс метаболической коррекции препаратов магния.
Эффективность применения препаратов магния в лечении ДКП оценивалась нами по результатам динамического обследования детей с ДКП на фоне магниевого дефицита. На момент обследования все 52 ребенка, включенные в исследование, получали адекватную инсулинотерапию, соблюдали диету и проводили регулярный самоконтроль показателей гликемии. Ни у одного из обследованных детей на период обследования не было кетоацидотических и гипогликемических состояний.
Учитывая различную биодоступность и эффективность препаратов магния для устранения магниевого дефицита, мы решили сравнить действие магния аспарагината и магния оротата у детей с ДКП. Все дети, включенные в исследование, были разделены на две равнозначные группы по 26 человек, которые в течение 1 месяца принимали комплексную кардионейрометаболи-ческую терапию (нейромультивит по 1 таблетке 3 раза в день и липоевая кислота по 25 мг 2 раза в день). Дополнительно в состав терапии у детей 1 группы был включен магния аспарагинат по 1 таблетке 3 раза в день, у детей 2 группы — магния оротат (в возрасте до 12 лет — по 1 таблетке (500 мг) 3 раза в день — 4 недели; старше 12 лет — по 2 таблетке (1000 мг) 3 раза в сутки в течение 7 дней, затем по 1 таблетке (500 мг) 3 раза в день — 3 недели).
Оценку эффективности применения выбранных препаратов магния у детей с ДКП мы проводили путем сравнения в исследуемых группах уровня магния эритроцитов периферической крови и магния секрета слюнных желез, показателей ЭхоКГ и показателей временного и спектрального анализов ВРС до и после проведения курса метаболической терапии.
Установлено, что 4-х недельный курс метаболической терапии с включением препаратов магния у детей с ДКП приводит к повышению концентрации магния в эритроцитах периферической крови и секрете слюнных желез. Однако в зависимости от биодоступности применяемых препаратов магния отмечалась различная динамика повышения концентрации магния в эритроцитах периферической крови и секрете слюнных желез. Так у детей,
получавших магния аспарагинат, после проведенного курса терапии отмечалось незначительное повышение концентрации магния в эритроцитах периферической крови (с 1,3+0,07 ммоль/л до 1,4+0,25 ммоль/л, р>0,05) и в секрете слюнных желез (с 0,03+0,004 ммоль/л до 0,04+0,003 ммоль/л, р>0,05). У детей, получавших магния оротат, содержание магния в эритроцитах периферической крови возросло с 1,3+0,09 ммоль/л до 1,6±0,06 ммоль/л (р<0,01), а в секрете слюнных желез — с 0,03±0,005 ммоль/л до 0,06+0,007 ммоль/л (р<0,01). Следовательно, магния оротат в отличие от аспарагината более эффективно устраняет дефицит магния у детей с ДКГТ.
Нами была установлена различная динамика ЭхоКГ показателей, отражающих диастолическую функцию ЛЖ и его концентрическое ремоделиро-ванис у детей с ДКП, в зависимости от состава метаболической терапии, также свидетельствующая о большей эффективности применения магния оротата по сравнению с аспарагинатом для восстановления релаксационной способности миокарда ЛЖ и профилактики его ремоделирования.
Устранение магниевого дефицита у детей с ДКП при помощи магния оротата способствовало восстановлению геометрии ЛЖ за счет уменьшения его гипертрофии, что нашло свое отражение в достоверном снижении ЭКМИ (р<0,01) с приближением его к показателю контрольной группы, а так же в достоверном уменьшении до нормальных размеров толщины миокарда МЖП (р<0,001) и ЗСЛЖ (р<0,001). Напротив, в группе детей, получавших магния аспарагинат, отмечалась лишь тенденция к уменьшению ЭКМИ (р>0,05) без существенных изменений толщины миокарда МЖП и ЗСЛЖ по сравнению с исходными значениями (р>0,05).
Применение магния оротата в составе метаболической терапии способствовало нормализации релаксационной способности миокарда у детей с ДКП, что проявлялось в достоверном увеличении ИПМ с 0,81+0,034 до 1,29+0,024 (р<0,001). При этом у детей, получавших магния аспарагинат, не смотря на достоверное увеличение ИПМ с 0,86+0,015 до 0,94+0,019 (р<0,01),
нормализации релаксационной способности ЛЖ достигнуто не было. Следовательно, применение магния оротата в составе метаболической терапии у детей с ДКП обеспечивает восстановление релаксационной способности миокарда ЛЖ и способствует замедлению его ремоделирования, являясь эффективным способом профилактики и лечения ДКП у детей с СД.
Нами установлено, что магния оротат в составе метаболической терапии оказывает эффективное воздействие не только на миокард, но и на вегетативную регуляцию ритма сердца у детей с ДКП, проявляющееся улучшением временных показателей ВРС по данным суточного мониторирования ЭКГ (рисунок 1).
До лечения о После лечения
Рис. 1. Динамика показателей временного анализа ВРС у детей с ДКП, получавших комплексную метаболическую терапию с включением магния оротата.
Увеличение общего среднего, среднего дневного и среднего ночного ¡">NN50 и гМБЗО после курса метаболической терапии (р<0,05), свидетельствующее о повышении чувствительности сиігусового узла к парасимпатическим влияниям и уменьшении ригидности сердечного ритма доказывает нормализующее влияние магния оротата на электрическую активность клеток
вегетативной нервной системы и улучшение проведения нервного импульса у детей с ДКП.
Вместе с тем, показатели временного анализа ВРС у детей с ДКП, получавших магния аспарагинат в составе метаболической терапии, не имели достоверной положительной динамики по сравнению с исходными значениями после курса лечения, что свидетельствует о неэффективности использования магния аспарагината в составе метаболической терапии для восстановления нормальных вагосимпатических взаимоотношений в вегетативной регуляции ритма сердца у детей с ДКП (рисунок 2).
а До лечения □ После лечения
Рис. 2. Динамика показателей временного анализа ВРС у детей с ДКП, получавших комплексную метаболическую терапию с включением магния аспарагината.
Результаты, полученные нами при оценке показателей временного анализа ВРС, подтверждались результатами спектрального ее анализа у детей с ДКП, получавших различную по составу метаболическую терапию (рисунки 3,4).
В группе детей, получавших магния оротат, отмечалось достоверное увеличение показателей высокочастотного (НБ) и низкочастотного (ІЛ7) спектров с нормализацией индекса вагосимпатического баланса в отличие от
группы детей, получавших магния аспарагинат, где не установлено достоверной разницы в показателях спектрального анализа ВРС до и после проведения курса терапии.
В До лечения И После лечения]
Рис. 3. Динамика индекса вагосимпатического баланса (ХР/НР) у детей с ДКП, получавших комплексную метаболическую терапию с включением магния оротата.
SIHF (общ ий средний) (.Р/НЯ (средний днем) ІР/НР (средний ночью)
| N До лечения и После лечения :
Рис. 4. Динамика индекса вагосимпатического баланса (и/ОТ) у детей с ДКП, получавших комплексную метаболическую терапию с включением магния аспарагината.
Таким образом, применение магния оротата в составе метаболической терапии в течение 4-х недель у детей с ДКП на фоне дефицита магния позво-
ляет эффективно восстанавливать релаксационную способность миокарда ЛЖ, препятствуя развитию его концентрического ремоделирования, и нормализовать вегетативную регуляцию ритма сердца.
1. Установлено, что клинико-апамнестический и функциональные методы обследования сердечно-сосудистой системы: электрокардиография, кардиоинтервалография, кардиоваскулярные тесты позволяют выявить у детей с сахарным диабетом 1 типа дезадаптационпый характер вегетативной регуляции функционирования сердечно-сосудистой системы и дистрофические изменения в миокарде, выделить группу детей повышенного внимания и определить показания для проведения у них углубленного функционального и эхокардиографического обследования.
2. Признаками диабетической автономной кардиоваскулярной ней-ропатии у детей, по данным бифункционального мониторировапия, являются: значения показателей временного анализа вариабельности ритма сердца (рКГЫ50, гМББВ) и показателей спектрального анализа вариабельности ритма сердца (1Л% Ш) ниже возрастных нормативов, увеличение соотношения (ЪР/НР) более 1,6, увеличение процентной представленности периодов повышенной дисперсии в структуре ночного сна более 50% и пробуждение из периода стабильного ритма с резким подъемом ЧСС, средние значения систолического и диастолического АД в дневное время и диастолического АД в ночное время выше возрастных нормативов, суточный индекс диастолического АД менее 10%, которые свидетельствуют о снижении регуляторной активности обоих отделов вегетативной нервной системы с нарушением ваго-симпатического баланса, проявляющимся преобладанием симпатических влияний на ритм сердца и сосудистый тонус.
3. У детей, больных сахарным диабетом 1 типа, с увеличением длительности заболевания и формированием поздних осложнений при эхокар-
диографии установлена смена типов центральной гемодинамики от гиперкинетического к гипокинетическому. Изменения центральной гемодинамики сопровождаются концентрическим ремоделированием левого желудочка с развитием его диастолической дисфункции I типа, которые являются критериями диагностики диабетической кардиомиопатии.
4. Определена роль диабетической автономной кардиоваскулярной нейропатии в формировании концентрического ремоделирования левого желудочка с развитием его диастолической дисфункции I типа и является одним из основных звеньев патогенеза диабетической кардиомиопатии у детей.
5. Нами установлены 3 стадии развития диабетической кардиомиопатии у детей:
1 стадия — напряжения адаптации сердечно-сосудистой системы, характерная для детей с манифестацией сахарного диабета;
2 стадия — начальной дезадаптации сердечно-сосудистой системы, характерная для детей с длительностью сахарного диабета от 1 до 5 лет;
3 стадия — дезадаптации сердечно-сосудистой системы, характерная для
детей с длительностью сахарного диабета более 5 лет.
6. У 68,9% детей с сахарным диабетом 1 типа выявлен дефицит магния в эритроцитах периферической крови и у 61,1% в секрете слюнных желез, распространенность и степень выраженности которого напрямую зависят от длительности заболевания и наличия его поздних осложнений.
7. Магниевый дефицит у детей с сахарным диабетом 1 типа является одним из звеньев патогенеза диабетической кардиомиопатии, оказывая непосредственное влияние на формирование автономной кардиоваскулярной нейропатии и концентрическое ремоделирование левого желудочка с развитием его диастолической дисфункции I типа.
8. Применение, разработанной нами метаболической терапии с включением магния оротата у детей с сахарным диабетом 1 типа и магниевым дефицитом, является эффективным способом профилактики и лечения
диабетической кардиомиопатии, обеспечивая нормализацию вагосимпатиче-ских взаимоотношений в вегетативной рефляции ритма сердца, устранение концентрического ремоделирования левого желудочка и восстановление релаксационной способности его миокарда.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для раннего выявления диабетической кардиомиопатии у детей, уточнения стадии ее развития и определения лечебно-диагностической тактики детским эндокринологам и врачам педиатрам первичного звена здравоохранения не реже 1 раза в 6 месяцев рекомендуется использовать следующий план диспансерного наблюдения за детьми с сахарным диабетом 1 типа:
Клинико-анамнестическое и функциональное обследование:
— наличие поздних осложнений СД;
— симпатикотоническая направленность вегетативной регуляции ритма сердца и артериального давления;
— метаболические нарушения на ЭКГ.
' ч Повторить через
6 месяцев
ЭхоКГ .4 с > Концентрация М§ в секрете слюнных желез -зт-' ( ^ Бифункциональное мониторирование
Критерии ДКП < 0,05 мМоль/л -^Т—— Критерии ДАКН Т—
Компенсация СД, метаболическая терапия с включением магния оротата в течение 1 месяца.
2. Уточнение диагноза диабетической автономной кардиоваскуляр-пой пейропатии у детей с сахарным диабетом 1 типа рекомендуется проводить при помощи суточного мониторирования ритма сердца и артериального давления с использованием комплексного подхода к оценке параметров временного и спектрального анализов вариабельности ритма сердца, показателей тренда частоты сердечных сокращений в период ночного сна и циркад-ной динамики артериального давления.
3. При выполнении эхокардиографии у детей с сахарным диабетом 1 типа рекомендуется оценка параметров центральной гемодинамики, эхо-кардиометрического индекса и трансмитралыгого диастолического потока для раннего выявления гипокинетического типа центральной гемодинамики, концентрического ремоделирования левого желудочка и его диастолической дисфункции I типа, свидетельствующих о наличии диабетической кардио-миопатии в стадии дезадаптации.
4. Оценку состояния магниевого обмена у детей с сахарным диабетом 1 типа наиболее целесообразно проводить с использованием неинвазив-ной методики определения концентрации магния в секрете слюнных желез, коррелирующей с концентрацией магния в эритроцитах периферической крови. Концентрация магния в секрете слюнных желез менее 0,05 ммоль/л у детей с сахарным диабетом 1 типа свидетельствует о наличии магниевого дефицита и является показанием для его медикаментозной коррекции.
5. Детям с ранними признаками диабетической кардиомиопатии на фоне дефицита магния в течение 1 месяца показана комплексная метаболическая терапия (нейромультивит по 1 таблетке 3 раза в день и липоевая кислота по 25 мг 2 раза в день) с включением магния оротата по схеме: для детей в возрасте до 12 лет — по 1 таблетке (500 мг) 3 раза в день — 4 недели; старше 12 лет — по 2 таблетки (1000 мг) 3 раза в сутки в течение 7 дней, затем по 1 таблетке (500 мг) 3 раза в день — 3 недели.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Иванов, Д. А. Современные возможности ранней диагностики и профилактики миокардиодистрофии у детей с сахарным диабетом [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Российский медицинский журнал. — 2003 .- № 3.- С. 32 — 35.
2. Дианов, О. А. Диагностика кардиальных осложнений сахарного диабета у детей [Текст] / О. А. Дианов, Д. А. Иванов, С. Ф. Гнусаев // Современные технологии в педиатрии и детской хирургии. материалы II Российского конгресса, (15 — 17 окт. 2003 г.). — М„ 2003. — С. 325.
3. Дианов, О. А. Ультразвуковая диагностика кардиальных осложнений сахарного диабета I типа у детей и подростков [Текст] / О. А. Диапов, Д. А. Иванов, С. Ф. Гнусаев // Тезисы докладов 4-го съезда Российской Ассоциации специалистов ультразвуковой диагностики в медицине, (27 — 30 окт. 2003 г.). — М. 2003 — С. 236.
4. Пат. 2218864 Российская Федерация, МПК 7 А 61 В 5/0452. Способ ранней диагностики автономной кардиальной пенропатии у детей, больных сахарным диабетом I типа [Текст] / Иванов Д. А. Гнусаев С. Ф.; заявитель и патентообладатель Гос. учреждение Тверская гос. медака-демия. — № 2002128160/14 ; заявл. 21.10.02 ; опубл. 20.12.03, Бюл. № 35. -11 с. ил.
5. Дианов, О. А. Бифункциональное мониторирование сердечного ритма и артериального давления в диагностике кардиоваскулярных осложнений сахарного диабета [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, Б. Н. Яковлев // Тезисы Всероссийского Конгресса «Детская кардиология -2004», (24 — 26 мая 2004 г.). — М. 2004. — С. 88 — 89.
6. Дианов, О. А. Критерии ранней диагностики диабетической автономной кардиоваскулярной нейропатии у детей и подростков [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, Б. Н. Яковлев // Тезисы докладов III
Всероссийского диабетологического конгресса, (24 — 27 мая 2004 г.). — М.,
2004,- С. 538 — 539.
7. Гнусаев, С. Ф. Критерии диагностики диабетической автономной кардиоваскулярной нейропатии у детей и подростков [Текст] / С. Ф. Гнусаев, О. А. Дианов, Д. А. Иванов, Б. Н. Яковлев // Современные технологии в педиатрии и детской хирургии. материалы III Российского конгресса, (26 — 28 окт. 2004 г.). — М. 2004,- С. 344.
8. Пат. 2242918 Российская Федерация, МПК А 61 В 5/02. Способ дифференциальной диагностики повышенного артериального давления и ранней диагностики артериальной гипертензии у подростков [Текст] / Яковлев Б. Н. Гнусаев С. Ф. Иванов Д. А.; заявитель и патентообладатель ГОУ ВПО «Тверская ГМА». — № 2003134209 ; заявл. 25.11.03 ; опубл. 27.12.04, Бюл. № 36. -Юс. ил.
9. Иванов, Д. А. Возможности холтеровского мониторирования сердечного ритма для ранней диагностики автономной кардиальной нейропатии у детей с сахарным диабетом [Текст] / Д. А. Иванов, С. Ф. Гнусаев, А. Н. Шибаев // Информатизация учебного процесса, научных и клипических исследований. материалы науч.-практ. конф. (18 февр. 2005 г.). — Тверь,
2005.-С. 105- 107.
10. Гнусаев, С. Ф. Взаимосвязь эхокардиографических изменений с показателями бифункционального мониторирования сердечного ритма и артериального давления у детей при сахарном диабете [Текст] / С. Ф. Гнусаев, О. А. Дианов, Д. А. Иванов, Б. Н. Яковлев // Тезисы I съезда врачей ультразвуковой диагностики Центрального федерального округа. М. 2005 г. // Ультразвуковая и функциональная диагностика. — 2005. — № 2. — С. 126.
11. Гнусаев, С. Ф. Новые подходы к лечению диабетической кардиопа-тии у детей [Текст] / С. Ф. Гнусаев, О. А. Дианов, Д. А. Иванов, Б. Н. Яковлев // Достижения науки в практику детского эндокринолога. материалы III Всероссийской науч.-практ. конф. (24 — 25 мая 2005 г.). — М. 2005. — С. 24.
12. Иванов, Д. А. Ранняя диагностика и профилактика кардиопа-тии у детей с сахарным диабетом I типа [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов // Педиатрия. — 2005. — № 3. — С. 19 — 25.
13. Дианов, О. А. Диастолическая функция миокарда при диабетической автономной кардиоваскулярной нейропатии у детей [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, Б. Н. Яковлев // Российский педиатрический журнал. — 2005. — № 3. — С. 8 — 11.
14. Дианов, О. А. Кардиоваскулярные нарушения у детей при са-харпом диабете [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, Б. Н. Яковлев // Сахарный диабет. — 2005.- № 4.- С. 40 — 44.
15. Гнусаев, С. Ф. Диабетическая автономная кардиоваскулярная нейропатия у детей как предиктор артериальной гипертензии [Текст] / С. Ф. Гнусаев, О. А. Дианов, Д. А. Иванов, Б. Н. Яковлев // Сибирский медицинский журнал. — 2005. — Т. 20, № 4.- С. 22 — 26.
16. Гнусаев, С. Ф. Способ профилактики прогрессирования автономной кардиальной нейропатии у детей с сахарным диабетом [Текст] / С. Ф. Гнусаев, Д. А. Иванов, Б. Н. Яковлев, О. А. Дианов // Современные технологии в педиатрии и детской хирургии. материалы IV Российского конгресса, (25 -27 окт. 2005 г.). — М„ 2005. — С. 253.
17. Иванов, Д. А. Ранняя диагностика и метаболическая терапия поражения миокарда у детей с сахарным диабетом [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов // Вестник педиатрической фармакологии и нут-рициологии. — 2006. — Т. 3. № 1. — С. 57 — 63.
18. Современные подходы к диагностике и лечению кардиопатин у детей с сахарным диабетом 1 типа [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Актуальные вопросы педиатрии, перинатологии и репродуктологии. сборник / под ред. А. В. Прахова, С. Б. Артифексова. Н. Новгород, 2006. — С. 166 — 172. (Изд. «Гладкова О. В.» ; вып. 3).
19. Дианов, О. А. Липидный обмен и функциональное состояние сердечно-сосудистой системы у детей с сахарным диабетом 1 типа [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, М. А. Горшкова // Актуальные проблемы кардиологии детей и взрослых — 2006. материалы межрегион, науч.-практ. конф. (23 — 24 апр. 2006 г.). — Астрахань, 2006. — С. 48 — 51.
20. Иванов, Д. А. Способ профилактики прогрессирования диабетической кардиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Актуальные проблемы кардиологии детей и взрослых — 2006. материалы межрегион, науч.-практ. конф. (23 — 24 апр. 2006 г.). — Астрахань, 2006. — С. 64 — 65.
21. Иванов, Д. А. Способ профилактики диабетической кардиопатии у детей и подростков [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Тезисы докладов Всероссийской науч.-практ. Конф. с международным участием «Некоронаро-генные заболевания миокарда: диагностика, лечение, проблемы профилактики». М. 14 — 15 сент. 2006 г. // Кардиология СНГ. — 2006. — Т. IV. — № 1.- С. 151.
22. Иванов, Д. А. Способ диагностики и лечения диабетической кардиопатии у детей и подростков [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Диапов, Т. А. Белякова, В. В. Жмуркин // Здоровье молодежи и будущее России. материалы Всероссийской научной конференции (19-20 окт. 2006 г.). -Тверь. Триада, 2006. — С. 244 — 246.
23. Иванов, Д. А. Способ профилактики и лечения диабетической кардиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов, Б. Н. Яковлев, Т. А. Белякова // Современные технологии в педиатрии и детской хирургии. материалы V Российского конгресса, (24 — 26 окт. 2006 г.). — М. 2006. — С. 95 — 96.
24. Иванов, Д. А. Диабетическая кардиопатия [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов // Коррекция метаболических нарушений при различных патологических состояниях у детей: (Опыт использования препарата
Элькар®) / под ред. А. Д. Царегородцева, Е. А. Николаевой, В. С. Сухоруко-ва. — М. ИД МЕДПРАКТИКА, 2006. — С. 35 — 39.
25. Дианов, О. А. Влияние липидного обмена на функциональное состояние сердечно-сосудистой системы у детей с сахарным диабетом 1 типа [Текст] / О. А. Дианов, Д. А. Иванов, С. Ф. Гнусаев // Бюллетень Восточно-сибирского научного центра. — Иркутск, 2007. — № 3 (55). — С. 76 -77.
26. Дианов, О. А. Бифункциональное мониторирование сердечного ритма и артериального давления в диагностике диабетической автономной кардиоваскулярной нейропатии у детей и подростков [Текст] / О. А. Дианов, Д. А. Иванов, С. Ф. Гнусаев // Тезисы Всероссийского Конгресса «Неинва-зивная электрокардиология в клинической медицине», (19-20 апр. 2007 г.). -М. 2007. — С. 27.
27. Иванов, Д. А. Влияние дефицита магния на формирование диабетической кардиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Т. А. Белякова // Детская кардиология 2008. материалы V Всероссийского конгресса, (6 — 7 июня 2008 г.). -М. 2008. — С. 160-161.
28. Дианов, O.A. Клинико-функциональные и метаболические нарушения при диабетической кардиопатии у детей и подростков [Текст] / О. А. Дианов, С. Ф. Гнусаев, Д. А. Иванов, М. А. Горшкова // Педиатрия.-2008. — Т. 87, № 5. — С. 17 — 21.
29. Иванов, Д. А. Роль диабетической автономной кардиальной нейропатии в развитии артериальной гипертензии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Т. А. Расторгуева, О. А. Дианов // Эндокринологические аспекты в педиатрии. материалы III Городской науч.-практ. конф. (12 — 13 нояб. 2008 г.). — М. 2008. — С. 9 — 11.
30. Иванов, Д. А. Эффективность магнерота в комплексной профилактике и лечении диабетической кардиопатии у детей [Текст] / Д. А. Иванов, Т. А. Белякова, С. Ф. Гнусаев // Современные технологии в педиатрии и детской
хирургии. материалы VIII Российского конгресса, (20 — 22 октября 2009 г.). -М. 2009. — С. 236.
31. Иванов, Д. А. Роль дефицита магния в формировании диабетической автономной кардиальной нейропатии у детей с сахарным диабетом 1 типа [Текст] / Д. А. Иванов, Т. А. Расторгуева, С. Ф. Гпусаев, М. А. Горшкова, Е. В. Декутович, В. В. Жмуркин // Российский вестник пери-натологии и педиатрии. — 2009. — № 5. — С. 70 — 75.
32. Пат. 2391905 Российская Федерация, МПК А 61 В 5/0452 (2006.01). Способ ранней диагностики диабетической автономной кардиальной нейропатии у детей и подростков [Текст] / Иванов Д. А. Гнусаев С. Ф. Расторгуева Т. А. ; заявитель и патентообладатель ГОУ ВПО «Тверская ГМА Росздрава». — № 2009101227/14 ; заявл. 15.01.09 ; опубл. 20.06.10, Бюл. № 17. -11 с. ил.
33. Гнусаев, С. Ф. Новый подход к диагностике и лечению диабетической автономной кардиоваскулярной нейропатии у детей [Текст] / С. Ф. Гнусаев, Д. А. Иванов, Т. А. Расторгуева // Тезисы VI Всероссийского Конгресса «Детская кардиология 2010», (1 — 3 июля 2010 г.). — М. 2010. — С. 461 — 463.
34. Гнусаев, С. Ф. Лечение диабетической автономной кардиоваскулярной нейропатии у детей препаратом магнерот [Текст] / С. Ф. Гнусаев, Д. А. Иванов, Т. А. Расторгуева // Российский вестник перинатоло-гии и педиатрии. — 2010. — № 4.- С. 114 — 118.
35. Иванов, Д. А. Эффективность метаболической терапии в профилактике и лечении подростков с диабетической автономной кардиоваскулярной нейропатией [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Е. П. Елизарова, Б. Н. Яковлев // Кардиология. — 2010. — № 9. — С. 47 — 50.
36. Иванов, Д. А. Закономерности изменения внутрисердечной гемодинамики у детей с сахарным диабетом 1 типа [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов, Т. А. Расторгуева // Инновационные технологии в пе-
диатрии и детской хирургии. материалы 9-го Российского конгресса, (19-21 окт. 2010 г.). — М, 2010. — С. 283 — 284.
37. Иванов, Д. А. Роль дефицита магния в патогенезе диабетической автономной кардиоваскулярной нейропатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Т. А. Расторгуева, И. А. Сизова // Здоровье детей: профилактика социально-значимых заболеваний. Санкт-Петербург-2011. материалы V Российского форума, (12 — 13 мая 2011 г.). — С. Пб. 2011. — С. 78.
38. Ivanov, D. A. Diagnostic possibilities of analysis of variability heart rate for early detection of diabetic autonomous cardiovascular neuropathy for children [Text] / D. A. Ivanov, S. F.Gnusaev // Book of abstracts 14th Congress of the International Society for Holter and Noninvasive Electrocardiology (ISHNE2011), (26 — 28 april 2011). — M. 2011. — P. 25.
39. Иванов, Д. А. Роль нарушений обмена магния у детей с сахарным диабетом I типа в формировании кардпопатии и способ ее метаболической коррекции [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Г. А. Масю-кова, Е. А. Лаврова, С. С. Косарев // Российский вестник перинатологии и педиатрии. — 2011. — № 5.- С. 63 — 70.
40. Иванов, Д. А. Алгоритм диагностики и лечения кардиомиопатии у детей с сахарным диабетом 1 типа [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Тезисы VII Всероссийского Конгресса «Детская кардиология 2012», (4-5 июня 2012 г.). — М. 2012,- С. 203 — 204.
41. Иванов, Д. А. Алгоритм диагностики, профилактики и лечения диабетической кардиомиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев // Российский вестник перинатологии и педиатрии. — 2012. — № 3.- С. 33-38.
Список сокращений:
ВРС — вариабельность ритма сердца
ДАКН — диабетическая автономная кардиоваскулярпая нейропатия
ДКП — диабетическая кардиомиопатия
ИПМ — индекс податливости миокарда
КИГ — кардиоиитервалография
ЛЖ — левый желудочек
СД — сахарный диабет 1 типа