Симптомы и признаки врожденных пороков сердца
Стандартные методы обследования беременной женщины включают в себя, среди прочих, и обязательное ультразвуковое исследование (УЗИ) сердца плода начиная с 14 недели развития.
Любое подозрение гинеколога, проводящего это исследование, на наличие какой-либо аномалии у плода, должно быть продублировано дополнительным исследованием специалистами репродуктивных центров.
При выявлении внутриутробного порока сердца, на основании степени его выраженности, сочетания с патологией других органов, прогнозируется жизнеспособность ребёнка после рождения. После чего, совместно с мамой, решается вопрос о возможном прерывании беременности.
Если мамой принято решение о дальнейшем вынашивании ребёнка, то роды планируются заранее. Их проводят в специализированном учреждении, в котором имеются все возможности для осуществления хирургической коррекции сердечной патологии сразу или через некоторое время после появления малыша на свет.
По различным причинам, ВПС не всегда диагностируется во время внутриутробного развития.
В этих случаях, установка диагноза после рождения зависит от уровня компенсаторных возможностей ребёнка. Часть пороков проявляет себя сразу через несколько часов после родов, часть – в течении месяца после рождения, а некоторые пороки остаются нераспознаны всю жизнь.
И всё же есть признаки, по которым можно заподозрить врождённую патологию сердца у новорожденного до выраженных проявлений сердечной недостаточности. И есть симптоматика, позволяющая предполагать ВПС у взрослых людей.
Симптомы и клиническая картина ВПС у новорожденных
- Цианоз (при синих пороках). Кожа и слизистые оболочки принимают синюшно-фиолетовый оттенок различной силы интенсивности. Это осуществляется за счёт снижения содержания кислорода в приходящей крови и присоединяющихся проблем с оттоком венозной от тканей. Цианоз кожных покровов может быть изначальным в области губ и носогубного треугольника. В дополнении к этим областям, которые могут быть скрыты от внимательного маминого взора при кормлении, обратить на себя внимание может тёмно-фиолетовый цвет кожи ушных раковин. Необходимо учитывать, что подобная симптоматика может наблюдаться при возникновении проблем у ребёнка при наличии патологии центральной нервной системы, при заболеваниях органов дыхания.
- Признаки нарушения периферического кровоснабжения (при белых пороках).Несовершенство терморегуляции у родившегося малыша, требует поддержания особого температурного режима для палат новорожденных и послеродового отделения в роддомах. У детей с ВПС, при равных условиях со своими ровесниками, мамы чаще ощущают похолодание ручек и ножек. Кожа и видимые слизистые оболочки становятся бледными, серо-белого цвета. Причиной этому – рефлекторное сужение просветов периферических сосудов и обкрадывание большого круга кровообращения или за счёт сброса крови в правые отделы сердца или при уменьшении диаметра просвета аорты.
- Выслушивание шумов в сердце при сокращении (в систолу) и при его расслаблении (диастола). Часть шумов у новорожденного можно выслушать изначально сразу после рождения, что обусловлено наличием фистул, оставшихся после внутриутробной работы сердца. Однако, в течении 4-5 дней, после полноценного запуска в работу легочного (малого) круга кровообращения, они постепенно стихают до полного отсутствия. Если это не происходит, то можно с полной уверенностью утверждать о наличии ВПС по причине продолжающегося изменения нормального движения крови по полостям сердца и магистральным сосудам.
- Изменение ритма и частоты сердечного сокращения новорожденных (более 150 в минуту или менее 110). Это хорошо определяется при аускультации сердца наряду с шумами.
- Учащённое дыхание в покое при сохраняющееся синюшности (бледности) кожи и нормальных показателях температуры тела .
- Снижение сократительной возможности миокарда .
С истончением компенсаторных механизмов (интервал у каждого порока свой), постепенно появляются признаки сократительной сердечной недостаточности. Они определяются в быстрой утомляемости ребёнка: сосательные движения у него слабые, непродолжительные; во время кормления он непрерывно срыгивает, синеет; во время плача так же быстро происходит цианоз кожи. Подкожная клетчатка нижних и верхних конечностей становится отёчной.
Это особенно бросается в глаза, когда свободно повязанная бирочка с числом рождения и фамилией мамы малыша, вдруг перестаёт свободно двигаться и даже оставляет борозды после себя. Кроме этого, начинает нарастать в объёмах живот ребёнка за счёт выпота жидкости и увеличения в размерах печени.
Признаки заболевания, которые проявляются не сразу после рождения, а в течение жизни
Наряду с описанными ранее признаками, определяющимися при аускультации сердца, которые могут быть выражены в различной мере, часть симптомов, появляются в процессе развития и взросления ребёнка.
- Отставание в умственном и (или) физическом развитии от своих сверстников. Особенно резко это проявляется в подростково-юношеском периоде, начиная с 10-11 лет.
- Сохраняющаяся бледность или синюшность кожных покровов. Вариации различные: от слегка заметной в области носогубного треугольника и (или) мочек ушных раковин, до выраженного цианоза всей поверхности тела.
- Утолщение контура концевых фаланг пальцев по типу «барабанных палочек» и выпуклая форма ногтей по типу формы часового стекла.
- Одышка и быстрое утомление при физической нагрузке.
- Отсутствие желания присоединиться к активным играм своих ровесников.
- Эпизоды с повторяющимися внезапными обмороками, связанными с эмоциональной или физической нагрузкой.
- Изменение формы грудной клетки с западением (вогнутые поверхности) нижних отделов с одновременным выпячиванием увеличенного в размерах живота. Иногда в проекции сердца у детей можно видеть «сердечный горб», обусловленный наличием увеличенного в размерах сердца в период роста и формирования грудной клетки.
- Частые простудные заболевания.
- Отсутствие аппетита.
- Жалобы на боли в сердце.
- Ощущения сердцебиения и перебоев в сердце.
Диагностика и тактика лечения врожденных пороков сердца
www . medic 72. ru – Первый форум студентов ТюмГМА
ГОУ ВПО Тюменская государственная медицинская академия
Министерства здравоохранения РФ
Диагностика и тактика лечения врожденных пороков сердца.
(Методическое пособие к практическому занятию студентов)
Тюмень- 2005
Методическое пособие «Диагностика и тактика лечения врожденных пороков сердца» является одним из комплексных учебно-методических материалов по сердечно-сосудистой хирургии.
^ Разработано ассистентом кафедры госпитальной хирургии с курсом анестезиологии ТГМА Соколовой В.В. под руководством д.м.н. профессор Керимов Г.Д.
1.Тема занятия: Диагностика и тактика лечения врожденных пороков сердца.
^ 2.Значение изучения темы.
Оздоровление населения от тяжелых аномалий системы кровообращения определяется уровнем подготовки врачей по вопросам диагностики, тактики и методов лечения данной патологии, качеством организации работы и достаточностью материального обеспечения.
По данным статистик России и других стран врожденные пороки сердца (ВПС) встречаются у 0,8-1 % новорожденных. Перед обществом, и, прежде всего врачами встает задача своевременного распознавания пороков сердца, подготовки пациентов к последующему сложному лечению, проведение этого лечебного хирургического процесса и обеспечение послеоперационной реабилитации.
^ 3.Цель занятия.
Первое практическое занятие в цикле хирургического лечения болезней органов кровообращения посвящалось методологии диагностики пороков сердца. Второе занятие, «Диагностика и тактика лечения врожденных пороков сердца», ориентировано на освоение и закрепление практического владения клинической диагностикой указанных заболеваний, и способность принимать тактические решения. Ознакомление студентов с методами выполнения коррегирующих вмешательств и возможным влиянием их на организм больного.
^ Для этого надо:
1. Знать:
1) Анатомию органов грудной клетки;
2) Нормальную и патологическую физиологию кровообращения, дыхания;
3) Нарушение гемодинамики отдельных врожденных пороков сердца: открытом артериальном протоке (ОАП), дефекте межжелудочковой перегородки (ДМЖП), дефекте межпредсердной перегородки (ДМПП), коарктации аорты, тетраде Фалло (ТФ);
4) Четко представлять клиническое течение порока в зависимости от изменения направления и объема сброса крови и возможности дифференциальной диагностики;
5) Современные способы лечения врожденных пороков сердца.
2. Уметь:
1) Провести клиническое обследование больного с врожденным пороком сердца.
2) Провести логический анализ информации анамнеза, данных физикального и рентгенологического исследования, ЭКГ, лабораторных показателей. В итоге установить логически обоснованный диагноз.
3) Определить тактику лечения.
4) Составить прогноз естественного течения порока и последствий планируемой операции.
3. Иметь представление:
1) О методике выполнения электрокардиографии, фонокардиографии, спирографии, ангиографии, аортографии, катетеризации полостей сердца.
2) Об этапах операции при врожденных пороках сердца.
4. Иметь навыки:
1) Правильно собрать анамнез, проанализировать данные клинических и специальных исследований и установить диагноз.
2) Правильно определить адекватность назначения специальных методов исследования.
^ 4.Самостоятельная работа студентов .
А. Теоретическая подготовка к занятию:
1. Восстановление в памяти знаний анатомии и физиологии органов кровообращения и дыхания;
2. Патологическая анатомия и патофизиология врожденных пороков (соответствующие разделы учебников, материалы лекций и методические пособия);
3. Методология диагностики пороков сердца (материалы лекций, методическое пособие);
4. Методы рентгенологического исследования сердца, органов дыхания;
5. Метод ЭКГ.
Б. Задание в форме ситуационной задачи на проверку исходного уровня знания.
ПРИМЕР. Ребенок 3 лет, по мнению родителей практически здоров. На консультацию явились по направлению участкового врача. До двух лет часто болел респираторными заболеваниями, во время которых выявлялся шум над сердцем, беспокоила одышка при небольших физических нагрузках. За последний год самочувствие ребенка существенно улучшилось, респираторные заболевания и одышка прекратились. При обследовании отмечено некоторое отставание в физическом развитии. Пульс на артериях рук и ног полный, ритмичный, АД в пределах нормальных показателей. Над сердцем выслушан интенсивный систолический шум над всей областью сердца с эпицентром в IY межреберье по левому краю грудины. Выраженный акцент II тона на легочной артерии. По ЭКГ — электрическая ось сердца не отклонена, признаки гипертрофии обоих желудочков. При рентгенологическом исследовании выявлено усиление сосудистого легочного рисунка, причем расширенными представлялись магистральные сосуды при относительном обеднении периферии легких. Выбухает дуга легочной артерии. Сердце умеренно расширено в поперечнике за счет обоих желудочков.
Результаты оценки информации отдельных этапов:
1. По анамнезу логичны следующие предложения:
а) частые респираторные заболевания у ребенка с шумами в сердце и одышкой указывают на возможную связь их с нарушением гемодинамики малого круга, обусловленным пороком сердца. Не исключалась первичная патология дыхательной системы и иммуннодефицитное состояние.
б) прекращение респираторных заболеваний, улучшение самочувствия ребенка может быть объяснено истинной положительной динамикой болезни. Если это порок сердца, то с возрастом уменьшаются гемодинамические нарушения (например, уменьшается размер ДМЖП, уменьшение сброса крови). Возможна и другая причина уменьшения сброса крови — легочная гипертензия.
Анализ сердечного шума:
а) если есть шум, значит, имеется вихревой поток;
б) шум интенсивный, поэтому и вихревой поток мощный;
в) систолический шум — связан с выбросом крови из желудочка;
г) IY межреберье по левому краю грудины – проекция правого желудочка.
Анализ сердечного шума указывает на то, что у ребенка в правом желудочке возникают интенсивные вихревые кровотоки, связанные с выбросом крови желудочками. Это может быть обусловлено ДМЖП или предклапанным легочным стенозом.
Значительное усиление II тона на легочной артерии свидетельствует о легочной гипертензии.
4. Усиление сосудистого легочного рисунка при расширении преимущественно магистральных сосудов и умеренном увеличении обоих желудочков говорит о легочной гипертензии. Этим уже исключается стеноз легочной артерии.
5. Гипертрофия обоих желудочков по ЭКГ не может помочь в дифференциации двух указанных пороков, но способствует оценке ситуации. Гипертрофия левого желудочка объясняется объемной перегрузкой, а гипертрофия правого желудочка согласуется с проявлениями легочной гипертензии.
Варианты заключения:
1. Из двух предполагаемых по шуму пороков правомерна диагностика ДМЖП. Такой диагноз правомерный и точный, но в тактическом плане недостаточно полный.
2. По шуму и рентгенологическим данным ставится диагноз: Врожденный порок сердца. ДМЖП. По акценту II тона на легочной артерии врач должен думать о легочной гипертензии и искать дополнительные аргументы для его подтверждения или исключения. Проведенное рентгенологическое исследование подтверждает наличие легочной гипертензии. А при этом синдроме становится понятна гипертрофия и увеличения левого желудочка. Правый желудочек, преодолевая высокое сопротивление сосудов малого круга, где повышено давление, неизбежно должен гипертрофироваться. У больного с легочной гипертензией определенное значение приобретает динамика самочувствия, жалоб больных. Исчезновение респираторных заболеваний и одышки уже не свяжешь с положительными изменениями порока. Они несомненно указывают на уменьшение сброса крови через ДМЖП, но не в результате уменьшения дефекта, а как следствие роста сопротивления сосудов малого круга, так как улучшение самочувствия у данного больного оказывается одним из проявлений развития прогностически крайне неблагоприятного осложнения — легочной гипертензии. Формулировка диагноза: Врожденный порок сердца с избыточным легочным кровотоком — ДМЖП, осложненный высокой легочной гипертензией. В таком варианте диагноз обязывает врача безотлагательно решать вопрос возможности хирургической коррекции порока.
^ Как решать тактические задачи по врожденным порокам сердца?
Предпосылка к ответу на этот вопрос заложена в классификации пороков сердца. Как известно, пороки сердца делятся на врожденные и приобретенные. Среди врожденных пороков выделяются пороки цианотического типа, т.е. с синдромом артериальной гипоксемии, и «бледные» без этого синдрома. «Бледные» пороки подразделяются на пороки с избыточным легочным кровотоком и с синдромом шлюза (синдром нарушения кровотока в естественном направлении). К числу первых относятся дефекты межпредсердной перегородки (ДМПП), дефекты межжелудочковой перегородки (ДМЖП), открытый артериальный проток (ОАП) или аорто-легочной свищ (АЛС).
К порокам с синдромом шлюза относятся стенозы любых отделов кровеносного русла и недостаточность клапанов, при которых также нарушен поток крови в естественном направлении. Группы приобретенных пороков в подавляющем большинстве случаев составляют «чистые шлюзы», хотя не исключаются и приобретенные дефекты перегородок сердца травматического и постинфарктного генеза.
Цианотические пороки делятся на две группы:
1. Аномалии сердца с уменьшенным легочным кровотоком, куда входят все пороки группы Фалло (триада, тетрада, пентада), атрезия правого венозного отверстия сердца и некоторые другие.
2. Аномалии с избыточным легочным кровотоком, к которым относятся транспозиция магистральных сосудов, истинный общий артериальный ствол.
От соотношения величин легочного сосудистого сопротивления и легочного кровотока зависит давление в малом круге кровообращения. Поэтому, при естественном течении врожденных пороков сердца с избыточным легочным кровотоком, длительное поступление большого количества крови в сосуды легких отражается на динамике кровообращения малого круга и приводит к развитию легочной гипертензии. Особенно часто легочная гипертензия наблюдается при больших ДМЖП, ТМС, сочетающейся с ДМЖП, общем артериальном стволе.
В связи с тем, что при этих пороках дополнительный объем крови попадает в малый круг кровообращения, нарушается баланс гидростатического и онкотического давления, повышается порозность сосудов, жидкая часть крови выпотевает в интерстиций, тем самым создаются условия для синдрома влажного легкого и в итоге, фактора воспаления. В клинике это проявляется частыми респираторными заболеваниями, затяжными пневмониями.
Примерно 50% детей первого года жизни с большим сбросом крови погибают при явлениях сердечной недостаточности на фоне гиперкинетической легочной гипертензии. Компенсаторное развитие рефлекторного спазма легочных артериол способствует уменьшению сброса крови. Лишь 50% детей переживают этот критический период. К одному году состояние ребенка постепенно стабилизируется, однако эта стабилизация относительна. У ребенка продолжают развиваться структурные изменения в сосудах легких, наступает так называемая смешанная форма легочной гипертензии.
Повышение сопротивления сосудов малого круга вначале носит компенсаторный характер, поскольку весь объем крови из левого желудочка будет опорожняться минуя аорту в легочную артерию. В дальнейшем, с ростом сопротивления сосудов малого круга из-за морфологических изменений в них направление сброса крови меняется.
Рост легочной гипертензии приводит к сбросу крови справа налево, то есть венозной крови в артериальное русло. Объективно у ребенка появляется цианоз. Появление цианоза, говорит о развитии легочной гипертензии IIIБ — IV стадии, что является противопоказанием для хирургической коррекции порока сердца. Поэтому, врач обязан вовремя диагностировать порок сердца, не пропустить развитие высокой легочной гипертензии, и своевременно направить ребенка в специализированный стационар для определения дальнейшей тактики ведения и решения вопроса о хирургическом вмешательстве.
Как определить развитие легочной гипертензии?
Аускультация сердца, изучение рентгенологической картины и данных ЭКГ дают очень много информации и позволяют сделать предварительное заключение о степени легочной гипертензии.
С ростом легочной гипертензии происходят изменения в клинической картине порока, а так же изменения при объективном обследовании. Из-за выраженного склероза сосудов малого круга кровообращения, выпотевания жидкой части крови не происходит, дети начинают меньше болеть простудными заболеваниями, пневмониями.
Чем тяжелее структурные изменения в легких, тем меньше аускультативных признаков. У больных III Б — IV стадии шум может отсутствовать в связи с тем, что сброс крови из-за выравнивания давления в правых и левых отделах сердца становится минимальным. При аускультации появляется характерный «металлический» II тон над легочной артерией. Степень усиления II тона пропорциональна выраженности гипертензии. Его так и характеризуют — II тон при легочной гипертензии. На ЭКГ — резко выраженная правограмма и перегрузка правых отделов сердца. Очень характерна рентгенограмма — сердце, как правило, умеренно увеличено в основном за счет желудочков. Резко расширены ствол легочной артерии и магистральные ветви. Однако на фоне такого расширения магистральных сосудов в легких периферия легочных полей как бы с ослабленным, повышенной прозрачности, легочным рисунком. Гиперволемия отсутствует. Опытный исследователь может заметить симптомы склеротического изменения в мелких ветвях легочной артерии.
Ценную информацию для определения стадии легочного гипертензии дает зондирование полостей сердца. В процессе этого исследования регистрируется давление в желудочках, легочной артерии и аорте, и определяется насыщение крови кислородом в полостях сердца. После определения гемодинамической группы легочной гипертензии морфологическая характеристика последней устанавливается после гистологического исследования участка легкого, взятого при биопсии.
Как отмечалось выше, первую подсказку по тактике лечения дает классификация. В группе пороков с гиперволемией малого круга главное гемодинамическое проявление состоит в избыточном кровотоке по сосудам легких соответственно объему сброса. Следовательно, прекращение сброса становится главной целью при любом из перечисленных пороков (ОАП, ДМЖП, ДМПП, АЛС). Второе обстоятельство, подлежащее обязательному учету: прогнозирование легочной гипертензии. Чем больше вероятность развития необратимых изменений в сосудах легких(III Б, IV стадии), тем желательнее выполнение коррегирующей операции в ранние сроки. Из перечисленных пороков, только при ДМПП нет прямого сообщения между полостями с высоким давлением (левым желудочком, аортой и малым кругом). Следовательно, ОАП, ДМЖП, АЛС желательно закрывать в первые месяцы после рождения. Однако коррекция ДМЖП, АЛС, ДМПП требует выключения сердца из кровообращения, оказывающего на организм ребенка побочное влияние. В связи с этим, коррекция данных пороков в первые месяцы жизни оправдана при угрозе развиться отека легкого, тяжелой сердечной недостаточности необратимой легочной гипертензии. При отсутствии таких угрожающих нарушений операция может быть отложена до 1-3 лет. Операция закрытия ОАП не сопряжена с травмой сердца, не требует выключения его из кровообращения, технически проста и малотравматична, поэтому должна выполняться в возрасте до 1 года. В более поздние сроки показания и противопоказания определяются объемом и направлением сброса крови, выраженностью вторичных изменений в сосудах малого круга кровообращения и миокарде желудочков. Для предупреждения развития необратимых изменений в сосудах легких была предложена операция сужения легочной артерии.
Таким образом, в настоящее время операцией выбора при изолированном ДМЖП является первичная радикальная коррекция порока. Сужение легочной артерии может быть предпочтительней, если риск операции с ИК выше, чем паллиативного вмешательства (например, оперирование в условиях ИК у детей с массой тела менее 4—6 кг, при сопутствующих аномалиях сердца и др.).
Основным признаком нарушения гемодинамики при ДМПП является сброс артериальной крови из левого в правое предсердие. Длительное поступление большого количества крови в сосуды легких постепенно приводит к развитию легочной гипертензии МКК. Основную роль в компенсации нарушения кровообращения при ДМПП выполняет правый желудочек. Такая компенсация может быть длительной, однако в итоге приводит к развитию недостаточности правого желудочка и нарушению кровообращения.
При ДМПП — операция единственный эффективный метод лечения. Небольшие вторичные ДМПП закрываются ушиванием; при больших дефектах, первичных ДМПП из-за опасности прорезывания швов от натяжения краев дефект всегда закрывают заплатой из аутоперикарда или синтетической ткани. Операция выполняется на открытом сердце в условиях гипотермии или искусственного кровообращения. Результаты вмешательства во многом определяются исходным состоянием больного. Летальность тем выше, чем выше степень легочной гипертензии, выраженнее недостаточность кровообращения и нарушения сердечного ритма и проводимости, тяжелее проявления сопутствующего инфекционного эндокардита.
Открытый артериальный проток встречается на первом году жизни в 6,1% случаев. Неосложненный ОАП корригируется в этот период с минимальным риском. В последние годы предложены способы закрытия ОАП у новорожденных с помощью ингибитора синтеза простагландинов индометацина. Однако продолжительность консервативного лечения не должна превышать 2—5 дней, а 11—36%, леченных индометацином больных, все же нуждаются в операции. Наиболее широко применяется метод закрытия ОАП путем перевязки протока либо пересечения с ушиванием обоих концов. Метод хорошо разработан, сравнительно безопасен и дает хорошие отдаленные результаты у 97-98 % оперированных больных, особенно детей первых лет жизни, у которых не развилась легочная гипертензия. В последнее время применяется метод катетерной эндоваскулярной окклюзии протока. Со стороны аорты с помощью специальных катетеров вводят «пробку» из синтетической ткани. В частности, чрескожным доступом через бедренную артерию в ОАП вводят соответствующий его размерам боталлоокклюзер, состоящий из пенистого полиуретана, армированного металлическим каркасом с фиксаторами, или проводят транскатетерную спиральную окклюзию ОАП при небольшом его диаметре (от 1 до 5 мм). Боталлоокклюзия противопоказана при очень широком или очень коротком ОАП, а также аневризме протока.
К порокам с синдромом «шлюза» относят: стеноз легочной артерии, недостаточность митрального клапана, митральный стеноз, стеноз и недостаточность клапана аорты, коарктацию аорты.
Общим проявлением легочного и аортального стенозов является анатомическое препятствие в выводных отделах этих желудочков. Значимость препятствия определяется степенью сужения. относительно нормальных размеров выводного тракта. Выброс достаточного объема крови обеспечивается усиленной нагрузкой гипертрофированного желудочка. Относительное благополучие больного сохраняется до тех пор, пока резервов миокарда хватает для обеспечения потребностей в кровоснабжении функционирующих систем. Резкая гипертрофия миокарда в предклапанных областях нередко становится причиной формирования вторичных предклапанных стенозов. Неадекватное кровоснабжение гипертрофированного, перегруженного работой миокарда неизбежно приводит к его склеротическим изменениям, что в свою очередь проявляется сердечной недостаточностью и регидностью предклапанных вторичных сужений. Из представленного следует, что лечение этих пороков должно предусматривать устранение препятствия на пути оттока желудочка до развития в нем необратимых изменений. При наиболее частых клапанных стенозах это достигается рассечением клапанной диафрагмы по комиссурам. Такая процедура эффективна всегда, когда нет грубого вторичного предклапанного стеноза. При наличии последнего требуется дополнительное травматичное иссечение стенозирующих структур. Необходимо учитывать еще одно обстоятельство. В отличие от предсердно-желудочкоых клапанов, имеющих папиллярные мышцы хорды, полулунные клапаны аорты и легочной артерии функционируют чисто механически и любые, даже небольшие деформации приводят к недостаточности.
Так как диастолическое давление в легочной артерии не велико (в пределах 12-16 мм.рт.ст.), обратный поток крови при недостаточности легочных клапанов сравнительно не велик. Больные сравнительно удовлетворительно переносят это осложнение. Высокое диастолическое давление в аорте при недостаточности ее клапанов обуславливает массивный обратный поток крови и развитие левожелудочковой недостаточности. Отмеченное различие в последствиях вмешательства на аортальном и легочном клапане определяют различия в тактике лечения. Выраженный легочной стеноз однозначно требует устранения – выполняется вальвулопластика (рассечение комиссур под контролем зрения). В случаях выявления значительного стеноза, операция дополняется инфундибулярной резекцией.
При аортальном стенозе такая тактика широко применявшаяся в 60-70-е годы в настоящее время считается порочной. Во всех случаях вмешательства на выводном тракте левого желудочка хирург должен быть готовым к коррекции возникающей недостаточности клапанов. У взрослых пациентов это решается сравнительно просто – имплантацией клапанного протеза. У маленького ребенка нельзя вшить протез большого диаметра, а маленький в скором времени станет узким для кровотока растущего ребенка. Поэтому операции при аортальном стенозе у детей раннего возраста выполняются только в случаях угрозы жизни и стремительного прогрессирования гипертрофии стенок левого желудочка.
Врожденные митральные пороки в изолированном виде встречаются относительно редко. Коррегируются в условиях искусственного кровообращения методом вальвулопластики соответственно форме аномалии.
В послеоперационном периоде на ответственности педиатров лежит тщательность наблюдения, определения динамики гемодинамических нарушений, функционирование клапанов.
^ Коарктация аорты — врожденное сужение просвета аорты на ограниченном участке. Коарктация может быть изолированной или сочетаться с ОАП. Сужение может находиться выше или ниже протока, в зависимости от этого называется пост- или предуктальный ОАП.
При коарктации происходит неравномерное снабжение кровью бассейнов выше или ниже места сужения. Ниже места сужения, если оно значительное, кровоснабжение органов идет чрез расширенные, извитые, часто склерозированные коллатерали. Гипертензия и развитие коллатеральных каналов, обходящих сужение, являются наиболее важным следствием изолированной коарктации аорты. К главным сосудам, участвующим в коллатеральных путях, относятся: подключичные артерии и их ветви, внутренние грудные артерии, межреберные артерии, сосуды вокруг лопатки, верхняя эпигастральная артерия, позвоночные артерии.
Понятно, что при наличии сужения с большей нагрузкой работает левый желудочек, перегрузка сопротивлением, компенсаторная гипертрофия миокарда. Если имеется постдуктальное сужение, то из-за значительного повышения давления выше места сужения происходит сброс через ОАП и присоединяется высокая легочная гипертензия.
Диагноз коарктации аорты обычно устанавливают на основании осмотра и клинических исследований. Повышение артериального давления на руках в сочетании со сниженным давлением и ослаблением пульсации на бедренных артериях. Обычно у больных с изолированной коарктацией аорты диагноз можно поставить без аортографии.
Хирургическое лечение коарктации аорты направлено на восстановление нормального кровотока по аорте. Это возможно выполнить путем иссечения суженного участка аорты и наложения анастомоза «конец в конец», вшиванием заплаты- истмопластика, протезирование суженного участка. Чаще выполняют операцию иссечения стенотического участка аорты с наложением анастомоза «конец в конец» или при большом протяжении стеноза, наложения сосудистого протеза между концами аорты.
В последнее время все шире применяется баллонная ангиопластика (дилататация) участка сужения аорты.
Наблюдающий за больным после операции врач, должен хорошо представлять варианты динамики порока. До коррекции в бассейне выше места сужения кровоток осуществлялся под повышенным давлением через склеротически измененные артерии( в том числе и артерии головного мозга). После устранения препятствия из дуги аорты кровь устремляется в сосуды нижней половины тела, не подвергнутые склерозу, а значит оказывающие меньшее сопротивление. Это создает предпосылку ухудшения кровоснабжения головного мозга. На последнее нарушение организм отвечает компенсаторным спазмом сосудов ниже места сужения. Такого не происходит. если к моменту операции склеротические изменения сосудов головного мозга не велики и снижения кровотока после коррекии порока не происходит. Этот факт показывает, что операция должна выполняться до развития таких изменений. В противном случае у больного останется высокая тотальная артериальная гипертония, очень трудно поддающаяся медикаментозному лечению. Кроме того, необходимо знать, адекватно ли растет аорта в месте пластики. При возврате симптомов коарктации в отдаленные сроки ставится диагноз рекоарктации и показания к повторной операции.
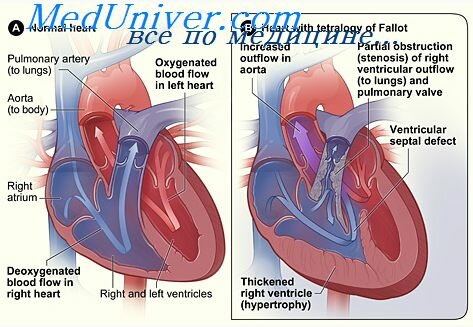
К цианотическим порокам с обеднением малого круга кровообращения относится болезнь Фалло. К данному заболеванию относят три аномалии, имеющие общие составляющие, общие звенья патогенеза нарушений гемодинамики. Наиболее часто встречается тетрада Фалло, которая состоит из стеноза легочной артерии, высокого дефекта межжелудочковой перегородки, декстрапозиции аорты и гипертрофии правого желудочка. Пентада Фалло имеет все вышеперечисленные аномалии, сочетающиеся с дефектом межпредсердной перегородки. Триада Фалло состоит из стеноза легочной артерии, дефекта межпредсердной перегородки и гипертрофии правого желудочка, при этом межжелудочковая перегородка сохраняется интактной.
Большую роль в определении тяжести порока играют стеноз выходного отверстия правого желудочка и дефект перегородки. Атрезия легочного ствола представляет собой наиболее тяжелую форму препятствия току крови из выходного отдела правого желудочка, так называемую крайнюю форму тетрады Фалло. Левый желудочек при данной аномалии чаще всего гипопластичен и функцию свою выполняет слабо. Из-за ДМЖП и декстрапозиции аорты происходит смешивание артериальной и венозной крови, нагнетание ее в большой круг кровообращения происходит за счет работы практически одного правого желудочка. Это обусловливает его компенсаторную гипертрофию. При тетраде Фалло резкая гипертрофия миокарда правого желудочка приводит к предклапанному стенозу легочного ствола.
Величина сброса и направление кровотока зависят от соотношения сопротивления малого круга и сопротивления большого круга кровообращения. Если стеноз легочной артерии незначителен, то устанавливается сброс слева направо –ацинотическая форма (клинически это соответствует бледной тетраде). Если стеноз легочной артерии выражен, устанавливается сброс справа налево – цианотическая форма. Степень сужения выходного отдела правого желудочка обуславливает тяжесть заболевания и клиническую картину порока.
Итак, при цианотических пороках сердца с гиповолемией малого круга, ведущим функциональным проявлением является снижение легочного кровотока. Именно малый легочной кровоток (а только он участвует в газообмене), крайне ограничивает жизнь и развитие ребенка. Следовательно, любой избираемый метод лечения должен предусматривать увеличение легочного кровотока. Вторым важным выражением пороков является артериальная гипоксемия, обусловленная сбросом крови справа налево. При всех перечисленных выше нарушениях задача увеличения легочного кровотока успешно решается выполнением радикальной операции: устранение стеноза и закрытие дефекта. К сожалению, радикальные операции не всегда выполнимы. Возможности их проведения ограничиваются малым возрастом (первые дни жизни), при котором высок риск операции. Кроме того, противопоказаниями к операции служат гипоплазия левого желудочка, не способного после операции нагнетать нормальный объем крови. Сдерживает операции также выраженная гипоплазия легочной артерии. В подобных ситуациях задача увеличения легочного кровотока может решаться наложением межсосудистых анастомозов. Наибольшее применение среди десятков методик получил подклдючично-легочный анастомоз. Достигаемое таким путем увеличение легочного кровотока позволяет ребенку расти, успешно развиваться и со временем быть готовым ко второму этапу лечения- радикальной операции. Из пороков этой группы межсосудистые анастомозы не показаны при триаде Фалло. Данный порок коррегируется только радикально.
В послеоперационном периоде обязателен контроль общего состояния, переносимость физических нагрузок, эффективность устранения стеноза в динамике, стойкость герметизма закрываемого дефекта. После наложения межсосудистых анастомозов определение факта функционирования соустья и его функциональной эффективности. Все эти вопросы доступны решению на основе информации традиционных методов клинического обследования. Огромную помощь предоставляет ЭХО – кардиография.
Оперативное лечение порока показано всем больным с ТФ. На первом году жизни необходимость в неотложной госпитализации возникает:
1) при «крайней» форме ТФ, ранних, частых и тяжелых одышечно-цианотических приступах;
2) при наличии стойкой одышки и тахикардии в покое, не купирующихся консервативной терапией;
3) при нарастании тяжелой дистрофии и анемизации.
Таким больным раннего возраста, а также более старшим детям с тяжелым инфундибулярным стенозом или гипоплазией легочной артерии (диаметр менее 1 /4 диаметра восходящей аорты) показана паллиативная шунтирующая операция по созданию аортолегочного анастомоза. Она направлена на обогащение малого круга кровообращения и позволяет больному выжить и окрепнуть для проведения ему через 2-3 года, уже с меньшим риском, более сложной радикальной операции по одновременному устранению всех дефектов. При этом безусловно устраняется и уже сыгравший свою роль артериовенозный анастомоз.
Идея создания анастомоза между аортой и легочной артерией (с целью устранения тяжелой гипоксемии) принадлежит педиатру Эллен Тауссиг, которая подсказала ее американскому кардиохирургу Блелоку, работавшему с нею и осуществившему первую операцию по созданию анастомоза между подключичной артерией и легочной артерией.
Радикальная операция включает одновременное устранение стеноза и пластику выводного отдела правого желудочка, закрытие большого ДМЖП с помощью синтетических (тефлон, дакрон) или биологических (ксеноперикард) заплат. Помещение заплаты правее устья аорты одновременно с закрытием ДМЖП корригирует и декстрапозицию аорты.
Первичная радикальная операция показана больным с 1 года. Операция проводится в условиях искусственного кровообращения в сочетании с регулируемой гипотермией тела.
Большинство кардиохирургов в настоящее время рекомендуют корригировать порок в грудном возрасте, т. к. вопреки распространенному мнению, ТФ значительно ухудшает состояние больных уже в раннем возрасте. Летальность при ранних радикальных операциях не превышает 10 %, а отдаленные результаты лучше, чем у больных, оперированных в более старшем возрасте.
^ Полная транспозиция магистральных сосудов относится к цианотическим порокам с обогащением малого круга кровообращения. Характеризуется тем, что морфологически аорта отходит от правого желудочка, а легочной ствол от левого, то есть магистральные сосуды перемещены или транспонированы. Образуется как бы два разобщенных круги кровообращения. Жизнеспособность зависит от наличия сообщений между большим и малым кругом кровообращения (ДМЖП, ДМПП, ОАП), через которые происходит смешивание артериальной и венозной крови. При свободном смешивании сброс может идти в переменном направлении, путем чего и происходит газообмен.
Лечебная помощь при ТМС заключается в выполнении паллиативных процедур и операций корррегирующих гемодинамику. Паллиативные операции направлены на увеличение размера дефекта овального окна. В. Рашкинд предложил осуществлять разрыв в перегородке катетером с раздувающимся баллоном. Однако ее можно выполнить лишь в течение первого месяца жизни. Позднее перегородка становится более плотной и разрыв ее баллоном не возможен. С.Парк сконструировал для этих целей катетер со складывающимся на его кончике лезвием ножа. Катетер вводят в левое предсердие, нож раскрывают и, опуская катетер, производят насечку на перегородке. Затем баллоном Рашкинда разрывают ее, увеличивая отверстие. При отсутствии эффекта от закрытых атриосептотомии, прибегают к хирургическому иссечению перегородки.
Литература:
Банкл Г. «Врожденные пороки сердца и магистральных сосудов». Москва.- Медицина.-1980.
Мутафьян О.А. «Врожденные пороки сердца у детей».Невский диалект.-2002.
«Лекции по сердечно-сосудистой хирургии» в 2 томах под ред.БокерияЛ.А. Издательство НЦССХ им.А.Н. Бакулева РАМН.,1999.
Диагностика врожденных пороков сердца
13 Октября в 7:39 260 0
Аномалии образования полостей сердца
Развитие сердца у зародыша и плода проходит 4 стадии: одно-, двух-у трех- и четырехкамерного сердца.
В однокамерном сердце нижний (каудальный) конец сердечной трубки в процессе роста перемещается кверху и кзади, а верхний (краниальный) конец — вниз и вперед. Намечаются четыре отдела: венозный синус, венозный отдел, артериальный отдел и артериальный ствол.
В дальнейшем путем довольно сложных процессов развития с разрастанием и срастанием отдельных разделов и частей, формируется двухкамерное сердце, в котором уже различают венозный синус, общее предсердие, общий желудочек и артериальный ствол. Имеется только один (большой) круг кровообращения.
На 4-й неделе развития начинают появляться первая и вторая перегородки предсердий, разделение предсердий, хотя неполное, поскольку имеется овальное окно. Образуется трехкамерное сердце.
Наконец, на 5—6-й неделе развития начинается развитие перегородки между желудочками и перегородки общего артериального ствола, отделяющей начальные отделы аорты и легочного ствола. У эмбриона длиной 10 мм уже имеется четырехкамерное сердце с артериальным стволом, разделенным на аорту и на легочный ствол (С. С. Михайлов).
Однополостное сердце (cor uniloculare) возникает при незаращении общего атрио-вентрикулярного отверстия и при недостаточном развитии перегородок сердца. Аномалия не влияет на развитие плода, но нарушения гемодинамики создаются сразу после рождения, приводят к ранней декомпенсации сердца и к гибели ребенка.
Двухполостное сердце (cor biloculare) описано в единичных наблюдениях. У него почти полностью отсутствуют перегородки между обоими предсердиями и обоими желудочками. В таких случаях практически имелось двухполостное сердце (cor biloculare).
Трехполостное сердце (cor triloculare) встречалось весьма редко, при этом полностью отсутствовали перегородки предсердий, двухжелудочковое сердце было с одним предсердием — cor monatriatum biventriculare. В единичных случаях отсутствовала перегородка желудочков п возникало одножелудочковое сердце с двумя предсердиями — cor monoventriculare biatriatum.
Все пороки развития сердца с недоразвитием перегородок между предсердиями и желудочками при больших дефектах приводят к появлению двух- и трехполостного сердца. Клиническая картина такая же, как при полной транспозиции магистральных сосудов. Судьба ребенка зависит от комплекса аномалий. Обычно такие дети умирают вскоре после рождения.
Аномалии положения сердца
Описаны отдельные наблюдения эктопии сердца на шее пли в брюшной полости, а также случаи частичного или полного расположения его вне грудной клетки. В последних случаях отсутствует грудина, иногда кожа и перикард, видна глазом и пальпируется пульсация сердца.
Закладка сердца появляется в шейной области у зародыша в конце 2-й недели развития. В дальнейшем сердечная трубка после 5-й недели перемещается каудально (С. С. Михайлов). В норме сердце останавливается над диафрагмой и располагается внутри грудной клетки.
Опасность грозит от сопутствующих пороков развития, от травматизации незащищенного грудной клеткой органа, от присоединения инфекции (эпикардит, перикардит).
Различают истинную декстрокардию и декстропозицию. При истинной декстрокардии выделяют три формы (рис. 104).
Рис. 104. Положение сердца и аорты, его аномалии (по И. Литтманну и Р. Фоно, несколько изменено).
а — нормальное положение; б — situs inversus; в — dextropositio cordis primaria; г — dextropositio cordis secundaria; 1 — правое предсердие; 2 — правый иелудочек; 3 — левое предсердие; 4 — левый желудочек.
1. Декстрокардия с обратным расположением внутренностей (situs viscerum inversus). Расположение сердца и соотношение его полостей являются как бы зеркальным отражением нормального расположения. Верхушечный толчок сердца оказывается на правой стороне, перкуторно и при аускультации. При рентгенологическом исследовании справа находится все то, что в норме определяется слева от средней линии. На ЭКГ I отведение соответствует зеркальному отражению обычного I отведения, положительные зубцы отрицательные, и наоборот, II отведение соответствует III отведению, а III отведение — IV отведению.
Аномалия не вызывает функциональных нарушений.
2) Декстрокардия без обратного расположения внутренностей. Расположение сердца обратное, как в зеркале, однако остальные органы занимают обычное расположение. Данные перкуссии, аускультации, рентгенологического исследования и ЭКГ такие же, как при предыдущей форме. Указанная аномалия развития сердца тоже не сопровождается нарушением функций в организме больного.
3) Поворот сердца без обратного расположения внутренностей: сердце как бы повернуто вперед и направо. Аорта при этом остается на месте, проходит слева от позвоночника. На правой стороне впереди оказывается левый желудочек, а за грудиной — левое предсердие. Обычно такая аномалия сопровождается другими аномалиями развития, от которых могут зависеть симптомы и течение. Диагноз уточняется ангиокардиографией и катетеризацией сердца (П. Кишш, Д. Сутрели).
Под декстропозицией сердца в собственном смысле слова подразумевают вторичное перемещение сердца вправо в результате патологических процессов: рубцов и сращений после воспалительных процессов (тянут сердце вправо), опухолей, выпота, диафрагмальных грыж, а также пневмоторакса (отодвигают сердце вправо). Симптомы и течение зависят от основных заболеваний.
Аномалии кровоснабжения сердца
Последние встречаются очень редко. В описанных наблюдениях венечные артерии отходили от легочного ствола, чаще левая, реже правая или обе. Направление венечных сосудов даже при тяжелых врожденных пороках сердца обычно остается постоянным, не меняется.
При аномальном отхождении от легочного ствола у плода никаких изменений нет, но после рождения в миокарде наступает гипоксия. Дальнейшее течение зависит от развития коллатералей. При недостаточном кровоснабжении от недостатка кислорода уже в ближайшие недели после рождения появляется быстро нарастающая недостаточность сердца и кровообращения. Дети погибают от декомпенсации.
В более легких случаях при хорошо развитых коллатералях ребенок может достичь подросткового и юношеского возраста, но обычно внезапно умирает (И. Литтманн, Р. Фоно).
Кровоснабжение сердца изменено также при аномалиях отхождения венечных артерий и впадения вен в сердце.
Аномалии проводящей системы сердца
Нарушения проведения раздражений наблюдаются не только при приобретенных заболеваниях сердца.
Доказательством врожденного происхождения считается их появление у новорожденных и у детей в тех случаях, когда можно исключить инфекционное происхождение их, но имеется врожденный порок сердца.
При классификации расстройств ритма учитывается способ образования импульсов, его место и в случае неправильного образования импульсов — отношение его в физиологическому образованию импульсов в сердце (табл. 10).
Таблица 10. Номотопные расстройства образования импульсов (по П. Кишшу и Д. Сутрели)
При наличии гетеротопного расстройства образования импульсов различают активное и пассивное гетеротопное образование импульсов (табл. 11).
Таблица 11. Гетеротопные расстройства образования импульсов (по П. Кишшу и Д. Сутрели)
Полный блок среди врожденных нарушений проведения раздражений встречался редко. Частичный блок иногда отмечался при некоторых врожденных пороках сердца, чаще при дефекте межпредсердной перегородки и высоком дефекте межжелудочковой перегородки (И. Литтманн, Р. Фоно).