Биология и медицина
Атеросклероз: клиническая картина
Большинство атеросклеротических бляшек клинически не проявляются. Даже распространенный атеросклероз может не давать существенной симптоматики, и многие больные умирают от других причин. В чем же причина различного течения болезни?
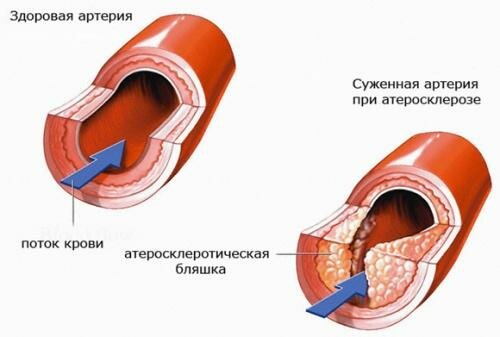
Большое клиническое значение имеет перестройка артерий в процессе атерогенеза. хотя это часто упускается из виду. На ранних стадиях бляшка обычно растет вне просвета сосуда, и его диаметр компенсаторно увеличивается. Поэтому на протяжении значительной части своего развития бляшка не препятствует кровотоку. Просвет начинает сужаться, когда она занимает более 40% окружности внутренней эластической мембраны.
Стеноз обычно ведет к стабильному снижению кровотока, что проявляется такими симптомами, как стенокардия напряжения или перемежающаяся хромота. Однако даже вызванная бляшкой полная окклюзия коронарной (или какой-либо иной) артерии не обязательно приводит к инфаркту. Повторяющаяся ишемия миокарда способствует развитию коллатерального кровообращения и смягчает последствия внезапной окклюзии. В то же время приступ нестабильной стенокардии. инфаркт миокарда и другие острые нарушения кровообращения часто обусловлены бляшками, не создающими выраженного стеноза. На обычных ангиограммах они видны лишь как незначительная неровность контура артерии. В трети случаев первым проявлением ИБС бывает инфаркт миокарда без предшествующей стенокардии. Вероятное объяснение этому — внезапное увеличение степени стеноза.
По данным патологоанатомических исследований, нарушение кровотока обычно происходит при повреждении эндотелия, изъязвлении или разрыве бляшки. ведущих к образованию тромба. Тромб может вызвать нестабильную стенокардию или — при стойкой окклюзии — инфаркт миокарда ( рис. 242.2. Д). В случае атеросклероза сонной артерии образование тромбоцитарных тромбов в области изъязвления бляшки может вести к преходящей ишемии мозга.
При разрыве фиброзной покрышки (слоя соединительной ткани, отграничивающей атероматозные массы от просвета сосуда) фактор свертывания VII связывается с тканевым фактором. синтезируемым ксантомными клетками. и запускается процесс тромбообразования. Если тромб не вызывает окклюзию или быстро растворяется, разрыв бляшки может пройти бессимптомно или привести к стенокардии покоя ( рис. 242.2. В). Стойкая тромботическая окклюзия часто вызывает инфаркт миокарда. особенно если плохо развито коллатеральное кровообращение. Повторные разрывы и рубцевания приводят к утолщению фиброзной покрышки ( рис. 242.2. Г). Заживление в стенке артерии, как и при повреждении кожи, сопровождается образованием нового межклеточного вещества и фиброзом.
Склонность бляшек к разрыву неодинакова. Изучение бляшек. вызвавших инфаркт миокарда. выявило ряд особенностей: тонкую фиброзную покрышку. большое количество атероматозных масс и высокое содержание макрофагов ( рис. 242.2. А). Показано, что в месте разрыва преобладают макрофаги и Т-лимфоциты ( рис. 242.2. Б), но мало гладкомышечных клеток. В этих местах скапливались клетки с признаками воспалительной активации, степень которой оценивают по экспрессии антигена HLA-DR. Его экспрессия клетками сосудистой стенки в состоянии покоя незначительна, но возрастает в макрофагах и гладкомышечных клетках. локализованных в местах разрыва.
Медиаторы воспаления также регулируют прочность фиброзной покрышки (или, наоборот, склонность ее к разрыву). Интерферон гамма. выделяемый Т-лимфоцитами и стимулирующий экспрессию HLA-DR клетками в месте разрыва, подавляет деление гладкомышечных клеток и синтез ими коллагена. Цитокины активированных макрофагов ( ФНОальфа и ИЛ-1 ), а также интерферон гамма вызывают синтез протеаз, разрушающих межклеточное вещество фиброзной покрышки. Таким образом, цитокины нарушают синтез и ускоряют распад коллагена. что ослабляет фиброзную покрышку и облегчают ее разрыв. В то же время бляшки с большим количеством межклеточного вещества, толстой фиброзной покрышкой и низким содержанием атероматозных масс, как правило, не разрываются и не ведут к тромбозу ( рис. 242.2. Г).
Атеросклероз – одно из самых распространенных заболеваний
Атеросклероз является одним из самых распространенных заболеваний современного человека. У людей, не соблюдающих диету и не выполняющих регулярно физические упражнения, систематически подвергающихся стрессам, стенки артерий покрываются холестерином, разрушающим их и формирующим рубцовую ткань. Борьбу с атеросклерозом следует начинать не тогда, когда он уже имеется, а задолго до этого — со времени проявлений нейро-сосудистой дистонии. Атеросклероз развивается медленно, иногда в течение десятков лет, поражая сосудистую систему и затрудняя поступление с кровью питательных веществ к органам и тканям.
Есть 5 основных факторов, способствующих возникновению и развитию болезни.
1. Нервные нарушения, приводящие к изменению липидно-белкового равновесия.
2. Эндокринные и метаболические нарушения в организме.
3. Фактор питания (большое количество холестерина, белковых и жировых продуктов, вводимых в организм с пищей).
4. Малоподвижный образ жизни.
5. Наследственность.
Атеросклеротический процесс поражает все артерии, но в зависимости от того, в каких тканях и сосудах процесс зашел глубже, различают несколько его разновидностей: атеросклероз с преимущественным поражением сосудов головного мозга, атеросклероз коронарных сосудов, атеросклероз нижних конечностей (облитерирующий эндоартериит) и т. д.
При атеросклерозе коронарных сосудов (сердечных) появляются приступы стенокардии, т. е. боли сжимающего или давящего характера в области сердца, которые могут усиливаться как при физической нагрузке, так и в состоянии покоя. Если приступы стенокардии затягиваются надолго, может наступить омертвление участка сердечной мышцы. Это состояние называется инфарктом.
При атеросклерозе мозговых сосудов больной жалуется на головокружение, шум в голове, ослабление памяти. При закупорке мозговой артерии может произойти ее разрыв, сопровождающийся кровоизлиянием. Тогда наступает инсульт.
При поражении атеросклерозом периферических сосудов появляются такие симптомы, как сухость и морщинистость кожи, исхудание, боли в спине и пояснице, руках и ногах. Часто атеросклероз нижних конечностей ведет к гангрене и вынужденной их ампутации.
Лечение атеросклероза
— сложное, долгое и кропотливое дело. Развитие атеросклероза можно остановить, а иногда даже повернут процесс вспять, так как атеросклероз обратим на ранних стадиях. В народной медицине существует много средств, рекомендуемых при заболевании атеросклерозом. В основном они направлены на сохранение и восстановление эластичности сосудов, вывод холестерина, усиление защитных сил организма. Но нужно помнить, что борьба с заболеванием не даст эффекта и самые лучшие средства будут бесполезны пока организм зашлакован и не избавлен от токсинов. Поэтому перед тем, как начать лечение, необходимо провести очистку организма по одному из многочисленных методов очищения.
Приблизительная схема лечения больного атеросклерозом.
1. Очистить организм от шлаков.
2. Избавиться от вредных привычек.
3. Вывести из организма соли.
4. Начать лечение проросшими зерновыми ростками.
5. Отрегулировать питание, по возможности соблюдая православные посты. В мясоед основной упор делать на вегетарианские продукты питания, овощи, фрукты. Мясо есть не более 3 раз в неделю, отдавая предпочтение рыбным блюдам. Исключить из рациона кофе, уменьшить потребление сахара и соли.
6. Голодание на воде 1 раз в неделю.
7. Трехдневное голодание 1 раз в месяц.
8. Принимать травы и настои. Каждый настой менять 1 раз в два месяца.
9. Ежедневная ходьба до 3 км, закаливание, водные процедуры.
Очень важным фактором питания в рационе больных является клетчатка. Грубая растительная клетчатка (ржаной хлеб, салаты, овощи) усиливает моторную функцию кишечника, способствует выведению излишков холестерина, солей и соединений азота.
Углеводы в пище должны содержаться в значительном количестве. Их много в крупах, фруктах, овощах, хлебе, меде, варенье. Пища, богатая углеводами, улучшает работу сердца, усиливает отложение гликогена в печени, что повышает ее функциональную очистительную способность.
Жиры необходимы в пищевом рационе больного атеросклерозом, так как они содержат нужные для организма человека жирные кислоты и жирорастворимые витамины. Но к жирам нужно относиться с осторожностью и принимать их в умеренном количестве, предпочитая жиры растительного происхождения.
Больным атеросклерозом следует избегать холодных и газированных напитков, холодной пищи. Пища, принятая в холодном виде, затрудняет пищеварение. Об этом не следует забывать никому.
Многие специи и травы способствуют уменьшению количества холестерина в крови и способствуют рассасыванию атеросклеротических бляшек в сосудах. К таким специям относятся куркума, имбирь, лук, чеснок. Чеснок, кроме всего содержит микроэлемент германий, который способствует уменьшению количества холестерина в крови.
Распространенный атеросклероз в общетерапевтической практике: на пути к оптимизации тактики ведения
Фомин В.В.
Обсуждаются современные подходы к раннему выявлению доклинических маркеров распространенного атеросклероза и ведению этой категории больных. Подчеркивается, что доступные сегодня инструментальные методы ранней доклинической диагностики атеросклеротического поражения основных сосудистых бассейнов приобретают особое значение с точки зрения своевременной оптимизации терапевтической стратегии. Максимальное использование возможностей лечения подразумевает в т. ч. применение у этих больных ингибиторов АПФ и пентоксифиллина.
Доклиническая диагностика распространенного атеросклероза, осуществляемая с помощью инструментальных методов обследования, прежде всего ультразвукового исследования (УЗИ) доступных крупных артерий (стандартом является исследование общей сонной артерии – СА), представляет собой принципиально важный этап обследования больного артериальной гипертензией (АГ) высокого/очень высокого риска, метаболическим синдромом и сахарным диабетом (СД) типа 2. Констатация наличия распространенного атеросклероза, возможная сегодня в ситуации, когда типичные жалобы, определяющиеся гипоперфузией и ишемией органов, кровоснабжаемых соответствующими сосудистыми бассейнами, еще отсутствуют, принципиально важна с позиции определения рациональной тактики ведения и неизбежно влечет за собой увеличение числа назначаемых лекарственных препаратов, к числу которых наряду с антигиперлипидемическими (статины, фибраты) относятся также и антитромбоцитарные средства (ацетилсалициловая кислота, клопидорел).
Согласно общепринятым рекомендациям, в т. ч. Российского Медицинского общества по артериальной гипертензии [1], выявляемое с помощью УЗИ атеросклеротическое поражение СА, включая бессимптомное, не сопровождающееся жалобами, нередко объединяемыми термином “дисциркуляторная энцефалопатия”, рассматривают в качестве одного из вариантов поражения органов-мишеней. Признано, что, как и гипертрофия левого желудочка и/или микроальбуминурия, атеросклеротическое поражение СА может быть обратимым под действием эффективной антигипертензивной терапии и антигиперлипидемических препаратов.
Среди вариантов поражений органов-мишеней при АГ в качестве универсального признака наличия распространенного атеросклероза названы констатируемые с помощью УЗИ увеличение толщины комплекса интима-медиа (ТИМ) в СА > 0,9 мм или явная атеросклеротическая бляшка в них [1]. При клинической оценке АГ, сочетающейся с атеросклеротическим поражением СА, следует учитывать значительную вероятность наличия у подобного пациента распространенного атеросклероза, что подразумевает высокий риск сердечно-сосудистых осложнений [2]. Очевидно, что способность того или иного класса антигипертензивных препаратов тормозить увеличение ТИМ в СА могла бы стать эталонным доказательством наличия у них антиатерогенных свойств и обосновать их применение у пациентов с АГ и различными клиническими вариантами атеросклероза, в т. ч. страдающих ишемической болезнью сердца (ИБС) и/или синдромом перемежающейся хромоты (СПХ).
Общепризнанно, что пациенты с атеросклеротическим поражением СА, в частности бессимптомным, выявляемым только с помощью УЗИ, всегда характеризуются очень высоким риском сердечно-сосудистых осложнений, которые развиваются не только в бассейне церебральных артерий [3]. Данные, полученные в крупном популяционном исследовании Atherosclerosis Risk in Communities (ARIC), свидетельствуют о том, что повышение ТИМ в общей СА до величины от 0,6 до 1,0 мм сопровождается ростом частоты ИБС у мужчин в 4,3, у женщин – в 19,5 раз [4].
Именно в исследовании ARIC эпидемиология и прогностическое значение атеросклеротического поражения СА были охарактеризованы наиболее полно. При обследовании с помощью УЗИ 14 056 пациентов в возрасте от 45 до 64 лет атеросклеротическая бляшка в СА была выявлена у 34,0 % из них, причем у 6,4 % она выступала в просвет артерии, что приводило к появлению дополнительных ультразвуковых сигналов (“теней”). Четко продемонстрировано увеличение распространенности атеросклеротического поражения СА с возрастом: у 45-летних частота его не превышала 2,5 %, тогда как у лиц старше 60 лет этот показатель достигал 12,4 %. Вероятность появления атеросклеротических бляшек в СА у афроамериканцев оказалась достоверно более высокой по сравнению с белыми [5]. Установлено, что к атеросклеротическому поражению СА предрасполагают повышение сывороточных уровней общего холестерина и липопротеидов низкой плотности, в меньшей степени – АГ и курение [6]. Риск его возрастал и по мере увеличения массы тела [7]. В течение более чем 6-летнего наблюдения за исследуемой когортой было показано, что атеросклеротическое поражение СА – одна из основных детерминант ишемического инсульта. Вероятность его у женщин, у которых ТИМ в СА составляла не менее 1 мм, в 8,5 раз превосходила таковую у обследованных с ТИМ, не превышавшей 0,6 мм. При аналогичном сопоставлении у мужчин оказалось, что риск ишемического инсульта при максимальных величинах ТИМ в СА-артериях возрастает в 3,6 раза [8]. Результаты других популяционных исследований также подтверждают значение выявленного при УЗИ увеличения ТИМ в СА как маркера неблагоприятного сердечно-сосудистого прогноза [6, 7, 9]. Установлено, что атеросклеротическое поражение СА всегда указывает на распространенность атеросклероза, в т. ч. на высокую вероятность вовлечения коронарных артерий [10].
Необходимость максимально широкого, по существу скринингового, обследования на наличие атеросклеротического поражения СА особенно очевидна у представителей соответствующих групп риска (АГ, метаболический синдром, СД типа 2) и подразумевает широкое использование УЗИ. Этот метод, позволяющий своевременно, на потенциально стабилизируемом этапе выявлять распространенный атеросклероз, тем самым обосновывает применение соответствующих терапевтических стратегий, направленных на улучшение долгосрочного прогноза. Еще раз следует подчеркнуть, что обоснование необходимости УЗИ СА должен в первую очередь осуществлять именно терапевт задолго до появления у больного специфических жалоб.
Поражение магистральных артерий нижних конечностей, для обозначения которого также используют термин “атеросклеротическое поражение периферических артерий” (АППА), в клинической практике зачастую ассоциируют только с СПХ и более выраженными трофическими расстройствами, диагноз которых, как правило, не вызывает сомнения. В свою очередь ранняя стадия АППА, выявляемая по снижению величины лодыжечно-плечевого индекса (ЛПИ) менее 0,9 [1], зачастую остается своевременно нераспознанной. Необходимо подчеркнуть, что именно исходя из величины ЛПИ сегодня стратифицируют тяжесть АППА [11]: величина ее менее 0,9, как уже было сказано, указывает на ее наличие, от 0,9 до 0,7 – свидетельствует в пользу легкой, 0,69–0,50 – умеренной и
Еще в начале 1990-х гг. [13] было четко продемонстрировано, что риск смерти у пациентов с СПХ возрастает в 3,1 раза, риск смерти от сердечно-сосудистых осложнений – в 5,9 раза. Риск развития любого коронарного события в течение 10 лет у пациента с СПХ возрастает на 20 %. Снижение ЛПИ менее 0,9 удается обнаружить у 37 % госпитализированных пациентов с ИБС, у 21 % наличие СПХ является при этом клинически очевидным. Больные ИБС, имеющие АППА, отличаются достоверно большим возрастом, более интенсивным курением, достоверно чаще страдают СД и АГ, а также характеризуются более выраженной дислипопротеидемией [14].
Продемонстрировано, что снижение ЛПИ на 0,15 и более за 4 года сопряжено с увеличением риска сердечно-сосудистой смерти почти в 3 раза [15]. Исходя из данных, полученных в исследовании PIPS [16], включившем 800 больных ИБС, которым была выполнена коронароангиография, 15 % из них демонстрируют признаки ранее не распознанного АППА, частота его достигает максимума (25,2 %) у лиц старше 70 лет. АППА достоверно чаще наблюдалось у пациентов с вовлечением ствола левой коронарной артерии, а также при многососудистом типе поражения.
Популяционное исследование, включившее 8000 мужчин и женщин в возрасте от 60 до 90 лет, четко показало, что частота АППА существенно возрастает по мере увеличения возраста, составляя 7,9 % в группе от 60 до 65 лет и достигая 47,2 % в группе от 85 до 90 лет [17]. В исследовании IPSILON [18], направленном на оценку частоты ранее не распознанного АППА при ИБС, его удалось обнаружить у 26,6 % пациентов, при этом у 16,2 % отсутствовали признаки СПХ.
В эпидемиологическом исследовании ELLIPSE [19] cнижение ЛПИ менее 0,9 оказалось достоверно ассоциированным с отсутствием одного и более пульсовых ударов на тыле стопы, шумами при аускультации крупных артерий, ранее перенесенным острым инфарктом миокарда без зубца Q, курением, возрастом > 81 года, снижением клиренса эндогенного креатинина
Сегодня констатация наличия у пациента распространенного атеросклероза подразумевает обязательное назначение антигиперлипидемических препаратов, а также антитромбоцитарных средств, нередко в комбинациях (ацетилсалициловая кислота, клопидогрел). Вместе с тем признаки распространенного атеросклероза, в т. ч. выявленные при инструментальном обследовании, диктуют необходимость определенной коррекции, а также и антигипертензивной терапии. Исходя из данных экспериментальных исследований, посвященных оценке роли компонентов ренин-ангиотензин-альдостероновой системы в прогрессировании атеросклероза, ингибиторы АПФ могли бы замедлять темпы увеличения ТИМ в СА. Мишенью для действия этих препаратов является ангиотензин-превращающий фермент (АПФ), в большом количестве экспрессирующийся в атеросклеротической бляшке, преимущественно эндотелиоцитами и макрофагами [21]. Более того, с помощью специальных методов удалось показать, что в атеросклеротических бляшках, извлеченных при эндатерэктомии из СА пациентов, страдавших их окклюзирующим поражением, экспрессируется 2-я изоформа АПФ, непосредственно принимающая участие в атерогенезе. Наибольшее количество ее удалось обнаружить в клетках макрофагального ряда (в т. ч. пенистых) и на обращенной в просвет сосуда поверхности эндотелиоцитов [22]. Эти данные убедительно обосновывают попытки применения ингибиторов АПФ для торможения роста атеросклеротических бляшек, тем более что, как показано на аутопсийном материале в отношении коронарных артерий, экспрессия АПФ не только эндотелиоцитами, но и макрофагами, а также сосудистыми гладкомышечными клетками всегда ассоциирована с прогрессированием атеросклеротического поражения [23].
В одной из частей проекта HOPE – субисследовании SECURE – не удалось продемонстрировать способности витамина Е (известно, что ему длительно приписывали антиатерогенные свойства) замедлять увеличение ТИМ общей СА, но при этом было показано достоверное торможение ее прироста при применении ингибитора АПФ рамиприла (10 мг/сут) [24]. Таким образом, результаты исследования SECURE можно считать одним из первых аргументов в пользу прямого антиатерогенного действия ингибиторов АПФ, в частности рамиприла. Кроме того, в исследовании HOPE была предпринята оценка прогностического значения АППА c использованием ЛПИ. Данный индекс был определен у 8986 из 9297 включенных в исследование HOPE пациентов; у 3099 (34,5 %) его значение оказалось ≤ 0,9, что свидетельствовало в пользу наличия распространенного атеросклероза [25]. Снижение ЛПИ оказалось достоверным предиктором смерти и наступления событий, относящихся к первичной конечной точке. Сердечно-сосудистая смерть, мозговой инсульт и острый инфаркт миокарда были отмечены у 13,1 % представителей группы с ЛПИ > 0,9, у 18,2 % – с ЛПИ от 0,9 до 0,6 и у 18,0 % – с ЛПИ менее 0,6 (p
Увеличение числа лекарственных средств, назначаемых пациентам, имеющим распространенный атеросклероз, неизбежно, его не следует интерпретировать как полипрагмазию. Среди дополнительных возможностей оптимизации тактики ведения этой категории больных особого внимания заслуживает пентоксифиллин. Уже в начале 1990-х гг. [26] было установлено, что 8-недельный курс лечения пентоксифиллином сопровождается определенным улучшением самочувствия у 64 % больных СПХ, у 31 % увеличивается дистанция, преодолеваемая при ходьбе до появления перемежающейся хромоты, у 52 % уменьшается выраженность связанных с ней болей, а у 51 % исчезают ишемические боли, возникающие в покое. Сегодня пентоксифиллин по-прежнему рассматривают в ряду препаратов, назначение которых показано при СПХ [27], причем накопленный опыт его применения может быть экстраполирован на популяцию пациентов, страдающих различными формами распространенного атеросклероза, тем более что этот позитивный опыт получил в последнее десятилетие убедительное патогенетическое обоснование.
Prasad и соавт. (2007) [28] на модели распространенного атеросклероза у белых новозеландских кроликов с гиперхолестеринемией показали, что в отличие от группы, получавшей плацебо, у животных, получавших пентоксифиллин, удалось добиться уменьшения площади атеросклеротического поражения аорты на 38,1 %; одновременно пентоксифиллин снижал активность системы перекисного окисления липидов, в пользу чего свидетельствует уменьшение уровня ее маркеров – содержание малонового диальдегида в плазме крови уменьшилось на 32 %, в стенке аорты – на 37 %. Эти данные не только указывают на антиатерогенные свойства пентоксифиллина, но и косвенно свидетельствуют в пользу его способности блокировать повреждение сосудистой стенки перекисями и реактогенными субстанциями кислорода, представляющее собой один из ключевых этапов патогенеза “больших” сердечно-сосудистых осложнений. Кроме того, антиатерогенные свойства пентоксифиллина включают способность уменьшать выраженность индуцированной тромбоцитарным фактором роста пролиферации сосудистых гладкомышечных клеток и стимулированной трансформирующим фактором роста β1 продукции ими коллагена I типа – важного элемента фиброза пораженной атеросклерозом сосудистой стенки [29].
Противовоспалительные свойства пентоксифиллина, в частности его способность блокировать секрецию фактора некроза опухоли α, может приносить особую пользу больным группы максимального риска сердечно-сосудистых осложнений, в т. ч. страдающим СД типа 2. Maiti и соавт. (2007) [30] продемонстрировали, что применение пентоксифиллина в течение месяца у больных СД типа 2 с АГ позволяет достигать достоверного снижения сывороточной концентрации С-реактивного белка на 20,9 % (p
Влияние пентоксифиллина на маркеры системного воспаления было специально изучено в контролируемом исследовании, включившем 64 больных острым коронарным синдромом, рандомизированных к приему пентоксифиллина (400 мг/сут) или плацебо в течение 6 месяцев [31]. Было установлено, что пентоксифиллин достоверно уменьшал сывороточную концентрацию С-реактивного белка и фактора некроза опухоли α, а также воспалительных цитокинов (интерлейкины-10 и -12). Способность пентоксифиллина уменьшать плазменную концентрацию системных маркеров воспаления свидетельствует в пользу того, что этот препарат тормозит также реализацию воспалительных каскадов непосредственно в атеросклеротических бляшках, тем самым оказывая васкулопротективный эффект. Необходимо отметить, что при распространенном атеросклерозе пентоксифиллин, особенно его оригинальная лекарственная форма (Трентал), высокобезопасен, что позволяет применять его в комбинации с другими общепринятыми терапевтическими стратегиями, в частности со статинами [32].
Больные распространенным атеросклерозом остаются одной из наиболее трудных для ведения категорий, а их долгосрочный прогноз зачастую бывает неблагоприятным. В связи с этим доступные сегодня инструментальные методы ранней доклинической диагностики атеросклеротического поражения основных сосудистых бассейнов приобретают особое значение с точки зрения своевременной оптимизации терапевтической стратегии. Максимальное использование возможностей лечения подразумевает в т. ч. применение у этих больных ингибиторов АПФ и пентоксифиллина.