Инфаркт миокарда диафрагмальный. Диафрагмальный лоскут для лечения инфаркта миокарда. Особенности кровоснабжен
Диафрагмальный лоскут для лечения инфаркта миокарда. Особенности кровоснабжения диафрагмы
В 1954 г. Temesvari применил диафрагмальный лоскут на ножке с целью лечения экспериментального инфаркта миокарда. В первой серии опытов (10 собак) он делал сквозной дефект (окошечко) на передней стенке правого желудочка размером 3X3 см. Этот дефект он замещал выкроенным из диафрагмы лоскутом на ножке (или лоскутом из грудной мышцы), который подшивал швами к краям дефекта миокарда. Во второй серии опытов (10 собак) автор предварительно вызывал инфаркт передней стенки правого желудочка путем перевязки венечных сосудов, а затем производил иссечение сердечной мышцы в зоне ишемии (как и в первой серии опытов) с последующим замещением дефекта диафрагмальный лоскутом на ножке или лоскутом грудной мышцы.
Как в первой, так и во второй группе опытов сразу после операции на электрокардиограмме отмечалась картина острого инфаркта миокарда, а через несколько месяцев электрокардиографическая кривая приходила к норме. У 10 собак, оставшихся в живых, спустя 8—10 месяцев произведена повторная операция перевязки венечной артерии сердца. Все 10 животных хорошо перенесли операцию, на электрокардиограммах не отмечено изменений, свойственных инфаркту миокарда. Это указывало на хорошую реваскуляризацию сердечной мышцы за счет прорастания в нее сосудов мышечного лоскута.
При гистологическом исследовании у забитых или погибших от разных причин собак отмечено хорошее приживление диафрагмального лоскута к сердечной мышце и прорастание сосудов.
При плохом снабжении кровью мышечного трансплантата, что, по-видимому, зависело от погрешности операции, наблюдалось его соединительнотканное перерождение, но даже и в этом случае в месте пришитого к сердцу лоскута не наблюдалось аневризматического выпячивания.
Проведенные нами и другими авторами экспериментальные исследования и многочисленные клинические наблюдения показали, что выкроенный из диафрагмы мышечный лоскут на ножке, близкий по своему строению, иннервации и кровоснабжению к мышце сердца, прекрасно приживает к нему, укрепляет его истонченную и рубцово измененную стенку и улучшает кровоснабжение миокарда.

Во второй серии экспериментов мы изучали хирургические методы лечения аневризмы сердца. 22 собаки, перенесшие операцию создания экспериментальной аневризмы сердца, спустя 3—9 месяцев были подвергнуты вторичной операции — ликвидации аневризмы. Нами применено два метода: ушивание аневризмы путем погружения ее лоскутом диафрагмы на ножке (12 собак); резекция аневризматического мешка с последующими зашиванием и пластикой области шва лоскутом диафрагмы на ножке (10 собак). Для изучения пластических свойств диафрагмы были поставлены эксперименты на 10 собаках и проведены ангиорентгенографические исследования на 5 трупах животных.
Нас интересовало строение диафрагмы и особенно ее внутриорганное кровоснабжение, которое, как известно, играет большую роль при определении пластических качеств той или иной ткани. Внутриорганное кровоснабжение диафрагмы изучалось методом контрастной вазографии и препаровки. Наряду с этим мы изучали наиболее приемлемые способы выкраивания лоскутов диафрагмы на ножке, учитывая направление сосудов и ход мышечных волокон.
Заполнение сосудов контрастной массой с целью последующего ангиографического исследования мы производили у только что забитых животных и на нефиксированных трупах людей.
Собак забивали электротоком, после чего сразу же у них выпускали кровь путем обнажения и вскрытия бедренных вен или нижней полой вены. В брюшную аорту (ниже отхождения от нее почечных артерий) вводили стеклянную канюлю, которую укрепляли ниткой. Ниже введения канюли аорту нервязывали шелковой лигатурой. Кровяное русло промывали теплым физиологическим раствором, а затем заполняли контрастной массой (взвесь 750 г углекислого свинца в 1000 мл 4% раствора желатины).
После застывания контрастной массы диафрагму иссекали, растягивали на картоне; затем делали рентгенологические снимки.
Приведенные нами экспериментальные исследования показали, что строение и внутриорганное кровоснабжение диафрагмы собаки и человека имеют большое сходство. Данное обстоятельство позволяет считать собак наиболее подходящими животными для проведения на них опытов по выкраиванию диафрагмального лоскута и приживлению его к сердцу, а также для перенесения этих результатов исследования в известной степени на человека.
— Читать далее « Строение диафрагмы. Диафрагма как пластический материал при аневризме сердца»
Оглавление темы «Коррекция аневризмы сердца»:
1. Течение экспериментального инфаркта миокарда. Морфология некроза при инфаркте миокарда
2. Формирование постинфарктного рубца на сердце. Миомаляция при инфаркте миокарда
3. Значение состояния сердца перед инфарктом миокарда. Проводящая система сердца при инфаркте миокарда
4. Хроническая аневризма сердца. Кровоснабжение зоны инфаркта миокарда и аневризмы сердца
5. Хирургия экспериментальной аневризмы сердца. Легкое для пластики аневризмы сердца
6. Недостатки пластики сердца легким. Пластика аневризмы сердца диафрагмальными лоскутами
7. Диафрагмальный лоскут для лечения инфаркта миокарда. Особенности кровоснабжения диафрагмы
Инфаркт миокарда диафрагмальный. Занятия у больных с инфарктом миокарда. Первый месяц после инфаркта миокарда
Занятия у больных с инфарктом миокарда. Первый месяц после инфаркта миокарда
Для больных с тяжелой формой инфаркта миокарда мы применяем методику, предложенную В. Ларцевым и Л. Ворошиловой.
Авторы предлагают в первую неделю занятий проводить следующие упражнения.
1) медленный глубокий вдох через нос и выдох через рот;
2) диафрагмальное дыхание;
3) медленное сжимание пальцев в кулак и разжимание;
4) статическое дыхание с паузами 30 секунд;
5) сгибание и разгибание ног в голеностопных суставах поочередно;
6) спокойное произвольное дыхание;
7) повороты головы в стороны;
8) ротационные движения рук и ног;
9) сгибание рук в локтевых суставах одновременно;
10) сгибание рук в лучезапястных суставах поочередно.
Каждое из этих упражнений повторяется от 2 до 4— 5 раз, постепенно удлиняясь от первого дня занятий к последующим.
Начиная со 2-й недели занятий упражнения проводятся с большей нагрузкой и не только лежа, но и сидя.
1) лежа: сгибание и разгибание рук в локтевых суставах с напряжением;
2) динамическое дыхание в сочетании с движениями РУк;
3) сгибание и разгибание кистей и стоп поочередно;
4) статическое дыхание;
5) переход в положение сидя (с помощью методиста); при этом лежа больной делает вдох, поднимаясь — выдох; это упражнение проводится один раз в день;
6) сидя: руки сгибать в локтевом суставе, кисти к подбородку; затем руки разводить до уровня плеч;
7) стопа соприкасается с полом; делается «перекат» стопы с пяток на носки без напряжения;
8) больной ложится; лежа на спине делается прогиб кверху в грудном отделе позвоночника;
9) поднимание и опускание таза (ноги согнуты в коленях; упор на локтях и стопах);
10) сгибание и разгибание ног в коленных суставах попеременно;
11) динамическое дыхание;
12) диафрагмальное дыхание.
Количество этих упражнений. как и в первой неделе. Начиная с 3-й недели больной переходит к упражнениям, связанным с ходьбой.
1) сидя проводится динамическое дыхание;
2) упражнение «ходьба сидя»;
3) спокойное статическое дыхание;
4) правильно встать — сесть — встать;
5) ритмированная ходьба по коридору на 30—40 м: на 3 шага вдох, на 5 — выдох.
После этих упражнений больной отдыхает сначала сидя, а затем лежа. Но надо иметь в виду, что в зависимости от реакции сердечно-сосудистой системы эти упражнения видоизменяются во времени и по объему.
В благоприятных случаях на электрокардиограмме после нагрузки быстрее восстанавливаются изменения интервала S—Т и зубца Т, что указывает на уменьшение проявлений ишемии в сердечной мышце под влиянием лечебной гимнастики. По данным М. А. Восканова (ЦИУВ) и по нашим наблюдениям, лечебная гимнастика в благоприятных случаях приводит к укорочению фазы изометрического напряжения (период R—Н) и удлинению фазы изгнания (H—К.) баллистокардиограммы. Отношение фазы изгнания к фазе изометрического напряжения М. С. Вовси назвал внутрисистолическим коэффициентом (ВК).
Следовательно, увеличение ВK — положительный показатель увеличения систолического объема крови под влиянием физической нагрузки, а уменьшение ВК — отрицательный показатель.
Методика применения лечебной физкультуры у больных с аневризмой сердца примерно такая же, как при тяжелой форме инфаркта миокарда (С. В. Шестаков, А. Федосеев, А. Лепорский, В. Ларцев, Л. Ворошилова, А. А. Возилло и др.), но имеет и свои некоторые особенности.
Эти особенности, по мнению А. Пантелеевой. следующие:
1) более длительное занятие в положении лежа;
2) в первые дни занятий делаются только пассивные движения, ограниченные по амплитуде;
3) медленный темп упражнений;
4) более поздние сроки перехода к повороту на бок, в положение сидя, стоя и ходьба.
Оглавление темы «Лечение аневризмы сердца и инфаркта миокарда»:
1. Пример реабилитации при аневризме сердца. Пример течения аневризмы сердца
3. Режим при аневризме сердца. Режим больного с инфарктом миокарда
Книга: Инфаркт миокарда
III. Осложнения инфаркта миокарда Острая недостаточность кровообращения
Нарушения ритма и проводимости сердца у больных острым инфарктом миокарда
Нарушения ритма и проводимости — самое частое осложнение острого ИМ. По данным мониторного наблюдения ЭКГ, в остром периоде те или иные нарушения ритма отмечаются более чем у 90% больных. Нарушения ритма сердца — не только частое, но и опасное осложнение. До внедрения в клиническую практику принципов интенсивного наблюдения коронарных больных аритмии были непосредственной причиной смерти не менее чем в 40% летальных исходов у госпитализированных больных. На догоспитальном же этапе нарушения ритма сердца являются причиной смерти в значительном большинстве случаев.
Частота нарушений ритма в разные периоды ИМ неодинакова. Это особенно справедливо для таких тяжелых форм, как желудочковая тахикардия, фибрилляция желудочков, предсердно-желудочковая блокада. Аритмии чаще развиваются в остром периоде заболевания, особенно в первые часы после начала ангинозного приступа. Нередко наблюдаются множественные нарушения ритма и проводимости. Обычно они очень нестабильны, хаотично сменяют друг друга, могут на короткое время (минуты, часы) исчезнуть, а затем-, иногда без очевидной причины, возникнуть вновь. Это создает чрезвычайно изменчивую, мозаичную картину сердечного ритма в остром периоде ИМ. Важно отметить, что в разные периоды заболевания одни и те же нарушения ритма могут по-разному реагировать на медикаментозную терапию. Причину такой нестабильности следует искать в очень динамичных морфологических, метаболических и гемодинамических изменениях, развивающихся при острой коронарной недостаточности.
Острый ИМ вызывает комплекс изменений, которые тем или иным путем могут участвовать в развитии аритмий. Это: 1) образование участков некроза миокарда; 2) появление участков миокарда с ишемией различной степени; 3) изменения метаболизма миокарда непораженных участков в связи с изменениями условий их функционирования; 4) многообразные нейрогуморальные влияния на миокард в ответ на острую коронарную недостаточность и развитие некроза миокарда; 5) влияние измененной в результате ИМ центральной и периферической гемодинамики. Особую группу причин нарушения ритма у больных ИМ представляют ятрогенные воздействия (в первую очередь медикаментозные).
Ишемия, потеря клетка калия и повышение его концентрации во внеклеточной жидкости, другие водно-электролитные нарушения, ацидоз, гиперкатехоламинемия, повышение концентрации свободных жирных кислот и прочее обусловливают изменение электрофизиологических свойств миокарда, в первую очередь его возбудимости и проводимости. Отдельные участки миокарда, отдельные его волокна и даже отдельные участки волокон могут подвергнуться патологическим воздействиям различной выраженности и по-разному изменять свои электрофизиологические свойства. В частности, это приводит к тому, что во многих, нередко соседних участках миокарда процесс реполяризации (восстановление возбудимости) протекает неодинаково. В результате в какой-то момент одни участки миокарда уже способны возбудиться, получив соответствующий импульс, а другие еще не готовы к этому. В определенных "условиях создаются такие комбинации/ участков сердца, непосредственно соприкасающихся, но находящихся в разной степени готовности к восприятию возбуждения, которые обеспечивают длительную непрерывную циркуляцию по ним волны/возбуждения (см. Лечение аритмий). Это так называемый феномен повторного входа волны возбуждения («re-entry»). По современным представления?/, такой механизм лежит в основе многих нарушений ритма. Феномен «повторного входа волны возбуждения»— лишь один из механизмов патогенеза аритмий при острой коронарной недостаточности. В реальных условиях они значительно более многообразны. В частности, пароксизм желудочковой тахикардии может быть вызван появлением очага патологической эктопической активности, вырабатывающего импульсы возбуждения с частотой большей, чем физиологический водитель ритма — синусовый узел.
Необходимо обратить внимание на два факта, имеющих существенное практическое значение:
энергия импульса, которая может вызвать пароксизм желудочковой тахикардии в ишемизированном сердце, значительно ниже, чем в нормальном сердце. Практически для возникновения приступа в этих условиях может быть достаточно одной экстрасистолы;
нарушения ритма, особенно фибрилляция желудочков, при прочих равных условиях значительно чаще развиваются при гипертрофии сердца.
Влияние, оказываемое нарушениями ритма сердца на организм, многообразно. Особенно важны изменения гемодинамики npw аритмиях. Они наиболее выражены при резком ускорении, либо, наоборот, замедлении сердечного ритма. Так, при тахиаритмиях укорочение периода диастолы ведет к резкому уменьшению ударного объема, который обычно не компенсируется увеличением/частоты сердечных сокращений. Это приводит к существенному падению минутного объема. Важным фактором, влияющим при аритмиях на величину ударного объема, представляется и нарушение нормальной последовательности сокращения миокарда под /влиянием импульсов из эктопического фокуса. Существенна роль нарушения координации работы предсердий и желудочков при некоторых нарушениях ритма. Так, при мерцательной аритмии нагнетательная функция предсердий сводится к нулю. Практически неэффективна их работа при желудочковой тахикардии и в некоторых других случаях.
У больных ИМ функциональная способность сердца существенно нарушается, компенсаторные возможности сердечно-сосудистой системы резко снижены. В этих условиях влияние аритмий на гемодинамику оказывается еще более резким; если недостаточность кровообращения при нормальном ритме была скрытой, то на фоне аритмии она может проявиться, а если была умеренно выраженной — то резко усугубиться. Аритмии, протекающие со значительным изменением частоты сердечных сокращений, у больных ИМ нередко приводят к развитию острой недостаточности кровообращения. Е. И. Чазов и соавт. (1970), И. Е. Ганелинаи соавт. (1970) даже выделяют особую аритмическую форму кардиогенного шока, когда на фоне аритмий (например, желудочковой или наджелудочковой тахикардии, поперечной блокады сердца) развивается типичная клиническая картина шока со снижением АД, нарушением периферической циркуляции, резким уменьшением диуреза. Точно так же можно говорить о нарушениях ритма как причине развития отека легких. Характерная особенность острой «аритмической» недостаточности кровообращения заключается в том, что она не поддается практически никакому лечебному воздействию до тех пор, пока не восстановлен ритм или частота сокращений желудочков не войдет в пределы физиологической нормы. Соответственно в значительном большинстве случаев бывает достаточно нормализации ритма или хотя бы частоты желудочковых сокращений (как, например, при электростимуляции сердца или лечении мерцания предсердий сердечными гликозидами), чтобы значительно уменьшились и даже практически исчезли все клинические проявления недостаточности кровообращения.
Кроме отрицательного влияния на гемодинамику, аритмии создают предпосылки для развития остановки сердца. При пароксизмальных тахикардиях сердце работает в очень «невыгодных» условиях: при высокой частоте сердцебиения значительно возрастает потребность миокарда в кислороде, а коронарный кровоток из-за снижения перфузионного давления и укорочения диастолы не только не увеличивается, но и значительно падает. Несоответствие между потребностью миокарда в кислороде и его поступлением, которое наблюдается и при острой коронарной недостаточности, еще более усугубляется. Это способствует прогрессированию электрофизиологической негомогенности миокарда и создает благоприятные условия для проявления электрической нестабильности сердца. В итоге под влиянием комплекса факторов повышается вероятность развития фибрилляции желудочков. Она особенно высока при желудочковой тахикардии.
Брадиаритмии тоже способствуют возникновению фибрилляции желудочков, так как и они увеличивают гипоксию миокарда из-за уменьшения коронарного кровотока. Важно отметить, что при брадикардии создаются благоприятные условия для проявления активности патологических эктопических очагов, в частности желудочковой экстрасистолии — важного пускового механизма фибрилляции желудочков.
Аритмии при остром ИМ имеют неодинаковую клиническую значимость. Одни из них протекают относительно благоприятно и существенно не влияют на прогноз. Другие значительно ухудшают состояние больного. На этой основе некоторые авторы делят все аритмии на «доброкачественные» и «злокачественные». В какой-то степени такое деление оправдано, так как предопределяет медицинскую тактику: «злокачественные» нарушения ритма (например, желудочковая тахикардия, фибрилляция желудочков) требуют немедленного энергичного лечения; при «доброкачественных» аритмиях можно наблюдать за естественным развитием событий. Следует подчеркнуть условность выделения «доброкачественных» аритмий. Например, КП-Пр (1974) относит к ним наджелудочковые тахиаритмии, в том числе трепетание предсердий. Однако наш клинический опыт показывает, что нередко пароксизм трепетания предсердий приводит к резкому нарастанию недостаточности кровообращения и по тяжести гемодинамических последствий может быть поставлен сразу после желудочковой тахикардии.
Более оправданы классификации, построенные на основе патофизиологических особенностей тех или иных нарушений ритма. Lown и соавт. (1967) различают: 1) аритмии электрической нестабильности ( желудочковая экстрасистолия, желудочковая тахикардия); 2) аритмии, которые потенциально могут способствовать электрической нестабильности (синусовая брадикардия, узловые экстрасистолы, узловые ритмы, предсердно-желудочковая блокада); 3) аритмии, возникновение которых тесно связано с сердечной недостаточностью (синусовая тахикардия, мерцание и трепетание предсердий, узловая или предсердная тахикардия); 4) аритмии, отражающие глубокие нарушения электрофизиологических свойств сердца (фибрилляция желудочков, асистолия). С клинической точки зрения, такое деление тоже далеко не безупречно, но оправдывается тем, что каждая из этих групп аритмий (за исключением последней) требует во многом сходного лечения.
В отечественной литературе нередко используется деление аритмий по области их возникновения, частоте сокращений желудочков. Отдельно рассматриваются нарушения проводимости. Для систематического изложения вопроса в практических целях эти принципы представляются достаточно оправданными и удобными.
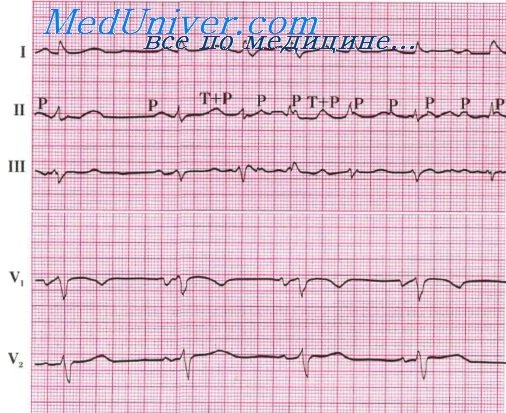
Синусовая тахикардия, строго говоря, не является нарушением ритма, но обычно рассматривается в этой группе осложнений. Диагностика ее не представляет трудностей. Нет единой точки зрения о минимальной частоте, при которой можно определить ритм как синусовую тахикардию. Если за такую частоту принять 100 в минуту, то синусовая тахикардия определяется у 25—30% больных крупноочаговым ИМ. Следует помнить, что о синусовой тахикардии говорят на основании частоты предсердных сокращений. Так, синусовая тахикардия может диагностироваться и у больного с полной поперечной блокадой и числом желудочковых сокращений менее 30 в минуту, если частота сокращений предсердий при этом превышает 100 в минуту.
Обычно в основе синусовой тахикардии при остром ИМ лежит сердечная недостаточность. Тем не менее ее могут обусловить и другие причины: повышение температуры, перикардит, тромбэндокардит, ишемическое поражение синусового узла, эмоциональное напряжение, некоторые препараты (атропин, стимуляторы р-адренергических рецепторов). Следует помнить и о такой причине синусовой тахикардии, как массивное внутреннее кровотечение — нередкое осложнение острого ИМ, особенно при использовании антикоагулянтов. Синусовая тахикардия не всегда ощущается больным. В случаях, когда синусовая тахикардия является симптомом сердечной недостаточности, наличие ее в течение нескольких дней служит плохим прогностическим признаком.
Предсердная экстрасистолия, предсердная пароксизмальная тахикардия, мерцание и трепетание предсердий — группа аритмий, которые обычно возникают вследствие ИМ, сердечной недостаточности, гипокалиемии и реже — передозировки сердечных гликозидов. Однако в основе их развития может лежать и образование фокусов некроза в миокарде предсердий, которое наблюдается не только при инфаркте предсердий, но и при инфаркте желудочков сердца [Вихерт А. М. и др. 1974]. Поэтому было бы неправильным, ориентируясь на классификацию Lown, использовать для лечения этой группы аритмий только меры, направленные на компенсацию кровообращения, и отказываться от применения собственно антиаритмических препаратов. Наиболее частые причины узловых тахикардии (тахикардия из области предсердно-желудочкового соединения) — передозировка дигиталиса и гипокалиемия.
Предсердная экстрасистолия определяется у 20—25% больных острым ИМ. Она не всегда ощущается больными и мало влияет на течение заболевания, но может быть предвестником других наджелудочковых аритмий, в том числе мерцания и трепетания предсердий. Электрокардиографическая диагностика в большинстве случаев проста. Затруднения могут возникнуть, если на исходной ЭКГ имеются нарушения внутрижелудочковой проводимости, например блокада одной из ножек предсердно-желудочкового пучка, и в том случае, если преждевременный импульс возбуждения придет к желудочкам ранее, чем завершится их реполяризация; это тоже может обусловить уширение и деформацию комплекса QRS. Некоторую помощь в дифференциальной диагностике оказывает анализ других признаков наджелудочковых и желудочковых экстрасистол (наличие компенсаторной паузы и т. п.), направленности начальных отклонений в нормальном и экстрасистолическом комплексе и пр. Наиболее точно дифференциальная диагностика наджелудочковой и желудочковой экстрасистол (как и вообще наджелудочковых и желудочковых ритмов) может быть осуществлена при регистрации электрической активности проводящей системы сердца (см. ниже). Если причиной возбуждения желудочков является наджелудочковый импульс, то на электрограмме проводящей системы желудочковому комплексу предшествует отклонение Н, обусловленное возбуждением предсердно-желудочкового ствола.
Не следует забывать и о возможности ранних предсердных экстрасистол, которые возникают столь быстро после предыдущего сокращения сердца, что застают предсердно-желудочковое соединение еще в состоянии рефрактерности и поэтому не проводятся к желудочкам. Естественно, что на ЭКГ вслед за предсердным сокращением нет желудочкового комплекса. Предсердное отклонение при этом обычно накладывается на зубец Т предыдущего цикла и поэтому может быть плохо различимо. Необходимо дифференцировать ранние предсердные экстрасистолы с синоаурикулярной, предсердно-желудочковой блокадой и некоторыми другими нарушениями ритма.
Пароксизмальная предсердная тахикардия — относительно редкое осложнение острого ИМ. По нашим данным, она встречается у 2—3% больных, причем более чем у половины в виде коротких (до 20) следующих друг за другом сокращений сердца — приступов. Короткие приступы могут протекать незаметно для больного, но при затяжных приступах обычны жалобы на сердцебиение и слабость. Возможно развитие ангинозного приступа. При физикальном исследовании выявляются ритмичное сердцебиение с частотой 140—220 в минуту, снижение АД, бледность, потливость и другие признаки ухудшения периферического кровообращения. Уменьшение минутного объема сердца может усугубить сердечную недостаточность: усилить одышку, явления застоя в малом и большом круге и пр.
Диагноз предсердной тахикардии уточняется по ЭКГ, на которой в большинстве случаев определяется измененный предсердный зубец Р, после которого с интервалом, мало отличающимся от нормы, следует комплекс QRS обычной «наджелудочковой» формы, т. е. по виду мало отличающийся от нормального. Характерный признак наджелудочковых пароксизмальных тахикардии — строгая регулярность желудочковых сокращений (интервалы R—R одинаковы по длительности). В некоторых случаях диагностика затруднена, так как предсердный зубец плохо различим, а форма комплекса QRS может меняться по тем же причинам, что и при предсердных экстрасистолах (см. выше). Зубец Р обычно имеет наибольшую амплитуду в отведениях II, Vi_2. Если же его нельзя отчетливо выделить на стандартной ЭКГ, то используют специальные отведения: внутриполостные или внутрипищеводные. Суть метода сводится к тому, что электрод подводится как можно ближе к предсердию или непосредственно контактирует с ним. При таком отведении регистрируется прежде всего потенциал предсердий, причем предсердное отклонение становится сравнимым по амплитуде с желудочковым, а нередко и большим.
Для записи отведения из полости предсердий можно использовать стандартные электроды для электростимуляции сердца, которые присоединяются к проводу грудного отведения или любого отведения от конечностей. Другой вариант методики регистрации внутриполостного отведения применение с этой целью пластиковых катетеров для в/в вливаний лекарств и взятия проб крови, которые широко используются в отделениях интенсивной терапии любого профиля. Обычно такой катетер вводят пункционно в подключичную вену и продвигают на 15—20 см. Если ввести его немного дальше — на 20—25 см, то его конец попадает в правое предсердие. Катетер заполняют токопроводящим раствором (обычно гипертонический раствор NaCl) — и зонд для регистрации внутриполостного отведения готов. Остается лишь присоединить его к соответствующему проводу электрокардиографа и зарегистрировать кривую.
Такая же ЭКГ может быть получена и при использовании пищеводного отведения, для регистрации которого зонд с электродом на конце (это может быть тот же электрод для электростимуляции сердца) проводится в пищевод до уровня правого предсердия (около 30 см от уровня зубов). Существенный минус этого метода — раздражение задней стенки глотки и корня языка, вызывающее у ряда больных рвотный рефлекс. По той же причине не удается оставить зонд, введенный в пищевод, на более длительный срок.
Некоторые преимущества имеет способ введения зонда в пищевод через носовые ходы. В общем же регистрация отведения ЭКГ из полости предсердия приносит больному меньше беспокойства, чем из пищевода. Регистрация предсердных или пищеводных отведений — один из наиболее полезных приемов дифференциальной диагностики аритмий.
Выявление предсердных зубцов ЭКГ в стандартном отведении в ряде случаев значительно облегчается при надавливании на каротидный синус (раздражение блуждающего нерва, урежение желудочковых сокращений). Однако мы избегаем этого метода как для диагностики, так и в лечебных целях в связи с тем, что у больных острым ИМ он чреват нежелательными последствиями.
Особую форму представляет собой пароксизмальная наджелудочковая тахикардия с предсердно-желудочковой блокадой, при которой нарушается проведение частых эктопических предсердных импульсов к желудочкам. При нормализации ритма блокада, как правило, исчезает даже в тех случаях, когда частота сокращений предсердий не намного ниже наблюдавшейся во время пароксизма. Степень предсердно-желудочковой блокады может быть различной. Чаще наблюдается форма, при которой на два предсердных сокращения приходится одно желудочковое. Выраженность нарушений гемодинамики и прочие клинические симптомы во многом зависят от частоты желудочковых сокращений.
Не менее чем в половине случаев наджелудочковая тахикардия с предсердно-желудочковой блокадой — следствие передозировки сердечных гликозидов, особенно в условиях гипокалиемии.
Наиболее сложна дифференциальная диагностика пароксизмальной наджелудочковой тахикардии, сочетающейся с предсердно-желудочковой блокадой, и трепетания предсердий. Основные различия: 1) при пароксизмальной наджелудочковой тахикардии с предсердно-желудочковой блокадой частота предсердных зубцов редко превышает 200 в минуту, а при трепетании предсердий в среднем составляет 280—320 в минуту; 2) при пароксизмальной наджелудочковой тахикардии с предсердно-желудочковой блокадой в одном или нескольких стандартных отведениях ЭКГ между двумя зубцами Р регистрируется изоэлектрическая линия, при трепетании же предсердий — характерная пилообразность; 3) введение солей калия часто снимает пароксизм наджелудочковой тахикардии с предсердно-желудочковой блокадой, при трепетании предсердий оно обычно не оказывает такого действия.
Трепетание предсердий встречается у З— 5% больных острым ИМ. При трепетании предсердия сокращаются с очень высокой частотой (250—350 в минуту и более). В большинстве случаев предсердно-желудочковый узел не может провести к желудочкам каждый импульс, поэтому соотношение между частотой сокращения предсердий желудочков обычно составляет 2 :1, 3. 1 и т. д.
Трепетание предсердий — весьма опасное нарушение ритма при ИМ, так как значительно нарушает гемодинамику и часто служит причиной развития отека легких или «аритмического» шока. Трепетание предсердий может привести к тяжелым нарушениям кровообращения и в тех случаях, когда частота желудочковых сокращений относительно невелика (100—ПО в минуту).
Самочувствие большинства больных на фоне трепетания предсердий значительно ухудшается. Их жалобы, данные физикального исследования, а также природа этих симптомов аналогичны описанным при пароксизмах наджелудочковой тахикардии.
Диагноз ставят на основании ЭКГ, на которой в одном или нескольких отведениях имеется характерная «пилообразность» изоэлектрической линии. Она легче различима при большом соотношении между частотой предсердий и желудочков, а также в случаях так называемой неправильной формы трепетания предсердий, при которой меняется проводимость предсердно-желудочкового узла, а следовательно, и соотношение между числом предсердных и желудочковых комплексов. Если «пилообразность» маскируется часто следующими зубцами QRS и Г, в качестве дополнительного диагностического приема рекомендуется записать пищеводное или внутриполостное отведение ЭКГ.
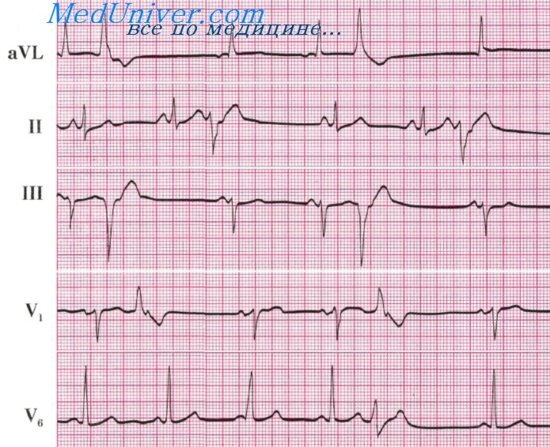
Мерцание предсердий (мерцательная аритмия) — одно из наиболее частых нарушений ритма при остром ИМ. Его можно наблюдать не менее чем у 15% госпитализированных больных (рис. 10).
Рис. 10. Острый диафрагмальный инфаркт миокарда левого желудочка. Мерцание предсердий, нарушения внутрижелудочковой проводимости, затрудняющие электрокардиографическую диагностику, имеют преходящий характер: в комплексах, которым предшествуют более длительные диастолические интервалы, проводимость восстанавливается, что позволяет уточнить наличие очаговых изменений и их локализацию.
Клинические наблюдения показывают, что мерцательная аритмия чаще всего возникает у больных, имеющих выраженную недостаточность сердца. При этом значительно повышается давление в предсердиях, что и способствует развитию этой аритмии. Косвенное подтверждение такой гипотезы — случаи нормализации ритма при улучшении гемодинамики. Вместе с тем далеко не всегда удается проследить четкую взаимосвязь между степенью сердечной недостаточности и появлением мерцательной аритмии. Очевидно, что в ее основе могут лежать и другие причины, в частности очаги некроза и дистрофии в предсердиях.
Длительность пароксизмов различна: от нескольких секунд до нескольких суток. В ряде случаев они многократно повторяются, но нередко бывает лишь один более или менее длительный эпизод мерцания предсердий. Мерцательная аритмия, возникающая в остром периоде ИМ, редко переходит в постоянную форму.
Тяжесть клинических проявлений определяется не только длительностью пароксизма, но и в значительной степени частотой желудочковых сокращений, которая в зависимости от состояния предсердно-желудочкового узла может колебаться от 40—50 до 150— 180 в минуту и выше. При прочих равных условиях чем больше частота сокращений желудочков, тем выраженнее нарушения гемодинамики и соответствующие им симптомы. Как правило, при тахикардитической форме мерцательной аритмии наблюдается значительный дефицит пульса, достигающий у некоторых больных 50% и более. Обычно при одной и той же частоте желудочковых сокращений трепетание предсердий приводит к более тяжелым нарушениям кровообращения, чем мерцание. Тем не менее появление мерцательной аритмии—неблагоприятный прогностический признак: летальность в группе больных с мерцательной аритмией составляет 22—25%, а при неосложненном течении заболевания среди госпитализированных не превышает 7—8%. Для сравнения укажем, что при стойкой синусовой тахикардии прогноз хуже, чем при мерцательной аритмии: больничная летальность составляет 30—35%, а по некоторым данным, — до 50%. Есть веские основания считать, что более высокая летальность у больных с мерцательной аритмией обусловлена не самим нарушением ритма, а контингентом больных: как правило, это пожилые лица с заболеванием сердечно-сосудистой системы в анамнезе и более обширными поражениями миокарда.
С высокой степенью вероятности мерцание предсердий может быть диагностировано на основании аускультации сердца. Электрокардиографическая диагностика обычно не вызывает затруднений даже на фоне сопутствующего нарушения внутрижелудочковой проводимости.
Узловая пароксизмальная тахикардия по происхождению, диагностике и клиническому значению во многом соответствует предсердной наджелудочковой тахикардии (см. выше).
Синусовая брадикардия диагностируется, когда имеет место синусовый ритм с частотой менее 60 в минуту. Она наблюдается у 20—30% больных в остром периоде, причем более характерна для первых часов заболевания: в первые 2 ч от начала ангинозного приступа синусовую брадикардию можно зарегистрировать почти у половины больных. Синусовая брадикардия чаще наблюдается при ИМ задней (нижней) стенки левого желудочка, так как причина заднего инфаркта — это обычно тромбоз правой коронарной артерии, от которой в большинстве случаев отходят веточки, снабжающие синусовый узел. Ишемия синусового узла ведет к снижению его функции, выражающемуся, в частности, в виде синусовой брадикардии. Кроме синусовой брадикардии, поражение синусового узла может приводить к синоаурикулярной блокаде, к его остановке. В большинстве случаев при этом не происходит асистолии желудочка, так как начинают функционировать водители ритма второго порядка. Такие нарушения, как ускоренный желудочковый ритм, пароксизмальные наджелудочковые тахиаритмии, могут быть проявлением снижения функции синусового узла. Об этом же может говорить и нестойкость результатов кардиоверсии при наджелудочковых аритмиях, в частности при мерцании предсердий. В последнее время проявления функциональной недостаточности синусового узла объединяют под названием «синдром слабости синусового узла» (sick sinus syndrom) (рис. 11). Кроме ишемического поражения, причиной появления синусовой брадикардии могут быть рефлекторные влияния (например, в ответ на боль) и некоторые медикаментозные воздействия (сердечные гликозиды, морфин). Нередко проявления синдрома слабости синусового узла отмечаются после электроимпульсной терапии.
В большинстве случаев синусовая брадикардия хорошо переносится больными. Однако при обширных ИМ, когда сократительная способность левого желудочка существенно снижается, она может обусловить падение минутного объема, усугубить явления недостаточности кровообращения. Другое нежелательное последствие синусовой брадикардии, как и любой брадикардии у больных ИМ,— это проявление патологической эктопической активности (например, желудочковой экстрасистолии), которое потенциально опасно переходом в фибрилляцию желудочков. Впрочем, есть основания считать, что опасность развития эктопических аритмий и фибрилляции желудочков на фоне брадикардии в предыдущие годы преувеличивалась. Это относится как к синусовой брадикардии, так и к другим формам брадикардии, например при полной поперечной блокаде сердца (см. ниже).
Желудочковая экстрасистолия — самое частое нарушение ритма при остром ИМ (у 90—95% госпитализированных). В большинстве случаев относительно редка: 1—2 экстрасистолических сокращения на 100 нормальных и даже реже. Даже более частые экстрасистолы редко приводят к ухудшению гемодинамики и далеко не всегда вызывают неприятные субъективные ощущения у больных. Опасность желудочковой экстрасистолии заключается в том, что иногда она является предвестником таких тяжелых нарушений ритма, как желудочковая тахикардия и фибрилляция желудочков.
Диагноз экстрасистолии может быть поставлен на основании определения пульса и аускультации сердца, а уточняется электрокардиографически. Для желудочковых экстрасистол характерны следующие признаки:
преждевременное возникновение комплекса QRS;
отсутствие зубца Р перед комплексом QRS; 3) уширение и значительная деформация экстрасистолического комплекса QRS, который по форме существенно отличается от комплекса QRS в нормальных циклах; 4) зубец Т в экстрасистолическом комплексе обычно направлен в противоположную от QRS сторону; 5) после желудочковой экстрасистолы выявляется компенсаторная пауза. Суммарная длительность интервалов от зубца Р предыдущего нормального комплекса до зубца Р первого нормального после экстрасистолы равна двум интервалам R—R.
Более высока вероятность желудочковой тахикардии и фибрилляции желудочков, если: 1) желудочковые экстрасистолы появляются очень часто (10 и более в минуту), 2) имеется политопная экстрасистолии,
3) наблюдается групповая экстрасистолия. Считается, что особенно опасны в прогностическом отношении ранние желудочковые экстрасистолы, наступающие в так называемый ранимый период желудочков.
«Ранимый» период в сердечном цикле был обнаружен Wiggers и Wegria (1940), которые нашли, что стимул определенных параметров, нанесенный в это время, приводит к развитию фибрилляции желудочков. На ЭКГ «ранимый» период соответствует восходящему колену и вершине зубца Т. Smirk и Palmer (1960) впервые обратили внимание на потенциальную опасность желудочковых экстрасистол, возникающих в это время. Феномен получил название экстрасистол типа «R на 7». Lown и соавт. (1967) предложили для определения «ранних» экстрасистол вычислять соотношение между длительностью интервала от зубца Q нормального комплекса до R экстрасистолического и интервалом QT нормального комплекса (соотношение QRIQT). Если это отношение составляет 0,60—0,85, то следует ожидать желудочковой тахикардии и фибрилляции желудочков. Следует отметить, что в настоящее время положение об особо неблагоприятном прогностическом значении желудочковых экстрасистол типа «R на Г» подвергается сомнению [Мазур Н. А. и др. 1979, и др.].
Желудочковая тахикардия — один из самых тяжелых и прогностически неблагоприятных видов нарушения ритма при остром ИМ. Как показали мониторные наблюдения за ритмом сердца, желудочковая тахикардия встречается не менее чем у 15—20, а по некоторым данным, — у 25—30% госпитализированных больных.
Под желудочковой тахикардией понимают ряд следующих одно за другим с частотой не менее 120 в минуту сокращений сердца желудочкового происхождения. Строго говоря, нет четкой границы между групповой желудочковой экстрасистолией и пароксизмом желудочковой тахикардии. Обычно считают, что если имеются три или более таких сокращения, то это пароксизмальная желудочковая тахикардия. Частота желудочковых сокращений при желудочковой тахикардии колеблется чаще всего от 140 до 220 в минуту, иногда достигает и 300 в минуту. На ЭКГ пароксизм желудочковой тахикардии выглядит как следующие друг за другом желудочковые экстрасистолы, исходящие из одного источника и поэтому имеющие одинаковую форму. Интервалы R—R между соседними комплексами могут быть не строго одинаковыми. Это характерный признак желудочковой тахикардии, отличающий его от пароксизмальной наджелудочковой тахикардии. Другой часто встречающийся электрокардиографический признак желудочковой тахикардии, помогающий в дифференциальной диагностике желудочковой тахикардии и наджелудочковых тахикардии с нарушенной внутрижелудочковой проводимостью, — это независимое, обычно происходящее в значительно более низком ритме появление предсердной волны Р. Если она плохо выявляется на стандартной ЭКГ, то можно использовать пищеводные или внутриполостные отведения (см. выше). В последнее время показано, что наиболее точный метод дифференциальной диагностики желудочковых и наджелудочковых аритмий — регистрация электрической активности проводящей системы сердца. Поставить диагноз желудочковой тахикардии на основании физикального исследования, например, используя такой ее отличительный признак, как меняющаяся в отличие от других тахиаритмий звучность тонов сердца, трудно, да в этом и нет необходимости, если принять во внимание неоспоримые преимущества электрокардиографической диагностики.
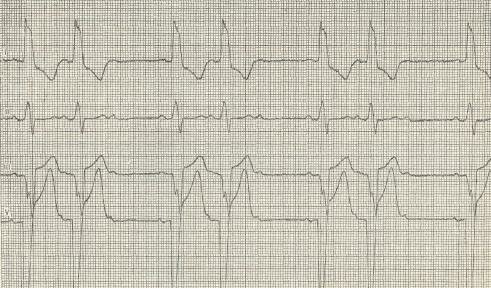
От истинной желудочковой тахикардии следует отличать так называемую медленную желудочковую тахикардию или ускоренный идиовентрикулярный ритм, при котором происходит сокращение сердца под влиянием эктопических импульсов из желудочков с частотой 60—100 в минуту. Этот вид аритмии обычно непродолжителен (длительность пароксизма чаще всего не превышает 30 с), не вызывает недостаточности кровообращения и не переходит в фибрилляцию желудочков. Такие пароксизмы обычно возникают на фоне синусовой брадикардии или предсердно-желудочковой диссоциации. Отмечаются у 15—20% больных острым ИМ (рис. 11).
Рис. 11. «Медленная желудочковая тахикардия» у больного острым инфарктом миокарда в диафрагмальной области левого желудочка, развившаяся на фоне синусовой брадикардии и периодов узлового ритма — синдрома слабости синусового узла. Мониторное отведение ЭКГ (аналог II стандартного). Сверху вниз запись непрерывная. Отметка времени 1 с. Частота сердечных сокращений во время пароксизма тахикардии 88 в 1 мин.
Даже короткие пароксизмы желудочковой тахикардии опасны, так как чреваты переходом в фибрилляцию желудочков. Более длительные приступы обычно обусловливают появление тяжелой недостаточности кровообращения, которая бывает более выраженной и развивается быстрее, чем при любой другой тахикардии с соответствующим числом желудочковых сокращений. Желудочковая тахикардия — самая частая причина «аритмической» формы шока. При желудочковой тахикардии отмечаются серьезные нарушения не только общей, но и регионарной гемодинамики. Например, на фоне приступа могут наблюдаться глубокие нарушения сознания, судороги как проявление недостаточности мозгового кровообращения. Желудочковая тахикардия часто сопровождается появлением ангинозных болей, что объясняется как увеличением потребности миокарда в кислороде, так и ухудшением коронарного кровотока. Развивающаяся при этом общая гипоксия миокарда создает дополнительные предпосылки для перехода желудочковой тахикардии в фибрилляцию желудочков.
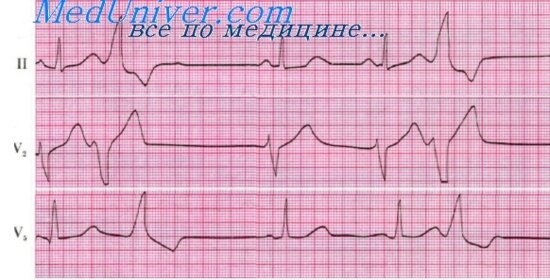
Фибрилляция желудочков — самая частая непосредственная причина смерти больных острым ИМ. Фибрилляция желудочков представляет собой полную дезорганизацию работы сердца как органа и обусловливает практически немедленное прекращение кровообращения. Симптомы фибрилляции желудочков — это симптомы остановки сердца, иными словами, симптомы клинической смерти: сознание исчезает, пульс и АД не определяются, тоны сердца не выслушиваются. Зрачки расширяются и не реагируют на свет. Агональное дыхание может сохраняться иногда довольно долго. В редких случаях, когда фибрилляция желудочков имеет характер коротких пароксизмов, она может проявляться приступами Адамса — Стокса — Морганьи. Форма остановки сердца (фибрилляция желудочков, асистолия, терминальная брадиаритмия) может быть установлена лишь на основании ЭКГ, на которой фибрилляция желудочков имеет характерную картину (рис. 12).
Рис. 12. ЭКГ при фибрилляции желудочков. А — мелковолновая (мелкоамплитудная); Б — крупноволновая.
По мере нарастания гипоксии миокарда и углубления нарушений метаболизма фибрилляция желудочков из крупноамплитудной в течение ближайших минут переходит в мелкоамплитудную и в таком виде может продолжаться очень долго, иногда часами.
Чрезвычайно важно знать, что фибрилляция желудочков особенно часто возникает в первые дни и особенно часы заболевания (см. ниже). Она может возникать без предвестников, но часто ей предшествует желудочковая экстрасистолия, особенно политопная и групповая. Еще более определенный предвестник фибрилляции — желудочковая тахикардия.
В обычных условиях энергии- одиночной экстрасистолы, даже появившейся в «ранимый» период, недостаточно для развития фибрилляции желудочков. Однако при ИМ создаются условия, во много раз уменьшающие пороговую энергию возникновения фибрилляции желудочков. Еще меньше энергии нужно при этом для развития желудочковой тахикардии (так называемая желудочковая тахикардия «ранимого» периода), (Lown et al. 1967), которая в 75% случаев затем переходит в фибрилляцию желудочков.
С клинической точки зрения необходимо различать «первичную» и «вторичную» фибрилляцию желудочков. Под «первичной» фибрилляцией желудочков следует понимать те случаи, когда она развивается на фоне относительно удовлетворительного состояния гемодинамики при так называемом неосложненном ИМ. «Первичная» фибрилляция желудочков возникает вследствие нарушения электрофизиологических функций сердца при сохранной сократительной способности миокарда и практически нормальном состоянии других внутренних органов. По современным представлениям, «первичная» фибрилляция желудочков — механизм остановки сердца в значительном большинстве случаев «внезапной» смерти коронарных больных. «Вторичная» фибрилляция желудочков в своей основе обычно имеет тяжелые поражения сократительной функции миокарда или других жизненно важных органов или развивается под влиянием посторонних патогенных воздействий.
«Вторичную» фибрилляцию желудочков мы подразделяем на:
возникающую на фоне другого осложнения (например, у больного ИМ, осложнившимся отеком легких). В этой ситуации причина появления фибрилляции желудочков заключается не только в нарушении возбудимости и проводимости, обусловленном очаговыми изменениями миокарда, но и его тяжелой диффузной гипоксией в результате острой сердечно-легочной недостаточности;
развивающуюся как атональный ритм. Наблюдается в тех случаях, когда вначале прекращается другая жизненно важная функция — дыхание, и лишь затем происходит остановка сердца;
фибрилляцию желудочков ятрогенного происхождения, обычно являющуюся следствием неправильно проводившегося лечения. Типичный пример такой ситуации — фибрилляция желудочков при широко, к сожалению, используемом до настоящего времени введении солей кальция на фоне сердечных гликозидов для лечения отека легких. При этом резко повышается чувствительность миокарда к сердечным гликозидам, а если еще принять во внимание, что у больных ИМ она и так повышена, то опасность такой комбинации становится очевидной.
Фибрилляция желудочков лишь в крайне редких случаях спонтанно переходит в нормальный ритм. Обычно же без немедленных энергичных лечебных мероприятий она заканчивается летально.
Нарушения проводимости. Импульс возбуждения, возникающий в синусовом узле, распространяется на предсердия, область предсердно-желудочкового соединения, а затем по предсердно-желудочковому стволу, его ножкам и системе волокон Пуркинье — к миокарду желудочков. В патологических условиях, в том числе при ИМ, проведение импульса возбуждения может нарушаться на любом из этих уровней. Соответственно различают синоаурикулярную (синопредсердная), внутрипредсердную, предсердно-желудочковую и внутрижелудочковую блокаду.
Синоаурикулярная блокада — сравнительно редкое осложнение острого ИМ. При этом виде блокады синусовый узел вырабатывает импульсы возбуждения, но они не переходят на предсердия. На ЭКГ можно видеть паузы, в течение которых отсутствуют как предсердные, так и желудочковые комплексы. Увеличенный интервал между двумя зубцами Р—Р в 2 раза больше обычного. Если синоаурикулярная блокада продолжается более двух циклов, увеличенный интервал Р—Р соответственно удлиняется, оставаясь кратным нормальной длительности интервала Р—Р. Синоаурикулярная блокада рассматривается как одно из проявлений синдрома слабости синусового узла (см. выше). Она исключительно редко приводит к серьезным нарушениям гемодинамики, так как обычно при выраженном замедлении сердцебиения развиваются «выскальзывающие» ритмы за счет проявления активности водителей ритма второго порядка—области предсердножелудочкового соединения. Наряду с ишемией синусового узла синоаурикулярная блокада может быть проявлением передозировки сердечных гликозидов.
Клиническое значение внутрипредсердной блокады при ИМ невелико, чего нельзя сказать о предсердно-желудочковой блокаде, которая наблюдается у 12—13% больных ИМ. Средний возраст больных, у которых течение заболевания осложняется поперечной блокадой, выше, чем у больных с нормальной проводимостью.
Различают 4 степени предсердно-желудочковой блокады [Мясников А. Л. 1965]. При блокаде I степени замедляется предсердно-желудочковое проведение, Р—Q или Р—R увеличивается более 0,20 с. При II степени наблюдается постепенное замедление предсердно-желудочковой проводимости, что выражается в нарастающем увеличении с каждым сокращением сердца интервала Р—Q, пока не происходит выпадения одного из желудочковых комплексов. После этого предсердножелудочковая проводимость на некоторое время восстанавливается, а затем снова постепенно ухудшается. При предсердно-желудочковой блокаде III степени из предсердий в желудочки проводится лишь один из каждых двух-трех и т. д. импульсов. Предсердно-желудочковая блокада IV степени — это полная поперечная блокада. При полной предсердно-желудочковой блокаде импульсы возбуждения не доходят до желудочков, предсердия и желудочки сокращаются совершенно независимо, причем сокращение желудочков происходит под влиянием эктопических импульсов, возникающих в самих желудочках («идиовентрикулярныи» ритм).
Причина предсердно-желудочковой блокады при ИМ — некроз или ишемия предсердно-желудочкового узла либо проводящих волокон системы Гиса — Пуркинье. В некоторых случаях появление предсердно-желудочковой блокады, особенно II степени, — результат передозировки сердечных гликозидов.
Обычно полная поперечная блокада развивается вскоре после начала заболевания. Так, к концу 1-х суток происходит уже не менее 60% всех блокад, а после 5-х суток полная блокада, как правило, уже не развивается.
При появлении предсердно-желудочковой блокады низкой степени весьма значительна вероятность ее прогрессирования в более высокую. Так, по нашим данным, при диафрагмальном инфаркте в 40% случаев предсердно-желудочковая блокада, которая при поступлении была I степени, впоследствии перешла в полную, при переднем инфаркте это отмечено в 3/4 случаев.
Можно выделить два типа развития блокады. При первом типе происходит постепенный, нередко в течение достаточно продолжительного времени (от нескольких часов до нескольких суток) переход от блокады I степени ко II и далее к III и IV. Для этого варианта развития характерна блокада III степени первого типа с периодами Самойлова — Венкебаха. При втором типе развития полной поперечной блокады наблюдается резкий, скачкообразный переход ее от более низкой степени, минуя промежуточные ступени, причем возможны случаи, когда полная поперечная блокада принимает сразу характер асистолии. Если при этом варианте наблюдается блокада II степени, то это, как правило, блокада второго типа.
Эти особенности обусловлены различиями электрофизиологических свойств и характера поражения тех структур, которые повреждаются вследствие ишемии и приводят к появлению блокады; первый вариант наблюдается при так называемых проксимальных блокадах — в их основе лежит ишемия предсердно-желудочкового узла, а второй — при дистальных, в основе которых лежит поражение ветвей предсердно-желудочкового пучка. При проксимальных блокадах водитель ритма расположен в области предсердно-желудочкового соединения, поэтому он достаточно стабилен и обеспечивает относительно высокую частоту желудочковых сокращений — до 50—60 и более в минуту. Возбуждение по желудочкам при проксимальных блокадах распространяется обычным путем, поэтому и комплекс QRS обычной, наджелудочковой формы.
При дистальной блокаде водитель ритма расположен в ветвях предсердно-желудочкового пучка или волокнах Пуркинье. Он значительно менее стабилен и обеспечивает существенно более низкую частоту желудочковых сокращений — обычно не выше 30 в минуту. Отсюда большая склонность при дистальных блокадах к развитию асистолии и приступов Адамса — Стокса — Морганьи. При дистальной блокаде ход распространения возбуждения по миокарду желудочков извращен, поэтому уширенным и деформированным оказывается желудочковый комплекс.
Как показали исследования электрической активности проводящей системы сердца, проксимальная блокада, как правило, наблюдается при заднем (диафрагмальном) ИМ, а дистальная — при переднем. Это настолько закономерно, что, зная локализацию очага некроза, можно достаточно точно прогнозировать электрофизиологические особенности и даже клиническое течение этого осложнения. Эта закономерность обусловлена особенностями кровоснабжения соответствующих отделов сердца.
Еще одно отличие блокад при переднем и заднем ИМ, в основе которого лежат те же особенности поражения сосудов и специализированного миокарда, о которых говорилось выше, заключается в том, что перед развитием поперечной блокады при переднем ИМ, как правило, наблюдаются предшествующие нарушения внутрижелудочковой проводимости, а при заднем ИМ их, как правило, нет. Если же принять во внимание, что полной поперечной блокаде при переднем инфаркте соответствует особо обширное поражение миокарда, то становится понятной вся гамма различий в клинике переднего и диафрагмального ИМ, осложненного полной поперечной блокадой сердца. Если полная поперечная блокада при переднем ИМ предполагает тяжелый прогноз (летальность до 70%), то при диафрагмальном он более благоприятен (летальность до 30%).
Одна из наиболее важных клинических особенностей полной поперечной блокады при ИМ заключается в том, что она, как правило, у выживших имеет преходящий характер. Ее длительность обычно не превышает 6 сут, колеблясь в отдельных случаях от минут до 4 нед, составляя в среднем около 2 сут.
Клиника предсердно-желудочковой блокады при остром ИМ характеризуется в первую очередь замедлением сердцебиения со всеми вытекающими отсюда последствиями (см. Брадиаритмии). Однако нарушения гемодинамики при поперечной блокаде, например полной, все же более выражены, чем при синусовой брадикардии. Это объясняется тем, что, во-первых, замедление желудочковых сокращений при поперечной блокаде более выражено, во-вторых, развитие блокады обычно наблюдается при более обширном поражении миокарда, в-третьих, при полной поперечной блокаде нарушается координация между работой предсердий и желудочков. Клиническая картина при предсердно-желудочковой блокаде у больных острым ИМ зависит от степени блокады и некоторых других факторов.
Очень часто поперечной блокаде при ИМ сопутствует недостаточность кровообращения, выраженные признаки которой можно определить у 70—80% больных. Причем, если при диафрагмальном инфаркте у 7з больных признаки декомпенсации отсутствуют, то при переднем они имеют место практически во всех случаях. Сердечно-сосудистая недостаточность у больных ИМ, осложнившимся предсердно-желудочковой блокадой, значительно ухудшает прогноз. Развитие декомпенсации чаще наблюдается у более пожилых и перенесших ранее ИМ больных. У некоторых больных острая недостаточность кровообращения на фоне полной поперечной блокады является следствием брадисистолии, однако в большинстве случаев это «истинный» кардиогенный шок, обусловленный обширностью поражения миокарда. Об этом говорит, в частности, тот факт, что картина шока обычно сохраняется и после восстановления проводимости. Недостаточность кровообращения — наиболее частая непосредственная причина летальных исходов у больных ИМ, осложнившимся поперечной блокадой. Например, гемодинамические нарушения при предсердно-желудочковой блокаде у больных переднеперегородочным ИМ, как правило, более выражены, так как частота сердечных сокращений у них незначительна, а область некроза обширна. Именно при таком поражении чаще отмечается не только тяжелая общая недостаточность кровообращения вплоть до развития картины «аритмического» шока, но и признаки нарушения регионарной гемодинамики, из которых наиболее характерны приступы Адамса — Стокса — Морганьи. Приступы Адамса — Стокса — Морганьи — результат нарушения мозгового кровообращения, который может проявляться в различной форме — от легких головокружений до развернутого приступа с глубокой потерей сознания, конвульсиями, непроизвольным мочеиспусканием и т. п. Важно помнить, что при предсердно-желудочковой блокаде синдром Адамса — Стокса — Морганьи может быть обусловлен не только редкими сокращениями или временной остановкой желудочков, но и короткими пароксизмами фибрилляции желудочков или желудочковой тахикардии. Приступы Адамса — Стокса— Морганьи наблюдаются приблизительно у каждого четвертого больного ИМ, осложнившимся полной поперечной блокадой. Эта группа больных особенно тяжела; летальность в ней достигает 75%, тогда как при полной поперечной блокаде у больных ИМ она составляет 40%. Комбинация полной поперечной блокады у больных острым ИМ с другими нарушениями ритма — ее характерная клиническая особенность. Сопутствующие аритмии у этих больных наблюдаются приблизительно так же часто, как и при нормальной проводимости. Синдром Фредерика — мерцание предсердий на фоне полной поперечной блокады — встречается при ИМ относительно редко (приблизительно 5% всех случаев с полной поперечной блокадой). Он имеет ограниченное клиническое значение и потому, что течение болезни и ее прогноз мало отличаются от наблюдаемых при обычном варианте, блокады у этих больных.
Предсердно-желудочковая блокада может быть заподозрена на основании данных физикального обследования больного, например редкого ритма или появления характерного «пушечного» тона. Тем не менее уточняется он при помощи ЭКГ.
Нарушения внутрижелудочковой проводимости при остром ИМ наблюдаются у 10— 15% больных. Часто они имеют характер блокады правой или левой ножки предсердно-желудочкового пучка, однако в ряде случаев не могут быть объяснены с этих привычных позиций. Например, долгое время оставалось непонятным, почему иногда при блокаде правой ножки пучка имеется отклонение электрической оси сердца влево. В последнее время этот и некоторые другие феномены стали более понятными, так как гистологические и электрофизиологические исследования показали, что левая ножка представляет собой по сути дела две самостоятельные ветви — переднюю (верхнюю) и заднюю (нижнюю). Типичная картина блокады левой ножки имеет место при одновременном нарушении проведения по обеим этим ветвям. Возможны и комбинированные нарушения проводимости, например по правой ножке и по передней или задней ветви левой. Этим и объясняется многообразие электрокардиографических проявлений при внутрижелудочковой блокаде. При нарушении проведения по всем ветвям предсердно-желудочкового пучка — правой ножке и обеим ветвям левой — развивается поперечная блокада.
Само по себе появление внутрижелудочковой блокады не ухудшает течения болезни. Ее клиническое значение заключается в том, что она: 1) обычно свидетельствует об обширном поражении миокарда; 2) может служить предвестником наступления поперечной блокады и остановки желудочков; 3) затрудняет электрокардиографическую диагностику очаговых изменений миокарда (особенно при блокаде левой ножки); 4) затрудняет дифференциальную диагностику желудочковых и наджелудочковых нарушений ритма; 5) затрудняет электрокардиографическую диагностику гипертрофии желудочков сердца.
Блокада ветвей предсердно-желудочкового пучка, возникающая в остром периоде ИМ, обычно имеет преходящий характер. Она в 3 раза чаще встречается при переднем ИМ. Блокада ветвей предсердно-желудочкового пучка (особенно правой ветви)—неблагоприятный прогностический признак. Среди этих больных нередко отмечаются случаи поздней фибрилляции желудочков и, по-видимому, это — контингент, нуждающийся в более длительном пребывании в условиях интенсивного наблюдения. Среди этих лиц вероятность развития предсердно-желудочковой блокады выше, чем у больных с нормальной внутрижелудочковой проводимостью. Она особенно высока в группе больных с комбинированными (двух- и трехпучковыми) блокадами: развитие полной поперечной блокады или асистолии можно наблюдать не менее чем у каждого третьего такого больного. Диагностические электрокардиографические критерии монофасцикулярных и комбинированных внутрижелудочковых блокад детально приводятся в соответствующих руководствах.
Одна из форм остановки сердца при остром ИМ — асистолия — наблюдается реже, чем фибрилляция желудочков. Она обычно наступает у больных с нарушениями предсердно-желудочковой и внутрижелудочковой проводимости, а также при других тяжелых осложнениях, особенно острой недостаточности кровообращения. Клинически проявляется, как и фибрилляция желудочков, симптомами полного прекращения кровообращения.
Прогноз даже при немедленном начале реанимационных мероприятий значительно хуже, чем при фибрилляции желудочков, так как асистолия — обычно следствие осложненного ИМ и развивается на фоне глубоких нарушений структуры и метаболизма миокарда.
> · Нарушения ритма и проводимости сердца у больных острым инфарктом миокарда
· Острая недостаточность кровообращения
· Перикардит (эпистенокардический )
· Аневризма сердца
· Тромбоэндокардит