ПРИМЕНЕНИЕ ГЛИАТИЛИНА И МЕКСИДОЛА В ИНТЕНСИВНОЙ ТЕРАПИИ ТЯЖЕЛОГО ОСТРОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
В.И. Серегин Неврологическое отделение Скопинской ЦРБ, Рязанская область
Проведено сравнительное рандомизированное исследование эффективности комбинации ноотропного препарата Глиатилин (холина альфосцерат) и антигипоксического препарата Мексидол (оксиметилэтилпиридина сукцинат) у больных в остром периоде тяжелого ишемического инсульта. Основная группа (59 больных) получала базисную терапию, Глиатилин и Мексидол; контрольная группа (53 больных) — только базисную терапию. На 10-й день лечения смертность в основной и контрольной группах составила 27 и 42 % соответственно, а частота благоприятных исходов — 73 и 58 %. Глиатилин и Мексидол не вызывали значимых побочных реакций.
Введение
Острые нарушения мозгового кровообращения (ОНМК) — одна из ведущих причин заболеваемости, смертности и инвалидизации в России, в частности и в нашем регионе. Частота ОНМК в России составляет 0,5-7,4 на 1000 населения и в большинстве регионов постепенно повышается, в т. ч. и среди работоспособного населения (Виленский Б.С. 1995; Гусев Е.И. 1992; Смирнов В.Е. 1991; Агю К. 1980). В разных странах смертность от ОНМК варьируется от 0,61 до 2,43 на 1000 населения. В России ОНМК занимают второе место в структуре общей смертности. В остром периоде инсульта умирают 30 %, а в ближайший год после него — 45-48 % больных. Высоки и показатели инвалидизации пациентов, перенесших ОНМК: 75-80 % выживших утрачивают трудоспособность и нуждаются в длительной, дорогостоящей медико-социальной помощи (Верещагин Н.В. 1995; Мартынов Ю.С. 1996). До 1960-х гг. доминировало мнение, что при ОНМК ишемическое повреждение возникает быстро и является необратимым. В нашей стране существовала установка, согласно которой больные инсультом считались нетранспортабельными в течение первых 2 недель заболевания; в этот период они находились в домашних условиях. Однако с 1962 г. по инициативе крупнейшего невропатолога Н.К. Боголепова сроки госпитализации были пересмотрены. В начале 1980-х гг. сформировалось представление о том, что церебральная ишемия — это динамический процесс, подразумевающий обратимость поражений и не тождественный инфаркту мозга. В дальнейшем было доказано, что ОНМК — это неотложное состояние, требующее быстрой медицинской помощи, была сформулирована концепция «терапевтического окна» и коренным образом видоизменились взгляды на стратегию патогенетического лечения ОНМК.
Выделяют три основных направления терапии ишемического инсульта:
- реперфузия (воздействие на ранние события патогенетического каскада);
- нейропротективная терапия (воздействие на более поздние события);
- репаративная терапия (воздействие на отдаленные события).
Реперфузия наиболее эффективна в первые минуты после инсульта. Характер реперфузионной терапии определяется патогенетическим вариантом инсульта. Гемодилюция и антиагрегантная терапия улучшают микроциркуляцию в ткани мозга и применяются в первые дни после инсульта под контролем гемостаза и реологических показателей. Радикального действия эта терапия не оказывает.
Нейропротективная терапия более сложна и разнообразна. Выделяют первичную и вторичную нейропротекцию. Первичная направлена на подавление нейротоксичности глутамата кальция и свободнорадикального окисления. Проводится с первых минут и продолжается первые 3 дня. Вторичная нейропротекция направлена на ослабление отдаленных последствий ишемии, на блокаду высвобождения провоспалительных цитокинов, молекул клеточной адгезии, торможение прооксидантных ферментов, усиление питания ткани мозга, прерывание апоптоза нейронов. Вторичную нейропротективную терапию начинают спустя 3-6 часов после инсульта и продолжают не менее 7 дней.
После формирования морфологических инфарктных изменений в веществе мозга все большее значение приобретает репаративная терапия, направленная на улучшение питания здоровой ткани, окружающей зону ишемии, и на активацию образования полисинаптических связей. Однако грань между нейропротективной и репаративной терапией условна. Большинство нейропротекторов обладают и репаративными свойствами.
К препаратам репаративного действия относят агонисты ГАМК и ноотропы (пиритинол, карнитина хлорид, холина альфосцерат и др). В последнее время широко применяется ноотроп Глиатилин (действующее вещество — холина альфосцерат). Это препарат с центральным холиномиметическим действием, обладающий выраженным пробуждающим действием при расстройстве сознания и ярким позитивным влиянием на когнитивные и мнестические функции. Глиатилин повышает пластичность плазматической мембраны нейронов, улучшает кровоток и усиливает метаболические процессы в ЦНС, активирует ретикулярную формацию, способствует регрессу очаговых неврологических симптомов. Препарат производится компанией Italfarmaco (Италия); формы выпуска: раствор для инъекций в ампулах по 4 мл (1 г активного вещества) и капсулы (0,4 г активного вещества).
По данным литературы, в терапии заболеваний ЦНС все чаще применяются антигипоксические средства, поддерживающие активность сукцинатоксидазного звена цикла Кребса. Это ФАД-зависимое звено, которое в условиях гипоксии угнетается позднее, чем НАД-зависимые оксидазы, и может определенное время поддерживать продукцию энергии в клетке при условии наличия в митохондриях субстрата окисления — сукцината. При выборе препаратов сукцината надо учитывать, что он относительно плохо проникает через биологические мембраны. В этом смысле перспективен оксиметилэтилпиридина сукцинат, представляющий собой комплекс сукцината с антиоксидантом эмоксипином. На российском фармацевтическом рынке оксиметилэтилпиридина сукцинат представлен, в частности, препаратом Мексидол. Формы его выпуска: 5 %-ный раствор для инъекций в ампулах по 2 и 5 мл и таблетки по 0,125 г.
Собственные исследования
Предпосылки. В Скопинском районе Рязанской области с 1998 г. кривая заболеваемости ОНМК резко пошла вверх. С 1999 по 2002 г. общее число пациентов, находящихся на лечении в неврологическом отделении Скопинской ЦРБ, увеличилось в 2 раза, а больных ОНМК — в 10 раз; существенно выросла доля пациентов, поступивших в коматозном состоянии (до 30 %) и как следствие — повысилась летальность в стационаре. В связи с этим мы начали искать пути повышения эффективности лечения ОНМК в условиях неврологического отделения ЦРБ. При этом мы учитывали следующие обстоятельства:
- инсульт — это не отдельная нозологическая форма, а клинический синдром, требующий применения нескольких групп лекарственных средств;
- поскольку многие методы диагностики (например, ЯМР) в условиях ЦРБ недоступны, медикаментозная терапия должна перекрывать как можно больше патоморфологических вариантов инсульта;
- стоимость лекарственных средств должна быть приемлемой.
С 2002 г. мы начали применять Мексидол в сочетании с базисной терапией для лечения ишемического и геморрагического инсульта разной степени тяжести. Наибольшую клиническую эффективность препарата наблюдали при инфаркте мозга, особенно при его применении в первые часы ОНМК, т. е. в период «терапевтического окна». С 2003 г. мы начали применять Глиатилин в сочетании с базисной терапией при тяжелом ишемическом инсульте тяжелой степени тяжести (у больных с нарушениями сознания, когнитивными нарушениями, сенсорной и моторной афазией). Однажды мы назначили Мексидол в сочетании с Глиатилином больному с тяжелым ишемическим инсультом, вызванным нарушением кровообращения в бассейне сонной артерии. Отметили, что эффективность комбинации Мексидол + Глиатилин + базисная терапия оказалась существенно выше, чем эффективность комбинаций Мексидол + базисная терапия и Глиатилин + базисная терапия. Это наблюдение и послужило предпосылкой для нашего клинического исследования.
Цель работы: изучение эффективности курсовой комбинированной терапии Глиатилином и Мексидолом в остром периоде ишемического инсульта.
Пациенты и методы
В сравнительное рандомизированное клиническое исследование были включены 112 больных ишемическим инсультом, вызванным нарушением кровообращения в бассейне сонной артерии, госпитализированных в первые сутки после начала инсульта (в т. ч. в первые 6 часов). Диагноз ишемического инсульта устанавливали, если у больного имело место острое (в течение минут или часов) развитие симптомов острых очаговых неврологических нарушений длительностью не менее 24 часов. В исследование не включали больных с тяжелой сердечной недостаточностью.
Больных, включенных в исследование, разделили на две группы — основную и контрольную. Основная группа (59 больных) получала базисную терапию в сочетании с Глиатилином (1 г/сут; продолжительность курса — 9 дней) и Мексидолом (4 мл 5 %-ного раствора на физиологическом растворе внутривенно; 2 раза в сутки; продолжительность курса — 10 дней). Контрольная группа (53 больных) получала только базисную терапию. Обе группы были сопоставимы по возрасту и полу.
Тяжесть инсульта оценивали по Скандинавской шкале инсультов (Scandinavian Stroke Study Group, 1985 г.), степень нарушения сознания — по шкале комы Глазго. Эффективность терапии оценивали по шкале Ранкина:
- 0 баллов — неврологической симптоматики нет;
- 1 балл — минимальные неврологические нарушения;
- 2 балла — нарушения, ведущие к ограничениям повседневной активности;
- 3 балла — умеренные нарушения, ограничивающие самостоятельность больного;
- 4 балла — нарушения средней тяжести, значительно ограничивающие самостоятельность больного;
- 5 баллов — больной нуждается в постоянном уходе;
- 6 баллов — летальный исход.
Неблагоприятными исходами считали смерть больного (6-й балл по шкале Ранкина) и выраженную инвалидизацию (5-й балл по шкале Ранкина). Оценивали также побочные эффекты Глиатилина и Мексидола.
Результаты
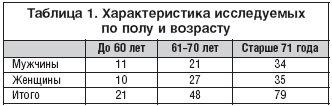
Зависимость исходов инсульта от сроков начала лечения представлена на рисунке. Как при раннем (в первые 6 часов), так и при отсроченном начале лечения в основной группе доля благоприятных исходов (3 и 4 баллов по шкале Ранкина) была существенно выше, а смертность (6 баллов по шкале Ранкина) — существенно ниже, чем в контрольной группе. Зависимость исходов от тяжести нарушения сознания в раннем периоде инсульта представлена в табл. 1.
Таблица 1. Исходы тяжелого ишемического инсульта в зависимости от уровня сознания в раннем периоде заболевания
Исход, баллы по шкале Ранкина
Международный неврологический журнал 5 (43) 2011
Вернуться к номеру
Глиатилин в лечении больных в восстановительном периоде мозгового инсульта
Авторы: Мищенко В.Н. Лапшина И.А. ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины», г. Харьков
Версия для печати
Резюме / Abstract
Статья посвящена применению производного экзогенного холина Глиатилина в качестве нейропротектора в восстановительном периоде инсульта. Показано, что назначение Глиатилина больным в восстановительном периоде ишемического инсульта в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг 2 раза в сутки в течение 2 месяцев позволяет ускорить восстановление неврологических функций, в том числе уменьшить очаговую неврологическую симптоматику.
Ключевые слова / Key words
Инсульт, восстановление, Глиатилин, симптомы.
В последние годы во всем мире прогрессивно возрастает количество мозговых инсультов (МИ), и в первую очередь за счет ишемических нарушений мозгового кровообращения [1–3]. В ближайшие десятилетия эксперты ВОЗ предполагают дальнейший рост количества мозговых инсультов [4–7]. Это обусловлено возрастанием в популяции населения планеты людей пожилого возраста и значительной распространенностью таких факторов риска МИ, как артериальная гипертензия, болезни сердца, сахарный диабет, ожирение, курение и др. [8–10]. Также актуальна проблема МИ в Украине, где около 110 тыс. населения ежегодно заболевает инсультом, из них 35 % людей трудоспособного возраста [11].
Инсульт является ведущей причиной смертности и инвалидизации в развитых странах мира. Только 10–20 % больных после инсульта возвращается к труду. Около 25 % инвалидизации взрослого населения обусловлено инсультом [1, 6].
Согласно данным регистров инсульта, 20–43 % больных после МИ нуждаются в постороннем уходе, у 33–48 % наблюдаются явления гемипареза, а у 18–27 % имеются афатические нарушения [8–10]. Следствием этого являются огромные экономические потери, которые, по некоторым оценкам, составляют 4 % бюджета здравоохранения развитых стран [5]. Так, например, во Франции стоимость постинсультной помощи в течение 1,5 года на одного больного составляет 19 513 евро [5].
Растет во всем мире и количество случаев хронических нарушений мозгового кровообращения, которые приводят к развитию мозгового инсульта или деменции [8, 9, 11].
Возрастающая заболеваемость мозговым инсультом и связанная с ней высокая инвалидизация определяют актуальность проблемы эффективного лечения больных с сосудистыми заболеваниями головного мозга [12, 13].
Основной целью терапии ишемического инсульта в восстановительном периоде является восстановление функциональной интеграции центральной нервной системы (ЦНС) и устранение неврологического дефицита. В этот период, когда уже сформировались морфологические инфарктные изменения в веществе головного мозга, все большее значение приобретает репаративная терапия с использованием средств, направленных на улучшение пластичности неповрежденной мозговой ткани и межнейронального взаимодействия. К таким препаратам относятся нейропротекторы, обладающие трофическими и модуляторными свойствами, усиливающие регенераторно-репаративные процессы, способствующие восстановлению нарушенных функций. Они оказывают прямое активирующее влияние на структуры головного мозга, улучшают память и когнитивные функции, а также повышают устойчивость ЦНС к повреждающим воздействиям [12, 14–16].
Основные задачи нейрореабилитации больных, которые перенесли инсульт, сводятся к восстановлению нарушенных функций, психической и социальной реадаптации пациентов, профилактике постинсультных осложнений (спастичность, контрактуры и др.). Раннее начало (в острейшем периоде), длительность и систематичность, комплексность, этапность, а также активное участие больного и членов семьи определяют успех реабилитационных мероприятий [17]. На темпы восстановления нарушенных функций влияет много различных факторов: возраст больных, тяжесть инсульта, локализация очага поражения, сопутствующие заболевания, начало реабилитационных мероприятий, время и качество оказания медицинской помощи и другие [18]. В последнее время появилось много данных, свидетельствующих о роли когнитивных и аффективных нарушений, оказывающих негативное влияние на эффективность реабилитации у постинсультных больных. Когнитивные нарушения встречаются, по данным разных авторов, у 22–77% больных в течение года от начала развития инсульта. При этом когнитивные нарушения, достигающие степени деменции, выявляются у 25–34 % больных [19–22].
Таким образом, когнитивные нарушения наряду с другими последствиями инсульта вносят существенный вклад в социальную и бытовую дезадаптацию больных после инсульта. Постинсультными когнитивными расстройствами принято называть нарушения памяти и других высших мозговых функций, которые возникли или достигли клинической значимости в первые месяцы после инсульта. Основными причинами когнитивных нарушений у больных после перенесенного мозгового ишемического инсульта могут быть поражение в результате инсульта стратегических для когнитивной деятельности отделов головного мозга, развитие мультиинфарктного состояния, обширные поражения белого вещества (лейкоареоз), сопутствующие нейродегенеративные заболевания, депрессия [23].
Когнитивные нарушения оказывают отрицательное влияние на реабилитационный процесс, усиливают инвалидизацию и значительно ухудшают качество жизни больных, а также людей, которые ухаживают за ними.
Лечение больных в постинсультном периоде является сложной задачей, обусловленной многообразием патобиохимических и патофизиологических механизмов, лежащих в его основе.
В литературе имеются данные о положительном влиянии нейропротекторов на эффективность восстановления после перенесенного инсульта [15, 16, 24, 25].
Одними из наиболее эффективных препаратов среди нейропротекторов являются производные экзогенного холина: CDP (цитиколин), GPS (холина альфосцерат (Глиатилин)), рекогнан.
Глиатилин (альфа-глицерилфосфорилхолин, аlpha- glycerylphosphorylcholine) — соединение, содержащее 40 % холина и превращающееся в организме в метаболически активную форму — фосфорилхолин, способный проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [26].
В экспериментах на животных показано, что Глиатилин предупреждает индуцированный холинергический дефицит, предотвращает развитие деменции, облегчает процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [27].
Другим механизмом действия Глиатилина является анаболический эффект, проявляющийся в стимуляции мембранного и глицеролипидного синтеза вследствие образования предшественников фосфолипидов мембран из продуктов его метаболического распада [27, 28].
Таким образом, Глиатилин активирует холинергическую нейротрансмиссию, повышая пластичность ткани мозга, оказывает мембраностабилизирующее и антиоксидантное действие.
Нами был проанализирован ряд клинических исследований по применению холина альфосцерата у пациентов с различными сосудистыми заболеваниями головного мозга.
Пилотные клинические исследования Глиатилина в остром периоде тяжелого ишемического инсульта (внутривенные введения в дозе 1 г 3–4 раза в сутки в течение 5 дней) выявили «пробуждающий» эффект препарата (рис. 1). Отмечались уменьшение выраженности нарушений дыхания и кровообращения, улучшение показателей церебральной оксиметрии, положительная динамика стволовых вызванных потенциалов на акустическую стимуляцию, что свидетельствовало о нормализации функционального состояния ствола мозга. Отмечено также благоприятное влияние Глиатилина на психическую деятельность больных, память, восстановление речевых функций [29–33].
Особого внимания заслуживают результаты обширного мультицентрового 3-летнего исследования возможностей Глиатилина у 800 пациентов с острым ишемическим инсультом в ведущих клиниках Российской Федерации [29]. Согласно полученным результатам при введении препарата начиная с 1-х до 90-х суток (1–15-й дни — 200 мг/сутки, 15–30-й дни — 100 мг/сутки, далее — 800 мг/сутки) было выявлено, что уже к 30-му дню введения у пациентов, получавших Глиатилин, отмечалось значимое повышение способности к самообслуживанию (показатель менее 2 баллов по шкале Рэнкина), к 90-му дню достоверно чаще отмечалось снижение неврологического дефицита (выраженность менее 2 баллов по шкале NIHSS) (рис. 2). Важно подчеркнуть, что отмеченные клинические параметры улучшения коррелировали с данными нейровизуализации объема очага поражени: в группе пациентов, получавших Глиатилин, к 30-му дню отмечалось минимальное увеличение объема инфаркта мозга.
Исследование, проведенное группой итальянских ученых (F. Amenta и соавт. 2010), показало, что применение препарата Глиатилин вызывало значительное улучшение когнитивных функций у пациентов с легкой и среднетяжелой формой болезни Альцгеймера [34].
Итальянскими учеными Lucilla Parnetti, Francesco Amenta, Virgilio Gallai был проведен обзор научных данных, касающихся клинической эффективности холина альфосцерата, предшественника ацетилхолина, который применялся для лечения деменции [35].
Приведенные сведения были получены в результате обобщения данных, полученных в ходе тринадцати клинических испытаний, в которые было включено 4054 пациента с ишемическим инсультом, с различными формами сосудистой деменции, в том числе деменцией альцгеймеровского типа, а также при лечении острых нарушений мозгового кровообращения (рис. 3). Результаты этих исследований показали положительное влияние препарата Глиатилин на когнитивные функции у обследуемых больных.
Были проведены многочисленные исследования, которые продемонстрировали эффективность Глиатилина в отношении двигательных нарушений, уровня сознания, когнитивных расстройств у больных в остром периоде мозгового инсульта (рис. 4). Вместе с тем эффективность и безопасность препарата Глиатилин у больных в восстановительном периоде ишемического инсульта представляет научный интерес.
На базе отдела сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины» было проведено открытое исследование эффективности и переносимости холина альфосцерата у больных в восстановительном периоде ишемического мозгового инсульта.
Цель исследования — определить влияние препарата Глиатилин на выраженность неврологического дефицита, показатели повседневной жизненной активности и состояние когнитивных функций в восстановительном периоде ишемического инсульта.
Задачи исследования:
1. Оценить влияние препарата Глиатилин на основные субъективные проявления заболевания у больных в постинсультном периоде.
2. Оценить динамику объективных неврологических симптомов заболевания в результате лечения Глиатилином.
3. Изучить влияние препарата Глиатилин на когнитивные функции у обследованных больных.
4. Определить влияние препарата на повседневную жизненную активность и показатели качества жизни.
5. Оценить переносимость препарата Глиатилин, выявить возможные побочные явления, в том числе проанализировать влияние терапии Глиатилином на общее состояние больных, перенесших ишемический инсульт.
В исследование было включено 20 пациентов в восстановительном периоде ишемического мозгового инсульта в возрасте 45–75 лет, которые находились на лечении в отделении сосудистой патологии головного мозга ГУ «Институт неврологии, психиатрии и наркологии НАМН Украины». Все пациенты получали исследуемый препарат Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки — 2 месяца.
Для решения поставленных задач исследования в работе были применены следующие методы обследования: клинико-неврологический; психодиагностический (шкала MMSE); уровень повседневной жизненной активности, а также степень инвалидизации пациентов определялись при помощи шкалы Рэнкина; функциональное состояние больных и их способность к самообслуживанию оценивались при помощи индекса Бартель; качество жизни больных определяли с помощью опросника SF-36.
Диагноз выставлялся на основании изучения жалоб больных, данных анамнеза жизни и болезни, неврологического и соматического статуса.
Среди обследованных пациентов у 15 (75 %) больных в патологический процесс были вовлечены бассейны средних мозговых артерий, у 5 (25 %) больных — вертебробазилярный бассейн. У 8 больных очаг ишемии локализовался в правом полушарии, у 7 — в левом.
Для верификации диагноза ишемического инсульта и определения его подтипа проводили КТ или МРТ головного мозга, ультразвуковую допплерографию, дуплексное сканирование каротидных артерий и электрокардиографию. По механизму развития атеротромботический инсульт перенесли 12 больных, кардиоэмболический — 6 больных, лакунарный — 2 больных.
У больных, перенесших МИ в системе средних мозговых артерий, превалировали жалобы на слабость в контралатеральных конечностях, онемение и нарушения чувствительности в этих конечностях. У больных с левополушарными каротидными нарушениями отмечались расстройства речи в виде моторной и сенсорной, амнестической афазии. Для больных, перенесших инсульт в вертебробазилярном бассейне, были более характерны жалобы на стойкие головокружения, в основном при смене положения тела, поворотах головы, шум, звон в голове и ушах, тошноту, затруднение при глотании, дизартрию, зрительные нарушения.
При объективном исследовании у всех больных отмечалась диффузная органическая симптоматика в сочетании с очаговыми нарушениями. Превалировали глазодвигательные нарушения: слабость конвергенции, ограничение взора вверх, недостаточность отводящих нервов. У больных выявлялись асимметрия лицевой мускулатуры, нистагм при крайних отведениях, нарушения статики и координации, афатические, двигательные (разной степени выраженности), чувствительные (преимущественно по гемитипу), тонусные нарушения, анизорефлексия, преимущественно по гемитипу, снижение силы в конечностях (контралатеральных очагу поражения). Выявлялась группа симптомов: снижение корнеальных рефлексов, отечность языка с отпечатками зубов, болезненность глазных яблок при надавливании, которые расценивались как косвенные признаки ликворной гипертензии.
Кроме того, у больных обнаруживались рефлексы орального автоматизма, патологические знаки, анизокория.
Очаговая неврологическая симптоматика отвечала пораженному сосудистому бассейну, локализации ишемического очага.
Анализ субъективной и объективной неврологической симптоматики позволил выделить ведущие клинические синдромы.
Очаговые неврологические синдромы отмечались в 75 % случаев. Симптоматика соответствовала локализации ишемического очага, пораженному сосудистому бассейну.
Вестибулоатактический синдром отмечался у 80 % больных, характеризовался головокружениями, шаткостью при ходьбе, усиливающейся при взгляде на движущиеся предметы и изменении положения тела, сопровождался нарушениями статики и координации, атаксией в пробе Ромберга.
Цефалгический синдром встречался в 95 % случаев. Он характеризовался выраженностью, монотонностью и однообразием головной боли.
Ликворно-гипертензионный синдром встречался у половины больных. Он характеризовался упорными головными болями распирающего характера, с чувством давления на глазные яблоки, тошнотой и обусловливал развитие и усугубление неврологической симптоматики вторично-стволового характера (глазодвигательные нарушения, пирамидные знаки, патологические рефлексы, псевдобульбарные нарушения). Наличие гипертензионного синдрома подтверждалось данными обследования глазного дна, КТ-данными, косвенными ЭЭГ-, УЗДГ-признаками.
Астенический синдром отмечался у всех обследованных больных. Он представлен в основном в виде выраженного компонента физической и психической утомляемости и снижения сенсорной толерантности.
Нами была оценена динамика неврологических симптомов и синдромов до и после лечения препаратом Глиатилин. Как видно из данных, представленных в табл. 1, под влиянием лечения препаратом Глиатилин отмечается ослабление выраженности синдромальной неврологической симптоматики.
Как правило, соответствующие позитивные сдвиги у пациентов начинали проявляться через 2 недели лечения исследуемым препаратом, и в дальнейшем редукция неврологической и соматической симптоматики усиливалась.
Как видно из табл. 1, терапия препаратом Глиатилин способствовала существенному уменьшению количественной выраженности и встречаемости практически всего перечня объективной и субъективной симптоматики. У большинства пациентов степень выраженности жалоб снизилась от 4 баллов до 1–2 баллов, а у 2 пациентов отмечалась полная редукция предъявляемых ими жалоб.
В процессе лечения отмечалось уменьшение выраженности астенического синдрома, псевдобульбарных расстройств. У части больных наблюдалась редукция очаговых неврологических синдромов (улучшение двигательных функций, речи, вестибулоатактического синдрома).
Состояние когнитивных функций до и после лечения препаратом Глиатилин было оценено с помощью шкалы MMSE. До лечения общий показатель когнитивной продуктивности по шкале MMSE составлял 24,3 ± 1,8 балла. Имело место выраженное сужение объемов вербальной памяти и счетных операций. У обследованных больных характерными были нарушения в сфере внимания, признаки дисфункции лобных долей (импульсивность, некритичность, персеверации). Нарушения памяти у этих больных сочетались с другими когнитивными расстройствами — дефектами устойчивости и переключения внимания, нарушением критики, поведения и др. В первую очередь страдала кратковременная память, уменьшался ее объем, выявлялось повышение тормозимости следов кратковременной памяти.
Динамика показателей по шкале MMSE до и после лечения представлена в табл. 2.
Анализ динамики когнитивных функций в процессе лечения больных показал статистически значимое улучшение всех показателей когнитивной сферы (памяти, внимания, ориентации, счетных функций). У больных после лечения общий показатель когнитивной продуктивности составил 26,1 ± 1,9 балла.
Анализируя результаты психодиагностического исследования, следует отметить, что у большинства пациентов под влиянием лечения препаратом Глиатилин существенно улучшились когнитивные функции, повысилась умственная работоспособность, улучшились показатели памяти, внимания.
Балльная динамика функционального состояния больных в восстановительном периоде ишемического инсульта и их способности к самообслуживанию, оцененных с помощью индекса Бартель, представлена в табл. 3.
В начале исследования средний балл по индексу Бартель у больных в восстановительном периоде ишемического инсульта составил 55,0 ± 5,0.
На фоне проводимой терапии через 2 недели (14 ± 2 дня), а затем через 1,5 месяца (44 ± 3 дня) у всех больных наблюдалось улучшение их функционального состояния, средний показатель индекса Бартель за этот период повысился на 14,5 балла и составил 69,5 балла.
К концу лечения, через 2,5 месяца (74 ± 3 дня), индекс Бартель у обследуемых больных был в пределах 78,5 ± 2,5, он возрос по сравнению с исходным визитом на 23,5 балла.
Степень инвалидизации по шкале Рэнкина в динамике на фоне лечения препаратом Глиатилин у больных в восстановительном периоде ишемического инсульта представлена в табл. 4.
Как видно из табл. 4, в начале исследования уровень инвалидизации по шкале Рэнкина у больных в восстановительном периоде ишемического инсульта составил 3,4 ± 0,2 балла.
На фоне лечения препаратом Глиатилин отмечалось уменьшение степени инвалидизации больных, которое характеризовалось уменьшением баллов по шкале Рэнкина, что свидетельствовало об улучшении функциональных возможностей пациентов в постинсультном периоде.
Результаты клинического исследования влияния курса Глиатилина на динамику показателей качества жизни представлены в табл. 5.
В результате тестирования по всем показателям опросника качества жизни SF-36 после терапии Глиатилином параметры качества жизни были существенно выше, чем до лечения. Почти по всем базовым значениям субсфер опросника SF-36 был превышен 50-балльный барьер, что свидетельствовало о достижении пациентами лучшего качества жизни.
Так, показатель «физическая активность» (переносимость физических нагрузок) и показатель «роль физических проблем в ограничении жизнедеятельности» достоверно возросли. Пациенты отмечали повышение внутренней энергии и энтузиазма при выполнении своих обычных повседневных обязанностей. На фоне лечения Глиатилином снизилась чувствительность к некоторым проявлениям физической боли, она меньше влияла на поведение, активность и объем выполняемых работ. Пациенты также значительно выше оценивали свое общее восприятие здоровья и жизнеспособность.
Улучшение общего физического состояния оказывало положительный эффект и на осознание своего психического здоровья, так как для большинства пациентов психологический статус тесно связан с физическим и функциональным. Пациенты отмечали повышение своей социальной активности, они получали удовлетворение от возможности поддерживать контакты с окружающими. Можно говорить о снижении степени фиксации на негативных эмоциях, когда пациенты чувствовали себя бесполезными и беспомощными, и повышении возможности расширения социального и психологического мира.
В ходе настоящего клинического исследования больных в восстановительном периоде ишемического инсульта было зарегистрировано 4 случая нежелательных явлений. У одного пациента была острая респираторная вирусная инфекция, данное неблагоприятное явление не связано с приемом исследуемого препарата. У двоих пациентов отмечалась легкая тошнота, которая прошла самостоятельно без коррекции дозы препарата, у одного больного возник металлический привкус во время инфузии. Ни у одного из пациентов проявление побочного эффекта не потребовало прекращения лечения.
Препарат не оказал отрицательного влияния на основные показатели сердечной деятельности и гемодинамики (артериальное давление и частоту сердечных сокращений): по завершении исследования у больных не отмечено достоверных изменений показателей частоты сердечных сокращений и артериального давления.
Назначение исследуемого препарата не оказало также какого-либо отрицательного влияния на показатели морфологического состава периферической крови, на уровни ее основных биохимических констант, характеризующих функциональное состояние печени и почек, а также не отразилось на показателях клинического анализа мочи.
Исследование показало, что применение препарата Глиатилин в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев у больных в восстановительном периоде ишемического инсульта позволяет ускорить восстановление неврологических функций, в том числе уменьшить очаговую неврологическую симптоматику.
Следует отметить, что терапевтические эффекты препарата Глиатилин направлены на коррекцию нарушений высших корковых функций. Эти эффекты включают восстановление концентрации внимания и памяти, улучшение умственной и физической работоспособности, эмоционального состояния больных, улучшение когнитивных функций.
Курсовое применение препарата Глиатилин у пациентов в восстановительном периоде ишемического инсульта положительно сказывается на качестве их жизни.
Препарат хорошо переносится пациентами и не вызывает каких-либо клинически значимых побочных эффектов при длительном приеме в течение 2,5 месяца.
Таким образом, препарат Глиатилин при назначении в дозе 1000 мг в/м 1 раз в сутки на протяжении 14 дней, а затем 400 мг (одна капсула) 2 раза в сутки в течение 2 месяцев может быть рекомендован к применению в качестве средства лечения больных в восстановительном периоде ишемического мозгового инсульта.
Список литературы / References
1. Cordonnier С. Leys D. Stroke: the bare essentials // Practical Neurol. — 2008. — 8. — 263-272.
2. World Health Organization. STEP wise approach to surveillance (STEPS).— Geneva, Switzerland: WHO, 2006 (http://www.who.int/ chp/steps/en).
3. World health statistics 2007. — Geneva, Switzerland: WHO, 2006 (http://www.who.int/statistics).
4. Olesen J. Baker M.G. Freud T. et al. Consensus document on European brain research // JNNP. — 2006. — 77 (suppl. 1). — il-49.
5. Andlin-Sobocki P. Jonsson B. Wittchen H.-U. et al. Costs of disorders of the brain in Europe // Europ. J. Neurol. — 2005. — 12 (suppl. l). — 1-24.
6. Mathers C.D. Loncar D. Projections of global mortality and burden of disease from 2002 to 2030 // PloS Medicine. — 2006. — 3. — e442.
7. World Health Organization. The World Health Report 2003: shaping the future. — Geneva, Switzerland: WHO, 2003.
8. Argentine C. Prencipe M. The burden of stroke: a need for prevention // Prevention of Ischemic Stroke / Eds. C. Fieschi, M. Fisher. — London: Martin Dunitz, 2000. — 1-5.
9. Warlow С. van Gijn J. Dennis M. et al. Stroke: practical management. — 3rd ed. — Blackwell Publishing, 2008.
10. Adams H.P. del Zoppo G. Alberts M.J. et al. Guidelines for the Early Management of Adults With Ischemic Stroke // Stroke. — 2007 — V. 38. — P. 1655-1711.
11. Мищенко Т.С. Эпидемиология цереброваскулярных заболеваний в Украине // Практична ангіоневрологія. — 2009. — № 1/1. — С. 5.
12. Верещагин Е.И. Современные возможности нейропротекции при острых нарушениях мозгового кровообращения и черепно-мозговой травме (обзор литературы) // Журнал интенсивной терапии. — 2006. — № 3. — С. 4-28.
13. Мищенко Т.С. Достижения в области сосудистых заболеваний головного мозга за последние 2 года // Здоров’я України. — 2010. — № 5. — 12-13.
14. Беленичев И.Ф. Черний В.И. Колесников Ю.М. и др. Рациональная нейропротекция. — Донецк: Издатель Заславский А.Ю. 2009. — 262 с.
15. Дафин Ф. Мурешан. Комплексный подход к нейропротекции и нейропластичности при лечении инсульта // Международный неврологический журнал — 2007. — № 6 (16).
16. Скворцова В.И. Стаховская Л.В. Шамалов Н.А. Кербиков О.О. Результаты многоцентрового исследования безопасности и эффективности церебролизина у больных с острым ишемическим инсультом // Журн. неврологии и психиатрии имени С.С. Корсакова. Прил. Инсульт. — 2006. — № 16. — С. 41-45.
17. Варлоу Ч.П. ван Гейн Ж. Инсульт: Практическое руководство для ведения больных. — СПб. 1998.
18. Seitz R.J. How imaging will guide rehabilitation // Curr. Opin. Neurol. — 2010. — 23. — 79-86.
19. Путилина М.В. Громадская Н.В. Лаздон Н.Е. Ермошкина Н.Ю. Особенности коррекции когнитивных нарушений у пациентов в остром периоде ишемического инсульта // Клиническая фармакология и терапия. — 2005. — Т. 14, № 3. — С. 71-74.
20. Яхно Н.К. Вейн А.М. Голубева В.В. и др. Психические нарушения при лакунарном таламическом инфаркте // Неврол. журн. — 2002. — Т. 7, № 2. — С. 34-37.
21. Bomstein N.M. Gur A.Y. Treves T.A. et al. Do silent brain infarctions predict the development of dementia after first ischemic stroke? // Stroke. — 1996. — Vol. 27. — P. 904-905.
22. Henon H. Pasquir F. Durieu I. et al. Pre-existing dementia in stroke patients. Baseline frequency, associated factors, and outcome // Stroke. — 1997. — Vol. 28. — P. 2429-2436.
23. Яхно Н.Н. Когнитивные расстройства в неврологической клинике // Неврол. журн. — 2006. — № 11 (прил. № 1). — С. 4-13.
24. Виленский Б.С. Кузнецов А.Н. Виноградов О.И. Новое направление применения церебролизина — повторное курсовое введение препарата больным, перенесшим полушарный ишемический инсульт // Неврол. журн. — 2007. — № 1. — С. 1-3.
25. Янишевский С.Н. Одинак М.М. Вознюк И.А. Онищенко Л.С. Клиническая и морфологическая оценка эффективности препаратов с метаболической активностью при острой церебральной ишемии // Современные подходы к диагностике и лечению нервных и психических заболеваний. — СПб. 2000. — 364-365.
26. Lopez C.M. Govoni S. Battaini F. et al. Effect of a new cognition enhancer, alpha-glycerylphosphorylcholine, on scopolamine-induced amnesia and brain acetylcholine // Pharmacol Biochem Behav. — 1991. — Vol. 39, Issue 4. — P. 835-840.
27. Fallbrook A. Turenne S.D. Mamalias N. Kish S.J. Ross B.M. Phosphatidylcholine and phosphatidylethanolamine metabolites may regulate brain phospholipid catabolism via inhibition of lysophospholipase activity // Brain Res. — 1999. — Vol. 10. — P. 207-210.
28. Khaselev N. Murphy R.C. Structural characterization of oxidized phospholipid products derived from arachidonate-containing plasmenyl glycerophosphocholine // J. Lipid Res. — 2000. — № 41. — Р. 564-572.
29. Одинак М.М. Вознюк И.А. Пирадов М.А. Румянцева С.А. Кузнецов А.Н. Янишевский С.Н. Голохвастов С.Ю. Цыган Н.В. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — Т. 4, № 1. — С. 20-27.
30. Вознюк И.А. Одинак М.М. Кузнецов А.Н. Применение глиатилина у больных с острым нарушением мозгового кровообращения // Сосудистая патология нервной системы. — СПб. 1998. — 167-172.
31. Антонов И.П. Эффективность применения препарата глиатилин у больных с острыми нарушениями мозгового кровообращения в раннем восстановительном периоде. — СПб. Terra Medica, 1998. — 36-44.
32. Черний Т.В. Андронова И.А. Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
33. Никонов В.В. Савицкая И.Б. Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии // Медицина неотложных состояний. — 2011. — № 1–2. — С. 101-106.
34. Amenta F. Carotenuto A. Fasanaro A.M. Lanari A. Previdi P. Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — V. 58. — P. 64-68.
35. Lucilla Parnetti, Francesco Amenta, Virgilio Galla. Choline alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mechanisms of Ageing and Development. — 2001. — Vol. 122. — Issue 16. — P. 2041-2055.
"Medexport Italia" Представительство
МЕДИЦИНСКИЙ ВЕСТНИК № 520. 28-05-2010
Портал российского врача
Глиатилин уже несколько лет применяется в России и, казалось бы, хорошо изучен врачами-неврологами. Однако в последнее время накапливается все больше данных, позволяющих взглянуть на этот препарат по-новому, переоценивая возможности его использования в разных сферах неврологии. Выясняется, что спектр применения данного препарата может быть существенно расширен. Об этом мы беседуем с одним из наиболее компетентных в данном вопросе специалистов — профессором М.М. ОДИНАКОМ. Мирослав Михайлович — доктор медицинских наук, член-корреспондент РАМН, заслуженный врач РФ, начальник кафедры и клиники нервных болезней Военно-медицинской академии, главный невролог Министерства обороны РФ, автор более 350 научных работ, 6 монографий, 3 учебников, 15 учебных и методических пособий.
Беседовал Алексей ГОРИЧЕНСКИЙ,