Проблемы с сердцем. Гипертрофия левого желудочка
07 июня, 2009
 В последнее время Вас беспокоит нарушение сердцебиения? Может быть, появилась одышка? А может, у Вас случался обморок? Вполне возможно, что Вы стали жертвой гипертрофии левого желудочка. Болезнь эта достаточно распространенная, к тому же большинство ее жертв это достаточно молодые люди. Опасность гипертрофии левого желудочка, а в частности гипертрофической кардиомиопатии заключается в том, что это заболевание нередко заканчивается внезапной смертью пациента. По статистике смертность от гипертрофии левого желудочка достигает четырех процентов.
В последнее время Вас беспокоит нарушение сердцебиения? Может быть, появилась одышка? А может, у Вас случался обморок? Вполне возможно, что Вы стали жертвой гипертрофии левого желудочка. Болезнь эта достаточно распространенная, к тому же большинство ее жертв это достаточно молодые люди. Опасность гипертрофии левого желудочка, а в частности гипертрофической кардиомиопатии заключается в том, что это заболевание нередко заканчивается внезапной смертью пациента. По статистике смертность от гипертрофии левого желудочка достигает четырех процентов.
Каковы причины возникновения этого заболевания? Как оно проявляет себя и поддается ли излечению? Прочитав до конца эту статью, Вы найдете ответы на эти вопросы.
Что такое гипертрофия левого желудочка?
При гипертрофии левого желудочка стенка левого желудочка сердца становится намного толще, чем это предусмотрено природой. Утолщение происходит не за счет внутреннего пространства, оно остается неизменным. Нередко при гипертрофии видоизменяется и перегородка между левым и правым желудочками. Вследствие гипертрофических изменений, стенка становится менее эластичной. Она может утолщаться равномерно, а может только в определенных областях. Это влияет на проявления заболевания.
Если перегородка расширилась неравномерно, то может быть нарушена работа основных клапанов сердца: митрального и аортального. Но при таком неравномерном расширении не всегда страдает работа клапанов.
Гипертрофия левого желудочка может быть верхушечной. Это происходит, если утолщается миокард лишь на верхушке. А еще может быть симметричная в сочетании с круговой гипертрофией миокарда левого желудочка.
Симптоматика гипертрофии левого желудочка настолько неоднородна, что на первый взгляд может запутать кого угодно. Есть множество больных страдающих гипертрофией левого желудочка и даже не догадывающихся об этом. Но нередко пациенты жалуются на боли в области сердца. Они могут быть разной интенсивности и разного типа. Не редка и стенокардия. Она вызывается тем, что вследствие гипертрофии сжимаются сосуды, питающие сердечную мышцу, но мышца стала больше, ей надо больше питательных компонентов и кислорода. Развивается голодание миокарда.
При гипертрофии обычным явлением можно назвать аритмию. Сердце то частит, то вдруг замирает. В некоторых случаях для клинической картины гипертрофии левого желудочка характерна и потеря сознания. Приходят пациенты и с жалобами на одышку, а у них диагностируется гипертрофия левого желудочка.
Почему же возникает гипертрофия левого желудочка, а точнее кардиомиопатия?
Ученые совершенно точно могут сказать, что есть семейная предрасположенность к гипертрофии левого желудочка. Хорошенько присмотритесь к биографиям своих дедушек и бабушек. Возможно, Вы обнаружите среди них подобных больных. Это послужит пищей для размышления.
Если же больных родственников нет, то есть еще одна теория, достаточно загадочная, которая совершенно ничего не объясняет. У некоторых людей под влиянием неизвестных факторов начинают мутировать гены, которые напрямую связаны с состоянием клеток миокарда. Под влиянием этой мутации сердечная мышца разрастается.
Как лечить гипертрофию левого желудочка?
В заключении медколлегия tiensmed.ru хочет обратить Ваше внимание на следующее. Основное лечение гипертрофии левого желудочка заключается в том, чтобы при помощи медикаментов улучшить работу миокарда. Если же состояние ухудшается, и лекарства не дают эффекта, делают операцию. В ходе операции перегородке придают нормальную физиологическую форму. Если начать вовремя лечить гипертрофию, то можно прожить долгие годы. Можно даже выносить и родить малыша. Единственное, что запрещено больным гипертрофической кардиомиопатией – это тяжелый физический труд.
Перед применением необходимо проконсультироваться со специалистом.
Автор: Пашков М.К. Координатор проекта по контенту.
Мерцательная аритмия: общие сведения
Мерцательная аритимия (полная аритмия. абсолютная аритмия) — нарушение ритма сердца с фибрилляцией либо трепетанием предсердий и полной дезорганизацией ритмической деятельности желудочков. Может быть пароксизмальной или постоянной. Наиболее часто развивается при кардиосклерозе. митральном стенозе. тиреотоксикозе ; сопровождается беспорядочным пульсом, иногда с дефицитом его. Ведет к сердечной недостаточности.
Это широко распространенная аритмия, она имеет две формы — пароксизмальную мерцательную аритмию и постоянную мерцательную аритмию. Пароксизмы мерцательной аритмии возникают на фоне разнообразных сердечных и легочных заболеваний. если они сопровождаются тяжелой гипоксией. гиперкапнией. метаболическими нарушениями. гемодинамическими нарушениями. иногда — в отсутствие органических заболеваний сердца, особенно после тяжелой физической или эмоциональной нагрузки, хирургических вмешательств. алкогольной интоксикации.
Так называемую идиопатическую мерцательную аритмию многие рассматривают как проявление синдрома брадикардии-тахикардии.
Клинические проявления мерцательной аритмии таковы:
— остановка синусового узла перед восстановлением синусового ритма (может привести к обмороку );
При митральном стенозе продолжительность диастолы тоже имеет очень важное значение, поэтому мерцательная аритмия с высокой ЧСС может быстро привести к отеку легких.
Длительная мерцательная аритмия с высокой ЧСС может, кроме того, вызвать аритмогенную кардиомиопатию (из-за постоянно высокого сердечного выброса).
На ЭКГ при мерцательной аритмии ( рис. 231.2. Г) зубцов Р нет, вместо них — беспорядочные мелко- или крупноволновые колебания изолинии с частотой 350-600 в мин. Ритм желудочков хаотичный. Частые предсердные импульсы поступают в АВ-узел ; к желудочкам они не проходят, но приводят АВ-узел в состояние относительной рефрактерности. Это явление подобно тому, что наблюдается при ретроградном проведении желудочковых экстрасистол к АВ-узлу, и называется скрытым проведением. Именно этим явлением объясняется тот факт, что при мерцательной аритмии ЧСС обычно ниже, чем при трепетании предсердий. хотя число предсердных импульсов существенно выше.
Если мерцательная аритмия переходит в трепетание предсердий (например, под действием хинидина или флекаинида ), эффект скрытого проведения исчезает и ЧСС может резко увеличиться.
Если на фоне мерцательной аритмии ритм желудочков становится правильным и редким (30-60 в мин), то следует заподозрить полную АВ-блокаду ( феномен Фредерика ). Если же ритм становится правильным и частым (более 100 в мин), это означает, что к феномену Фредерика добавился ускоренный АВ-узловой или идиовентрикулярный ритм. Причиной всех перечисленных нарушений может быть гликозидная интоксикация.
При мерцательной аритмии нет волн A венозного пульса, а амплитуда артериального пульса все время меняется. Громкость I тона тоже в разных циклах разная. По данным ЭхоКГ, левое предсердие расширено. Если переднезадний размер левого предсердия превышает 45 мм, то восстановить синусовый ритм, а затем поддерживать его становится трудно.
Артериальная гипертония и гипертрофия миокарда левого желудочка. Лозартан: «верный друг лучше новых двух»
Остроумова О.Д. Шорикова Е.Г. Галеева Н.Ю.
Тяжесть клинических проявлений и прогноз больных с артериальной гипертонией (АГ) определяется не только степенью повышения артериального давления (АД), но и в значительной мере поражением органов–мишеней, в том числе наличием гипертрофии миокарда левого желудочка (ГМЛЖ). Она характеризуется гипертрофией миоцитов, повышением содержания коллагена и фиброзом миокарда. Данные изменения способствуют повышению потребности миокарда в кислороде, а следовательно, развитию ишемии, изменению систолической и диастолической функций, аритмии. Распространенность ГМЛЖ в популяции достигает 13,3 на 1 тыс. человек (NHANES II).
В настоящее время ГМЛЖ рассматривают как независимый предиктор ранней сердечно–сосудистой заболеваемости и смертности. У пациентов с АГ и имеющих ГМЛЖ риск развития сердечно–сосудистых событий достоверно выше по сравнению с больными АГ без ГМЛЖ (рис. 1). Так, в течение двухлетнего наблюдения установлено, что инсульт и ИБС при ГМЛЖ встречаются почти в 3 раза, а сердечная недостаточность – в 4 раза чаще, чем у пациентов с АГ, но без ГМЛЖ. По данным Casale и соавт. (1986), наличие ГМЛЖ обусловило развитие осложнений (смерть, инфаркт миокарда. инсульт) в 4,6% случаев (по сравнению с 1,2% в группе без ГМЛЖ); по данным Koren и соавт. (1991), сердечная смерть развивалась в 1,4% случаев с ГМЛЖ (для сравнения – 0,1% без ГМЛЖ), а сердечно–сосудистые осложнения – в 6,3% случаев с ГМЛЖ (для сравнения –. 2,2% без ГМЛЖ); по данным Silberberg и соавт. (1989), риск смерти при ГМЛЖ составил 15,2% (по сравнению с 9,6% без ГМЛЖ); в исследовании Parfrey и соавт. (1990) смерть при ГМЛЖ была зарегистрирована у 15,3% пациентов и у 4,8% без ГМЛЖ. При сравнении прогностического значения разных факторов риска было обнаружено, что наличие ГМЛЖ обусловливает значительно более высокий относительный риск кардиоваскулярных осложнений, чем наличие гиперхолестеринемии, сахарного диабета, а также курения. Это связано с тем, что ГМЛЖ миокарда усугубляет его ишемию, способствует нарушениям сократимости, наполнения левого желудочка. развитию желудочковых аритмий. Наличие ГМЛЖ ассоциируется с нарушением коронарной гемодинамики, систолической и диастолической дисфункцией сердца, с повышением риска развития сердечной недостаточности и жизнеугрожающих аритмий, ускорением прогрессирования коронарного атеросклероза, снижением коронарного резерва, возникновением стенокардии независимо от наличия атеросклеротических изменений коронарных артерий.
Развитие ГМЛЖ связано с различными генетическими, демографическими, клиническими и биохимическими факторами. Демографические факторы и образ жизни, ассоциированные с развитием ГМЛЖ, включают возраст, пол, физическую активность, расу, ожирение, чувствительность к соли, количество потребляемого алкоголя. Известно, что в возрасте до 55 лет ГМЛЖ несколько чаще наблюдается у мужчин, чем у женщин, однако в дальнейшем ее частота у лиц разного пола примерно одинакова. Число больных с ГМЛЖ увеличивается с возрастом (рис. 2). Важное значение для развития ГМЛЖ имеет тяжесть клинического течения АГ, среди пациентов с АГ 3 степени (АД 180/110 мм рт.ст. и выше) ГМЛЖ встречается в 2 раза чаще, чем при АГ 1 степени (АД 140–159/90–99 мм рт.ст.) (рис. 2). Кроме степени повышения АД, важную роль в развитии ГМЛЖ играет избыточный утренний подъем АД. Значительное повышение АД в утренние часы ассоциировано с развитием ГМЛЖ как у леченных, так и у нелеченных больных АГ. Развитию ГМЛЖ также способствуют гемодинамические факторы: нагрузка давлением и объемом, изменение структуры артерий, нарушения реологических свойств крови.
Для диагностики ГМЛЖ могут использоваться различные методы: рентгенография, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), радиоизотопная вентрикулография, компьютерная томография, магнитно–резонансная томография. Наибольшее клиническое значение в настоящее время имеют ЭКГ и ЭхоКГ; рентгенография сегодня уже не играет принципиальной роли, а более сложные визуализирующие исследования требуют дорогостоящей аппаратуры и далеко не везде могут быть доступны (кроме того, их преимущество перед ЭхоКГ невелико). Согласно 4–й редакции российских рекомендаций по диагностике и лечению АГ (2010 г.) к ЭКГ–признакам ГМЛЖ относят:
1. Признак Соколова–Лайона более 38 мм
2. Корнельское произведение более 2440 мм х мс.
При ЭхоКГ рассчитывают индекс массы миокарда левого желудочка (ИММЛЖ). Если его значение > 125 г/м2 у мужчин и > 110 г/м2 у женщин, диагностируют ГМЛЖ.
В плане обследования сердца, как органа–мишени АГ, в российских рекомендациях сказано, что для оценки состояния сердца выполняются ЭКГ и ЭхоКГ. ЭКГ по критериям индекса Соколова–Лайона (SV1+RV5–6 > 38 мм) и Корнельского произведения ((RAVL+SV5) мм х QRS мс >2440 мм х мс) позволяет выявить ГМЛЖ. Более чувствительным и специфичным методом оценки поражения сердца при АГ является расчет ИММЛЖ с помощью ЭхоКГ*. Верхнее значение нормы для этого показателя составляет 124 г/м2 для мужчин и 109 г/м2 для женщин. По соотношению толщины задней стенки левого желудочка (ТЗСЛЖ) и его радиуса (РЛЖ), а также с учетом величины ИММЛЖ можно определить тип ремоделирования левого желудочка. При ТЗСЛЖ/РЛЖ >0,42 и увеличении ИММЛЖ имеет место концентрическая ГМЛЖ, при ТЗСЛЖ/РЛЖ 0,42 и при нормальном ИММЛЖ – концентрическое ремоделирование. Прогностически наименее благоприятной является концентрическая ГМЛЖ. ЭхоКГ позволяет также оценить диастолическую и систолическую функции левого желудочка.
ГМЛЖ представляет собой физиологическую реакцию сердца на увеличение постнагрузки на левый желудочек, связанное с повышением общего периферического сосудистого сопротивления. Однако по мере ее прогрессирования возникает несоответствие между возрастающей потребностью гипертрофированного миокарда в кислороде и ограниченными возможностями доставки его с кровью по коронарным артериям. Патофизиологически ГМЛЖ – это реактивное увеличение массы миокарда левого желудочка в ответ на повышенную рабочую нагрузку, сопровождающееся гипертрофией миоцитов, а также повышением содержания коллагена и фиброзом. В основе развития ГМЛЖ лежат в первую очередь патологические эффекты ангиотензина II, которые обусловлены стимуляцией АТ1–рецепторов. Уровни концентрации ангиотензина II коррелируют с выраженностью ГМЛЖ, поскольку чем выше его концентрация, тем более активно проходят такие процессы, как вазоконстрикция, оксидативный стресс, усиленное высвобождение факторов роста, что стимулирует пролиферацию кардиомиоцитов, а в последующем – фиброз, ремоделирование миокарда, апоптоз его клеток. В то же время в связи с вазоконстрикцией и другими эффектами ангиотензина II подобные процессы происходят и в гладкомышечном слое артерий, вследствие чего возрастает общее периферическое сопротивление, еще больше увеличивается нагрузка на левый желудочек и ускоряется его гипертрофия. Таким образом происходит единый процесс сердечно–сосудистого ремоделирования, отражающий трансформацию функциональных изменений в структурные. В миокарде имеют место увеличение размеров миоцитов, изменение их изоэнзиматического профиля, повышение содержания субэндокардиального коллагена, что приводит к изменению растяжимости, сократимости, проводимости миокарда, гипертрофии левого желудочка, его ишемии и развитию сердечной недостаточности в конечном итоге. Согласно определению Ю.Н. Беленкова (2002) ремоделирование левого желудочка представляет собой его структурно–геометрические изменения, в том числе процессы гипертрофии левого желудочка и дилатации, которые приводят к изменениям геометрии, сферичности и нарушениям систолической и диастолической функции.
Следует отметить, что генетические и гуморальные факторы отвечают за степень гипертрофии миокарда, механический фактор – за ее направление (концентрическая, эксцентрическая), а на тип ремоделирования влияют как механический, так и экстракардиальные факторы. Это имеет значение в связи с тем, что не только выраженность ГМЛЖ, но и сама геометрия левого желудочка определяет риск сердечно–сосудистых осложнений. Если происходит концентрическое ремоделирование левого желудочка без гипертрофии стенок миокарда, вероятность сердечно–сосудистых осложнений в течение 10 лет составляет 15%; при эксцентрической ГМЛЖ она достигает 25%; при концентрической ГМЛЖ – 30%.
Наиболее существенную роль в развитии гипертрофии и ремоделирования левого желудочка играет собственная кардиальная ренин–ангиотензиновая система (РААС). Известно, что РААС в организме представлена как в плазме крови, так и в тканях. При этом плазменная часть РААС составляет всего 10% и вызывает немедленные эффекты (сердечные, почечные), в то время как большая часть (90%) РААС распределена в различных тканях и ответственна за длительные эффекты, в том числе за формирование необратимых изменений в органах и тканях. Ангиотензинпревращающий фермент (АПФ) в тканях сердца первично представлен в эндотелиальных клетках и фибробластах. АПФ больше в предсердиях, чем в желудочках, он присутствует во всех клапанах, сосудах сердца, аорте, легочных артериях, эндокарде и эпикарде. Собственно сократительная система сердца содержит мало АПФ: здесь превращение ангиотензина I в ангиотензин II происходит преимущественно альтернативным путем – с помощью фермента химазы. В связи с исключительной ролью РААС в развитии ГМЛЖ из всех ее этиопатогенетических факторов (возраст, пол, генетические особенности, раса, потребление соли, нейрогуморальные нарушения, ожирение, АГ и др.) наибольшее значение имеет АГ. Именно АГ является основной причиной развития гипертрофии миокарда. Следовательно, раннее и эффективное лечение АГ предотвращает развитие гипертрофии и ремоделирования левого желудочка, то есть улучшается прогноз для пациента в целом. Кроме того, при уже сформировавшейся ГМЛЖ на фоне эффективной антигипертензивной терапии может уменьшаться выраженность патологических изменений миокарда, что также улучшает прогноз [Verdecchia et al. 1998].
Необходимо подробнее остановиться на роли различных антигипертензивных средств в регрессе ГМЛЖ. Оказалось, что основные классы антигипертензивных препаратов в разной степени влияют на ее течение (рис. 3). Показано, что наиболее сильно на регресс ГМЛЖ влияют блокаторы рецепторов ангиотензина II (БРА), ингибиторы АПФ (иАПФ) и блокаторы кальциевых каналов, а β–блокаторы и диуретики – в значительно меньшей степени. Правда, необходимо отметить, что у диуретиков и β–блокаторов нет класс–эффекта в отношении регресса ГМЛЖ. Среди диуретиков лишь индапамид ретард доказал свою способность вызывать регресс ГМЛЖ, а среди β–блокаторов таким эффектом обладают только липофильные представители, например, бисопролол, метопролола сукцинат.
Согласно российским рекомендациям по диагностике и лечению АГ (4 пересмотр, 2010 г.) при наличии ГМЛЖ у больных АГ предпочтение следует отдавать БРА, иАПФ и длительнодействующим дигидропиридиновым антагонистам кальция. Кроме того, в рекомендациях сказано, что для замедления темпов прогрессирования поражений органов–мишеней и возможности регресса их патологических изменений хорошо зарекомендовали себя иАПФ и БРА. Они доказали свою эффективность в плане уменьшения выраженности ГМЛЖ, включая ее фиброзный компонент.
В связи с этим хотелось бы акцентировать внимание на роли БРА в лечении ГМЛЖ. Ряд клинических исследований, в том числе такие крупные, как LIFE, убедительно доказали, что БРА индуцируют регресс гипертрофии миокарда. Этот эффект достигается не только благодаря собственно антигипертензивному действию БРА, но и за счет нейтрализации органоповреждающего действия ангиотензина II, то есть в связи с наличием дополнительных (АД–независимых) органопротективных влияний. Препараты этой группы селективно «выключают» все неблагоприятные эффекты ангиотензина II, реализуемые через АТ1–рецепторы. Этим БРА принципиально отличаются от другого класса ингибиторов РААС – иАПФ.
Исследование LIFE (Losartan Intervention For Endpoint reduction in hypertension) является краеугольным в формировании практических рекомендаций для лечения больных АГ и ГМЛЖ. Идея проведения исследования LIFE базировалась на гипотезе, согласно которой длительная блокада рецепторов ангиотензина II, с точки зрения предупреждения сердечно–сосудистой заболеваемости и смертности при АГ, сочетающейся с ГМЛЖ, будет эффективнее β–адреноблокады. Атенолол в качестве препарата сравнения был выбран в связи с тем, что на тот момент он являлся одним из наиболее широко применяемых β–адреноблокаторов. Он оказывает сходный с лозартаном антигипертензивный эффект и обладает подтвержденной в некоторых плацебо–контролируемых исследованиях способностью снижать риск сердечно–сосудистых осложнений. В случаях, когда необходимый контроль АД не достигался, к обоим препаратам добавлялся гидрохлоротиазид.
В исследовании LIFE (двойное слепое рандомизированное исследование в условиях амбулаторной практики) участвовали 9193 пациента (45,9% мужчин, 54,1% женщин) в возрасте от 55 до 88 лет (в среднем 66,9 лет) с ранее леченной или нелеченной АГ и признаками ГМЛЖ, выявленными на стандартной ЭКГ. Больные были рандомизированы в группу лозартана или в группу атенолола, если после 1–2–недельного назначения плацебо в положении сидя отмечалось систолическое АД (САД) 160–200 мм рт.ст. и/или диастолическое АД (ДАД) 95–115 мм рт.ст. (в среднем 174,4/97,8 мм рт.ст.). В исследование не включались пациенты с вторичной (симптоматической) АГ; инфарктом миокарда или инсультом в течение последних 6 месяцев; стенокардией, требующей назначения β–адреноблокаторов или антагонистов кальция; сердечной недостаточностью; другими состояниями, при которых, по мнению лечащего врача, необходимо назначение лозартана или иных антагонистов ангиотензиновых рецепторов, атенолола или иных β–адреноблокаторов, гидрохлоротиазида или ингибиторов АПФ.
Начальная доза лозартана составила 50 мг один раз в сутки, а атенолола – 50 мг один раз в сутки (рис. 4). Если в течение 2 месяцев не удавалось достигнуть целевого АД (140/90 мм рт. ст.), к лечению добавляли гидрохлоротиазид (12,5 мг/сут). Если и после этого целевое АД не было достигнуто, дозу лозартана и атенолола увеличивали до 100 мг. В случаях, когда максимальные дозы исследуемых препаратов в комбинации с диуретиком не обеспечивали адекватного контроля АД, разрешалось применение других антигипертензивных средств, за исключением антагонистов ангиотензина II, ингибиторов АПФ и β–адреноблокаторов).
Наблюдение за больными продолжалось не менее 4 лет (в среднем 4,8 года) и до момента развития осложнений, составляющих комбинированную первичную (главную) конечную точку (смертность от сердечно–сосудистых причин, нефатальные инфаркт миокарда или инсульт). Другими регистрируемыми конечными точками (исходами) являлись смертность от любых причин, стенокардия или сердечная недостаточность, требующие госпитализации, коронарные или периферические реваскуляризационные процедуры, регрессия ЭКГ–документированной ГМЛЖ (по двум методикам), новые случаи сахарного диабета.
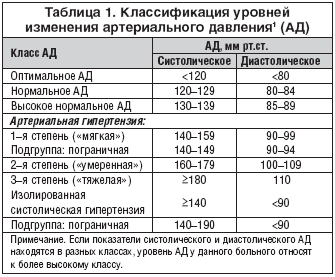
Результаты исследования LIFE подтвердили высокую антигипертензивную эффективность лозартана и атенолола. К концу наблюдения САД в положении сидя снизилось в группе лозартана в среднем на 30,2 мм рт.ст. а в группе атенолола – на 29,1 мм рт.ст. ДАД в группах лозартана и атенолола снизилось в среднем на 16,6 и 16,8 мм рт.ст. соответственно. Таким образом, лозартан и атенолол обладали практически одинаковым антигипертензивным действием (рис. 5). Средние дозы этих препаратов к моменту завершения исследования составляли 82 и 79 мг в сут. соответственно. Использование дополнительных разрешенных антигипертензивных средств в группах было сходным. Однако поскольку вопрос о дозах является едва ли ни самым главным для клинической практики, необходимо остановиться на этом подробнее (табл. 1).
Как видно из таблицы, лишь около 10% больных в каждой группе получали монотерапию исследуемыми препаратами в стартовой дозе, в том числе лозартаном в дозе 10 мг. Каждый пятый пациент (20%) получал комбинацию, в том числе лозартан 10 мг плюс гидрохлоротиазид (ГХТ) 12,5 мг. Большинство же больных получали 100 мг исследуемого препарата, в том числе с ГХТ.
Результаты исследования LIFE оказались удивительными. Лозартан достоверно превосходил атенолол с точки зрения воздействия на комбинированный риск сердечно–сосудистых осложнений (на 13%) (рис. 6) и, главное, на риск фатального и нефатального инсульта (на 25%) (рис. 7). И это при одинаковом снижении АД! Не удивляет только факт, что лозартан достоверно превосходил атенолол по вероятности развития новых случаев сахарного диабета (на 25%), учитывая негативное влияние атенолола на углеводный обмен. В сравнении с атенололом лозартан снижал и общую смертность (на 10%), но этот эффект не являлся статистически значимым. Как следует из рисунков 6 и 7, различие в эффективности атенолола и лозартана (в пользу последнего) прогрессивно возрастает по мере увеличения продолжительности применения. Это справедливо как в отношении воздействия на комбинированный риск сердечно–сосудистых осложнений, так и на риск инсульта.
Почему же лозартан оказался эффективнее атенолола в плане профилактики инсульта и сердечно–сосудистых осложнений при равном гипотензивном эффекте? Здесь следует вспомнить, что в исследовании LIFE все пациенты имели ГМЛЖ, а как было сказано выше, она является самостоятельным независимым фактором риска развития осложнений. Лозартан, как и следовало ожидать, значительно более выраженно, чем атенолол, способствовал обратному развитию ГМЛЖ (Р
Эти другие механизмы протекторного (защитного) действия лозартана на сердечно–сосудистую систему требуют тщательного изучения. Учитывая схожесть антигипертензивного действия атенолола и лозартана, эффекты последнего не могут быть объяснены исключительно снижением АД. В определенной степени преимущество лозартана перед атенололом может быть связано с более выраженным позитивным влиянием на ГМЛЖ, но и этот эффект, как свидетельствуют данные исследования LIFE, не вполне объясняет полученные результаты. Можно предполагать, что существенный вклад в протекторное действие лозартана вносит обеспечиваемая им селективная блокада неблагоприятных эффектов ангиотензина II. Кроме того, в экспериментальных и клинических работах выявлено, что лозартан, аналогично ингибиторам АПФ, способен оказывать антиатерогенное действие.
Существует и еще одно уникальное свойство лозартана, которое также объясняет его эффективность в исследовании LIFE. В нескольких больших эпидемиологических исследованиях была выявлена взаимосвязь повышенного уровня мочевой кислоты сыворотки крови и риска развития сердечно–сосудистых осложнений как в общей популяции, так и у больных АГ. Считают, что гиперурикемия связана с эндотелиальной дисфункцией, замедлением окислительного метаболизма, адгезией тромбоцитов, нарушением реологии крови и агрегации. Признаком, который отличает лозартан от других БРА, является способность молекулы лозартана (но не его активных метаболитов) снижать уровень мочевой кислоты путем влияния на реабсорбцию уратов в почечных проксимальных канальцах. В норме и у больных АГ введение лозартана вызывает устойчивое снижение уровней мочевой кислоты. Ингибиторы АПФ и антагонисты кальция оказывают слабый урикозурический эффект, но не снижают концентрацию мочевой кислоты, диуретики увеличивают ее уровень, в то время как β–блокаторы не влияют на концентрацию мочевой кислоты.
Специально проведенный анализ взаимосвязи уровня мочевой кислоты при терапии лозартаном и первичной комбинированной конечной точки (кардиоваскулярная смертность, фатальный и нефатальный инфаркт миокарда, фатальный и нефатальный инсульт) в исследовании LIFE показал, что замедление нарастания уровня мочевой кислоты под действием лозартана (в сравнении с атенололом) вносит значительный вклад (29%) в снижение частоты возникновения событий первичной конечной точки. Данная взаимосвязь была особенно выражена у женщин. Следовательно, 13%–е снижение риска сердечно–сосудистых осложнений при приеме лозартана в сравнении с атенололом почти на треть было обусловлено гипоурикемическим эффектом лозартана. Следовательно, данный эффект лозартана может быть одной из причин снижения риска сердечно–сосудистых осложнений в большей степени, чем просто эффект снижения АД (как у других антигипертензивных препаратов).
Таким образом, результаты исследования LIFE имеют важные последствия для практического здравоохранения. Представитель класса БРА лозартан продемонстрировал уникальные свойства и исключительно благоприятное соотношение эффективность/безопасность.
Однако в реальной практике важна доступность современной терапии АГ для широкого круга пациентов. В этой связи появление так называемых дженериковых препаратов, соответствующих международным стандартам качества, позволяет снизить затраты на лечение и сделать современную терапию доступной большему числу пациентов.
С позиций клинициста немаловажным условием позитивного отношения к дженерику является качество его производства и репутация производителя. Однако, основным отличием «хорошего дженерика» является наличие собственных клинических исследований. В этой связи большие перспективы имеет препарат Лориста компании КРКА, недавно появившийся на российском рынке, а также его фиксированные комбинации с ГХТ. Лориста имеет уникальный набор дозировок – 12,5 мг, 25 мг, 50 мг и 100 мг. Для лечения АГ применяют дозы 50 и 100 мг, для максимально эффективной церебропротекции необходима доза 100 мг (см. результаты исследования LIFE и табл.1). Дозы 12,5 и 25 мг применяют для лечения больных с хронической сердечной недостаточностью. Еще более важное значение имеет появление на российском рынке фиксированных комбинаций: Лориста Н (лозартан 50 мг/ГХТ 12,5 мг) и Лориста НД (лозартан 100 мг/ГХТ 25 мг). Лориста H является препратом первой линии для всех больных АГ 1–2 степени, имеющих высокий и очень высокий риск развития сердечно–сосудистых осложнений. В случае если необходимо усиление антигипертензивного эффекта, пациенту может быть назначен препарат Лориста HД. Лориста HД может быть назначена и сразу, в качестве стартовой терапии, больному с АГ 3 степени (АД 180 мм рт.ст. и выше/110 мм рт.ст. и выше).
Таким образом, появление этих препаратов позволит сделать лечение лозартаном более доступным широкому кругу пациентов, а наличие большого разнообразия доз будет способствовать максимальной индивидуализации терапии.
*Масса миокарда левого желудочка (г) = 1,04 х [(ТМЖП, см + ТЗС, см + КДР, см)3– (КДР, см)3] – 13,6
ИММЛЖ = ММЛЖ/площадь поверхности тела
Площадь поверхности тела = масса тела 0,425 (кг) х рост 0,725 (см) х 0,007184 (г/м2).
Литература
1. Диагностика и лечение артериальной гипертензии. Журнал «Системные гипертензии» 2010; 3: 5–26
2. Руководство по артериальной гипертонии. Под ред. Е.И. Чазова, И.Е. Чазовой. М. Медиа Медика, 2005. – С.201–217, 596–616.
3. Danlof B, Devereux RB, Kieldsen SE, et al, for the LIFE study group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002;359:995–1003.