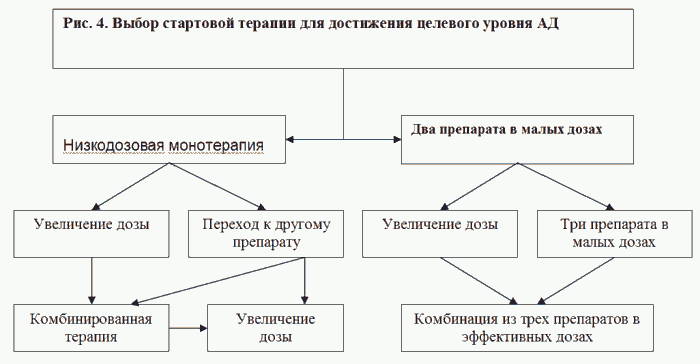
Лекарственная терапия в кардиологии. Риск и польза лекарств
В 2004 г. американцы потратили на лекарственные препараты $244 млрд. Предполагают, что нежелательные эффекты лекарств служат причиной каждого 4-6-го летального исхода в США и обходятся в $19-27 млрд ежегодно; кроме того, эти эффекты являются непосредственной причиной 2-3% всех госпитализаций. Широкое распространение сердечно-сосудистых заболеваний и рост случаев применения не только экстренной, по и длительной терапии в целях профилактики объясняют преобладающую статью расходов на сердечно-сосудистые препараты (20% всех затрат).
Полагают, что в 2006 г. эта сумма составит $50,1 млрд. С ростом достижений не только в кардиологии, но и в других областях клинической медицины кардиолог все чаще сталкивается с ситуацией, когда пациент принимает несколько препаратов, с которыми врач еще недостаточно знаком. Цель наших статей — определить принципы действия и взаимодействия лекарств, что позволит проводить наиболее безопасное и эффективное лечение каждого конкретного больного.
При назначении любого лекарственного препарата основополагающим служит предположение, что ожидаемая польза превосходит предполагаемый риск. Изначально эффект лекарственной терапии определялся в клинических исследованиях перед одобрением и продажей препарата с участием нескольких тысяч пациентов. В конечном счете эффективность и безопасность любого препарата определяли после того, как лекарство было продано и использовано сотнями тысяч пациентов.
Когда препарат назначают в экстренной ситуации при жизнеугрожающих состояниях, эффект зачастую очевиден: инсулин — при диабетическом кето-ацидозе, нитропруссид — при гипертонической энцефалопатии, лидокаин — при желудочковой тахикардии (ЖТ). Тем не менее экстраполяция очевидных эффектов на другие клинические ситуации не всегда оправдана.

Лидокаин для купирования ЖТ повсеместно применяли в профилактических целях в случае острого инфаркта миокарда до тех пор, пока не стало очевидным, что в такой ситуации лидокаин не влияет на летальность. Результаты исследования CAST (Cardiac Arrhythmia Suppression Trial) подтвердили ошибочность распространения этого до конца не понятого физиологического феномена па длительную терапию. В этом исследовании проверялась гипотеза, что подавление желудочковой эктопической активности (очевидного фактора риска внезапной смерти при инфаркте миокарда) снизит смертность; это представление прочно укоренилось в кардиологической практике в 1970-1980-е гг.
В исследовании CAST антиаритмиками из ряда блокаторов каналов натрия подавляли эктопические желудочковые сокращения, но одновременно неожиданно в 3 раза повысилась летальность. В этом случае оценка подавлении аритмии как суррогатного маркера желаемого действия препарата (снижения смертности) была ошибочной, т.к. патофизиология лежащего в основе процесса была осмыслена неверно.
Подобным образом снижение сократимости миокарда при сердечной недостаточности способствовало созданию и применению препаратов с положительной инотропной активностью, но это привело к увеличению смертности, вероятно в результате развития лекарственно обусловленных аритмий. Тем не менее клинические исследования с назначением этих препаратов указали на уменьшение симптоматики. Таким образом, врач и пациент’ могут выбрать лечение препаратами с положительным инотропным действием, учитывая возможный риск.
Эти примеры подчеркивают необходимость взаимодействия врача и пациента и придают особое значение ожидаемой пользе от терапии, а также ясному пониманию патофизиологии болезни и ответной реакции на лекарственную терапию в процессе создания и назначения лекарственных препаратов.
Оглавление темы «Качество медицинской помощи в кардиологии»:
Скрининг сердечно-сосудистого риска у бессимптомных пациентов Текст научной статьи по специальности « Медицина и здравоохранение »
Новости науки
Oculus создаст виртуальный мультфильм про ежика
Компания Oculus, занимающаяся разработками в сфере виртуальной реальности, опубликовала информацию о создании виртуального мультфильма. Об этом сообщается в блоге компании.
Читать полностью
-
Шипоклювки научились угрожать нападающим воронам появлением ястреба
Биологи из Австралии, Финляндии и Великобритании выявили механизм, по которому птицы из семейства шипоклювковых спасаются от хищников, разоряющих их гнезда. Во время атаки вороны Strepera graculina на гнездо шипоклювки, та изображает крик другой безобидной птицы — медососа, — когда на него нападает ястреб. Вороны стоят ниже ястребов в пищевой пирамиде, поэтому пугаются и отвлекаются, чтобы осмотреть небо в поисках приближающегося хищника. По мнению ученых, этой задержки хватает шипоклювкам и их потомству, чтобы покинуть гнездо и спрятаться.
Стартовала кампания по сбору средств на производство водостойкого квадрокоптера с возможностью установки сонара. Подробнее можно прочитать на странице проекта на краудфандинговой платформе Kickstarter.
Читать полностью
Проблемы применения антитромбоцитарной терапии в кардиологии
Показано, что повысить доступность этого вида терапии в реальной клинической практике может позволить применение качественных генерических препаратов клопидогрела (Плагрил, Dr. Reddy’s).
Антитромбоцитарная терапия на сегодняшний день является важнейшим звеном первичной и вторичной профилактики сердечно-сосудистых заболеваний. Один из наиболее изученных препаратов для антиагрегантной терапии с доказанной клинической эффективностью – ацетилсалициловая кислота (АСК). Во многих клинических исследованиях убедительно показано, что у больных с нестабильной стенокардией, острым инфарктом миокарда (ИМ) или у лиц, перенесших ИМ, препарат снижает частоту возникновения новых смертельных и несмертельных коронарных эпизодов [1–3]. Антитромбоцитарная терапия (АТТ) – одно из наиболее активно развивающихся направлений фармакотерапии в кардиологии. В последние годы появляются новые стандарты лечения пациентов с высоким риском тромбоза: им назначается двойная антиагрегантная терапия, включающая как препарат ацетилсалициловой кислоты, так и тиенопиридин (клопидогрел).
Отметим, что в настоящее время клопидогрел успешно применяется в лечении пациентов с клиническими проявлениями коронарного атеросклероза, в том числе при развитии острых тромботических осложнений. Механизм действия препарата отличается от влияния «классического» антиагреганта – АСК, антитромботический эффект которой ограничивается ингибированием продукции тромбоксана А2 при отсутствии воздействия на агрегацию тромбоцитов, индуцируемую другими факторами (в частности, аденозиндифосфатом (АДФ) и коллагеном) [4]. Клопидогрел, будучи препаратом группы тиенопиридинов, действует на P2Y12-рецепторы тромбоцитов, селективно подавляя их связывание с АДФ и препятствуя активации гликопротеинового рецепторного комплекса IIb/IIIa. Соответственно, тромбоциты, подвергшиеся воздействию клопидогрела, становятся невосприимчивыми к стимуляции АДФ, что необратимо подавляет их агрегационную способность в течение всего срока их жизни (7–10 дней) [5].
Доказательства эффективности двойной антиагрегантной терапии были получены, в частности, в ходе исследования COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial), где на примере более 45 000 больных с острым ИМ показано значительное снижение смертности и риска развития осложнений [6]. Частота использования клопидогрела увеличилась после публикации результатов испытаний CLARITY-TIMI (CLopidogrel as Adjunctive ReperfusIon TherapY – Thrombolysis In Myocardial Infarction), подтвердившего безопасность применения препарата дополнительно к реперфузионной терапии в остром периоде ИМ [7].
В дальнейшем результаты исследования CURE (Clopidogrel in Unstable angina to prevent Recurrent ischemic Events) с участием 12 562 пациентов с острым коронарным синдромом (ОКС) без подъема сегмента ST продемонстрировали значительное преимущество двойной антитромбоцитарной терапии в сравнении с изолированным назначением АСК. Относительное снижение риска ИМ, инсульта или смерти от сердечно-сосудистых причин достигало 20%, причем эффект клопидогрела проявлялся через несколько часов после приема препарата и оставался практически постоянным в течение всего периода наблюдения, составившего в среднем 9 месяцев [8].
В настоящее время принципы антитромботической терапии у больных, перенесших инфаркт миокарда, регламентированы рекомендациями ведущих профессиональных кардиологических сообществ. Согласно этим документам, аспирин должен назначаться на неограниченный период, а клопидогрел – в течение 12 месяцев. Кроме того, двойная антиагрегантная терапия показана всем больным с ОКС вне зависимости от того, реализовался ли он в инфаркт миокарда или нет, а также пациентам, перенесшим ангиопластику с установкой любого типа стента [4, 5, 9–13].
В современной интервенционной кардиологии эра использования клопидогрела началась после публикации результатов рандомизированного исследования CLASSICS (CLopidogrel ASpirin Stent International Cooperative Study), где были получены доказательства лучшей переносимости клопидогрела в сравнении с тиклопидином в дополнение к АСК при коронарном стентировании и показана возможность безопасного использования нагрузочной дозы препарата [14]. Это позволило сделать вывод о целесообразности замены тиклопидина на клопидогрел в комбинации «аспирин +
тиенопиридин», применяемой для профилактики острых тромбозов стентов.
После окончания исследования PCI-CURE были определены показания к применению клопидогрела у больных ОКС без подъема сегмента ST, которым выполнялись процедуры чрескожных коронарных вмешательств (ЧКВ). Проспективный анализ показал снижение числа случаев развития ИМ и смерти от сердечно-сосудистых причин на фоне комбинированной антитромбоцитарной терапии, включающей клопидогрел, более чем на 31% по сравнению с группой, получавшей монотерапию АСК. В то же время у больных, рандомизированных в группу комбинированной терапии клопидогрелом + АСК, в период до выполнения ЧКВ регистрировалось достоверно меньшее число таких событий, как сумма ИМ и случаев рефрактерной ишемии миокарда, и ИМ отдельно (на 24% и 32%, p = 0,008 и 0,04 соответственно) [15]. Эффективность и безопасность подобной тактики продемонстрирована еще в клиническом исcледовании CREDO (Clopidogrel for the Reduction of Events During Observation), в котором было достигнуто достоверное уменьшение риска неблагоприятных кардиоваскулярных событий на фоне приема нагрузочных дозировок препаратов (300 мг клопидогрела и 325 мг
АСК) в среднем за 6 часов до выполнения ЧКВ с последующей длительной двухкомпонентной АТТ в течение не менее 1 года [16].
В последнее время разрабатываются более агрессивные схемы медикаментозной терапии пациентов с ОКС с использованием мощных пероральных антитромбоцитарных препаратов, включая прасугрел, тикагрелор, кангрелор и др. Однако более выраженное ингибирование тромбоцитарной активности сопровождается значимым увеличением частоты геморрагических осложнений [17, 18], что во многом ограничивает их рутинное применение.
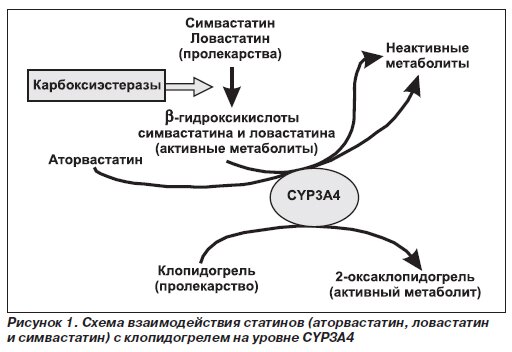
Все большее значение на современном этапе приобретает проблема резистентности к антитромбоцитарным препаратам, следствием которой является ослабление их эффективности. Следует напомнить, что клопидогрел фармакологически неактивен. Образование его активного метаболита, который в дальнейшем связывается с тромбоцитарными P2Y12 аденозиновыми рецепторами, происходит в гепатоцитах при участии различных печеночных изоферментов микросомального окисления (главным образом – цитохрома CYP2C19) [19]. Таким образом, интенсивность ответа на терапию клопидогрелом может варьировать у разных пациентов, что связано как с особенностями всасывания препарата, так и с различиями метаболизма, превращения пролекарства в активный метаболит. Возможным подходом к лечению пациентов с низким ответом на антиагрегантную терапию является эскалация поддерживающей дозы клопидогрела до 150 мг в сутки на фоне постоянного мониторирования агрегационной функции тромбоцитов. Однако подобная практика имеет некоторые ограничения, поскольку на данный момент неизвестны лабораторные показатели, позволяющие достоверно определить недостаточный ответ на терапию. Как показали недавно проведенные исследования, генетический полиморфизм изофермента CYP2C19 может в определенной степени влиять на эффективность клопидогрела, однако выраженность такого влияния и его клиническое значение требуют дальнейшего изучения [20–22].
Довольно часто причиной несоблюдения рекомендуемого режима приема клопидогрела является потенциальная вероятность увеличения риска геморрагических осложнений, прежде всего гастроинтестинальных кровотечений. Тем не менее достаточно большое число исследований показало безопасность длительной АТТ с применением клопидогрела у различных групп пациентов. Так, в исследовании CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events) частота развития желудочно-кишечных кровотечений у больных, получавших клопидогрел, была статистически значимо ниже, чем у больных, принимавших АСК (1,99% по сравнению с 2,66%) [23]. Противоречивые результаты получены в исследовании CURRENT-OASIS (Clopidogrel and aspirin optimal dose Usage to Reduce Recurrent EveNTs / Optimal Antiplatelet Strategy for InterventionS). Комбинированная первичная конечная точка (смерть от сердечно-сосудистого заболевания, инфаркт миокарда или инсульт через 30 дней) для всей популяции при высокодозированном и стандартном режимах клопидогрела не достигла статистически достоверных различий, однако в подгруппе стентированных пациентов анализ показал улучшение прогноза на фоне высоких дозировок клопидогрела. Важно, что подобный режим терапии не приводил к увеличению частоты развития серьезных, в том числе фатальных, кровотечений по оценочной шкале TIMI (Thrombolysis In Myocardial Infarction) [24].
Сравнительная безопасность длительного приема тиенопиридинов оценивалась в работе J. Hallas и соавт. (2006), где относительный риск развития кровотечения из верхних отделов ЖКТ при монотерапии клопидогрелом не различался по сравнению с группой, не получавшей антитромбоцитарного лечения [25]. В уже упоминавшемся контролируемом исследовании PCI-CURE после месяца наблюдения в группе клопидогрела было зарегистрировано 15 крупных кровотечений, а в группе плацебо – 14. В исследовании CREDO увеличение числа кровотечений на фоне длительного применения клопидогрела (43 случая против 33 в группе плацебо) также не являлось статистически значимым [15, 16]. Наиболее адекватной превентивной стратегией, направленной на снижение риска геморрагических осложнений у пациентов, длительно получающих комбинированную АТТ, представляется дополнительное назначение антисекреторных препаратов. Опасения исследователей насчет возможного подавления антитромбоцитарной активности клопидогрела на фоне приема ингибиторов протонного насоса (ИПН), в частности омепразола и эзомепразола, в настоящее время не подтвердились [26].
Так, при ретроспективном анализе результатов исследования CREDO и TRITON-TIMI 38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition With Prasugrel-Thrombolysis in Myocardial Infarction 38) не было выявлено увеличения частоты тромбоэмболических осложнений вследствие ослабления активности клопидогрела на фоне приема ИПН. Хотя лабораторный анализ показал умеренное снижение антитромбоцитарной активности тиенопиридинов при их комбинации с омепразолом, это не привело к худшим клиническим исходам у больных ОКС с ЧКВ [16, 17]. По данным недавно завершившегося крупного контролируемого исследования COGENT (Clopidogrel and the Optimization of Gastrointestinal Events Trial) также не отмечено клинически значимого неблагоприятного взаимодействия между клопидогрелом и ИПН [27].
Таким образом, проблема возникновения геморрагических осложнений у пациентов с ОКС, особенно в период после хирургической реваскуляризации, связанная с необходимостью постоянного приема антитромботических препаратов, несомненно, является актуальной. В любом случае в реальной клинической практике необходима индивидуальная оценка риска развития кровотечений при назначении длительной комбинированной АТТ и вероятности тромботических осложнений вследствие ее прерывания. У пациентов с нарушениями гемокоагуляции, серьезными кровотечениями в анамнезе или при необходимости постоянного приема непрямых антикоагулянтов предпочтительно выполнение только баллонной ангиопластики или использование металлических стентов без покрытия, что сокращает необходимую длительность приема клопидогрела. При наличии прямых показаний для продолжения двухкомпонентной АТТ у пациентов с высоким риском развития гастроинтестинальных кровотечений рекомендовано назначение антисекреторных препаратов с профилактической целью [28].
Необходимо отметить, что, кроме потенциального увеличения риска кровотечений на фоне приема клопидогрела, высокая стоимость лечения значительно ограничивает возможности его широкого применения [29]. В настоящее время проводится крупное российское исследование АТЛАНТ (Антиагрегантная Терапия: кЛиническая эффективность и оценкА привержеНности пациентов, перенесших ОКС и коронаропластику со стентированием, к длительной Терапии), в котором оценивается реальная приверженность пациентов, перенесших ОКС, к двойной антиагрегантной терапии, изучается клиническая эффективность и переносимость препаратов у таких пациентов. Исследование максимально приближено к повседневной клинической практике, его первые результаты уже позволяют отметить достоверное улучшение прогноза пациентов, соблюдающих предписанный режим приема клопидогрела [30].
Однако ситуация с нерегулярным приемом лекарственных средств особенно актуальна в Российской Федерации, так как на сегодняшний день далеко не все пациенты, перенесшие инфаркт миокарда или операцию коронарной реваскуляризации, в полном объеме соблюдают рекомендованные схемы приема антиагрегантов на амбулаторном этапе – реальное количество больных, находящихся на двухкомпонентной АТТ, не превышает 5%, в то время как остальные 95% получают монотерапию АСК [31]. Возможным выходом, способствующим повышению доступности лечения, представляется разработка качественных генерических препаратов клопидогрела, соответствующих по клиническим и фармацевтическим параметрам оригиналу.
Следует помнить, что вся доказательная база по эффективности и безопасности клопидогрела была получена на оригинальном препарате – Плавиксе, – который официально разрешен к применению с 1997 г. и хорошо изучен в многочисленных многоцентровых клинических исследованиях [6, 15, 16, 23]. В последнее время на фармацевтическом рынке представлено большое количество генерических копий клопидогрела, среди которых восемь были одобрены Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration – FDA). Несомненно, решающим фактором, определяющим выбор качественного дженерика в реальной клинической практике, должна являться подтвержденная фармацевтическая, фармакокинетическая и терапевтическая эквивалентность оригинальному препарату.
Недавно завершилось рандомизированное клиническое исследование, где оценивалась сравнительная эффективность и безопасность оригинального клопидогрела (Плавикс производства «Санофи-Авентис») и его дженерика – Плагрила (Dr. Reddy’s) – у пациентов высокого риска развития сердечно-сосудистых осложнений, ранее не получавших антиагрегантную терапию. Эффективность препаратов оценивалась по суррогатной конечной точке – уровню снижения агрегации тромбоцитов, индуцированной АДФ в концентрации 5 мкМ, а безопасность изучаемых средств – на основании контроля клиническими осмотрами, общего анализа крови и анализа мочи на скрытую кровь. Исходно группы пациентов не имели отличий по основным гемодинамическим параметрам, возрасту, индексу массы тела и агрегационной активности тромбоцитов [32].
В ходе исследования было установлено, что на фоне приема оригинального и воспроизведенного препаратов динамика изменения показателей агрегации тромбоцитов была сопоставимой. Перекрестное назначение Плагрила и Плавикса также продемонстрировало терапевтическую эквивалентность данных препаратов. Среди исследуемого контингента больных не было зарегистрировано нежелательных явлений, связанных с применением обоих препаратов. Дополнительно следует указать, что Плагрил обладал значительными фармакоэкономическими преимуществами в сравнении с оригинальным препаратом.
В литературе также имеются сведения о положительном влиянии препарата Плагрил (Dr. Reddy’s) на прогноз пациентов с облитерирующими заболеваниями периферических артерий нижних конечностей. В исследовании А.А. Штутина и соавт. (2009) приняли участие 20 пациентов с хронической ишемией артерий нижних конечностей, перенесшие реконструктивные оперативные вмешательства. В первые сутки после операции назначали клопидогрел в дозе 75 мг 2 раза в сутки с дальнейшим снижением дозы до 75 мг 1 раз в сутки с параллельным приемом аспирина в дозе 100 мг в сутки. В результате у всех пациентов отмечена положительная динамика – отсутствие тромботических и эмболических осложнений по данным контрольного УЗДГ-исследования зон реконструкции и ЭхоКГ. Летальных исходов, аллергических реакций на препарат за период исследования также не было отмечено. Целевой показатель АДФ у пациентов исследуемой группы составлял 50–55% (норма 50–75%) [33].
Таким образом, не вызывает сомнений необходимость назначения клопидогрела в дополнение к традиционным антиагрегантам в лечении ОКС, при проведении чрескожных коронарных вмешательств, а также в качестве вторичной профилактики после перенесенного инфаркта миокарда. Проблема выбора между оригинальными препаратами и дженериками неисчерпаема. Для оценки рисков, связанных с заменой брендов на воспроизведенные лекарственные средства, в реальной клинической практике следует опираться на надежные данные об их надлежащем качестве, безопасности и клинической эффективности.