Биология и медицина
Послеродовая кардиомиопатия
Послеродовая кардиомиопатия. одна из форм дилатационной кардиомиопатии. возникает в конце беременности или после родов, чаще всего — в первые 6 нед. Возможно, ее причиной служит миокардит. Заболевание может сочетаться с преэклампсией. Материнская смертность достигает 30% в первые несколько месяцев заболевания; если тяжелая сердечная недостаточность развивается во время беременности, перинатальная смертность тоже высока.
Лечение включает постельный режим, сердечные гликозиды. диуретики и вазодилататоры ( ингибиторы АПФ противопоказаны). Примерно в трети случаев функция сердца нормализуется, еще у трети больных наблюдается стойкая тяжелая левожелудочковая недостаточность. Последующие беременности противопоказаны из-за возможного рецидива.
Эта кардиомиопатия развивается в III триместре беременности или в первые 6 мес после родов. чаще всего — за месяц до родов или сразу после них. Причина неизвестна, иногда при биопсии обнаруживают миокардит. На аутопсии сердце увеличено, часто имеются пристеночный тромбоз, дистрофия и фиброз миокарда.
Послеродовая кардиомиопатия чаще встречается после 30 лет, у многорожавших и негритянок.
По некоторым данным, смертность достигает 25-50%. Прогноз в большой мере зависит от того, чем завершится первый эпизод послеродовой кардиомиопатий. Если размеры сердца возвращаются к норме, то последующие беременности обычно протекают без осложнений, а если нет, то каждая новая беременность усугубляет поражение миокарда и заболевание заканчивается рефрактерной сердечной недостаточностью и смертью. В любом случае рекомендуют предохраняться от беременности, особенно если остается кардиомегалия.
Книга: Кардиомиопатии
Наследственная предрасположенность Токсические вещества
Беременность и роды
Основной раздел: Современные представления об этиологии идиопатической дилатационной кардиомиопатии
Дополнения к основному разделу:
- Вирусная инфекция 28.48 Кб
- Наследственная предрасположенность 7.73 Кб
- > Беременность и роды 3.23 Кб
- Токсические вещества 8.36 Кб
- Недостаточное поступление в организм различных веществ 2.03 Кб
- Артериальная гипертензия 3.16 Кб
Возникновение без видимой причины кардиомегалии и застойной сердечной недостаточности в последние месяцы беременности и в первые полгода после родов у ранее здоровых женщин было впервые описано G. Herman и Е. King (1930). В последующем это заболевание стало известно под названием "послеродовая", или перипортальная кардиомиопатия". Как показали многочисленные исследования, по своему морфологическому субстрату, клиническим проявлениям и характеру изменения функционального состояния миокарда, по данным эхо- и ангиокардиографии, послеродовая КМП неотличима от идиопатической ДКМП.
Заболеваемость послеродовой КМП в Европе и Северной Америке относительно невелика — 1:1300-1: 4000 (W. Meadows, 1960; J. Pierce с соавт. 1963). Удельный вес таких случаев среди больных ДКМП — жителей США и Великобритании не превышает 9% (A. Kristinson, 1969; J. Goodwin, 1975) и, по нашим наблюдениям, составляет 4,4%. В то же время распространенность этого заболевания среди рожениц в странах Африки довольно высока и достигает 1% (I. Brockington и G. Edington, 1972).
Высказываются предположения о том, что развитию послеродовой КМП способствуют такие факторы, как алиментарная недостаточность (J. Perloff, 1980, и др.), в частности, бери-бери (S. Blegen, 1965), токсикоз беременных (К. Stuart, 1968; J. Demakis с соавт. 1971), объемная перегрузка сердца вследствие задержки натрия и воды и артериальная гипертензия беременных (М. Davidsson и Е. Parry, 1979; J. Sanderson с соавт. 1979). Однако поскольку вызываемые беременностью нарушения гемодинамики как у ранее здоровых женщин, так и у рожениц с патологией сердечно-сосудистой системы исчезают обычно сразу после родов, то есть в большинстве случаев до появления признаков ДКМП, эти гипотезы не получили дальнейшего развития.
Интересные данные были получены в последние годы с помощью ЭМБ, которая позволила обнаружить признаки "заживающего" миокардита у 9% (М. Rizeq с соавт. 1994) до 20-40% (К. Melvin с соавт. 1982; J. Sanderson с соавт. 1986) больных послеродовой КМП. В части таких случаев, причем не обязательно при наличии воспалительных инфильтратов в миокарде, отмечены также серологические признаки перенесенной вирусной инфекции (G. Sainani с соавт. 1975) и изменения со стороны иммунорегуляторных субпопуляций Т-лимфоцитов, в частности, увеличение коэффициента "хелперы/супрессоры" в крови (J. Sanderson с соавт. 1986). У трех больных, описанных К. Melvin с соавторами (1982), зарегистрирован заметный клинический эффект иммуносупрессивной терапии с исчезновением признаков хронического воспаления в миокарде при ЭМБ. Таким образом, есть основания предполагать связь части случаев послеродовой КМП с протекающей субклинически вирусной инфекцией и развитием миокардита. При этом вызываемая беременностью повышенная нагрузка на сердце способствует более глубокому, чем можно было бы ожидать при иных обстоятельствах, поражению миокарда, имеющему, вероятно, аутоиммунный патогенез. Необходимо отметить, однако, что у большинства больных послеродовой КМП не удается обнаружить связь заболевания с миокардитом, и характер повреждающего сердечную мышцу фактора (или факторов) остается неясным.
· Определение
· Распространенность
> · Современные представления об этиологии идиопатической дилатационной кардиомиопатии
Учебник по медицине / Заболевания человека / Послеродовая кардиомиопатия. Гипертрофическая кардиомиопатия
Начиная с 30-х годов и до настоящего времени в литературе неоднократно описывались случаи остро возникшей послеродовой сердечной недостаточности, нередко со смертельным исходом. Тяжелое поражение сердца развивалось, казалось бы, без всякой определенной причины у здоровых прежде женщин.
Существование такой самостоятельной нозологической формы, этиологически связанной с беременностью и родами, до настоящего времени представляется дискуссионным.
Однако то обстоятельство, что именно в послеродовой период, при отсутствии какой-либо видимой причины, преимущественно у женщин молодого возраста, неоднократно наблюдалась тяжелая сердечная недостаточность, подтверждает предположение о существовании болезни сердца, причинно обусловленной беременностью и родами. Среди возможных конкретных этиологических факторов послеродовой кардиомиопатии упоминаются: инфекция, в том числе вирусная, предшествующая токсемия беременности, и аутоиммунная реакция на неустановленный антиген, проявившийся в связи с беременностью. Однако обе эти причины пока не имеют достаточного фактического обоснования. Описаны случаи семейного распространения послеродовой кардиомиопатии (I. A. Pierce с соавт. 1963). Не исключено, что у некоторых рожениц скрытая и недиагностированная патология сердца предшествовала беременности и родам. В подобных случаях недостаточность кровообращения прогрессирует и становится явной в связи со стрессовыми ситуациями, сопутствующими беременности и родам.
Вне зависимости от причин поражения сердечно-сосудистой системы в послеродовой период происходят гемо-Динамические сдвиги, неблагоприятные для деятельности сердца. Объем циркулирующей крови после родов увеличивается, даже несмотря на кровопотерю: внезапное опорожнение матки, отключение кровообращения плода и выключение обширного артерио-венозного шунта, каким вляется плацентарное кровообращение,— все это значительно повышает сосудистое сопротивление и нагрузку на сердце. К действию этих неблагоприятных для гемодинамики факторов могут присоединиться послеродовая инфекция, тромбоэмболические осложнения, анемия, гипопроте-инемия, гиповитаминоз. Хотя каждый из перечисленных факторов вряд ли может служить единственной причиной поражения сердца, их одновременное влияние может либо вызвать, либо, что бывает чаще, способствовать обострению и выявлению скрыто до того развивающихся патологических изменений в сердце.
Трудно, а подчас и невозможно клинически и даже морфологически разграничить острое воспалительное поражение миокарда в послеродовой период и дистрофические изменения его. Морфология пораженного сердца у умерших также не имеет каких-либо специфических отличий. Сердце, как правило, увеличено, миокард, в особенности левого желудочка, гипертрофирован, а полость его дилатирована. Микроскопически выявляются дистрофия мышечных волокон, фиброзные пучки в миокарде, немногочисленные лимфоидные и макрофагальные клеточные скопления в интерстиции. Последние могут и вовсе отсутствовать. При электронной микроскопии в миоцитах отмечается повреждение и разрушение митохондрий, накопление липоидов.
Развернутая картина сердечной недостаточности по лево-, реже правожелудочковому типу обычно возникает во время 2—4-й недели послеродового периода и характеризуется одышкой, удушьем, отеками. Возможна загрудин-ная боль, При исследовании определяются характерные признаки поражения миокарда: кардиомегалия, ритм галопа, ослабление 1-го тона, иногда систолический мышечный шум над верхушкой, тахикардия. Нарушения сердечного ритма встречаются реже, чем при других формах кар-диомиопатий. Упоминается экстрасистолическая аритмия, суправентрикулярная пароксизмальная тахикардия и пред-сердно-желудочковая блокада.
Артериальное давление у таких больных понижено, пульс частый и малый. На электрокардиограмме выявляются признаки гипертрофии, чаще левых отделов сердца, и нарушение сердечного ритма, может иметь место сжижение вольтажа. Встречаются как резистентные к действию сердечных гликозндов, так и поддающиеся лечебному воздействию варианты болезни. Болезнь нередко принимает затяжное хроническое течение, рецидивируя с каждыми последующими беременностями и родами. Описан случай внезапной смерти, обусловленный мерцанием желудочков, тромбоэмболическими осложнениями, остро развившейся необратимой и резистентной к терапии сердечной недостаточностью.
Диагноз послеродовой кардиомиопатии базируется на исключении предшествующих известных болезней сердца, симптомах поражения миокарда, развитии этих симптомов на 2—4—6-й неделе послеродового периода. Лечение такое же, как и при других формах кардиомиопатии.
[NEXT_PAGE]
Гипертрофическая кардиомнопатия
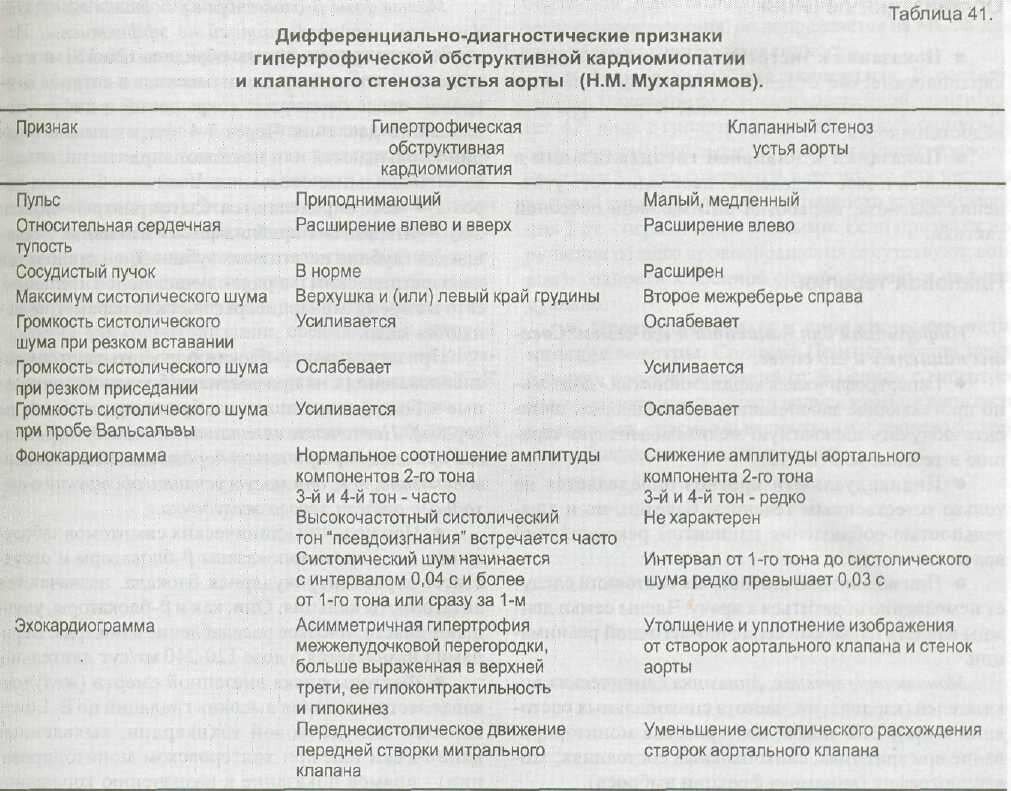
В группе гипертрофических кардиомиопатии выделяются в настоящее время две основные формы: симметричная, без обструкции путей оттока, и асимметричная, или об-структивная, сопровождающаяся сужением путей оттока, называемая также гипертрофическим субаортальным стенозом. Клиническая картина и эволюция этих форм дает основание предполагать, что обструкция путей оттока развивается по мере прогрессирования начальной необструктивной формы поражения.
Симметричная гипертрофическая кардиомиопатия характеризуется равномерным утолщением стенки левого желудочка и межжелудочковой перегородки, уменьшением объема полости левого желудочка по сравнению с толщиной его стенки. При обструктивной кардиомиопатии (субаортальном стенозе) гипертрофируется передняя часть межжелудочковой перегородки и верхние 2/з ее, а также свободная стенка левого желудочка. Отсюда еще одно название болезни — асимметричная гипертрофия межжелудочковой перегородки. Обычно изменен и митральный клапан, переднемедиальная створка его утолщена, малоподвижна, а сосочковая мышца этой створки укорочена. Эти изменения вызывают резкое сужение выходного отдела левого желудочка в период систолы: в начале систолы в основном за счет выбухания межжелудочковой перегородки в полость левого желудочка, а затем и вследствие парадоксального движения передней створки митрального клапана, которая приближается к межжелудочковой перегородке и способствует регургитации крови в левое предсердие. Сужение правожелудочкового пути оттока наблюдается значительно реже, всего лишь в 0,2—2% случаев (М. San-giorgu с соавт. 1976; Н. van Calcer, 1973). При морфологическом исследовании обнаруживается утолщение межжелудочковой перегородки, увеличение соотношения между толщиной перегородки и толщиной стенки левого желудочка. В норме это соотношение составляет 0,95, при гипертрофии без обструкции — 0,98—1,25; при асимметричной обструктивной кардиомиопатии возрастает до 1,55—1,76 (Н. Mendes с соавт. 1961), а в случае, описанном Н, van Calcer (1973), достигало 2,67. Мышечные волокна гипертрофированного участка обычно резко утолщены, короткие, пересекаются в различных направлениях, фибриллы внутри волокон расположены беспорядочно, образуя завихрения. В области выходного отдела отмечается выраженный фиброз.
Этиология субаорталыюго стеноза, как и большинства кардиомиопатии, неизвестна. Высказываются предположения о полиэтиологичности этого заболевания. У 25— 30% больных выявлен семейный наследственный характер обструктивной кардиомиопатии с аутосомно-доминантным типом наследования и способностью к самопрогрессирова-нию (L. В. Brent с соавт. 1959, 1960; W. A. Littler, 1972; Н. В. Бунчук, 1976).
Для иллюстрации приведем следующее наблюдение.
Больной Ц. 52 лет, жалуется на учащенное сердцебиение и перебои в деятельности сердца, усиливающиеся при ходьбе, одышку в покое, отеки голеней, появляющиеся к вечеру. В 1943 г. во время призыва в ряды Советской Армии был обнаружен врожденный порок сердца. Состояние оставалось удовлетворительным. В 1973 г. сын больного направлен военкоматом в клинику, где обратили внимание ка его низкий рост, «гротескные черты лица» (низкий лоб, вдавленная переносица, глубоко посаженные глаза, большие губы), симптомы врожденного порока сердца. Заподозрена наследственная патология, в связи с чем на обследование был вызван его отец—больной Ц. В анамнезе — два грыжесечения по поводу паховых грыж.
Объективные данные: рост 145 см, масса тела 52,5 кг, брахидак-тилия, гротескные черты лица, некоторое снижение интеллекта. Левая граница относительном тупости сердца умеренно смещена влево, над верхушкой 1-й то» ослаблен, расщеплен короткий нарастающий систолический шум, более громкий в точке Боткина; пульс медленный, 68 в 1 мин, изредка — экстрасистолы. Артериальное давление: НО/80 мм рт. ст. (18,66/10,66 кПа). Анализы крови, мочи без особенностей, гликозоаминоглнканы мочи — 23 ед.
Рентгенологические данные: небольшое усиление легочного рисунка и теней корней легких, выступает конус легочной артерии. Сердце расширено влево за счет гипертрофии левого желудочка, небольшое отклонение контрастированного пищевода на уровне левого предсердия; во втором косом положении — гипертрофия миокарда обоих желудочков, преимущественно левого.
Данные ЭКГ: гипертрофия левого желудочка и левого предсердия, синусовая брадикардия, предсердные экстрасистолы.
Учитывая наличие врожденной патологии (малый рост, гротескные черты лица, снижение интеллекта, брахидактилия), смещение левой границы сердца кнаружи, раздвоение 1-го тона, систолический шум в точке Боткина, рентгенологические и электрокардиографические при знаки гипертрофии левого желудочка и левого предсердия, наличие аналогичных изменений внешнего вида и врожденного порока сердца у сына больного, диагностирован мукополисахаридоз типа синдрома Шайе, гипертрофическая кардиомиопатия.
К этиологическим факторам обструктивной кардиомиопатии относятся гликогеноз миокарда, врожденные аномалии митрального клапана (дополнительные створки, аномальное прикрепление передней створки, хорд и др.). Причиной поражения клапанного аппарата может быть перинатальная инфекция. Сходство гипертрофированных мышечных волокон при субаортальном стенозе с мышечными волокнами предсердий позволило A. Pierse (1964) высказать предположение о том, что причиной асимметричной гипертрофической кардиомиопатии могут быть дистония предсердной ткани и аномалия развития симпатической иннервации сердца.
В большинстве случаев (93%) первые симптомы заболевания появляются после 20 лет и расцениваются как признаки дефекта межжелудочковой перегородки, митральной Недостаточности, ревматизма, опухоли. Характерны жалобы на боль в сердце, одышку, обмороки, приступы учащенного сердцебиения. При объективном обследовании сердца определяется резистентный сердечный толчок, смещение левой границы сердечной тупости влево, тоны громкие, акцент 2-го тона над аортой; 2-й тон над легочной артерией расщеплен, может выслушиваться пресистолический и протодиастолический галоп. Характерным и ранним признаком субаортального стеноза является систолический шум, который выслушивается вдоль левого края грудины, в точке Боткина, распространяется на сосуды шеи, отделен от 1-го тона, иногда состоит из двух фаз, может сопровождаться систолическим дрожанием грудной клетки. Часто выслушивается систолический шум над верхушкой, который проводится в подмышечную область (шум регургитации). На ЭКГ регистрируются признаки гипертрофии левого желудочка и предсердий, отрицательные зубцы Т и смещение книзу интервала 5 — Т в левых грудных отведениях. Иногда в классических отведениях появляются глубокие зубцы Q как отражение гипертрофии межжелудочковой перегородки. I. Heublein с соавторами (1971) считают, что характерным электрокардиографическим признаком субаортального стеноза являются комплексы типа qrS в сочетании с. положительным зубцом Т в левых грудных отведениях. Рентгенологически определяется умеренное увеличение левого желудочка и левого предсердия, усиление легочного рисунка за счет застоя, иногда расширение восходящей аорты.
Источник Редкие и атипичные синдромы заболевания в клинике внутренних заболеваний / Ганджа И.М. Децик Ю.И. Пелещук А.П. и др.; Под ред. И.М. Ганджи.- Киев. Здоровье, 1982.