Применение Ритмонорма при мерцательной аритмии
Классификация антиаритмических препаратов по E. M. Vaughan Williams (1969) в модификации D. Harrison (1979)
I. Блокаторы «быстрых» Na + каналов (мембраностабилизаторы)
В. Лидокаин, мексилетин, тримекаин, дифенин
С. Этацизин, Ритмонорм (пропафенон), аллапинин
II. Блокаторы β-адреноэргических рецепторов
Атенолол, метопролол
III. Блокаторы K + каналов
Амиодарон, d, l-соталол, ибутилид, дофетилид, азимилид
IV. Блокаторы «медленных» Ca 2+ каналов
Верапамил, дилтиазем
Мерцательная аритмия. Принципы лечения
Американская Ассоциация Сердца и Европейское Кардиологическое общество (2006) рекомендуют использовать в первую очередь препараты с доказанной эффективностью: амиодарон, пропафенон, и хинидин*
Согласно рекомендациям Американской Ассоциации Сердца и Европейского Кардиологического общества (2006) препараты класса 1С являются первой линией средств лечения мерцания предсердий при отсутствии органического поражения сердца
В России из этой группы чаще применяют пропафенон 150 мг х 3-4 р/д, этацизин 25-50 мг х 3-4 р/д и аллапинин 25 мг х 3-4 р/д
У больных с органическим поражением сердца — амиодарон (III класс ААП)
* Эксперты считают неэффективным соталол. Аллопенин и этацизин не изучались в крупных рандомизированных исследованиях!
Д.В. Преображенский и соавт. Мерцание предсердий: фармакологическая кардиоверсия. Consilium Medicum, том 05, № 5, 2003
Пропафенон (Ритмонорм) — препарат для пациентов без органических поражений сердца!
Что такое органические поражения сердца?
1. Фракция выброса (ФР) менее 35%
2. Гипертрофия Левого Желудочка (ГЛЖ) более 1,4 мм
Лечение мерцательной аритмии: новые антиаритмические препараты
Лечение мерцательной аритмии: новые антиаритмические препараты
Введение
Вплоть до 80-х годов прошлого века большинство антиаритмических препаратов (ААП) было направлено на лечение желудочковых аритмий. Однако, с тех пор, развитие антиаритмической терапии сконцентрировалось на лечении мерцательной аритмии (МА). Было доказано, что следующие фармакологические средства являются эффективными для кардиоверсии и поддержания синусового ритма: блокаторы натриевых каналов IA класса (хинидин, прокаинамид и дизопирамид) и IC класса (флекаинид и пропафенон IR и SR) а также агенты III класса (соталол, дофетилид и амиодарон) (1). Кроме того было показано, что внутривенная форма ибутилида — эффективна для прекращения пароксизмов мерцательной аритмии. В настоящее время препараты IA класса используются значительно реже: это связано с их побочными органотоксическими эффектами, выраженным проаритмическим потенциалом и недостаточными данными по отношению надежности этих препаратов при наличии структурных сердечных заболеваний. В свою очередь, препараты IC класса могут использоваться у пациентов с незначительными структурными сердечными заболеваниями или же без таковых. Однако имеются случаи возникновения тахикардии типа «пируэт» (torsade de pointes) при лечении соталолом и дофетилидом, а клиническое использование амиодарона ограничено его органо-токсическим воздействием. Вследствие вышеописанных ограничений в использовании ААП, необходим дальнейший поиск более эффективного и надежного лечения мерцательной аритмии.
Идеальный ААП для лечения МА должен бы обладать следующими свойствами: подавлять автоматизм, возникающий в 4-й фазы потенциала действия и являющийся предсердным триггером; удлинять предсердный рефрактерный период; замедлять внутрипредсердную проводимость; быть селективным по отношению к предсердиям, избегая таким образом желудочкового проаритмического эффекта; удлинять рефрактерность и снижать проводимость через АВ-узел, способствуя адекватному контролю частоты сердечных сокращений; иметь достаточно продолжительный период полувыведения, для приема этого препарата 1 раз в день; обладать низкой вероятностью проаритмических и побочных эффектов; быть надежным при лечении больных со структурными сердечными заболеваниями; не иметь значительного негативного инотропного эффекта, ни взаимодействия с другими препаратами.
В настоящее время антиаритмическое фармакологическое развитие идет в различных направлениях (2). Во-первых, начат анализ неизученной до сих пор антиаритмической эффективности таких известных препаратов, как карведилол (3). Во-вторых, ведутся работы по модификации существующих уже антиаритмических препаратов. таких как амиодарон, для улучшения их эффективности и надежности. В-третьих, развиваются ААП с новыми терапевтическими механизмами, которые бы позволили повысить эффективность лечения. И в конечном счете, изучается возможность подавления мерцательной аритмии с помощью таких препаратов (не относящихся к ААП) как ингибиторы АПФ, блокаторы рецепторов ангиотензина, ингибиторы HMG CoA редуктазы и рыбий жир.
Карведилол
Карведилол обладает зависящими от дозы антиадренергическими (р1. р2 и а) свойствами. Кроме того, этот препарат владеет мембраностабилизирующей активностью (подобно ААП IA класса); удлиняет реполяризацию, блокируя калиевые каналы (подобно ААП III класса); а также ингибирует кальциевые каналы L-типа (подобно ААП IV класса) (3).
Карведилол блокирует различные калиевые каналы, ответственные за реполяризацию. При этом он воздействует на быстрые и медленные активирующие компоненты замедленного выпрямляющего (delayed rectifier current — /Kr и /Ks ) и кратковременного выходящего калиевого токов (transient outward current — /to ). Данный препарат не влияет на входящий выпрямляющий ток (inward rectifier current — /KI), который увеличивает продолжительность потенциала действия и эффективный рефрактерный период при повторном возбуждении (4-6). Карведилол снижает частоту желудочковых сокращений и проводимость через АВ-узел и при этом не имеет проаритмогенной активности.
Многие исследования показали эффективность карведилола в лечении мерцательной аритмии. что частично объясняется неадренергическими свойствами препарата. Так, при лечении пациентов, подвергшихся кардиоверсии, на протяжении 1-летнего периода следования карведилол показал снижение риска рецидивов МА на 14% (по сравнению с бисопрололом) (7). При исследовании пациентов после операции на сердце, МА возникла у 8% больных, принимающих карведилол и у 32% — метопролол или атенолол, что соответствует снижению риска МА на 75% (8). В другое клиническое контролируемое плацебо испытание были включены пациенты с хронической формой МА и произвелось их наблюдение за 6 недель до и после программированной электрической кардиоверсии. Эти больные получали карведилол, амиодарон или вовсе не принимали ААП. Кардиоверсия была успешной у 87% пациентов, принимающих карведилол; у 94% — амиодарон; и лишь у 69% больных, не получающих антиаритмические препараты. Пациенты, принимающие карведилол или амиодарон (по сравнению с группой без ААП), имели более продолжительные интервалы фибрилляторного цикла до кардиоверсии и более длительный рефрактерный период через 5 минут после данной процедуры. Рецидивы мерцательной аритмии. на протяжении первых 7-и дней, чаще возникали в группе пациентов, не получающих антиаритмическую терапию (44%), по сравнению с карведилолом (29%) или амиодароном (19%) (9). Доказательства подавления МА с помощью карведилола были приведены в клиническом испытании CAPRICORN (10). Кроме того, этот препарат (подобно другим бета-адреноблокаторам) замедляет частоту сокращения желудочков как при изолированном его использовании, так и при сочетании с дигоксином (11).
Новые антиаритмические препараты
С той или иной степенью специфичности, воздействие многих экспериментальных препаратов со свойствами III класса направлено на различные калиевые каналы. Некоторые из этих препаратов способны блокировать и другие ионные каналы (см.таблицу 1) (12-18). В последнее время ученые сумели блокировать сверх быстрый выпрямляющий калиевый ток (/Kur), существующий лишь в предсердиях, достигая таким образом специфичности воздействия на предсердия и избегая риска тахикардии типа «пируэт», которая возникает по причине удлинения желудочкового потенциала действия. Другой возможностью специфического воздействия на предсердия является блокада зависимого от ацетилхолина калиевого тока (/KAch).
Таблица 1: Экспериментальные антиаритмические средства (механизмы действия)
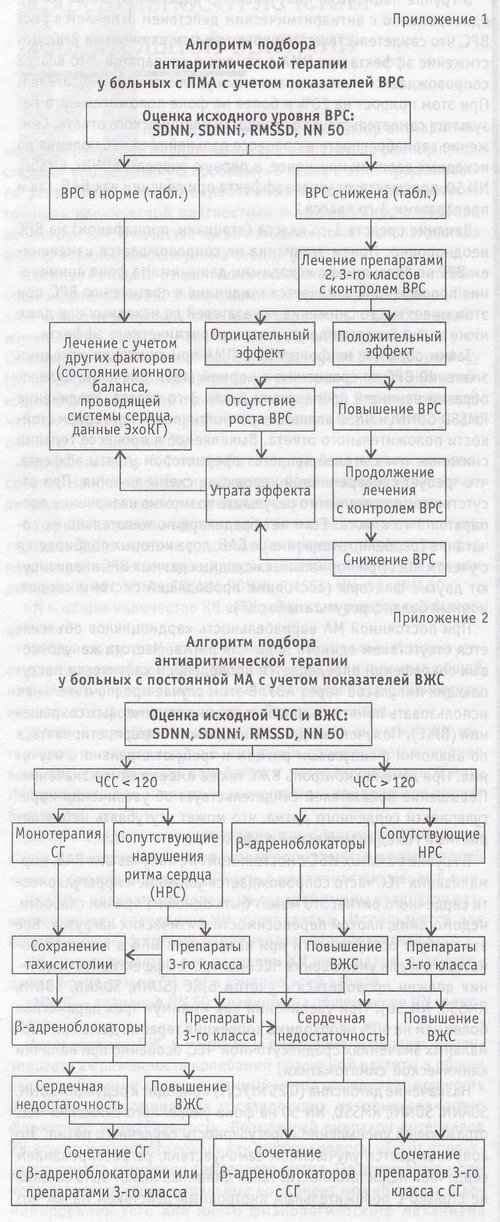
Методика подбора антиаритмических препаратов при мерцательной аритмии с учетом динамики ВРС
До настоящего времени не опубликовано результатов изучения влияния различных антиаритмических препаратов на вариабельность ритма сердца у больных с нарушениями ритма сердца. В то же время эффективность подбора антиаритмической терапии может быть повышена, если при этом учитывать индивидуальные особенности сердечно-сосудистой системы, характер гемодинамических нарушений, течение основной и сопутствующей патологии. Такой подход позволит снизить роль «слепого эмпиризма» при лечении сердечных аритмий и объективно обосновать выбор адекватных схем, уменьшив при этом частоту возможных осложнений, включая проаритмию.
Нами разработана методика подбора антиаритмических препаратов при пароксизмальной и постоянной мерцательной аритмии с учетом динамики вариабельности ритма сердца в процессе лечения. Критерием оценки изменений у больных с пароксизмальной мерцательной аритмией является отсутствие пароксизмов при исходном и последующем холтер-мониторировании.
Анализ вариабельности ритма сердца у пациентов с пароксизмальной мерцательной аритмией проводится на фоне синусового ритма и не имеет принципиальных отличий от общепринятого при ИБС. Увеличение показателей вариабельности ритма сердца (SDNN, SDANN, SDNNi, RMSSfl, NN 50) можно рассматривать как благоприятный прогностический признак.
В группе пациентов, получавших β-адреноблокаторы, одновременно с антиаритмическим действием отмечается рост вариабельности ритма сердца. что свидетельствует о положительном влиянии на ВНС. Достижение эффекта при пароксизмальной мерцательной аритмии с помощью препаратов 3-го класса сопровождается менее выраженным увеличением показателей. При этом прирост на 20% и более на фоне положительного результата свидетельствует о стойкости клинического ответа. Снижение вариабельности в процессе дальнейшего наблюдения до исходных величин или менее, в первую очередь, SDNNi, RMSSД, NN 50, предшествует утрате эффекта при лечении как β-адреноблокаторами, так и препаратами 3-го класса.
Влияние средств 1-го класса (этацизин, пропафенон) на вариабельность ритма сердца неоднородно. Прием этацизина не сопровождается изменением вариабельности ритма сердца по сравнению с исходными данными. На фоне применения пропафенона отмечается тенденция к повышению вариабельности ритма сердца, при этом имеет место снижение показателей до исходных или даже ниже за 1-1,5 месяца до утраты антиаритмического эффекта.
Таким образом, на фоне ИБС с пароксизмальной мерцательной аритмией при снижении исходных значений вариабельности ритма сердца по сравнению с нормой (табл.) лечение целесообразно начинать препаратами 2 или 3-го класса. Увеличение RMSSD,SDNNi и NN50 является прогностическим критерием стойкости положительного ответа. Выявляемое в процессе терапии снижение показателей является предиктором утраты эффекта, что требует своевременной коррекции схемы лечения. При отсутствии положительного результата возможно назначение препаратов 1-го класса. Если нет брадикардии, желательно их сочетание (особенно этацизина) с β-адреноблокаторами, доза которых подбирается с учетом ЧСС. При нормальных исходных данных вариабельность ритма сердца анализируют другие факторы (состояние проводящей системы сердца, ионный баланс, результаты ЭхоКГ).
При постоянной мерцательной аритмии вариабельность кардиоциклов объясняется отсутствием единого водителя ритма. Частота желудочковых сокращений определяется проведением хаотически поступающих импульсов через АВУ. В этом случае предпочтительнее использовать понятие вариабельности желудочковых сокращений (ВЖС). Полученные данные не должны интерпретироваться по аналогии с синусовым ритмом и требуют отдельного изучения. При лечении контроль вариабельности желудочковых сокращений также имеет важное значение. Повышение показателей свидетельствует об увеличении иррегулярности сердечного ритма, что может усугублять неблагоприятный гемодинамический эффект мерцательной аритмии.
В группе больных ИБС с постоянной мерцательной аритмией, получавших β-адреноблокаторы, нормализация ЧСС часто сопровождается усилением иррегулярности сердечного ритма. Это может быть одной из причин слабости, недомогания, плохой переносимости физических нагрузок. Все это требует осторожности при назначении β-адреноблокаторов в качестве монотерапии для уменьшения ЧСС. Контроль эффективности лечения должен проводиться с учетом вариабельности желудочковых сокращений (SDNN, SDANN, SDNNi, RMSSD, NN 50). При увеличении как минимум трех параметров более чем на 50% необходима коррекция терапии даже при нормальных значениях среднесуточной ЧСС, особенно при наличии клинической симптоматики.
Назначение дигоксина (0,25 мг/сут) приводит к редукции SDNN, SDANN, SDNNi, RMSSD, NN 50 на фоне умеренного снижения ЧСС, отражающей уменьшение иррегулярности сердечного ритма. Это сопровождается улучшением самочувствия, регрессированием сердечной недостаточности. Такая динамика может быть связана не столько с положительным инотропным действием малых доз дигоксина, сколько с его модулирующим влиянием на проводимость в АВУ. Однако при выраженной тахисистолии не всегда удается нормализовать среднесуточную ЧСС.
Сочетание β-адреноблокаторов и сердечных гликозидов (СГ) приводит к достаточному снижению ЧСС без достоверных изменений вариабельности желудочковых сокращений и представляется оптимальным у больных с тахисистолической формой мерцательной аритмии в том случае, когда монотерапия сердечными гликозидами не дает достаточного уменьшения ЧСС.
Препараты 3-го класса (амиодарон, соталол) наиболее показаны при наличии сопутствующих нарушений ритма (частая, политопная экстрасистолия, пароксизмы неустойчивой желудочковой тахикардии). Их назначение приводит к снижению ЧСС и не влияет на вариабельность желудочковых сокращений (SDNN, SDANN, SDNNi, RMSSD, NN 50).
Контроль ЧСС при постоянной мерцательной аритмии следует начинать с β-адреноблокаторов в случае выраженной тахисистолии при исходном холтер-мониторировании (среднесуточная ЧСС более 130 уд./мин). При повышении вариабельности желудочковых сокращений на фоне приема β-адреноблокаторов более чем на 50%, даже при нормальной среднесуточной ЧСС во время контрольного исследования, рекомендуется их замена препаратами 3-го класса или дополнительное назначение дигоксина. Начальная монотерапия сердечными гликозидами показана при среднесуточной ЧСС, не превышающей 120 уд./мин, и высоких RMSSD, SDNNi и NN 50, особенно при наличии признаков сердечной декомпенсации. При этом необходим контроль среднесуточной ЧСС в процессе лечения. Если не удается достичь оптимальной средней ЧСС (70-90 уд./мин) несмотря на снижение RMSSD, SDNNi и NN 50, рекомендовано сочетание сердечных гликозидов с β-адреноблокаторами.
Вышеизложенные рекомендации приведены в виде алгоритма подбора терапии у пациентов с мерцательной аритмией в Приложениях 1 и 2.
=================
Вы читаете тему:
Вариабельность ритма сердца и ее роль в оценке эффективности лечения мерцательной аритмии
2. Методика подбора антиаритмических препаратов при мерцательной аритмии с учетом динамики ВРС.
Корнелюк И. В. Никитин Я. Г. РНПЦ «Кардиология».



Мне 82г.Стоит 5 лет кардиостимулятор,впервае ночью тахикардия ,пульс 136 По экг -мерцательная аритмия предсердий,какие есть средства прфилактики?