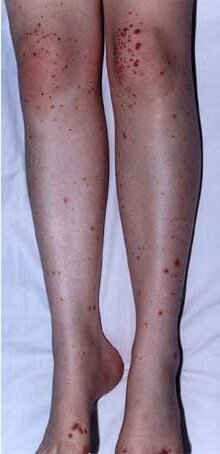
Геморрагический кожный васкулит
Геморрагический васкулит фото
Фото prouro.ru
#image.jpg
Геморрагический васкулит
Геморрагический васкулит представляет собой одно из заболеваний сосудов, которое имеет токсико – аллергическое происхождение. Эта болезнь принадлежит к группе геморрагических диатезов, которое связанно с асептическим повреждением эндотелия микро — сосудов, которые циркулируют иммунными комплексами. Болезнь является полиэтиологической. Антигены могут быть вирусными, бактериальными, химическими, пыльцевыми, лекарственными и так далее.
Симптомы заболевания
— геморрагические высыпания на коже особенно на руках, ногах. Сыпь со временем приобретает багрово – синий цвет;
— боль при движении;
— может быть кровоизлияние в полости суставов, которые были поражены;
— приступообразные острые боли в области живота;
— кровавый стул и рвота;
— боль в области кишечника при пальпации;
— поражение почек;
— поражение нервной системы;
— синевато – багровые кожные кровоизлияния и другие.
Причины болезни
Врачи не могут с точностью назвать причину появления такого заболевания. Однако в некоторых случаях его проявление может быть связанно с аллергическими процессами и чувствительности организма больного к некоторым лекарственным препаратам. Вызвать васкулит могут инфекции дыхательных путей. К редким заболеваниям его довольно сложно отнести. Заболеть могут абсолютно все люди, но по статистике, дети с двух до восьми лет болеют чаще.
Лечение геморрагического васкулита
Определенного лечения такого вида заболевания в принципе нет. В некоторых случаях, когда доказана связь болезни с определенным аллергеном, больного стараются изолировать от него. Когда заболевание связанно с бактериальными инфекциями, врачи элиминируют такого возбудителя из организма.
По материалам Медицина как есть
Кожный васкулит: симптомы и причины возникновения
Содержание:
Васкулит представляет собой группу заболеваний кожных покровов, развивающихся в результате всевозможных поражений подкожной клетчатки и мелких сосудов, реже – крупных сосудов мышечного типа. Основная группа – аллергические васкулиты.
Кожный васкулит: причины
Факторов, обуславливающих развитие заболевания, множество. Основным из них медицина называет вяло протекающую инфекцию: аднекситы, тонзиллиты, отиты, инфекционные поражения кожи хронического типа. Среди прочих причин выделяются:
- вирусы;
- стафилококки, стрептококки, некоторые разновидности патогенных грибов, микобактерии туберкулеза;
- различные длительные интоксикации;
- повышенная чувствительность к лекарствам (как правило, к антибиотикам и сульфаниламидным средствам).
Васкулит: классификация
Описывая любое заболевание, в том числе поражающее кожные покровы, в том числе и васкулит, симптомы, конечно играют немаловажную роль. Но сначала следует разобраться с разновидностями рассматриваемой кожной болезни – от этого очень часто зависит и меняется симптоматика, а также направления лечения.
В основе классификации васкулита — гистоморфологические признаки: размер пораженных сосудов и глубина их расположения в кожном покрове. Наиболее распространенные виды васкулита с проявлениями на кожных покровах следующие:
- Поверхностный.
- Геморрагический лейкокластический микробид Мишера-Шторка.
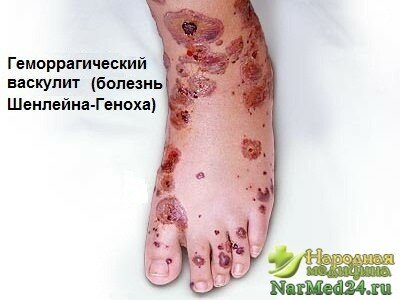
- Геморрагический капилляротоксикоз, болезнь Шенлейна-Геноха.
- Узелковый некротический васкулит Вертере-Дюмлинга.
- Аллергический артериолит Руитера Гужеро-Дюппера.
- Диссеминированные аллергоиды Роскама.
- Подострый мигрирующий гиподермит.
- Кожная форма узелкового периартериита.
Васкулит: симптомы
Как уже было отмечено ранее, симптоматика напрямую зависит от разновидности заболевания.
Поверхностная форма поражает капилляры, венулы и артериолы кожных покровов.
Геморрагический кожный васкулит проявляется в следующих признаках:
- резкие высыпания на кожных покровах ягодиц и живота;
- некрозы кожи, вплоть до гангрены;
- симметричность распространенности сыпи;
- исчезновение и изменение окраски высыпаний при надавливании и в зависимости от времени проявления;
- отечность кожных покровов кистей рук, стоп, губ (чаще всего проявляется у пациентов детского возраста).
Геморрагический лейкокластический микробид Мишера-Шторка проявляется в виде внезапных высыпаний на кожных поверхностях ног, причиной чего является обострение очаговой инфекции. В период рецидивов возможно появление слабости и повышение температуры тела.
Некротический васкулит Вертере-Дюмлинга характеризуется появлением плотных синюшно-коричневых плоских узелков, основная часть которых некротизируется. Некоторые специалисты считают эту форму вялотекущим хроническим сепсисом.
Симптомами артериолита Руитера Гужеро-Дюппер являются пурпурозные и эритематозные пятна и узелки, характеризующиеся четкими границами и немного выступающие над эпидермисом.
Диссеминированные аллергоиды Роскама проявляются в виде множественных кровоизлияний на слизистых и кожных покровах. Могут явиться следствием небольшой травмы.
Узелковый периартериит отличается множественностью симптомов: снижение веса, лихорадка, боли в мышцах и суставах, а также образование по ходу суставов характерных узелков.
Кожный васкулит с язвенно-геморрагическими высыпаниями. Геморрагический васкулит
#image.jpg
Лекция 7.
Геморрагический васкулит. Тромбоцитопении и тромбоцитопатии.
План лекции
1. Этиология геморагических васкулитов
2. Клиника геморрагическиї васкулитов.
3. Диагностика геморрагического васкулита.
4. Принципы терапии васкулита.
5. Профилактика васкулита.
ГЕМОРРАГИЧЕСКИЙ ВАСКУЛИТ
Геморрагический васкулит (ГВ) — болезнь Шенлейна—Геноха) — системное воспалительное заболевание с подавляющим поражением артериол, венул, капилляров и развитием микротромбоваскулита. Степень поражения и локализация определяют особенности клинических проявлений заболевания. Встречается у детей всех возрастных групп, несколько чаще у мальчиков.
Этиология ГВ до конца не определена. Многие авторы признают полиетиологичность заболевания. Отмечают связь его начала с перенесенными респираторными инфекциями вирусной и бактериальной (часто стрептококковой) природы, алергизирующим влиянием некоторых пищевых, медикаментозных, сывороточных и других антигенов. Возможно, много из них является факторами, которые провоцируют развитие болезни.
Патогенез ГВ изучен недостаточно. Нет сомнения, что в развитии заболевания основная роль принадлежит иммунологическим нарушением. ГВ — имунокомплексное заболевание, для которого характерный четко обнаружен развитие иммунологических реакций третьего типа за Gell и и Сооmbs, — действие иммунных комплексов (ИК) в сочетании со связыванием комплемента. Отдельные компоненты последнего (С3а, С5-С7) предопределяют хемотаксис нейтрофилов и развитие воспалительной реакции, которая поддерживается медиаторами воспаления и лизосомальными ферментами (включая колагеназу, эластазу) нейтрофилов, которые фагоцитируют ИК.
Плацдармом развития иммунного воспаления является эндотелий сосудов микроциркуляторного русла. На фоне повышения проницаемости сосудистой стенки отмечают скопление тромбоцитов, гранулоцитов под пораженным эндотелием, в капиллярной сетке — сгустки, которые содержат агрегированые тромбоциты, фибрин, ИК, развитие воспалительных изменений (микротромбоваскулит, ендотелит, капилярит) с лимфогистиоцитарной реакцией. Характерным является синдром множественного микротромбирования сосудов, подобный хроническому ДХСТ-синдрому. От последнего он отличается, в частности отсутствием II и III фаз, которые проявляются генерализованою кровотечением. Геморрагические симптомы при ГВ предопределены дезорганизацией и некротическими изменениями сосудистой стенки, а не тромбоцитопенией и коагулопатией потребления, как при «классическом» ДХСТ-синдроме. В сыворотке крови больных обнаруживают повышенное содержание ИgА и ЦИК, которые также имеют ИgА в антигенном составе. Допускается, что под воздействием этиологического агента ИgА приобретает свойства аутоантигену, который индуктирует продукцию соответствующих аутоантител и формирования ИК.
Данные о наличии аутоантител к цитоплазме нейтрофилов в результате их повреждения этиологическим фактором. Это осложняет характер имунопатологических нарушений и повреждений тканей и органов.
На фоне нарастания гипоксии наступает осложнение метаболических сдвигов, ацидоза, который поддерживает нарушение реологических свойств крови и гемостазу со снижением активности противосверточной системы. Самые тяжелые изменения наблюдают при молниеносной форме ГВ, а также у больных с острым течениеом и высокой активностью абдоминальной формы, когда развивается ДВС-синдром.
Патологическая анатомия. Морфологические изменения характеризуются наличием деструктивных, деструктивно-производительных и производительных артериолитов, капиляритов, венулитов. Относительно редко поражаются артерии мелкого и среднего калибра, а в магистральных сосудах иммунное воспаление отмечают в основном в vasa vasorum..
Патологические изменения локализуются преимущественно в микрососудах кожи, суставов, пищеварительного тракта и почек. При этом обнаруживают последовательное развитие процессов мукоидного отека, фибринозных изменений, инфильтративно-пролиферативных клеточных реакций, склероз стенок сосудов с сужением их диаметра. Повышена сосудистая и тканевая проницаемость, нарушения микроциркуляции и реологичних свойств крови приводят к кровоизлиянию вплоть до развития некроза тканей. Микроваскулиты кожи могут быть ограниченными, а у больных с тяжелой формой ГВ характеризуются распространенным генерализованным характером.
Некротические и язвенные поражения могут осложняться вторичной инфекцией. В суставных сумках отмечают поражение терминальных сосудов, которые за своими характеристиками не отличаются от васкулита кожи. Отек и геморагии в основном ограничиваются периартикулярными тканями: суставные хрящи и костная ткань интактные; синовиальная жидкость прозрачная, но иногда бывает с небольшой примесью эритроцитов.
В результате поражения кровеносных сосудов пищеварительного тракта на разных его участках (глотка, пищевод, желудок, тонкая и толстая кишки) отмечают геморрагические и язвенно-некротические изменения. Больше всего их на начальных и конечных отделах тонкой кишки. Некротические и язвенные изменения слизевой оболочки могут распространяться на мускульный слой и серозный покров, который ведет к развитию фибринозно-гнойного перитонита.
В печени и поджелудочной железе обнаруживают мелкое подкапсульное кровоизлияние. Имеются очаговые васкулиты, которые находят при микроскопии.
Почечная патология у больных ГВ нередко является основным и самым тяжелым клиническим проявлением болезни. Патоморфологический при остром гломерулонефрите выражен интракапилярные изменения в виде очаговой или диффузной пролиферации эндотелия сосудистых петель, клеток мезангия, фибриноидный некроз и тромбоз капиллярных петель. В случае подострого (злокачественного) протекания гломерулонефрита находят сочетание интракапилярных изменений с производительными экстракапиллярными изменениями в виде активной пролиферации подоцитов капсулы с формированием полумесяцев. В части капилляров пораженных гломерул развивается тромбоз и некроз, наблюдают васкулиты в интерстиций почек, дистрофию канальцев. При хроническом гломерулонефрите в клубочках почек преобладают пролиферативные и фибррпластичные процессы.
Микроваскулиты обнаруживают в разных отделах нервной системы. Они чаще не вызывают тяжелых поражений в результате незначительной очаговой распространенности.
Диффузное поражение микрососудов головного мозга является причиной многочисленного кровоизлияния и очагов размягчения, разных за интенсивностью и величиной. Подобные изменения возникают и в спинном мозге, их клиническое определяют как сосудистый менингоэнцефалит. В легких чаще возникают капиляриты межальвеолярных перегородок. Очаговые микроваскулиты в миокарде обычно не приводят к значительным повреждениям и кардиальной симптоматике. Но при геморрагическом гиперергическом панартериите коронарных артерий отмечают значительную ишемию. В тканях селезенки и лимфатических узлов находят микроваскулиты и микроплазмоцитарную клеточную реакцию, которая свидетельствует об иммунном характере патологии.
Клиника . У большинства детей болезнь начинается остро, обычно вскоре после перенесенных инфекционных заболеваний (ГРВИ, ангина), профилактических прививок, введения лечебных сывороток, принятия разных медикаментов, охлаждения. На фоне нарушения общего состояния, недомогания, ухудшения аппетита повышается температура тела к высокой, субфебрильной или фебрильной при одновременном (или на протяжении 2—3 дней) появлении характерного и патогномоничного для ГВ кожного синдрома, который является основой диагностики заболевания и отмечается у всех больных. В части больных детей его развитию предшествует суставной и (или) абдоминальный синдром или их признаки появляются в разных сочетаниях, одновременно или последовательно, в начальной стадии заболевания.
Кожный синдром характеризуется полиморфизмом сыпи. Сначала обычно появляется макулопапульозная сыпь с быстрым развитием характерного для ГВ геморрагического компонента. Элементы сыпи приобретают багрово-красный оттенок. По мере их рассасывания и угасания цвет становится коричнево-бурым, желтоватым со следующей пигментацией кожи в участках сыпи, что со временем исчезает.
#image.jpg
Кожный синдром при геморагическом васкулите
#image.jpg
#image.jpg
В части больных сыпь сразу имеет характер геморрагической и не изменяется в дальнейшем. У других детей сначала преобладают элементы типа крапивницы, потом — геморагии. Могут появляться отеки Квинке, а при тяжелых формах заболевания — сыпь буллезно-некротического характера с последующим формированием корок. Обычный размер геморрагических высыпаний — от 1 до 5 мм в диаметре. Они могут приобретать сливной характер. В разных вариантах проявлений кожного синдрома характерная симметричность высыпаний на разгибательных поверхностях верхних и нижних конечностей, над суставами, реже на туловище и лице. Нередко бывает кровоизлияние в слизевую оболочку щек, мягкого и твердого неба, половых органов. Высыпания на слизистых оболочках наблюдают и у детей старших возрастных групп. Неодновременность и разный характер сыпи, свои повторные волны определяют разнообразие проявлений кожного синдрома.
Суставной синдром — второе за частотой проявление болезни — наблюдают в 50—75 % больных детей в виде артралгий или развития артрита (олигоартрита), преимущественно в участке больших суставов — коленных, голеностопних, с отеком тканей вокруг них. К процессу привлекаются обычно параартикулярные ткани, при сопроводительном отеке Квинке — параартикулярные, что изменяет конфигурацию и нарушает функцию сустава. Относительно редко наблюдают отек и кровоизлияние в синовиальную оболочку с развитием реактивного синовита.
В участке ангионевротических отеков возможно подкожное кровоизлияние, о наличии которого свидетельствует появление синюшного цвета кожи в меру рассасывания отека (А.А.Яковлева, 1987). С началом развития артрита обнаруживают местную гиперемию и гипертермию кожи над суставом, болезненность и ограниченность движений. «Летучесть» суставных явлений не характерна, так же как и затяжне течение артрита. Развитие артрита может предшествовать проявлениям кожного и абдоминального синдромов приблизительно в 20—25 % больных, что
#image.jpg
Пятнисто-папулезна геморрагическая сыпь при ГВ
значительно осложняет распознавание заболевания. При этом нужно учитывать подавляющее привлечение к процессу пери- и параартикулярных тканей
Абдоминальный синдром отмечают в 50 % больных. Он развивается на фоне проявлений кожного и суставного синдромов, параллельно с ними или опережает их. Клиническая семиотика предопределена развитием отека и кровоизлиянием в стенке кишки, брыжейки, брюшине, дискинетическими явлениями, иногда язвенно-некротическими изменениями в пищеварительном тракте.
Рядом с болью разной локализации и интенсивности в части больных наблюдают то, что блюет, желудочно-кишечное кровотечение (рвота и пронос с кровью — мелена). Периодически бывают нападения боли, которые напоминают кишечную колику с локализацией вокруг пупка, в участке подреберья, нередко боль возникает в эпигастральной, правой подвздошной области. При интенсивной боли состояние больных значительно нарушено, они беспокойны, нередко находятся в вынужденном положении на боку, с подтянутыми к животу ногами, согнутыми в коленных суставах. Температура тела повышена, на лице отражается страдание, черты его заострены, язык сухой, обложен.
Во время пальпации живота отмечают болезненность в разных зонах, при наличии осложнений (кровотечение и перфорация в участке язвенно-некротических поражений, перитонит) — напряжения брюшной стенки.
Обследование живота часто вызывает усиление боли. Рентгенологически исследование обнаруживает нарушение моторики кишок, признака деструктивных изменений из згладженостью контуров кишечных петель, иногда «симптом ниши». Обязательной является консультация хирурга. При эндоскопическом обследовании желудочно-дуоденальной зоны у больных с абдоминальным синдромом обнаруживают распространенные поражения слизевой оболочки — отек, гиперемию, кровоизлияние, язвы. Незначительное увеличение размеров печенки отмечают в большинстве больных, селезенка бывает увеличенной значительно реже.
Почечный синдром, который имеет в основе подавляющее поражение клубочков почек, является отображением общей тяжести процесса и наблюдается (разной степени выраженности) в половины больных.
Чаще всего изменения мочи оказываются на 2—3-й неделе заболевания и характеризуются микроэритроцитурией, что впоследствии исчезает. У некоторых детей стойкие изменения мочевого осадка, геморенальных показателей свидетельствуют о развитии гломерулонефрита, преимущественно гематурической формы.
Более тяжелые формы заболевания бывают в случае развития нефротического синдрома. В большинстве больных поражения почек заканчивается благоприятно. При вариантах затяжного и рецидивирующего течения, особенно у больных с нефротическим синдромом и экстраренальными проявлениям, почечный процесс может приобрести хронический течение с разными темпами развития почечной недостаточности. Самое тяжелое поражение почек наблюдают у детей с ранним развитием почечной локализации в сочетании с абдоминальным синдромом.
Характер изменений в других системах и органах предопределен общей тяжестью процесса. Изменения со стороны сердца характеризуются симптоматикой функциональных нарушений. В части больных находят разной степени метаболические изменения в миокарде. Развитие хронического нефрита осложняется гипертрофиєю миокард левых отделов сердца. Может развиться сосудистая пневмония с легочным кровотечением (кровохарканье). Она может быть предопределена геморрагической сыпью на слизистой оболочке гортани. Изменения центральной нервной системы предопределены дисциркуляторными нарушениями, церебральным микротромбо-васкулитом. При тяжелой форме ГВ временами наблюдают отек и кровоизлияние в вещество мозга, менингеальные симптомы.
Общепринятой классификации ГВ нет. В рабочих классификациях ГВ, которые предложены и используются в клинической практике, определение клинических форм базируется на учете комбинации клинических симптомов, наличие которых отображено в названии клинической формы (А.А.Ильин, 1984, З.С.Баркаган, 1988), или на основе выделения ведущего клинического синдрома (кожная, или простая, суставная, абдоминальная, молниеносная формы — А.С.Калиниченко, 1968; Е.В.Прохоров, И.Т.Самойленко, 1997), с подчеркиванием наличия кожного варианта при всех формах.
Предусматривается определение степени активности, вариантов течения (острый — до 1,5—2 мес, затяжной — до 6 мес, хронический рецидивирующий — свыше 6 мес и больше с периодами обострения и ремесии).
Показатели лабораторных исследований . В периферичееской гемограмме на высоте активности болезни чаще всего отмечают нейтрофильный лейкоцитоз с незначительным сдвигом влево, особенно при абдоминальном синдроме, небольшое повышение СОЭ, сиалопротеинов, С-реактивного белка. При тяжелых формах ГВ наблюдают гипохромную анемию, диспротеинемию с увеличенной фракцией глобулинов. Изменения уровня сывороточных иммуноглобулинов не однородны. Чаще всего обнаруживают повышение содержания ИgG. Развитие нефротическогого синдрома сопровождается повышением содержания холестерина в крови
Изменения содержания фактора Виллебранда в плазме отражают тяжесть процесса, в частности, распространенность микротромбоваскулита (С.Л.Анмут, 1988). В острый период наблюдают повышение содержания фибриногена при снижении XII (фибринстабилизующего) фактора свертывания крови. По мере затухания активности процесса приведенные сдвиги приобретают оборотный характер.
Течение, окончание, прогноз . Преобладает острое течение с типичными для ГВ клиническими симптомами, интенсивность которых уменьшается параллельно с затиханием активности процесса. В большинстве больных выздоровление наступает через 1,5—2 мес. Возможная малосиндромность проявлений (преобладает кожный геморрагический синдром), однако наблюдают и сочетания синдромов.
Тяжесть и прогноз заболевания определяются интенсивностью проявлений абдоминального и почечного синдромов и их осложнений (кровотечение, перфорация кишки, инвагинация, почечная недостаточность). Рецидивирующее и хроническое течение свойственные вариантам ГВ с развитием почечной локализации.
• Диагноз . Характерным для этой болезни является наличие симметричной мелкоточечной геморрагической сыпи преимущественно на коже конечностей, реже на лице и туловище, которые появляются на фоне повышения температуры тела и в большинстве больных комбинируются с полиартритом или выраженными артралгиями, абдоминальным синдромом в виде приступопобобных болей в животе, часто с рвотой, нередко с меленой.
Приведенные проявления имеют волнообразный характер. Реже, в более поздние сроки, через 2—3 нед, развивается мочевой синдром с преходяящей микропротеинурией, микрогематурией. В части больных обнаруживают гломерулонефрит разной степени тяжести, вплоть до вариантов подострого и хронического течения с почечной недостаточностью.
Дифференциальный диагноз . Кожный геморрагический синдром ГВ следует дифференцировать из сыпью геморрагического характера у больных инфекционным эндокардитом, в которых она менее интенсивна, не имеет выборочной локализации, повторных волн, как при ГВ; лихорадка чаще интермитирующего характера с предыдущим ознобом и интенсивным выделением пота при снижении температуры тела. Характерные изменения в сердце с появлением и нарастанием интенсивности систолического (над верхушкой) или диастолического (над аортой) шумов, артралгии мигрирующего характера, спленомегалия, изменения мочевого осадка, нарастающая анемия. При эхокардиографии обнаруживают вегетации в участке клапанного и пристеночного эндокарда. Повторные исследования часто обнаруживают наличие позитивных результатов посева крови на микрофлору.
Развитие полиартрита, появление боли в животе требуют исключения ревматизма. Но для него характерными являются симптомы кардита с поражением клапанного аппарата (вальвулит), абдоминальный синдром с начала заболевания, какой опережает или является сопутствующим полиартриту, быстро ликвидируется и не рецидивирует на фоне лечения, отсутствие геморрагической сыпи, высокие титры противострептококковых антител.
При наличии почечной локализации ГВ важно учитывать ее сочетание с предыдущими кожным, суставным, абдоминальным синдромами (триада ГВ что дает основание для исключения гломерулонефрита другой этиологии.), Исключение системного заболевания крови при наличии значительных сдвигов показателей периферийной гемограммы предусматривает обязательное исследование костномозгового пунктату. В случае подобия симптоматики ГВ и СКВ (геморрагическая сыпь, артралгии, мочевой синдром) учитывают основные диагностические критерии отмеченной патологии («бабочка», серозит, протеинурия, лейкопения, Lе-клетки при СКВ).
Появление абдоминального синдрома требует исключения ряда инфекционных и хирургических заболеваний, что связано с необходимостью консультативных обзоров специалистов. Важно учитывать при этом наличие при ГВ характерного кожного синдрома. Этот синдром рядом с артритом, абдоминальным синдромом является типичной триадой ГВ и позволяет отличить это заболевание от других системных васкулитов (узелкового периартериита, синдрома Гудпасчера, аортоартериита).
Лечение. Необходимо сурово придерживаться коечного режима на протяжении всего периода максимальной активности (в зависимости от тяжести процесса 2—4 нед) с постепенным перетечениеом на полупостельпый и щадящий по мере затухания процесса. Следует избегать охлаждения больного.
Назначение лечебного питания базируется на принципах использования щадящей и специальной диеты (в пределах лечебных столов 1, 5, 7, 10) с учетом локализации процесса и тяжести симптомов. Из диетического рациона исключают алергизированные продукты (облигатные аллергены — яйца, цитрусовые, какао, шоколад), а также те из них, которые индивидуально плохо переносятся. Первые 2—3 дня полезно ограничить питание слизистыми отварами, протертыми супами, особенно у больных с абдоминальной формой.
Имунокомплексный характер патологии, которая протекает с развитием микротромбоваскулитов, нарушением реологических свойств крови, гиперкоагуляцией, предопределяет необходимость комбинированного принятия медикаментозных препаратов патогенетической терапии, которые способны подавлять активность имуновоспалительных реакций и сверточной системы крови. Обоснованна необходимость включения в медикаментозный комплекс гепарина, который не только является антикоагулянтом, но и дает противовоспалительный иммуносупрессивный эффект, имеет фибринолитическую и липолитическую активность.
В случае назначения гепарина контролируют показатели антикоагуляционного теста, свертывания крови, паракоагуляционные тесты — этаноловый, протаминсульфатный, содержание фибриногена Б. Показанням к назначению гепарина является высокой активностью процесса с нарушением гемокоагуляции. Исключением являются варианты ГВ с ограниченным кожным и суставным синдромом при отсутствии гиперкоагуляции. Препарат вводят 4 раза в сутки через ровные промежутки времени, каждые 5—6 час, подкожно в клетчатку передней брюшной стенки. У больных с тяжелыми формами 2 введения гепарина реализуют внутривенное в составе инфузионной терапии, последние — подкожное. Общий курс лечения — 2—3 нед. В случае развития гломерулонефрита срок введения продлевают под контролем соответствующих показателей до 4—6 нед
Суточная доза гепарина зависит от состояния свертывающей системы крови. При начальном уровне максимальной свертывающей активности (МА) 100% и больше, уменьшении часовых показателей свертывания суточная доза гепарина в среднем составляет 200—300 ОД на 1 кг массы тела в сутки, через 10—15 дней дозу уменьшают на 25 % через каждые 2—3 дня до полной отмены.
При начальной МА в пределах 80 % и меньше суточная доза гепарина составляет 100—150 ЕД на 1 кг массы тела на протяжении лечения — 1— 1,5 нед (Е.В.Прохоров, И.Т.Самойленко, 1997).
При наличии дефицита антитромбина (80 % и выше) как его донатор используют свежезамороженную плазму, которая, кроме того, содержит плазминоген, X и VII факторы свертывания крови, активаторы фибринолитической системы, ингибиторы протеаз. Уведення донорской криоплазмы повышает эффективность терапии. Необходимо учитывать, что гепарин снижает тромборезистентность сосудистой стенки и усиливает агрегационные свойства тромбоцитов. Названные реакции корректируются назначением дезагрегантов: дипиридамола (курантила) в дозах 3—5 мг на 1 кг массы тела в сутки, трентала (пентоксифилина) по 50—100 мг 3 раза в сутки детям до 10 лет и старшим перорально или внутривенно. Эти препараты можно использовать одновременно на фоне снижения дозы гепарина и в случае необходимости после его отмены. Блокаду микроциркуляции уменьшает реополиглюкин, который вводят внутривенно (10—15 мл на 1 кг массы тела) за показаниями у больных с тяжелыми вариантами ГВ, с ограничением при сердечной и острой дыхательной недостаточности, угрозе отека легких. Дозы гепарина при введении реополиглюкина уменьшаются на 1/3—1/2, потому что препарат усиливает эффект гепарина.
Улучшению гемоциркуляции способствуют платифиллин, эуфилин, но-шпа. Развитие суставного синдрома, наличие боли разной локализации оправдывает применение нестероидных противовоспалительных препаратов, из которых при учете переносной преимущество отдают вольтарена, ибупрофена, поскольку они имеют меньшее косвенное действие. Необходимо учитывать ульцерогенный (слизистая оболочка пищеварительного тракта). нефротоксический эффект этих препаратов и с осторожностью назначать их больным с абдоминальным синдромом при обязательной комбинации из гастропротекторами. Тяжелые формы ГВ с распространенными локализациями, абдоминальным и почечным синдромами является показаниями к назначению глюкокортикостероидив (особенно при наличии нефротического компонента).
На протяжении 1-й недели высокой активности болезни суточную дозу преднизолона (3—4 мг на 1 кг массы тела) распределяют на два внутривенных введения. С 2—3-й недели дозу постепенно уменьшают вплоть до отмены. При легких проявлениях ГВ преднизолон назначают через рот в небольших дозах (1,5—2 мг на 1 кг массы тела на протяжении 1,5—2 нед, реже дольше, с последовательным уменьшением дозы вплоть до отмены препарата). Кроме вариантов тяжелых форм глюкокортикостероиды в дозе 1— 1,5 мг на 1 кг массы тела на сутки назначают при отсутствии эффекта от проведенной терапии, которая включает гепарин, дезагреганты, при волнообразном, затяжном течении заболевания. У таких больных целесообразно назначать производные аминохинолинового ряда. Цитостатические препараты назначают больным, у которых есть угроза хронизации почечного процесса, при развитии вариантов подострого и хронического нефрита, рецидивов гломерулонефрита. В медикаментозном лечении больных необходимо избегать полипрагмазии, немотивованного назначения антибиотиков. Температурная реакция у больных ГВ резистентная к антибиотикам, потому что она предопределена нарушениями иммунного характера.
Значительное место в лечении больных отводят инфузионной терапии, которая исправляет дезинтоксикационное и регидратационное влияние (растворы 5—10 % глюкозы, Рингера, реополиглюкина, при наличии диареи — гемодез).
К комплексной терапии включают антиоксиданты и мембраностабилизирующие препараты. В интенсивном лечении больных с тяжелыми формами ГВ используют методики имуноелиминации, из которых преимущество отдают плазмаферезу, который способствует дезагрегации, антикоагуляции, улучшает микроциркуляцию. Во время проведения дискретного плазмафереза в один сеанс отводят 1/10—1/5 объема циркулирующей крови с замещением плазмозамещающими жидкостями (реополиглюкин, альбумин, свежая замороженная плазма, изотонический раствор натрия хлорида). Проводят 2— 5 сеансов применения поливалентных ингибиторов протеаз (контрикал по 300—500 ОД на 1 кг массы тела в сутки). Оно показано при выраженном повышении общей протеолитической активности и недостаточном уровне фибринолитической активности крови.
Больным, у которых имеется развитие эрозивного гастрита, дуодениту, рекомендуют включить в комплексное лечение Н-блокаторы рецепторов гистамина—ранитидин, квамател (фамогидин). За последние часы из препаратов поддерживающей терапии у больных с атопическим диатезом используют кетотифена флюмарат.
Профилактика обострений в значительной мере зависит от организации этапного лечения больных (стационар, местный ревматологический санаторий, диспансерное наблюдение педиатра, ревматолога, гематолога). Необходимо предотвратить заболеваемость ребенка на инфекционную патологию, аллергизации пищевыми продуктами, лекарственными препаратами, другими аллергенами. Опасные охлаждения и гиперинсоляция, противопоказанная аппаратная физиотерапия, активные спортивные занятия. При отсутствии обострений и осложнений заболевания на протяжении 5-летней ремесии можно снять ребенка из диспансерного учета.
Профилактические прививки проводят через 3—5 лет от начала стойкой клинико-иммунологической ремесии.
В первичной профилактике геморрагического васкулита необходимо исключить сенсибилизацию разными экзогенными (пищевые, медикаментозные, инфекционные) и эндогенными аллергенами, особенно среди контингента детей с алергическим диатезом.
Тромбоцитопеническая пурпура
В структуре детских гематологических заболеваний тромбоцитопении (тромбоцитопенические пурпуры) занимают второе место после анемий.
«Пурпура» — означает мелкое кровоизлияние в более толстые кожи, слизистых оболочек (ригрига — драгоценная античная краска темно-красного цвета, которую добывали из пурпурной улитки и использовали для окрашивания тканей).
Тромбоцитопения может наблюдаться как осложнение течения детских инфекций (корь, ветреная оспа, эпидемический паротит), но чаще всего она является самостоятельным синдромом, который возникает преимущественно после вирусных инфекций (острые респираторные инфекции, инфекционный гепатит), при наличии глистной инвазии, токсоплазмоза. Она может быть медикаментозного генеза, развиться в результате принятия сульфаниламида, анальгетиков, полусинтетических антибиотиков, противоглистяных препаратов, бутадиона, бруфена, делагила, метиндола и некоторых других средств.
В свете современных данных тромбоциты являют собой высокоспециализированные клетки, которые функционируют при отсутствии ядра, то есть они освобождены от ДНК, богатые на ферменты, содержание АТФ и АДФ у них намного превышает содержание их в других клетках крови.
В последнее время придают большое значение повышенному содержанию сиаловых кислот в гликопротеинах мембраны тромбоцитов как для процессов созревания тромбоцитов, так и для стимуляции мембранных реакций, то есть для взаимодействия пластин между собой и с клетками ретикулоэндотелиальной системы.
Участие тромбоцитов в гемостазе проявляется основными их функциями. Они поддерживают спазм поврежденных сосудов, обеспечивают трофику эндотелиальных клеток (ангиотрофическая функция), способствуют образованию первичной гемостатической пробки (функция адгезивно-агрегации), доставляют и концентрируют плазменные факторы свертывания крови в участке травмы (транспортно-концентрационная функция), принимают участие в процессах свертывания крови и оказывают ингибирующее влияние на фибринолиз. Продолжительность жизни тромбоцитов в кровообращении около 8—11 суток. Пять процентов тромбоцитов погибает ежесуточно в результате старения, ЗО % — тратится в процессе свертывания, которое протекает в организме постоянно.
Нормальные величины тромбоцитов в периферической крови — в пределах 150— 400 х Г/л, в среднем — 230Г/л.
Снижение количества тромбоцитов может быть предопределено усиленным их разрушением и потерей и недостаточным образованием. Процесс усиленного разрушения происходит чаще всего в патогенезе тромбоцитопений.
Выделяют наследственные и приобретены формы тромбоцитопений. При многих наследственных тромбоцитопениях наблюдают изменения разных функциональных свойств тромбоцитов, что дает основания относить эти болезни к группе тромбоцитопатий.
Приобретенные формы принято разделять за генезом повреждения мегакариоцитар-ного аппарата на иммунных и предопределенные механической травматизацией пластинок (при гемангиомах, спленомегалии), а также формы, связанные с притеснением пролиферации клеток костного мозга (при апластической анемии, химическом или радиационном повреждении костного мозга), замещением гемопоетическои ткани на опухолевую или соматической мутацией (при лейкозах, лимфомах, болезни Маркиафави—Микели) или повышенным растрачиванием тромбоцитов (при тромбозах, ДВС-синдроме) и недостаточностью цианокобаламина или фоллиевой кислоты.
В свою очередь среди иммунных тромбоцитопений выделяют такие: а) изоимунные, при которых разрушение тромбоцитов связано с несовместимостью за групповыми антигенами крови: бы) трансимунные, при которых антитела матери с болезнью Верльгофа проникают через плаценту и вызывают тромбоцитопению у ребенка; в) гетероиммунные, связанные с нарушением антигенной структуры тромбоцитов под воздействием вируса или с появлением нового антигену или гаптену; г) аутоимунные, при которых антитела производятся против собственного неизмененного антигена.
У детей чаще наблюдают гетероиммунные варианты, а у взрослых — аутоимунные. В зависимости от того, против которого антигену направлены антитела, тромбоцитопения может быть предопределена антителами против антигена тромбоцитов, против антигена мегакариоцитов или против антигена общего предшественника тромбоцитов, лейкоцитов и эритроцитов. Кровотечение при тромбоцитарной недостаточности имеет микроциркуляторный характер.
Геморрагический синдром наблюдают очень часто, однако у некоторых больных с умеренной тромбоцитопенией — ниже от 150 Г/л — и даже с выраженной тромбоцитопенией много месяцев и даже лет может не быть спонтанных кровотечений. Нет абсолютной зависимости между количеством тромбоцитов в периферической крови и тяжестью геморрагического синдрома. Клинические наблюдения свидетельствуют, что в случае снижения количества тромбоцитов до 80—100 Г/л спонтанные кровотечения наблюдают очень редко. Кровотечение может возникнуть в результате травмы. В случае снижения количества тромбоцитов до 30-40 Г/л спонтанное кровотечение бывает очень часто, но она не является неминуемой. Если количество тромбоцитов составляет 10 Г/л и ниже, спонтанное кровотечение наблюдают очень часто. Обычно она бывает достаточно сильной и изнурительной. 35 Г/л — это критическая цифра Франка, ниже от которой даже тромбоциты, которые функционируют нормально, могут не справиться с основным заданием в гемостазе.
Особенную группу составляют медикаментозные тромбоцитопении. Они сравнено частой побочной реакцией на употребление многих лекарств, естественной для цитостатических препаратов и неожиданной для других медикаментозных средств.
Основными методами диагностики тромбоцитопений являются такие: 1) количественное определение числа тромбоцитов в периферической крови; 2) время кровотечения за Дюком или Борхгревинком—Валлером; 3) ретракция кровяного сгустка; 4) тромбоцитограмма; 5) выявление антитромбоцитарных аутоантител; 6) исследование плазменных факторов свертывания крови; 7) аутокоагуляционный тест; 8) исследование мегакариоцитарного аппарата в стернальном пунктате костного мозга.
ДИАГНОСТИКА И ЛЕЧЕНИЕ ОСНОВНЫХ ФОРМ ТРОМБОЦИТОПЕНИЙ
Идиопатическая тромбоцитопеническая пурпура .
Этиология и патогенез. Основным механизмом развития идиопатической тромбоцитопенической пурпуры (ИТП) считают разрушение тромбоцитов антителами против антигенов, связанных с ними. Последние появляются в результате инфекции, влиянию лечебных препаратов, токсинов и является аутоантигенами. Это подтверждается тем, что инкубация лимфоцитов больных на ИТП с аутологичными тромбоцитами приводит к бласттрансформации лимфоцитам. Известно, что основным местом синтеза аутоантител является селезенка. Однако некоторая часть их синтезируется в костном мозге и разных лимфоидных тканях. Комплекс тромбоциты—антитела разрушается в макрофагах и ретикулоэндотелиальных клетках. Основным местом разрушения тромбоцитов является селезенка.
Доказано, что в 88 % больных на ИТП в патогенезе заболевания основное значение имеет наследственная склонность — качественная неполноценность тромбоцитов, которая передается по аутосомно-доминантному типу — тромбоцитопатия, как правило, дезагрегационного типа. Обнаружено наличие структурных изменений тромбоцитов при ИТП в виде анизоцитоза, увеличения канальцев, гиперплазии вакуолей, увеличения объема тромбоцитов (макротромбоциты). В настоящее время доказано, что при ИТП количество тромбоцитов, которые образуются за единицу времени, значительно растет сравнительно с нормой (с 2,1 до 6,5 раза), в сочетании с резким сокращением — до нескольких часов — продолжительности их жизни.
Клиника. Данные цитохимических исследований подтверждают увеличение в крови всех больных ИТП количества молодых форм тромбоцитов, качественный функциональный дефект которых заключается в значительном нарушении гидролитических и окислительно-восстановительных процессов в них.
Увеличение количества мегакариоцитов и гиперпродукция тромбоцитов связанные с повышением уровня тромбоцитопоетинов в ответ на низкое содержание тромбоцитов.
Считают, что количество деятельных мегакариоцитов у больных ИТП не уменьшено, а увеличено. Большое количество молодых мегакариоцитов, быстрое отшнуровывание тромбоцитов и быстрое их вливание в циркуляцию создают впечатление, что мегакариоциты при ИТП нефункциональные.
Болезнь может протекать в острой или хронически рецидивирующей форме. У детей чаще всего встречается хроническая форма, хотя в возрасте до 8 часов в 85 % случаев диагностируют острую форму ИТП. Считают, что отсутствие позитивных результатов лечения острой формы ИТП на протяжении 6 мес свидетельствует о переходе заболевания в хроническую форму.
ИТП может возникнуть в любое время часа, но максимальное количество заболеваний регистрируют весной. В 80 % больных детей в анамнезе даны об острой респираторной инфекции, токсоплазмоз, инфекционный мононуклеоз, красную сыпь, ветреную оспу, паротит и медикаментозные средства, что их применяют для лечения этих заболеваний.
Карпаткиним (1971) предложены пять критериев диагностики ИТП:
1. Повышена деструкция тромбоцитов, которая может быть некомпенсированной и компенсированной. В первом случае отмечают тромбоцитопению, во втором — при нормальном количестве тромбоцитов наблюдают сокращение их жизни, о чем может свидетельствовать увеличение количества мегакариоцитов (МКЦ) до 40 % (норма 6-Ю %).
2. Повышено количество МКЦ в костном мозге; часто отмечают патологическую морфологию МКЦ (асинхронизм созревания, потеря гранул, вакуолизация и другие дегенеративные изменения), которая объясняется усиленным образованием тромбоцитов в костном мозге.
3. Наличие антитромбоцитарных антител при отсутствии повторных переливаний крови и тромбомассы.
4. Отсутствие другой первичной патологии (гиперспленизм, ДВС-синдром, лимфопролиферативные заболевание, СКВ, инфекционная и лечебная тромбоцитопения).
5. Отсутствие спленомегалии.
В тех случаях, когда количество антитромбоцитарных антител очень большое или когда антитела направлены антигену мегакариоцитов, отсутствующего на поверхности тромбоцитов, возможно нарушение выработки магакариоцитов.
Определение антитромбоцитарных антител связано с большими методическими трудностями. В основном определяют тромбаглютинины сыворотки. Однако антитела при иммунных тромбоцитопениях чаще всего бывают неполными. Они фиксируются на тромбоцитах, нарушают их функции, приводят к их гибели, но не вызывают агглютинации. Метод тромбоаглютинации обнаруживает лишь полные антитела, которые вызывают агглютинацию при смешивании сыворотки больного с тромбоцитами донора.
Для определения антитромбоцитарных антител широко используют тест Штеффена, который основывается на определении потребления антиглобулина. Однако он оказался не достаточно чувствительным.
Для определения антитромбоцитарных антител более достоверным является количественное определение антитромбоцитарных антител на поверхности тромбоцитов за методом Диксона и соавторов (1975). В норме на поверхности тромбоцитов содержание иммуноглобулина класса не превышает 14 • 10-15 Г/тромбоцит. При иммунных тромбоцитопениях количество его растет до 200-250 • 10-15 Г/тромбоцит, что предопределяет сложность внедрения этого метода в широкую практику.
Проводя дифференциальную диагностику ИТП, нужно исключить тромбоцитопенические синдромы другого генеза, в первую очередь гемобластозы, при которых тромбоцитопению обнаруживают как синдром притеснения мегакариоцитарного звена за счет пролиферативного роста лейкемической популяции, аплазию кроветворения, которое сопровождается поражением всех трех звеньев кроветворения. В таких случаях стернальная пункция является решающим диагностическим средством.
Болезнь Маркиафави—Микели в детском возрасте встречается крайне редко. Тромбоцитопения предопределена неполноценностью мембраны как тромбоцитов, так и эритроцитов и лейкоцитов в результате соматической мутации. Гемолитический компонент, который приводит к анемизации разной степени, является ведущим симптомом в патогенезе заболевания. Пробы на гемолиз (из 10 % сахарозой), на дефицит Г-6-ФД и исследование гемосидерина в моче — адекватные вспомогательные диагностические тесты.
При дефиците цианокобаламина и фоллиевой кислоты тромбоцитопения совмещается из макроцитарной гиперхромной анемией и развивается в результате нарушения процессов митозу всех гемопоетических элементов.
Тромбоцитопении потребления связаны с массовым исключением из циркуляции тромбоцитов и фибриногена при тромбозах и диссеминованном внутрисосудистом свертывании. В этих случаях тромбоцитопения носит симптоматический характер, но диагностика нарушений сложна и включает в себя изучение в динамике всех лабораторных показателей системы свертывания и антисвертывания крови.
Лечение ИТП включает стероидную терапию, направленную на предотвращение разрушения тромбоцитов, нагруженных антителами, в селезенке. Кроме того, стероиды способствуют укреплению сосудистой стенки даже без соответствующего повышения количества тромбоцитов. Цель этой терапии — поддержать количество тромбоцитов на безопасном уровне (50 000).
Лечение стероидными гормонами проводят в дозе 1—1,5 мг на 1 кг (до 2,5 мг на 1 кг) массы тела в сутки на протяжении 2-4 мес. Повторный курс гормональной терапии оправдан в случаях тяжелых геморрагических проявлений. Иногда после отмены или уменьшения рабочей дозы гормонов наступает рецидив. Это требует возвращения к вытечениеным высоких доз преднизолона. Приблизительно в 10 % больных эффект кортикостероиднои терапии вообще отсутствует.
Хороший эффект у больных с иммунными формами тромбоцитопении отмечен от внутривенного введения иммуноглобулина.