Современная антитромботическая терапия у больных c острым Q-инфарктом миокарда
Тромболитическая терапия на сегодняшний день является основой медикаментозного лечения инфаркта миокарда (ИМ). Высокая агрессивность такого лечения обусловливает нежелательные эффекты терапии. Прежде всего практического врача беспокоит высокая частота осложнений, возникающих при применении тромболитических препаратов. Тяжелые кровотечения, значительное количество рецидивов заболевания, относительно высокая летальность больных, сложность их ведения не позволяют начинать тромболизис на догоспитальном этапе. К вопросу о способах преодоления этих трудностей при лечении больных с инфарктом миокарда постоянно обращаются ведущие кардиологи Украины.
Предлагаем вниманию читателей некоторые доклады, посвященные проблемам современного лечения инфаркта миокарда, прозвучавшие на Всеукраинской научно-практической конференции «Терапевтические чтения памяти академика Л.Т. Малой».
 Об основных проблемах современной тромболитической терапии и адъювантной терапии рассказывает член-корреспондент АМН Украины, главный кардиолог МЗ Украины, заведующая кафедрой госпитальной терапии №1 НМУ им. А.А. Богомольца, доктор медицинских наук, профессор Екатерина Николаевна Амосова .
Об основных проблемах современной тромболитической терапии и адъювантной терапии рассказывает член-корреспондент АМН Украины, главный кардиолог МЗ Украины, заведующая кафедрой госпитальной терапии №1 НМУ им. А.А. Богомольца, доктор медицинских наук, профессор Екатерина Николаевна Амосова .
Тромболитическая терапия: ее возможности
Как сказал известный кардиолог J. Trent (1995), после дефибриллятора тромболизис является самым крупным достижением в лечении ИМ.
Все современные достижения в антитромботической терапии базируются на гипотезе «открытой артерии» (E.Braunwald, 1989). Реканализация инфаркт-зависимой коронарной артерии способствует уменьшению очага некроза, сохранению функции левого желудочка и выживаемости больных. Интересным представляется наличие положительного эффекта реканализации на показатели выживаемости, независимо от влияния на размер очага некроза. Это касается тех пациентов, у которых происходит открытие коронарной артерии через 6-12 часов от начала заболевания, когда практически невозможно «спасти» ишемизированные клетки миокарда. Открытие коронарной артерии оказывает не только положительный ближайший эффект. Этот эффект сохраняется длительное время, что и обусловливает особое значение совершенствования методов реканализации коронарных сосудов при ИМ.
На сегодняшний день наиболее широко используемой комбинацией препаратов для медикаментозного открытия коронарной артерии является сочетание альтеплазного (тканевого) активатора плазминогена, аспирина и внутривенного нефракционированного гепарина (НФГ).
Хотя частота «открытия» коронарной артерии при таком лечении достаточно велика (85%), имеет значение не просто открытие артерии, а восстановление ее полной проходимости. Эти цифры значительно меньше и составляют 54%. Еще более важный показатель – частота реперфузии на уровне ткани, что далеко не всегда совпадает с проходимостью артерии и составляет около 40% при полном восстановлении эпикардиального кровотока. Большой проблемой для сохранения положительного эффекта тромболитической терапии остаются ретромбоз и реокклюзия, частота которых достигает 10-12%. Госпитальная летальность при такой терапии составляет около 6%, причем нужно учесть, что эти цифры касаются не всех больных, а только отобранных для тромболитической терапии. Больные, которым противопоказана тромболитическая терапия и не подвергшиеся вышеуказанной схеме лечения, относятся к другой группе и в данном анализе эффективности лечения не учитываются.
Серьезной проблемой также остаются такие осложнения антитромботической терапии, как внутричерепные кровотечения. Хотя частота их по абсолютным цифрам невелика (1 на 120-150 больных), но последствия для больного порой трагичны.
Оптимальной реперфузии после тромболизиса препятствуют:
• остаточный тромбоз КА;
• остаточный стеноз КА;
• микроэмболизация дистального русла;
• отсутствие миокардного кровотока при «открытой» КА (феномен «no-reflow»);
• ретромбоз.
Преодоление этих проблем подразумевает не только совершенствование тромболитических агентов. Революционных открытий в тромболитической терапии на данный момент не наблюдается, несмотря на появление новых, весьма эффективных и дорогостоящих препаратов. Все, чего кардиологи смогли достичь на сегодняшний день в этом направлении, это – усовершенствование методов введения тромботических препаратов и некоторое уменьшение частоты геморрагических осложнений.
Достаточно большое внимание уделяется совершенствованию адъювантной антитромботической терапии, которая направлена на предупреждение раннего и позднего ретромбоза и, возможно, на уменьшение частоты микроэмболизации сосудов дистального русла и улучшение тканевой реперфузии. К препаратам этой группы относятся низкомолекулярные гепарины, прежде всего эноксапарин, пентасахариды, прямые ингибиторы тромбина, непрямые антикоагулянты. Эти же цели преследует применение мощных антитромбоцитарных агентов, составляющих основу адъювантной антитромбоцитарной терапии, – внутривенных ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa.
Новые тромболитики: перспективы их применения
К появившимся в последние годы в широкой клинической практике новым тромболитическим препаратам относятся ретеплаза (которой в Украине на данный момент нет) и тенектеплаза (недавно появилась на украинском фармацевтическом рынке). Это – «усовершенствованные» тканевые активаторы плазминогена – высокофибринспецифичные агенты. По сравнению с альтеплазой и ретеплазой, тенектеплаза отличается более высокой фибриноспецифичностью и увеличенным периодом полужизни в плазме. Это позволяет вводить тенектеплазу в виде одного внутривенного болюса. Такой способ введения очень удобен и позволяет начинать тромболизис еще на догоспитальном этапе. Кроме того, только у тенектеплазы существует резистентность к ингибитору активатора плазминогена 1 типа.
Как же преимущества препаратов реализуются в клинике? Можно суммировать данные многоцентровых клинических исследований в виде сравнительной клинической эффективности тромболитических препаратов.
1. Альтеплаза незначительно превосходит стрептокиназу по эффективности (спасая одну жизнь из ста дополнительно по сравнению с применением стрептокиназы), но вызывает достоверно больше внутричерепных кровотечений (исследование GUSTO-I, 1993).
2. Ретеплаза эквивалентна стрептокиназе (исследование INJECT, 1995).
3. Ретеплаза не превосходит альтеплазу (исследование GUSTO-III, 1997).
4. Тенектеплаза эквивалентна альтеплазе, но безопаснее – вызывает меньше тяжелых внутричерепных кровотечений (исследование ASSENT-2, 1999).
5. Ланотеплаза эквивалентна альтеплазе, но вызывает больше внутричерепных кровотечений (исследование TIMI-2, 2000).
Из этого следует закономерный вывод, что существующие на данный момент тромболитические препараты, несмотря на наукоемкие и дорогостоящие технологии производства, обеспечивают очень ограниченный прирост клинической эффективности. Совершенствование препаратов состоит, главным образом, в удобстве введения и некотором уменьшении частоты тяжелых осложнений терапии (внутричерепных кровотечений).
Адъювантная антитромботическая терапия: низкомолекулярные гепарины
Тромболизис сопровождается одновременной активацией тромбинообразования. Процесс этот обусловлен обнажением тромбогенной поверхности, высвобождением тромбина из тромба, прокоагулянтным эффектом плазминемии и потреблением плазминогена. Активация тромбоцитов дополнительно усугубляет тромбообразование, что в итоге может приводить к ретромбозу. Ретромбоз является ахиллесовой пятой тромболитической терапии, способствует рецидивирующей ишемии и ИМ, прогрессирующему ухудшению функции левого желудочка и, как следствие, – уменьшению выживаемости больных. Ретромбоз через 6-12 часов встречается в 5-12% случаев, через 30 дней – в 10-25%, через 3-6 месяцев – в 25-35% случаев. В 40-50% случаев ретромбоз протекает бессимптомно. Поэтому уменьшение тромбинообразования является очень важной задачей в совершенствовании адъювантной терапии при проведении медикаментозного фибринолиза. Исследования свидетельствуют, что добавление нефракционированного гепарина к тромболитической терапии позволяет достоверно увеличить частоту достижения проходимости инфаркт-зависимой коронарной артерии. Метаанализ показал, что этот дополнительный эффект трансформируется в достоверное снижение показателей летальности – на 16% к 6-й неделе.
Практически все исследования, касающиеся низкомолекулярных гепаринов (НМГ), были проведены с эноксапарином (Клексаном). Поэтому все последующие заключения о результатах применения НМГ будут касаться практически исключительно эноксапарина.
Важным шагом в определении оптимальной адъювантной терапии при проведении тромболизиса стрептокиназой стало исследование AMI-SK, задачей которого была оценка эффективности эноксапарина как средства дополнительной антитромботической терапии. Известно, что при тромболизисе стрептокиназой введение нефракционированного гепарина не является обязательным, так как он не дает дополнительного клинического эффекта – ни при подкожном, ни при внутривенном введении. В силу неблагоприятной экономической ситуации в Украине стрептокиназа – наиболее доступный тромболитический агент. Поэтому повышение эффективности тромболизиса стрептокиназой особенно интересно именно отечественным врачам. В крупном исследовании AMI-SK оценена эффективность стрептокиназы в сочетании с эноксапарином (Клексаном) по сравнению с применением только стрептокиназы. По косвенному маркеру реперфузии – эволюции сегмента ST – частота реперфузии в группе эноксапарина увеличивается. Возрастает и частота проходимости инфаркт-зависимой коронарной артерии по данным ангиографии на 8-й день, то есть речь идет о предупреждении раннего ретромбоза. Этот эффект в наибольшей мере касается полного восстановления коронарного кровотока (TIMI-3), что трансформируется в выраженный клинический эффект. Эноксапарин, по сравнению с плацебо, позволяет существенно снизить суммарную частоту «смерть + реинфаркт + нестабильная стенокардия» (тройная конечная точка) на 30-е сутки.
Эффективность эноксапарина, в сравнении с нефракционированным гепарином, при тромболизисе тканевым активатором плазминогена (ТАП) впервые была оценена в исследовании HART-II. Известно, что, в отличие от тромболизиса стрептокиназой, при тромболизисе ТАП в связи с резким увеличением частоты ретромбоза применение гепарина обязательно. По сравнению с обычным гепарином, эноксапарин способствовал существенному уменьшению частоты ранней (на 5-7-е сутки) реокклюзии.
Данные крупного многоцентрового исследования ENTIRE-TIMI-23, с участием более 2000 больных, показали преимущества эноксапарина в сравнении с НФГ при тромболизисе тенектеплазой (наиболее эффективным и безопасным тромболитическим агентом на сегодняшний день). Наблюдалась одинаковая частота раннего полного открытия коронарной артерии, достаточно высокие показатели безопасности и достоверное значительное уменьшение двойной конечной точки – «смерть + реинфаркт» на 30-е сутки при применении эноксапарина. Следовательно, показано, что по сравнению с НФГ эноксапарин является не только более удобным и простым в применении антитромбиновым препаратом (не требующим контроля показателей коагуляции крови), но и способствует улучшению клинического эффекта при лечении ИМ за счет уменьшения частоты реинфаркта, предупреждения ранних и поздних реокклюзий.
В исследовании ASSENT-3 проанализированы два новых подхода в улучшении результатов тромболитической терапии тенектеплазой. Эноксапарин как адъювантный агент изучался в сравнении с мощным ингибитором гликопротеиновых рецепторов IIb/IIIa абсиксимабом, который назначался в дополнение к аспирину и НФГ в сниженной дозе. Результаты исследования показали одинаковую летальность в группах, которая была равна таковой при применении НФГ (в полной дозе), но в обоих случаях (группа эноксапарина и группа абсиксимаба) уменьшились частота реинфарктов миокарда и «двойной конечной клинической точки» – «смерть + реинфаркт».
Требования к безопасности препаратов остаются для нас не менее актуальной проблемой. При тромболитической терапии основным и тяжелым ее осложнением являются кровотечения. В том же исследовании обе стратегии адъювантной терапии показали отсутствие каких-либо преимуществ перед общепринятым подходом в отношении частоты геморрагий в группе больных моложе 75 лет, но среди больных старше 75 лет наблюдается значительное повышение частоты «больших» кровотечений. Особенно резко растет частота кровотечений в схеме, включающей абсиксимаб, что не позволяет рекомендовать ее использование в практике. Несколько повышается также частота кровотечений и при применении эноксапарина, по сравнению с НФГ в этой группе больных.
В исследовании ASSENT-3 изучалась эффективность догоспитального тромболизиса тенектеплазой, что является одним из приоритетных направлений в современной кардиологии. Сравнивалась методика введения тенектеплазы болюсно в сочетании с НФГ или эноксапарином (Клексаном). Анализируя показатель эффективности по тройной конечной точке «смерть + реинфаркт + нестабильная стенокардия», можно отметить, что применение Клексана вместо обычного гепарина было эффективным у больных моложе 75 лет, у больных старше 75 лет дополнительный эффект отсутствовал, кроме того, у второй группы больных существенно возрастала частота внутричерепных кровотечений при применении эноксапарина.
В результате анализа множества исследований по изучению эффективности и безопасности эноксапарина как агента адъювантной антитромбиновой терапии при тромболизисе получены следующие данные.
1. Полная проходимость инфаркт-зависимой коронарной артерии (КА) (исследование TIMI-3), 90 мин;
• ЭН=НФГ* (исследования НАRТ-II, ENTIRE-TIMI-23).
2. Проходимость КА TIMI-3, 7-е сутки:
• ЭН>плацебо (исследования AMI-SK);
• ЭН>НФГ (исследования HART-III).
3. Рецидив ИМ и рефрактерная ишемия:
• ЭН>НФГ (исследования AMI-SK, ASSENT-3).
4. Летальность:
• ЭН=НФГ (все исследования).
5. Тяжелые кровотечения (в том числе внутричерепные):
• ЭН=НФГ (все исследования, за исключением подгруппы >75 лет);
_______________
* (= – равноэффективен, > – более эффективен).
Следовательно, применение эноксапарина не улучшает проходимости коронарной артерии в остром периоде ИМ в сравнении с гепарином, но увеличивает ее проходимость в подостром периоде, предупреждает рецидивы ИМ и рефрактерную ишемию, не обладает преимуществами в отношении уменьшения летальности и частоты тяжелых кровотечений, а в группе больных старше 75 лет даже ассоциируется с увеличением риска последних.
С учетом полученных данных о высокой частоте осложнений у больных старческого возраста при применении НМГ в протокол крупного исследования ExTRACT-TIMI-25, в котором участвует и Украина, была сделана поправка: для больных старше 75 лет исключен болюс эноксапарина, а доза этого препарата для подкожного введения уменьшена до 0,75 мг/кг 2 раза в сутки (в остальных случаях – по 1 мг/кг). Это исследование должно окончательно выяснить сравнительную эффективность эноксапарина и НФГ при тромболизисе. Как предполагается, результаты этого исследования будут основополагающими в новой редакции рекомендаций по применению НМГ, в частности эноксапарина, при тромболитической терапии.
Адъювантная антитромботическая терапия: другие препараты
Преимущества пентасахаридов, казалось бы, должны способствовать повышению клинического эффекта: они не действуют на тромбин, не связываются с тромбоцитарным фактором 4 (ТФ 4), имеют период полужизни, равный 19 часам, и назначаются 1 раз в сутки. В исследовании PENTALYSE (2001) изучали пентасахарид фондапаринукс у больных, получавших тромболитическую терапию ТАП, по сравнению с НФГ. Открытие коронарной артерии и сохранение ее проходимости, частота реинфарктов и летальность оставались примерно одинаковыми в обоих случаях. При увеличении дозы фондапаринукса (к которому, что особенно важно, на сегодняшний день нет антидота!) растет риск тяжелых кровотечений. Лишь в дозе 4 мг этот препарат столь же безопасен, как и НФГ, при этом он не имеет преимуществ по клинической эффективности. Таким образом, пентасахариды не теряют значения как перспективная группа антитромботических препаратов, но на сегодняшний день целесообразность их применения при тромболитической терапии не определена.
Препараты, относящиеся к прямым ингибиторам тромбина, также имеют ряд преимуществ. Достаточно интересным их свойством является способность ингибировать тромбин независимо от концентрации антитромбина III (AT III). Кроме того, прямые ингибиторы тромбина частично инактивируют тромбин, связанный со сгустком, и не инактивируются белками плазмы и ТФ 4. Однако многочисленные исследования этих препаратов показывают очень незначительные преимущества относительно клинического эффекта. Исследование HERO-2, в котором участвовала и Украина, включало более 17 тысяч больных. Была убедительно показана способность препарата бивалирудин предупреждать ранние рецидивы ИМ (в течение 0-96 часов) по сравнению с НФГ при тромболизисе стрептокиназой. В остальном эффективность препарата не превышала таковую при применении НФГ. А учитывая необходимость контроля показателей коагуляции крови и достаточно узкое терапевтическое окно при применении прямых ингибиторов тромбина, особых надежд на эти препараты кардиологи пока не возлагают.
Не следует забывать также и о непрямых антикоагулянтах. Хотя они и достаточно неудобны в применении, требуют контроля международного нормализованного отношения, но они очень дешевы и потому доступны для многих пациентов. Ренессанс этой группы препаратов наметился после публикации в 2002 году результатов многоцентрового исследования APRІCOT-2, в котором изучался непрямой антикоагулянт кумарин в сочетании с аспирином по сравнению с одним только аспирином после тромболизиса. Добавление кумарина к аспирину выявило дополнительный эффект в отношении реокклюзий и выживаемости больных без коронарных событий. Столь же оптимистичные результаты получены в исследовании ASPECT-2.
Относительно внутривенных ингибиторов гликопротеиновых рецепторов IIb/IIIa тромбоцитов исследование ASSENT-3 показало отсутствие каких-либо преимуществ по сравнению с эноксапарином по суммарному показателю эффективность/безопасность.
Выводы
Рекомендации Европейского общества кардиологов по адъювантной антитромботической терапии у пациентов с Q-инфарктом миокарда таковы.
• Применение внутривенно блокаторов гликопротеиновых рецепторов IIb/IIIa в сочетании с тромболитиком (в сниженной дозе) не рекомендуется.
• Несмотря на полученные в нескольких исследованиях данные о большей эффективности эноксапарина по сравнению с НФГ, применение НМГ в комбинации с тромболитиками в Европе официально не рекомендовано (до получения результатов исследования ExTRACT-TIMI-25).
• Рекомендуемая доза НФГ уменьшена в связи с риском кровотечений и составляет:
• болюсно: 60 ЕД/кг, но не более 4000 ЕД;
• инфузионно: 12 ЕД/кг (но не более 1000 ЕД/ч) в течение от 24 до 48 часов. Целевое АЧТВ – 50-70 секунд. Контроль АЧТВ – через 3, 6, 12, 24 часа.
______________
 Другой аспект лечения инфаркта миокарда касается особенностей ведения больных при невозможности проведения реперфузионной терапии – как инвазивной, так и медикаментозной. Известно, что эти методы лечения в ряде случаев противопоказаны. Высокий риск возникновения тяжелых кровотечений и кровоизлияний порой делают тромболитическую терапию невозможной у отдельных пациентов, что ставит перед кардиологом сложную задачу – разработать успешную тактику лечения без применения тромболитиков. Об основных аспектах этой проблемы рассказывает сотрудник отдела острого инфаркта миокарда Института терапии им. Л.Т. Малой АМН Украины, кандидат медицинских наук Ярослав Васильевич Дыкун .
Другой аспект лечения инфаркта миокарда касается особенностей ведения больных при невозможности проведения реперфузионной терапии – как инвазивной, так и медикаментозной. Известно, что эти методы лечения в ряде случаев противопоказаны. Высокий риск возникновения тяжелых кровотечений и кровоизлияний порой делают тромболитическую терапию невозможной у отдельных пациентов, что ставит перед кардиологом сложную задачу – разработать успешную тактику лечения без применения тромболитиков. Об основных аспектах этой проблемы рассказывает сотрудник отдела острого инфаркта миокарда Института терапии им. Л.Т. Малой АМН Украины, кандидат медицинских наук Ярослав Васильевич Дыкун .
Актуальность проблемы
Инфаркт миокарда остается серьезной проблемой в нашей стране. В последние годы более 2 тысяч пациентов ежегодно поступают с инфарктом миокарда в отделения кардиологии города Харькова. Летальность таких больных остается очень высокой – в пределах 12-18%, среди пожилых пациентов (старше 70 лет) в стационаре умирает каждый четвертый. Высокой остается также частота рецидивов инфаркта.
Стандарт лечения этих пациентов – проведение тромболитической терапии (ТЛТ). В настоящее время в наших клиниках применяются несколько тромболитиков – стрептокиназа, альтеплаза, тенектеплаза. Но далеко не все пациенты в силу ряда причин в Украине имеют возможность получать тромболизис. По данным нескольких крупных исследований, примерно три пациента из десяти в мире не получают никакой реперфузионной терапии при остром ИМ.
Таким образом, возникает проблема лечения инфаркта миокарда в случае невозможности применения тромболитической терапии и коронарных вмешательств.
Различные методы лечения при ИМ
В первую очередь следует обратить внимание на антитромбоцитарную терапию, препаратом выбора при которой является аспирин. Он удовлетворяет основным критериям золотого стандарта своей группы, имея доказанную эффективность, удовлетворительную безопасность, небольшую нагрузочную дозу (150-325 мг), а также возможность неопределенно длительного приема в дозе 75-160 мг. При применении аспирина в таких дозах нет необходимости контроля основных показателей свертываемости крови.
Препарат выбора для антикоагулянтной терапии на сегодняшний день не определен. Применение нефракционированного гепарина требует регулярного мониторинга показателей свертываемости крови (АЧТВ). Низкомолекулярные гепарины имеют некоторые преимущества перед гепарином. В первую очередь, это – удовлетворительная безопасность применения, отсутствие необходимости в контроле свертывания крови. Но при этом доказанная эффективность определена только для эноксапарина (ASSENT-3, AMI-SK). На сегодняшний день эноксапарин может быть рекомендован в качестве замены НФГ, но этот вопрос требует проведения дальнейших клинических исследований. Поскольку отсутствуют данные об эффективности низкомолекулярных гепаринов в сравнении с нефракционированным гепарином у больных, которые не получают тромболизис, рабочая группа Украинского общества кардиологов осуществила многоцентровое украинское исследование, посвященное этому вопросу.
Дизайн исследования
Целью многоцентрового рандомизированного открытого сравнительного исследования было сравнительное изучение эффективности эноксапарина и нефракционированного гепарина у больных с острым инфарктом миокарда с зубцом Q, элевацией сегмента ST, не получавших тромболитическую терапию.
В исследовании участвовали ведущие кардиологические клиники Украины: Институт кардиологии АМНУ (Киев), городская клиническая больница №1 (Киев), кафедра госпитальной терапии НМУ, кафедра пропедевтики НМУ, Институт терапии АМНУ (Харьков), кафедра кардиологии ХМАПО (Харьков), городская клиническая больница №27 (Харьков), медицинская академия (Днепропетровск), областной кардиодиспансер (Львов), областной кардиодиспансер (Запорожье), городская больница №3 (Одесса).
Критериями включения пациентов в исследование были следующие:
• возраст старше 80 лет;
• симптомы острого ИМ в первые сутки (большинство больных поступили в клинику в первые 12 часов);
• элевация сегмента ST и/или наличие зубца Q или остро возникшей блокады левой ножки пучка Гиса;
• противопоказания к применению антикоагулянтов и любые состояния, которые, по мнению врача, не позволяли проводить тромболитическую терапию.
Из исследования были исключены больные, у которых имелись противопоказания к проведению антикоагулянтной терапии, или же те, у которых ТЛТ начата до рандомизации, а также пациенты с серьезными осложнениями ИМ (кардиогенный шок) до начала лечения или с любыми сопутствующими состояниями, способными увеличить риск антикоагулянтной терапии.
Всем больным с ИМ (282 человека) в первые сутки назначали аспирин в дозе 160-325 мг, в дальнейшем более 90% пациентов назначали аспирин, около 10% – клопидогрель и менее 8% – тиклопидин. По характеру антикоагулянтной терапии больные были рандомизированы на две группы: получавшие нефракционированный гепарин и эноксапарин. Достоверных различий между двумя группами ни по одному из значимых критериев не выявлено. Эноксапарин вводили по стандартной методике (30 мг в виде болюса, а далее 1 мг/кг/12 ч подкожно) не менее пяти суток. Путь введения, дозировку и длительность назначения нефракционированного гепарина определял лечащий врач. Примерно трети пациентов, которые получали стандартный гепарин, препарат вводили внутривенно, трети – подкожно и еще одной трети – внутривенно, а затем подкожно.
Всем пациентам проводили также стандартную антиишемическую и антигипертензивную терапию по различным схемам (нитраты, b-блокаторы, ингибиторы АПФ).
Эффективность в данном исследовании определяли как сочетание частоты развития рефрактерной (постинфарктной) стенокардии, рецидива ИМ и летального исхода в течение 30 дней. Кроме того, оценивали частоту других клинически значимых, с точки зрения врача-исследователя, осложнений острого периода ИМ.
О безопасности судили на основании частоты развития значимых кровотечений и любых нарушений мозгового кровообращения. Кроме того, частоту других нежелательных явлений (побочных эффектов) связывали с введением исследуемых препаратов.
Результаты исследования
Результаты лечения острого инфаркта миокарда были достоверно лучшими по всем показателям в группе пациентов, которые получали эноксапарин, и свидетельствовали об уменьшении риска постинфарктной стенокардии и рецидивов инфаркта при применении эноксапарина, по сравнению с нефракционированным гепарином, хотя эти различия были недостоверными. Однако конечная точка исследования – сочетание трех параметров (реинфаркта, рефрактерной стенокардии и летальности) – была достоверно ниже в группе пациентов, принимавших эноксапарин, по сравнению с группой пациентов, которым вводили нефракционированный гепарин. В группе пациентов, получавших эноксапарин, эти неблагоприятные события отмечены у 28 (20,6%) против 47 (31,9%) пациентов, которые получали нефракционированный гепарин (p=0,038). В группе леченных эноксапарином также отмечено меньшее количество других клинически значимых осложнений и летальных исходов. Оба препарата обладали одинаковым профилем безопасности.
В результате проведенного исследования сделаны следующие выводы: использование эноксапарина сопровождается достоверным уменьшением риска развития рефрактерной постинфарктной стенокардии, рецидивов инфаркта миокарда и летальных исходов. Эти события отмечались на 10% реже у пациентов, получавших эноксапарин, по сравнению с теми, кому вводили нефракционированный гепарин, что было статистически достоверно. Оба препарата обладали примерно одинаковым уровнем безопасности.
Таким образом, у больных с острым инфарктом миокарда с элевацией сегмента ST и/или наличием зубца Q или полной блокадой левой ножки пучка Гиса стандартный нефракционированный гепарин может быть успешно заменен на эноксапарин, что поможет кардиологам в решении сложных задач лечения ИМ.
Инфаркт миокарда актуальность проблемы. Актуальные проблемы диагностики и лечения острого инфаркта миокарда

 Версия для печати
Версия для печати Отправь ссылку другу
Отправь ссылку другу
В последнее время инфаркт миокарда стремительно «молодеет». Ныне не редкость, когда он поражает людей, едва перешагнувших тридцатилетний порог. Правда, у женщин моложе 50 лет инфаркт — большая редкость. До этого рубежа их сосуды защищены от атеросклероза эстрогенами и другими половыми гормонами. Но с наступлением климакса женщины, наоборот, заболевают чаще мужчин. По данным ВОЗ, от 2 до 5% населения планеты в разные периоды своей жизни страдают депрессиями, и 20-30% — среди контингента, наблюдаемого в общей медицинской практике. Еще больше распространены аффективные расстройства в выборочных группах населения, например, среди соматических больных депрессии встречаются в 19-49%. Аффективные расстройства наиболее распространены среди больных сердечно-сосудистыми заболеваниями.
Е.И. Чазов (2004) подчеркивает увеличение смертности от сердечно-сосудистых заболеваний за период с 1990 по 2003 г. и связывает это, в частности, с высокой распространенностью у таких больных депрессивных расстройств. Некоторыми авторами [Dobbels F. et al. 2000] депрессия рассматривается как независимый фактор риска развития кардиоваскулярных заболеваний.
F. Lasperance (2000) выделяет депрессию в качестве самостоятельного фактора риска повышения смертности после перенесенного инфаркта миокарда. У больных депрессией более чем на 7% в год увеличивается доля повторных коронарных катастроф или вмешательств на сердце [Shiotani I. et al. 2002]. По данным Смулевича А.Б. (2005), распространенность тревожно-депрессивных и панических расстройств у больных артериальной гипертонией составляет 40 и 19% соответственно.
Критерии диагностики депрессивного расстройства предусматривают стойкое (не менее 2 недель) снижение настроения или утрату интереса и удовольствия от любых видов деятельности, изменение в повседневной жизни в виде снижения работоспособности и социальной дезадаптации + изменения в соматической сфере.
Депрессивные состояния у кардиологических больных имеют ряд особенностей:
- амбулаторный уровень расстройств;
- полиморфизм проявлений, наличие коморбидных депрессивному аффекту расстройств: тревоги, астении, простых и социофобий, дереализации, ипохондрии, астенического аутизма, алгий и т.д.;
- анозогнозия своего состояния. Даже находясь в состоянии выраженной депрессии, отмечая подавленное настроение, больные не расценивают это как психическое расстройство, а связывают свое состояние с физическими факторами, обострением соматического заболевания, общей социальной ситуацией.
При первом контакте врача с больным, если имеется подозрение на ОКС по клиническим и ЭКГ-признакам, он может быть отнесен к одной из двух его основных форм.
Термин острый коронарный синдром (ОКС) был введен в клиническую практику, когда выяснилось, что вопрос о применении некоторых активных методов лечения, в частности тромболитической терапии, должен решаться до установления окончательного диагноза — наличия или отсутствия крупноочагового инфаркта миокарда.
Острый коронарный синдром (ОКС) — это любая группа клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда (ОИМ) или нестабильную стенокардию (НС). Включает в себя ОИМ, ИМ с подъемом сегмента ST (ИМП ST), ИМ без подъема сегмента ST (ИМБП ST), ИМ, диагностированный по изменениям ферментов, по биомаркерам, по поздним ЭКГ-признакам, и нестабильную стенокардию (НС).
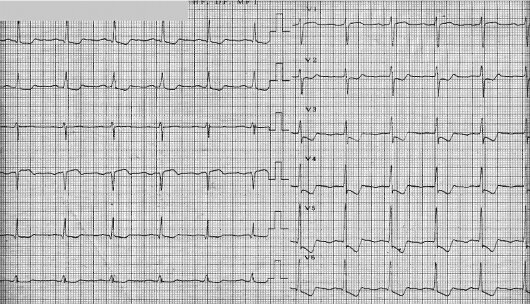
Инфаркт миокарда с подъемами сегмента ST. Это больные с наличием боли или других неприятных ощущений (дискомфорта) в грудной клетке и стойкими подъемами сегмента ST, или «новой» (впервые возникшей или предположительно впервые возникшей) блокадой левой ножки пучка Гиса на ЭКГ. Стойкие подъемы сегмента ST отражают наличие острой полной окклюзии коронарной артерии. Целью лечения в данной ситуации является быстрое и стойкое восстановление просвета сосуда. Для этого используются тромболитические агенты (при отсутствии противопоказаний) или прямая ангиопластика (при наличии технических возможностей).
Инфаркт миокарда без подъемов сегмента ST. Больные с наличием боли в грудной клетке и изменениями на ЭКГ, свидетельствующими об острой ишемии миокарда, но без подъемов сегмента ST. У этих больных могут отмечаться стойкие или преходящие депрессии ST, инверсия, сглаженность или псевдонормализация зубца Т. ЭКГ при поступлении бывает и нормальной. Стратегия ведения таких больных заключается в устранении ишемии и симптомов, наблюдении с повторной (серийной) регистрацией электрокардиограмм и определением маркеров некроза миокарда (сердечных тропонинов и/или креатинфосфокиназы МВ-КФК). В лечении таких больных тромболитические агенты не эффективны и не используются. Лечебная тактика зависит от степени риска (тяжести состояния) больного.
Нестабильная стенокардия (НС) — острый процесс ишемии миокарда, тяжесть и продолжительность которого недостаточны для развития некроза миокарда. Обычно на ЭКГ нет подъемов ST. Отсутствует выброс в кровоток биомаркеров некроза миокарда в количествах, достаточных для диагноза инфаркта миокарда.
Как ясно из приведенных определений, понятие ИМБП ST появилось в связи с широким внедрением в клиническую практику определения сердечных тропонинов. Больные с ОКС без подъемов ST с повышенным уровнем сердечных тропонинов (т.е. больные с ИМБП ST) имеют худший прогноз (более высокий риск осложнений) и требуют более активных лечения и наблюдения. Термин ИМБП ST используется для «маркировки» больного на протяжении непродолжительного времени, пока не выяснится окончательно, не развился ли у него крупноочаговый ИМ или процесс ограничился возникновением ИМ без зубца Q. Выделение ИМБП ST без определения сердечных тропонинов на основании менее чувствительных маркеров некроза, в частности — МВ-КФК, возможно, но приводит к выявлению только части больных с очагами некроза в миокарде и, следовательно, высоким риском.
Таким образом, для быстрого разграничения внутри ОКС без подъемов ST ИМБП ST и НС требуется определение уровней сердечных тропонинов, пока недоступное многим лечебным учреждениям России. Соответственно условия для широкого внедрения в клиническую практику термина ИМБП ST еще отсутствуют. Поэтому вследствие сложившейся традиции термины острый коронарный синдром без подъемов ST и нестабильная стенокардия могут употребляться как взаимозаменяемые.
Согласно международной классификации болезней внутренних органов (МКБ-10), выделяются следующие формы острого ИМ:
- острый трансмуральный инфаркт передней стенки миокарда (121.0);
- острый трансмуральный инфаркт нижней стенки миокарда (121.1);
- острый трансмуральный инфаркт миокарда других уточненных локализаций (121.2);
- острый трансмуральный инфаркт миокарда не-уточненной локализации (121.3);
- острый субэндокардиальный инфаркт миокарда (121.4);
- острый инфаркт миокарда неуточненный (121.9);
Периоды течения ИМ:
- Острейший период — от развития ишемии до возникновения некроза (от 30 минут до 2 часов).
- Острый период — образование участка некроза и миомаляции (от 2 до 10 дней).
- Подострый период — завершение начальных процессов организации рубца (до 4-5 нед. от начала заболевания).
- Послеинфарктный период — время окончательного формирования и уплотнения рубца (до 3-6 мес).
- Рецидивирующее течение ИМ наблюдается в пределах 4 нед. после предшествующего ИМ.
Главная причина болезни — атеросклероз, который в той или иной степени выражен почти у каждого из людей старше 40 лет. Кроме этого, назовем обстоятельства жизни (и зависящие от нас, и нет), при которых вероятность заболеть наиболее высока: мужской пол; для женщин опасный возраст наступает после 50 лет; наследственность (ИБС, инфаркт, мозговой инсульт, хотя бы у одного из прямых родственников: родителей, бабушки, дедушки, брата, сестры, особенно если болезнь у них началась до 55 лет); повышенное содержание холестерина в крови (более 5 ммоль/л или более 200 мг/дл); курение (один из наиболее существенных факторов риска!); избыточная масса тела и малоподвижный образ жизни; повышение артериального давления (более 140/90 мм рт. ст. в любом возрасте); сахарный диабет.
Наличие хотя бы одного из этих факторов реально повышает риск «знакомства» с инфарктом миокарда. Причем присоединение каждого нового фактора риска увеличивает вероятность заболеть в геометрической прогрессии. Существует мнение, что облысение у мужчин является своего рода предвестником инфаркта, поскольку одним из факторов появления алопеции является повышенный уровень андрогенов, а в случае гормональных колебаний организм реагирует на изменение содержания гормонов подъемом АД и повышением уровня холестерина в крови.
Первым признаком, позволяющим заподозрить инфаркт, обычно становится жестокая боль за грудиной, то есть в середине грудной клетки. Обычно в состоянии покоя; давит, жжет, сжимает, может отдавать в руку, плечо, спину, челюсть, шею. При стенокардии подобная боль возникает во время нагрузки, а при инфаркте она более сильная и чаще начинается в покое и не проходит после принятых друг за другом 3 таблеток нитроглицерина (по 1 таблетке под язык через каждые 5 минут).
Иногда заболевание проявляет себя рвотой или неприятными ощущениями в животе, перебоями в сердце или затруднением дыхания, потерей сознания Да, случается и такое: человек перенес инфаркт, даже не заметив этого. Так называемая безболевая форма инфаркта миокарда чаще наблюдается у людей, страдающих сахарным диабетом. Изменения, происходящие при инфаркте хорошо видны на электрокардиограме. Для уточнения области и степени поражения может быть назначено УЗИ сердца (эхокардиография), которая дает возможность увидеть структурные изменения. В ряде случаев врач может рекомендовать проведение сцинтиграфии.
О неосложненном течении инфаркта миокарда можно говорить только условно. Как правило, больные попадают в стационар не ранее чем через 30-60 минут после начала заболевания, поэтому осложнения, которые возникают в этот период, в частности, нарушения ритма, могут быть не распознаны своевременно. Кроме того, в любой момент так называемого неосложненного инфаркта миокарда могут развиться тяжелые осложнения, в том числе кардиогенный шок, фибрилляция желудочков и др.
Одним из наиболее ярких и постоянных симптомов инфаркта миокарда является боль. Частота болевого синдрома, по данным различных авторов, колеблется от 70-80% до 97,5%. Боль при инфаркте миокарда отличается от таковой при обычном приступе стенокардии интенсивностью и продолжительностью и тем, что не снимается нитроглицерином, а иногда повторным введением наркотиков. Боль чаще сжимающего, давящего характера, реже жгучая, разрывающая, режущая и прокалывающая.
Боль чаще локализуется в загрудинной области, в области сердца, реже захватывает всю переднюю поверхность грудной клетки. В отдельных случаях отмечается в нижней части грудины и в подложечной области. Иногда боль появляется в левой руке, плече и лишь затем распространяется на загрудинную область и область сердца.
Локализация боли в подложечной области или иррадиация ее в эту область чаще наблюдается при инфаркте миокарда задней или заднебоковой стенки левого желудочка.
Боли в загрудинной области и в области сердца чаще отмечаются при инфаркте передней стенки, переднеперегородочной области левого желудочка. Однако четкой корреляции между локализацией болей и очагом некроза нет, и топическая диагностика инфаркта миокарда на основании этого признака не может осуществляться.
Боль часто иррадиирует в левую руку, плечо, реже — в лопатку, обе руки, правую руку, межлопаточное пространство, шею, нижнюю челюсть, подложечную область. Довольно часто отмечается более широкая иррадиация боли, чем при обычном приступе стенокардии. В некоторых случаях имеет место необычная для данного больного иррадиация болей.
Боль при инфаркте миокарда обычно носит волнообразный характер: то усиливаясь, то ослабевая, она продолжается несколько часов и даже суток. Иногда болевой синдром характеризуется только одним длительным интенсивным приступом. Выраженность болевого синдрома не всегда соответствует величине инфаркта, но чаще тяжелый и длительный болевой приступ наблюдается при обширных инфарктах миокарда.
У людей молодого возраста типичный ангинозный статус наблюдается чаще, чем у людей пожилого и старческого возраста.
Характерной особенностью боли при инфаркте миокарда является ее выраженная эмоциональная окраска. Некоторые больные во время приступа испытывают чувство страха смерти, возбуждены, беспокойны. Стараясь облегчить боль, они постоянно меняют положение в постели, мечутся по комнате. Некоторые больные стонут, кричат, в дальнейшем обычно развивается резкая слабость.
Однако не всегда боль при инфаркте миокарда бывает столь сильной. В некоторых случаях она может быть средней интенсивности и лишь несколько более продолжительной, чем при обычном приступе стенокардии, а иногда мало от него отличается.
При объективном обследовании в ряде случаев могут отмечаться бледность кожных покровов, цианоз губ, повышенная потливость. Чаще же окраска и влажность кожных покровов не представляют особенностей.
В острейшем периоде заболевания, еще на догоспитальном этапе, часто наблюдается брадикардия, которая через некоторое время сменяется нормальной частотой пульса или тахикардией. У отдельных больных и в дальнейшем остается наклонность к брадикардии. В ряде случаев с самого начала отмечается учащение пульса до 90-120 ударов в минуту. В период болевого приступа артериальное давление может кратковременно повышаться. В некоторых случаях оно снижается уже в первые часы инфаркта миокарда. Обычно же в первые сутки артериальное давление изменяется незначительно и лишь в последующие дни снижается. Как правило, снижается систолическое и диастолическое давление, но систолическое в большей степени.
Через 2-3 недели артериальное давление несколько повышается, но все же обычно держится на более низких цифрах, чем до заболевания.
Артериальное давление снижается чаще при обширном поражении миокарда и повторных инфарктах. В случаях небольшого инфаркта оно может оставаться нормальным.
Изменения артериального давления имеют сложный генез и зависят от функционального состояния сердечной мышцы, разнообразных рефлекторных влияний из очага поражения, а также взаимоотношения этих и ряда других факторов.
Резюмируя вышеизложенное, необходимо подчеркнуть, что данные объективного обследования недостаточны для установления диагноза инфаркта миокарда. Они лишь дают ориентиры для дальнейшего направления диагностического исследования с применением инструментальных и лабораторных методов.
При инфаркте миокарда появляется ряд симптомов, обусловленных распадом мышечных волокон сердца и всасыванием продуктов аутолиза. К ним относятся лихорадка, увеличение количества лейкоцитов в крови с характерным изменением лейкоцитарной формулы и увеличением СОЭ, а также изменением активности ряда ферментов крови (разорбционно-некротический синдром по А.В. Виноградову).
Температура тела больного в первый день инфаркта миокарда обычно остается нормальной и повышается на второй, реже на третий день. Температура повышается до 37-38 градусов и держится на этом уровне 3-7 дней.
В отдельных случаях обширного поражения сердца длительность температурной реакции может увеличиваться до 10 дней. Более длительный субфебрилитет говорит о присоединении осложнений.
Высокая температура (39 градусов и более) наблюдается редко и обычно имеет место при присоединении какого-либо осложнения, например пневмонии. В некоторых случаях температура повышается медленно, достигая максимума через несколько дней, затем постепенно снижается и возвращается к норме. Реже она сразу достигает максимальной величины и затем постепенно снижается до нормы. Величина повышения температуры и длительность лихорадки в какой-то степени зависят от обширности инфаркта миокарда, но немалую роль в этом играет и реактивность организма.
У молодых людей температурная реакция более выражена. У лиц пожилого и старческого возраста, особенно при мелкоочаговом инфаркте миокарда, она может быть незначительной или же отсутствовать. У больных инфарктом миокарда, осложненным кардиогенным шоком, температура тела остается нормальной или даже повышенной.
Появление температурной реакции после ангинозного приступа является важным диагностическим признаком инфаркта миокарда и всегда должно насторожить врача в отношении развития свежих очаговых изменений в миокарде.
Картина изменений, возникающих в биохимических и клинических показателях периферической крови пациентов с развившимся ишемическим некрозом сердечной мышцы, складывается из двух основных лабораторных синдромов: цитолитического и резорбтивного.
Для инфаркта миокарда очень характерно повышение числа лейкоцитов в крови. Оно наблюдается уже через несколько часов после развития инфаркта и сохраняется 3-7 дней. Более длительный лейкоцитоз говорит о наличии осложнений.
Обычно имеет место умеренное повышение числа лейкоцитов в крови — до 10 000-12 000. Очень высокий лейкоцитоз (свыше 20 000) считается неблагоприятным прогностическим признаком. По мнению ряда авторов, выраженность лейкоцитоза в определенной мере зависит от обширности поражения миокарда.
Примерно в 10% случаев лейкоцитоз может быть нормальным на протяжении всего периода заболевания. Число лейкоцитов в крови увеличивается в основном за счет нейтрофилов, при этом отмечается сдвиг лейкоцитарной формулы влево.
Для первых дней болезни характерно уменьшение количества эозинофилов в крови, иногда вплоть до анэозинофилии. В дальнейшем число их увеличивается и приходит к норме, а в некоторых случаях даже превышает нормальные показатели.
Ценным диагностическим показателем при инфаркте миокарда является изменение скорости оседания ферментных элементов крови (СОЭ). В первые дни СОЭ остается нормальной и начинает увеличиваться через 1-2 дня после повышения температуры и числа лейкоцитов в крови.
Максимальная СОЭ наблюдается обычно между 8-м и 12-м днями болезни, в дальнейшем постепенно уменьшается и через 3-4 недели возвращается к норме. В некоторых случаях увеличение СОЭ может быть и более длительным, но чаще это говорит о каких-либо осложнениях инфаркта миокарда.
Характерный симптом инфаркта миокарда — «перекрест» между количеством лейкоцитов и СОЭ, который обычно наблюдается в конце первой-начале второй недели болезни: лейкоцитоз начинает снижаться, а СОЭ возрастает. Динамическое наблюдение за СОЭ, как и количеством лейкоцитов в крови, позволяет следить за течением болезни и судить о ходе восстановительных процессов миокарда.
Помимо изменения активности ферментов, имеющего значение для диагностики заболевания, при инфаркте миокарда происходят изменения в крови, отражающие нарушения углеводного, белкового, липидного обменов, кислотно-щелочного равновесия, электролитного баланса, гормонального профиля и т.д. Эти изменения не специфичны и практически не имеют значения при уточнении диагноза инфаркта миокарда.
Нарушение углеводного обмена в острой фазе инфаркта миокарда проявляется в виде гипергликемии, а иногда и гликозурии.
Повышение сахара в крови связано в какой-то степени с повышением секреции катехоламинов, что усиливает гликогенолиз и тормозит секрецию инсулина.
Гипергликемия более выражена при крупноочаговом инфаркте миокарда, чем при мелкоочаговом. Обычно она наблюдается в первые 5-10 дней и в дальнейшем исчезает. Однако в некоторых случаях она отмечается в течение 1-2 месяцев от начала инфаркта миокарда и может указывать на скрыто протекающий сахарный диабет.
Синдром цитолиза кардиомиоцитов возникает вследствие разрушения клеточной стенки, органелл (митохондрий, саркоплазматического ретикулума) и саркомеров, возникших при необратимой ишемии. При этом в плазме крови появляются химические соединения, в норме там не встречающиеся, либо имеющиеся в значительно меньших количествах. Некоторые из них могут определяться распространенными лабораторными методами уже спустя 2-3 часа с момента начала заболевания (ранние маркеры): тропонин Т, миоглобин, КФК (МВ- и ММ-фракции), что позволяет использовать их для ранней диагностики ОИМ. Другие нарастают спустя 4 суток (поздние маркеры): ЛДГ (изофермент ЛДГ1), АСТ, миозин (легкие фракции), больше отражают объем и глубину поражения и могут быть также использованы для ретроспективной диагностики некроза сердечной мышцы спустя несколько суток.
В оценке скорости наступления некроза и состояния периинфарктной зоны помогают различные методы инструментальной диагностики. Из непрямых методов наиболее распространенным является эхокардиография с анализом регионарной сократимости, с выявлением зон гипокинезии, акинезии, дискинезии, расширения полостей сердца, определением фракции выброса, состояния клапанов.
При допплеровском исследовании определяют особенности нарушенной внутрисердечной гемодинамики. Эхокардиография является методом выбора (золотым стандартом) в диагностике таких осложнений ИМ, как: перикардит, разрывы миокарда, острая митральная недостаточность при отрыве сосочковой мышцы, острая аневризма желудочка, внутрисердечный тромбоз, а также при осложненном течении ИМ, когда нет возможности осуществить мониторинг давления заклинивания легочной артерии для оценки состояния центральной гемодинамики. В большинстве случаев, при необходимости мониторинга функции левого желудочка на фоне лечения, данному методу ввиду его простоты и неинвазивности следует отдать предпочтение.
Лечение больных инфарктом миокарда
Больной острым ИМ должен быть госпитализирован в специализированный стационар для решения вопроса о выборе тактики лечения: консервативная медикаментозная, тромболизис, интервенционная или хирургическая (ТБКА, АКШ), кардиостимуляция и др. Больные должны быть доставлены в стационар как можно быстрее, лучше кардиологической бригадой скорой помощи с оснащением для проведения кардиореанимации и с возможным тромболизисом на догоспитальном этапе. Осмотр больного и регистрация ЭКГ должны быть проведены в первые 10 мин, но не позднее 20 мин после поступления больного в стационар. При отсутствии характерных изменений ЭКГ необходимо экстренное определение маркеров некроза в сыворотке крови (тропонины, миоглобин, МВ-КФК), а в сложных случаях показано проведение эхокардиографического исследования.
Основные принципы лечения ИМ:
- Купирование болевого синдрома.
- Лечение и предупреждение нарушений ритма и проводимости.
- Тромболизис и предупреждение тромбообразования в системе коронарных артерий и других сосудистых бассейнов.
- Снижение потребности миокарда в кислороде:
- уменьшение напряжения стенки левого желудочка;
- урежение ЧСС;
- разгрузка левого желудочка (за счет уменьшения пред- и постнагрузки и других факторов).
- Увеличение коронарного кровотока в ишемизированной зоне (тромболизис, вазодилатация, восстановление коллатерального кровотока).
- Ограничение зоны инфаркта миокарда.
- Коррекция нарушений электролитного и кислотно-щелочного состояния.
- Профилактика недостаточности кровообращения.
Обезболивание
Препаратом выбора являются морфин, возможно фентанил с дроперидолом (нейролептаналгезия), которые вводятся внутривенно. Морфин (омнопон) назначается по 1-2 мл в виде 1% раствора. Поскольку наркотические анальгетики часто вызывают побочные реакции (рвота, парез желудка, мочевого пузыря, кишечника, угнетение дыхательного центра), то для предупреждения указанных реакций эти препараты вводят в комбинации с 0,5 мл 0,1% раствора атропина. Промедол (1 и 2% раствор) по своей анальгетической активности уступает морфину в 2-4 раза. Нейролептанальгезия наиболее часто используется в следующей комбинации: дроперидол — от 1 до 2-4 мл 0,25% раствора и анальгетик фентанил 1-2 мл 0,005% раствора. Доза дроперидола подбирается в зависимости от исходного АД (Голиков А.П. и соавт.).
Значительный обезболивающий эффект дает наркоз закисью азота с кислородом. Действие такого наркоза может быть усилено небольшими дозами морфина, димедролом (1 мл 1% раствора внутримышечно) или пипольфеном (1-2 мл 2,5% раствора внутримышечно).
При наличии некупирующихся или повторяющихся болей рекомендуется внутривенное введение нитратов (нитроглицерин, нирмин, перлинганит) и/или b-адреноблокаторов. Для уменьшения беспокойства больного при отсутствии гипотонии назначают транквилизаторы, седативные средства.
Тромболитическая терапия
Наиболее оправдана рано начатая тромболитическая терапия. При этом идеальной является ситуация, когда такая терапия начинается еще на догоспитальном этапе врачом кардиологической бригады скорой помощи.
Введение тромболитических препаратов в 1-й час заболевания снижает 35-дневную летальность в среднем на 27%, а через 7-12 ч — только на 13%. После применения тромболизиса через 13-24 ч от развития ангинозного приступа влияние на 27%, а через 7-12 ч — только на 13%. После применения тромболизиса через 13-24 ч от развития ангинозного приступа влияние на показатели смертности такого лечения не наблюдается. На практике тромболитическая терапия (ТЛТ) проводится в сроки не более 6 часов от начала ИМ.
Может быть использовано 2 способа введения тромболитического препарата: внутривенно и внутрикоронарно. Внутрикоронарный тромболизис, хотя и представляется на первый взгляд предпочтительнее, всегда проигрывает во времени и по сложности. На его организацию требуется время, поскольку необходимо предварительно провести коронарографию, не исключено, что именно из-за потери времени результаты внутривенного и внутрикоронарного тромболизиса существенно не различаются. Однако при внутрикоронарном введении значительно уменьшается доза тромболитика, что позволяет резко снизить опасность геморрагии. Но в клинической практике, как правило, используется внутривенный системный тромболизис.
Показания к проведению тромболитической терапии:
Вероятный ИМ в первые 4-6 час при наличии длительного приступа ангинозной боли (30 мин и более), не купирующегося приемом нитроглицерина (при отсутствии других причин боли) и сопровождающегося «свежими» изменениями на ЭКГ (подъем сегмента ST более 1 мм, блокада левой ножки пучка Гиса).
Определенный ИМ с патологическими зубцами Q в первые 4-6 (до 12) часов от начала болезни (длительного приступа ангинозной боли).
Рецидивирующее течение ИМ
Тромбоз и эмболия магистральных и периферических сосудов.
Современная тромболитическая терапия при ИМ базируется на применении высоко активных и сравнительно безопасных средств, которые переводят эндогенный плазминоген из неактивного состояния в активное — плазмин. Последний разрушает фибрин. Наиболее часто в настоящее время при ИМ используются следующие тромболитические средства.
Стрептокиназа (стрептаза, авелазин, цепиаза) — белок, продуцируемый гемолитическим стрептококком. Вводится внутривенно капельно на 50-100 мл изотонического раствора хлорида натрия в течение 30-60 мин 1-15 000 000 ME препарата (или предварительно болюсом 250 000 ЕД, а потом остальная доза).
Анизоилированный плазминоген — стрептокиназный активированный комплекс (АПСАК, анистреплаза) — анизоилированное производное комплекса лизин-плазминоген-стрептокиназа. Вводится внутривенно струйно в течение 5 мин в дозе 30 ЕД.
Тканевой активатор плазминогена (ТАП, альтеплаза) — сериновая протеаза, обладающая высоким сродством к фибрину. Вводят внутривенно струйно 10 мг, затем капельно 50 мг в течение 1 ч, затем еще 40 мг со скоростью 20 мг/ч (всего 100 мг).
Тромболитические препараты назначаются одновременно с назначением аспирина и гепарина.
Профилактика аритмий
Аритмии являются самым частым осложнением ИМ и самой частой причиной смерти больных на догоспитальном этапе. Две трети случаев аритмической смерти приходятся на первые 6 ч после развития ИМ. В остром периоде ИМ в настоящее время не рекомендуется профилактическое применение лидокаина. Он действительно уменьшает вероятность фибрилляции сердца, но повышает возможность развития асистолии, с которой бороться значительно труднее. Большинство других антиаритмических средств, назначенных для профилактики аритмий, также мало эффективны.
Исключение составляют b-блокаторы, которые показали умеренно выраженную эффективность в профилактике внезапной смерти у больных ИМ.
В первые 2-4 часа ИМ, как правило, используют в/в введение b-адреноблокаторов с последующим переходом на пероральное применение (необходим контроль ЧСС, АД и интервала PQ на ЭКГ).
Нитраты и антагонисты кальция
Внутривенная инфузия нитроглицерина рекомендуется в первые 24-72 ч у больных ИМ при наличии сердечной недостаточности, АГ и при сохраняющемся ангинозном синдроме. Нитратами, которые используются для лечения ИМ, являются нитроглицерин (50-100 мг с средней скоростью инфузии 25-50 мкг/ч), нирмин, перлинганит. При наличии показаний далее переходят на таблетированные пролонгированные нитраты. Эффективность антагонистов кальция при остром ИМ не доказана, более того, была отмечена неблагоприятная тенденция, поэтому их применение нецелесообразно.
Ингибиторы АПФ
Применение небольших доз этих препаратов показано больным ИМ, особенно при наличии признаков сердечной недостаточности (ФВ < 40%) и при отсутствии значительной гипотонии.
Назначаются со 2-го дня от начала ИМ, (положительно влияют на процессы ремоделирования желудочка).
Примерная схема лечения неосложненного ИМ в первые 24-72 часа:
- Стрептокиназа в/в капельно в 2 приема в течение 30 мин, общая доза 1-1,5 млн. Ед (предварительно в/в 30 мг преднизолона).
- Гепарин 5 000-10 000 ед в/в болюсом, в/в капельно до общей дозы 20-40 тыс. ед. (1000 ед/час) или п/к по 5 000-10 000 ед 4-6 раз.
- Нитроглицерин, особенно при болях, в/в капельно с начальной скоростью введения 5-10 мкг/мин (средняя скорость обычно 25-50 мкг/мин).
- Нитраты пролонгированного действия, если не проводится постоянная инфузия нитроглицерина.
- Бета-адреноблокаторы: пропранолол в начальной дозе по 20 мг на прием (60-240 мг/сут. и более — до 320 мг/сут), оптимальный уровень контроля ЧСС — 50-60 в мин.
- Аспирин 0,25-0,5 мг/сут.
- Транквилизаторы 1-2 раза в сутки (при необходимости). Целесообразно назначение поляризующих смесей при гипокалиемии и связанных с ней нарушениях ритма, в качестве лечения и профилактики метаболического алкалоза на фоне применения мочегонных препаратов (натрий-калийуретиков). Относительно назначения в остром периоде ИМ глюкозо-инсулинокалиевых (поляризующих) смесей мнения противоречивы. Однако в последнее время вновь появляются исследования, подтверждающие их эффективность.
В последующем, при неосложненном течении ИМ, показано постоянное лечение b-адреноблокаторами и аспирином, гепарином на период постельного режима (3-5 дней).
При неосложненном ИМ длительность постельного режима составляет около суток. Еще в период соблюдения постельного режима больным с купированным болевым синдромом и стабильными показателями гемодинамики можно разрешить пользоваться стульчиком для отправления физиологических потребностей. В дальнейшем идет постепенное, но неуклонное расширение двигательного режима больного и проведение этапов ЛФК, адекватных срокам и тяжести заболевания. В нашей стране больные выписываются домой в среднем через 3 нед, хотя этот срок может быть сокращен в связи с возможностью реабилитации в загородных кардиологических санаториях или в амбулаторно-поликлинических условиях в отделениях восстановительного лечения.
Активизация больного при выписке из стационара должна быть такая, чтобы он мог обслуживать себя, подниматься по лестнице на один этаж и совершать прогулки 500-1 000 м без отрицательных реакций.
При неосложненном ИМ примерно через 1 мес после развития заболевания можно приступить к специальным тренировкам (Аронов Д.М. 1998). Безопасность их может быть повышена при назначении больным b-адреноблокаторов, нитратов, ингибиторов АПФ. Универсальных рекомендаций по продолжительности и интенсивности физических тренировок в процессе реабилитации не существует. Практика показывает, что адекватный уровень физической активности, примерно равный тому который был до болезни, может быть достигнут через 8-12 нед при занятиях 3 раза в неделю с длительностью каждой тренировки 30-60 мин. В дальнейшем должен быть решен вопрос о продолжении реабилитации под медицинским контролем или в индивидуальном режиме. Периодический врачебный контроль с проведением стресс-тестов, с суточным мониторированием ЭКГ и АД позволяют достаточно точно дозировать нагрузки и избежать нежелательных последствий. Больные с осложненным ИМ (группа «высокого риска»), имеющие тяжелые нарушения сократимости миокарда и фракцию выброса менее 30%, с нарушениями ритма в покое, со стенокардией III-IV ФК, перенесшим фибрилляцию сердца, должны проходить реабилитацию под интенсивным медицинским наблюдением. При этом необходимо с особым вниманием оценивать состояние сердечно-сосудистой и дыхательной систем и, в первую очередь, врач должен иметь информацию в динамике о состоянии сердечного выброса, и других основных эхокардиографических параметров.
В целом среди больных перенесших инфаркт миокарда в трудоспособном возрасте, возвращение к труду достигает 76-84%, что является несомненным достижением современной кардиологии. Больные пенсионного возраста после реабилитационных мероприятий должны занимать в семье активную позицию с полным самообслуживанием и иметь удовлетворительное качество жизни.
Литература
- Смулевич А.Б. Сыркин А.Л. Психокардиология. М. 2005. С. 777.
- Чазов Е.И. Психосоциальные факторы как риск возникновения сердечно — сосудистых заболеваний // Легкое сердце. М. 2004. N 3. С. 2-4.
- Окороков А.Н. Диагностика болезней сердца и сосудов — М. Мед. Лит. 2002.
- Инфаркт миокарда. Кардиошкола [Электронный ресурс]: база данных.- Режим доступа: http://www.critical.ru/CardioSchool/index.php
- Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ. Кардиосайт [Электронный ресурс]: база данных / Всероссийское научное общество кардиологов.- Режим доступа: http://www.cardiosite.ru/medical/recom-ostcorsin01.asp
Инфаркт миокарда актуальность. Методические рекомендации по подготовке к практическим занятиям по дисциплине «
^ ТЕМА № 11 ИНФАРКТ МИОКАРДА.
I. Тема и её актуальность: «ИБС. Инфаркт миокарда». ИБС. Инфаркт миокарда (ИМ) — острое заболевание, обусловленное возникновением одного или нескольких очагов ишемического некроза в сердечной мышце в связи с абсолютной или относительной недостаточностью коронарного кровотока.
Значительная распространенность ИМ, тяжелые осложнения, приводящие к стойкой потере трудоспособности, и высокая летальность определяют актуальность темы.
^ II. Учебные цели: овладение практическими умениями и навыками диагностики, оказания неотложной помощи, лечения и профилактики инфаркта миокарда.
Для формирования профессиональных компетенций студент должен знать:
современную этиологию и патогенез ИМ;
классификацию ИМ;
клинику ИМ при типичном ангинозном и атипичных вариантах болезни (астматический, гастралгический, аритмический, церебральный, с атипической локализацией боли, бессимптомный);
ЭКГ признаки ИМ в зависимости от глубины и распространенности поражения сердечной мышцы (крупноочаговый, трансмуральный, мелкоочаговый), от локализации (передний, заднедиафрагмальный, межжелудочковой перегородки), от стадии процесса (острейшая, острая, подострая, рубцевания);
своевременно распознать осложнения ИМ в остром, подостром и постинфарктном периодах;
назначить адекватное лечение в остром периоде;
а) купирование болевого синдрома;
б) антикоагулянтная и фибринолитическая терапия;
в) профилактика и купирование нарушений ритма сердца;