Примеры формулировки диагноза
1. ИБС. Трансмуральный инфаркт миокарда (Q-инфаркт) передней стенки левого желудочка с
распространением на перегородку и верхушку. Острый период. Пароксизмальная мерцательная аритмия.
Кардиогенный шок.
2. ИБС. Инфаркт миокарда задней стенки без зубца Q. Подострый период.
Лечение неосложненного инфаркта миокарда представляет собой одновременно и сложную и
понятную задачу. С одной стороны, разработаны достаточно подробные стандарты и формуляры терапии
подобных пациентов. С другой стороны, в ходе развития инфаркта возможно появление различного рода
осложнений и поворот ситуации в непредвиденную сторону даже казалось бы на фоне относительно
2. Реваскуляризация.
3. Ограничение зоны некроза и профилактика ремоделирования. Важнейшим вмешательством,
способным предотвратить фатальные осложнения, следует считать адекватное обезболивание пациента.
Для этой цели применяются наркотические анальгетики — морфин (1%), тримепиридин (промедол, 1-2%)
или фентанил (0,005%). Последний имеет преимущество, так как оказывает быстрый эффект, а в связи с
ускоренной фармакокинетикой создает условия для многократных повторный введений. Широкое
применение получил метод нейролептанальгезии, представляющий собой сочетанное введение
наркотического анальгетика фентанила и нейролептика дроперидола (0,25%). При этом достигается
оптимальный эффект: наркотический анальгетик вызывает сильное и адекватное обезболивание, а
нейролептик способствует уменьшению субъективного восприятия пациентом боли, потенцирует действие
анальгетика. С учетом гипотензивного эффекта дроперидола этот метод показан при инфарктах миокарда,
развивающихся на фоне повышенного артериального давления. Следует учесть, что при гипотонии
нейролептики надо вводить с осторожностью. С этой целью можно изменить соотношение вводимых
фентанила и дроперидола, которое обычно составляет 1:1. Все другие методы обезболивания инфаркта
малоэффективны.
Вопрос о возможности восстановления проходимости коронарного кровотока в зоне окклюзии
начал привлекать внимание врачей с момента понимания патогенеза инфаркта миокарда. Однако первые
попытки тромболизиса оказались не вполне удачными. У ряда пациентов при успешной реваскуляризации
отмечалось появление серьезных аритмий, иногда завершающихся фатально. При выяснении причин этого
явления было установлено, что зона некроза не представляет собой однородную структуру. В ней
присутствуют полоски живого миокарда толщиной в 2-3 клетки, которые располагаются ближе к
эндокарду. Иногда эти участки сохраняются непосредственно в сформировавшихся рубцах. При
восстановлении коронарного кровотока возможна активация этих клеток с соединением их в общую сетку.
Таким образом, создаются условия для возникновения механизма re-entry, являющегося
пусковым элементом тяжелых нарушений сердечного ритма. Этому способствуют также
реоксигенационные изменения, приводящие к активации свободнорадикальных реакций и
распространению некроза. Поэтому наиболее целесообразно использование этого метода в первые 4 часа от
появления симптомов заболевания, когда еще нет полноценного некроза и вероятность восстановления
кардиомиоцитов максимальна.
Медикаментозная реваскуляризация проводится с помощью препаратов, относящихся к группе
фибринолитиков. Механизм их действия связан с переводом циркулирующего в крови плазминогена в
активный фермент плазмин, который вызывает лизис и разрушение тромба. К ним относят
вырабатываемый β-гемолитическим стрептококком фибринолитик стрептокиназу, и тканевой активатор
плазминогена (альтеплаза). Препараты вводят внутривенно болюсно с последующей внутривенной
инфузией в течение 30-60 минут. Показанием служит достоверный инфаркт миокарда с подъемом сегмента
ST. Признаком успешного тромболизиса служит купирование болевого синдрома, снижение сегмента ST на
ЭКГ и ранний пик активности КФК (до 12 часов) вследствие выхода в кровь продуктов из зоны некроза.
Другим методом восстановления коронарного кровотока может считаться чрескожная
баллонная ангиопластика. На ранних стадиях коронарной окклюзии до организации тромба возможно
восстановление проходимости артерии катетеризацией ее с проведением баллона ниже места сужения.
Этот метод применяется при наличии технических возможностей, кардиогенном шоке и плохо
купирующемся болевом синдроме.
Поддержать проходимость коронарной артерии необходимо назначением антикоагулянтов
прямого действия, к которым относят разнообразные гепарины. Простой гепарин вводят болюсом 5000 ед,
с последующим внутривенным введением 1000 ед/час. Более эффективны и безопасны низкомолекулярные
(фракционированные) гепарины.
Применение этих препаратов следует прекратить через 48 часов, кроме случаев мерцательной
аритмии, повторной ишемии миокарда, передневерхушечном инфаркте для профилактики острых тром-
боэмболических осложнений.
Вполне понятно, что длительный прием гепарина больными инфарктом миокарда невозможен в
силу большого числа побочных эффектов. Между тем риск повышенного тромбообразования как
системного, так и внутрикоронарного требует продолжения противосвертывающей терапии. С этой целью
наиболее целесообразным следует считать использование препаратов из класса антиагрегантов. Вне
конкуренции в этой группе остается ацетилсалициловая кислота (аспирин). Его назначают с первых дней
инфаркта и на длительное время, иногда пожизненно. Препарат показан всем лицам с инфарктом миокарда
за исключением случаев истинной аллергии к препарату. Назначается перорально во время еды в суточной
дозе 325 мг. Использование специальных форм для кардиологических больных делает возможным прием
препарата даже при сопутствующей патологии желудочно-кишечного тракта.
Нитраты уменьшают ишемию и боль, осуществляют гемодинамическую разгрузку левого
желудочка уменьшением венозного возврата. Так как явления левожелудочковой недостаточности в той
или иной мере выраженности присутствуют у большинства пациентов с инфарктом, то в первые 24^48
часов целесообразно внутривенное введение нитроглицерина всем больным с постепенным повышением
дозы с 5-10 до 200 мкг/мин. При развитии сердечной астмы и отека легких, назначение нитроглицерина
служит методом выбора.
После купирования болевого синдрома и проведения адекватной тромболитической и
противосвертывающей терапии главной задачей остается ограничение зоны некроза и профилактика
постинфарктного ремоделирования. Так как ключевым патогенетическим звеном этих процессов является
нейрогуморальная активация, то именно препараты из группы нейрогуморальных модуляторов следует
назначать в первую очередь.
Прежде всего, эта цель достигается назначением β-блокаторов. При отсутствии
противопоказаний их назначают в первые сутки от начала заболевания. Следует избегать раннего
назначения лицам с брадикардией, гипотонией, нижним инфарктом миокарда, признаками сердечной
недостаточности, сниженной фракцией выброса левого желудочка, атриовентрикулярной блокадой,
хронической обструктивной болезнью легких. Прием (β -блокаторовов должен проводиться не менее 2-3
лет.
В связи с тем, что у большинства больных инфарктом миокарда отмечаются явления сердечной
недостаточности, оптимальным следует считать назначение (3-блокаторов, эффективность и безопасность
которых доказана при нарушениях сократительной функции миокарда. К ним относят селективные
препараты метопролол (Эгилок, «Egis») 25-50 мг 2 раза в сутки, или метопрололретард (Эгилок-ретард,
«Egis») в тех же дозах однократно; бисопролол 2,5-10 мг 1 раз в сутки; а также неселективный |3-блокатор
карведилол (Кориол, «KRKA») в дозе 3,125-6,25 мг 2 раза в сутки. Лечение начинают с минимальных доз, а
при хорошей переносимости ее постепенно повышают.
Многоцентровыми исследованиями последних лет доказана эффективность ингибиторов АПФ
для профилактики постинфарктного ремоделирования. Их назначают со вторых суток инфаркта и
применяют длительное время. Что касается конкретных препаратов, то возможности выбора в настоящее
время очень велики. Это кап-топрил 12,5-50 мг 3 раза в сутки, эналаприл (Энап, «KRKA») 2,5-10 мг/сут, в
два приема, рамиприл (Хартил, «Egis») 2,5-5 мг 1 раз в сутки, лизиноприл 10-20 мг 1 раз в сутки,
фозиноприл (Моноприл, BMS) 10-20 мг 1 раз в сутки, периндоприл (Престариум, «Sender») 4-8 мг в 1 раз в
сутки.
Если говорить о так называемой метаболической терапии, включающей витамины,
антиоксиданты и антигипоксанты, то их эффективность в остром периоде инфаркта не получила серьезной
доказательной базы.
Таким образом, к моменту выписки больной инфарктом миокарда должен получать три
обязательных препарата: аспирин, β-блокатор, ингибитор АПФ. Прочие препараты, применяемые для
лечения хронических форм ИБС, назначаются по показаниям, о которых говориться в соответствующей
лекции.
Лечение осложнений инфаркта миокарда проводится в соответствии с общепринятыми
стандартами терапии. Так лечение острой левожелудочковой недостаточности включает в себя применение
морфина, инфузию нитратов и диуретики. При кардиогенном шоке назначают вазоактивные
симпатомиметики (добутамин или допамин), глюкокортикоиды и противошоковую инфузионную терапию
под контролем давления в малом круге.
Лечение синдрома Дресслера заключается в применении НПВС. При их неэффективности
назначают глюкокортикоиды в стандартных дозировках с постепенным уменьшением дозы и отменой в
течение 2-4 недель.
Несколько слов о немедикаментозных методах лечения инфаркта миокарда, к которым следует
отнести хирургическое лечение и баллонную коронарную ангиопластику. Оперативное лечение в остром
периоде показано при угрожающих жизни разрывах стенки миокарда, сосочковых мышц и
межжелудочковой перегородки. При нарастании острой сердечной недостаточности показана аневриз-
мэктомия. Естественно по ходу таких операций решается вопрос о целесообразности аортокоронарного
Формулирование диагноза постинфарктного кардиосклероза
При формулировании диагноза постинфарктного кардиосклероза надо учитывать срок, прошедший после инфаркта миокарда. Этот диагноз устанавливается спустя 8 нед со дня возникновения или последнего рецидива острого инфаркта миокарда. Диагноз постинфарктного кардиосклероза сохраняется на протяжении всей жизни больного, даже если отсутствуют другие проявления ИБС и на ЭКГ исчезли признаки рубцового поражения миокарда. Пример формулировки диагноза: «ИБС, постинфарктный кардиосклероз».
Если у больного имеются нарушения сердечного ритма или признаки сердечной недостаточности, то их отмечают в диагнозе с указанием формы аритмии и стадии недостаточности кровообращения. Например: «ИБС, постинфарктный кардиосклероз, постоянная форма мерцательной аритмии, НК IIБ».
Если у больного имеется стенокардия, то ее указывают в диагнозе перед кардиосклерозом. Например: «ИБС, стенокардия напряжения ФК IV, постинфарктный кардиосклероз, атриовентрикулярная блокада II степени, НК IIА».
В современной классификации ИБС отсутствует привычный термин «атеросклеротический кардиосклероз». Необходимость в первой части термина, указывающей на ишемический генез патологии миокарда, отпала в связи с формулировкой «ИБС» в основном диагнозе. Вторая часть термина должна была указывать на то, что у больного под влиянием тяжелой ишемии развились диффузные мелкорубцовые поражения миокарда (в отличие от постинфарктных рубцов). Этим подчеркивался «органический» характер ишемического поражения как более значимый в противовес менее значимым «функциональным» поражениям.
На практике этот диагноз часто ставился больным ИБС с изменениями ЭКГ покоя. Однако по ЭКГ невозможно дифференцировать ишемические и «мелкорубцовые» изменения миокарда. Так, после успешной операции аортокоронарного шунтирования могут полностью исчезнуть многолетние изменения ЭКГ покоя, которые считались проявлениями кардиосклероза. У большинства больных изменения ЭКГ имеют иной генез.
«Стенокардия», В.С. Гасилин
Читайте далее:
Затруднения в формулировке диагноза ИБС
Кафедра внутренних болезней №3, поликлинической терапии и общеврачебной практики
^ ЧАСТЬ I. ОКС С ПОДЪЕМОМ СЕГМЕНТА ST
(КРУПНООЧАГОВЫЙ ИНФАРКТ МИОКАРДА)
1. ДИАГНОСТИКА ИНФАРКТА МИОКАРДА
1.1. Диагностические критерии ИМ (ESC/ACC, 2000 г.)
Критерии острого, развивающегося или недавнего ИМ
Один из критериев достаточен для диагноза острого, развивающегося или недавнего ИМ:
1) Типичное повышение и постепенное снижение (тропонины) или более быстрое повышение и снижение (КФК-МВ) биохимических маркеров некроза миокарда в сочетании как минимум с одним из следующих признаков:
а) ишемические симптомы;
б) изменения ЭКГ, свидетельствующие об ишемии (элевация или депрессия сегмента ST);
в) появление патологического зубца Q на ЭКГ;
г) коронарная интервенция (например, коронарная ангиопластика).
2) Патологоанатомические признаки острого ИМ.
Критерии подтвержденного ИМ
Один из критериев достаточен для диагноза подтвержденного ИМ:
1) Появление нового патологического зубца Q на нескольких ЭКГ. Пациент может помнить или не помнить предшествующие симптомы. Биохимические маркеры некроза миокарда могут нормализоваться в зависимости от времени, прошедшего с момента начала инфаркта.
2) Патологоанатомические признаки зажившего или заживающего ИМ.
Болевой синдром:
локализация – загрудинная; эпигастральная область;
иррадиация – широкая (в плечи, предплечья, ключицы, шею, нижнюю челюсть (чаще слева), левую лопатку, межлопаточное пространство);
характер – давящий, жгучий, сжимающий, распирающий;
продолжительность – от 20-30 минут до нескольких часов;
болевой синдром часто сопровождается возбуждением, чувством страха, двигательным беспокойством и вегетативными реакциями, потливостью, гипотензией, тошнотой, рвотой, не купируется нитроглицерином.
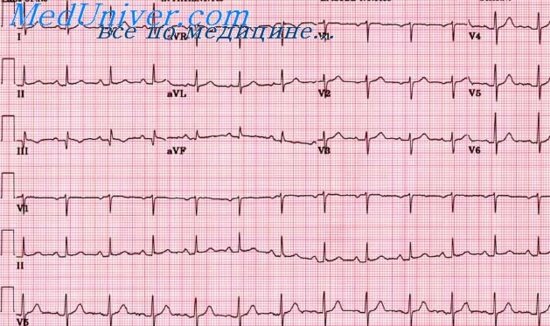
^ 1.2. Электрокардиографическая диагностика инфаркта миокарда
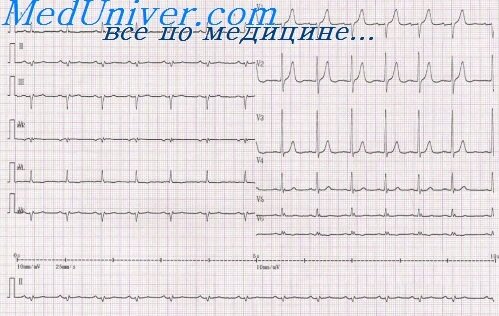
Острейший период: формирование высокого остроконечного зубца
Т (ишемия) и подъем сегмента ST (повреждение). Сегмент ST имеет горизонтальную, вогнутую, выпуклую или косовосходящую форму, может сливаться с зубцом Т, образуя монофазную кривую. В отведениях, характеризующих противоположные инфаркту зоны миокарда, может регистрироваться реципрокная депрессия сегмента ST.
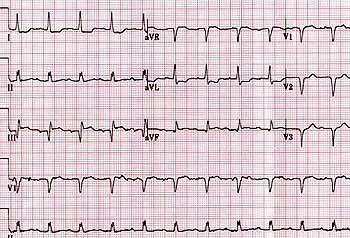
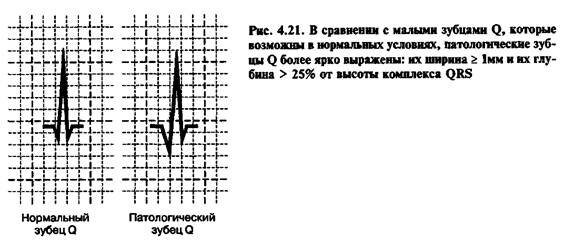
Острый период: появляется патологический зубец Q или комплекс
QS. Патологическим считается зубец Q продолжительностью более 0,03 с и амплитудой более. амплитуды зубца R в отведениях I, aVL, V1-V6 или более. амплитуды зубца R в отведениях II, III и aVF. Зубец R может уменьшиться или исчезнуть, а в противоположных отведениях – увеличиться. Подострый период: сегмент ST возвращается к изолинии, формируется отрицательный зубец Т.
Период рубцевания (постинфарктный кардиосклероз): амплитуда отрицательного зубца Т уменьшается, со временем он становится изоэлектричным и положительным. Сегмент ST на изолинии. Зубец Q обычно сохраняется, однако в ряде случаев он может уменьшиться или исчезнуть за счет компенсаторной гипертрофии здорового миокарда.
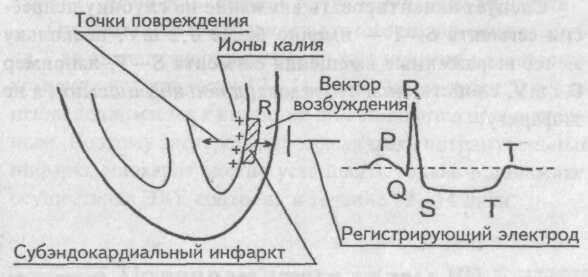
Данные изменения ЭКГ характерны для инфаркта миокарда с зубцом Q (крупноочагового, трансмурального). ИМ без зубца Q (мелкоочаговый, интрамуральный, субэндокардиальный) диагностируется на основании динамических изменений сегмента ST и зубца T.
^ 1.2. Электрокардиографическая диагностика инфаркта миокарда
Острейший период: формирование высокого остроконечного зубца Т (ишемия) и подъем сегмента ST (повреждение). Сегмент ST имеет горизонтальную, вогнутую, выпуклую или косовосходящую форму, может сливаться с зубцом Т, образуя монофазную кривую. В отведениях, характеризующих противоположные инфаркту зоны миокарда, может регистрироваться реципрокная депрессия сегмента ST.
Острый период: появляется патологический зубец Q или комплекс QS. Патологическим считается зубец Q продолжительностью более 0,03 с и амплитудой более. амплитуды зубца R в отведениях I, aVL, V1-V6 или более амплитуды зубца R в отведениях II, III и aVF. Зубец R может уменьшиться или исчезнуть, а в противоположных отведениях – увеличиться.
Подострый период: сегмент ST возвращается к изолинии, формируется отрицательный зубец Т.
Период рубцевания (постинфарктный кардиосклероз): амплитуда отрицательного зубца Т уменьшается, со временем он становится изоэлектричным и положительным. Сегмент ST на изолинии. Зубец Q обычно сохраняется, однако в ряде случаев он может уменьшиться или исчезнуть за счет компенсаторной гипертрофии здорового миокарда.
Данные изменения ЭКГ характерны для инфаркта миокарда с зубцом Q (крупноочагового, трансмурального). ИМ без зубца Q (мелкоочаговый, интрамуральный, субэндокардиальный) диагностируется на основании динамических изменений сегмента ST и зубца T.
^ Топическая диагностика инфаркта миокарда по данным ЭКГ
Локализация инфаркта
Признаки
Прямые Реципрокные