История развития эндоваскулярной диагностики и хирургии коронарных артерий
 Начало развития катетерной техники относится к глубокой древности. За 3 000 лет до н. э. египтяне впервые в мире выполнили катетеризацию мочевого пузыря, используя металлические трубки. С этого момента началась эра инвазивных вмешательств в человеческий организм.
Начало развития катетерной техники относится к глубокой древности. За 3 000 лет до н. э. египтяне впервые в мире выполнили катетеризацию мочевого пузыря, используя металлические трубки. С этого момента началась эра инвазивных вмешательств в человеческий организм.
Примерно за 400 лет до н. э. люди научились придавать изогнутую форму трубкам из полого тростника и использовали их на трупах для изучения анатомии и функции клапанов сердца.
В 1711 г. голландский физиолог Н. Hales выполнил первую катетеризацию полости сердца у лошади с помощью трубок из латуни, стекла и гусиной трахеи.
В 1844 г. французский физиолог Е. Bernard произвел зондирование камер сердца у животных с записью внутрисердечного давления. В 1895 г. W. Roentgen открыл неизвестные дотоле лучи, названные им Х-лучами. А уже в 1896 г. В. М. Бехтерев предсказал открытие ангиографии. Выдающийся русский невролог заметил: «. Раз стало известно, что некоторые растворы не пропускают лучи Рентгена, то сосуды мозга могут быть заполнены ими и сфотографированы in situ». Однако понадобилось более тридцати лет, чтобы эти смелые предположения были реализованы на практике.
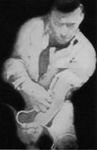
Годом возникновения интервенционной кардиологии можно считать 1929, когда интерн медицинского университета W. Forssman в эксперименте на себе впервые в мире провел мочеточниковый катетер через локтевую вену в полость правого предсердия, доказав тем самым безопасность введения катетера в живое сердце человека. Через два года он описал первую в истории ангиокардиографию, выполненную на самом себе. За эти дерзкие опыты на себе он был немедленно уволен из клиники в городе Эберсвальд (Германия) и лишен на всю жизнь возможности заниматься кардиологией.
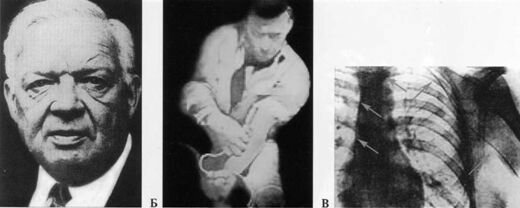
Рисунок: W. Forssman и первая в истории процедура катетеризации сердца, выполненная им на самом себе.
А — W. Forssman; Б — момент проведения катетера через локтевую вену; В — на рентгенограмме зафиксирован катетер, проведенный в правое предсердие (стрелки).
Медицинское сообщество проигнорировало его опыты и долгое время презрительно относилоськ нему. В 1941 г. A. Cournand и D. Richards впервые использовали сердечный катетер как диагностический инструмент, чтобы определить функциональное состояние сердца. И только в 1956 г. спустя 27 лет после отчаянного эксперимента W. Forssman, ученые из США A. Cournand и D. Richards были номинированы на Нобелевскую премию «за открытие, связанное с катетеризацией сердца и патологическими изменениями в системе кровообращения». Они предложили Нобелевскому комитету включить в список соискателей и своего немецкого коллегу, отметив, что начали свои исследования под влиянием его работ 20—30-х годов. Предложение было принято комитетом, и им была присуждена Нобелевская премия. На церемонии вручения премии A. Cournand во вступительной речи обобщил состояние вопроса крылатой фразой: «Сердечный катетер был ключом в замке». По иронии судьбы после смерти W. Forssman в 1979 г. клиника в Эберсвальде близ Берлина стала называться его именем.
В 1953 г. S. Seldinger предложил пункционный доступ в артерию, которым пользуются до сих пор.
В 1958 г. М. Sones впервые зафиксировал рентгеноконтрастное изображение коронарных артерий на кинопленку при выполнении аортографии у больного с поражением
аортального клапана. Он был детским кардиологом в Кливлендском центре. В дальнейшем исследователь предложил собственную методику диагностической коронарной ангиографии и сконструировал несколько моделей соответствующих катетеров.
В. П. Демихов в начале 50-х годов XX в. разработал методики маммарно-коронарного анастомоза в эксперименте на собаках, и его работы послужили основанием для внедрения В. И. Колесовым подобной операции в клиническую практику в 1964 г.
В 1964 г. Ch. Dotter и М. Judkins предложили новый транскатетерный метод восстановления атеросклеротически суженных и окклюзированных периферических артерий, который внес кардинальные изменения в лечение атеросклероза.
В 1967 г. впервые была представлена методика коронарографии по Judkins и одновременно R. Favaloro в Кливленде (США) впервые в мире выполнил операцию аортокоронарного венозного шунтирования. В 1969 г. R. Myler сконструировал приспособление для механической дилатации коронарных артерий, но ему не удалось разработать эффективную методику применения этого устройства в коронарном русле. Параллельно этим исследованиям A. Gruentzig в Цюрихе занимался вопросами периферической ангиопластики. Вскоре ему удалось в несколько раз уменьшить размер баллонного катетера для периферической ангиопластики и успешно использовать его для дилатации периферических и коронарных сосудов у собак.
В 1974 г. A. Gruentzig выполнил первую процедуру периферической ангиопластики. В 1976 г. он представил результаты экспериментальных работ по коронарной баллонной ангиопластике на животных, однако они получили мало отзывов и рассматривалисьс большим скептицизмом. В 1976 г. R. Myler и A. Gruen-tzig решили сотрудничать в поисках эффективного и безопасного способа выполнения коронарной баллонной ангиопластики.
В 1977 г. с участием A. Gruentzig, R. Myler и Е. Наппа в Сан-Франциско была выполнена первая интраоперационная коронарная баллонная ангиопластика. В 1977 г. A. Gruentzig и соавт. после многочисленных экспериментов на собаках впервые в клинической практике выполнили пациенту под местной анестезией успешную процедуру транслюминальной баллонной ангиопластики (ТЛБАП), таким образом начав эру коронарной ангиопластики. A. Gruentzig создал однопросветный, а затем двухпросветный баллонные катетеры и разработал показания к применению баллонной ангиопластики коронарных артерий. В СССР первую селективную коронарографию выполнили в 1971 г. Ю. С. Петросян и Л. С. Зингерман в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР, в дальнейшем опубликовав в 1974 г. первую в стране монографию по коронарографии. Первую процедуру коронарной баллонной ангиопластики в 1982 г. вы-полнили И. X. Рабкин и А. М. Абугов во Всесоюзном научном центре хирургии. И. X. Рабкин и соавт. в дальнейшем выпустили монографию по рентгеноэндоваскулярной хирургии, где подробно описали технику выполнения процедуры.
В 1982 г. J. Simpson и соавт. предложили новый тип проводника для коронарной ангиопластики — тонкий длинный металлический проводник с гибким направителем-кончиком J-образной формы длиной от 1 до 3 см. С тех пор стало возможным направлять коронарный проводник в нужную сторону, а следовательно, полностью контролировать пе-редвижение проводника и соответственно баллонного катетера. Таким образом, катетеры для коронарной ангиопластики стали управляемыми. Это способствовало работе на более дистальных участках коронарных артерий и повышению эффективности вмешательства. Так, после 1982 г. технический успех ТЛБАП резко возрос — с 65—70 до 80—85%.
В 1984 г. М. Kaltenbach и соавт. в Германии предложили технику применения длинного проводника для замены баллонных катетеров и введения рентгеноконтрастного вещества в коронарную артерию.
1985 год стал годом больших потерь в истории интервенционной медицины: скончались Ch. Dotter, F. Sones, M. Judkins и A. Gruentzig, навсегда вписав свои имена в историю становления интервенционной кардиологии и эндоваскулярной хирургии.
В 1986 г. Т. Bonzel и соавт. ввели новую концепцию «монорельсовых» катетеров для коронарной ангиопластики, с коротким дистальным сегментом, скользящим по металлическому проводнику.
В 1988 г. В. Meier и соавт. предложили проводниковую систему для реканализации окклюзированных коронарных артерий и прохождения жестких критических стенозов коронарных сосудов. Устройство имело на конце металлическую оливу диаметром до 2 мм и относительно жесткий стилет, что позволяло улучшить прохождение проводника через пораженный сегмент.
Высокая частота рестеноза, составляющая, по данным разных авторов, от 13 до 47%, а также острой окклюзии и остаточного стеноза после ТЛБАП, вызвали необходимость разработки новых манипуляций, дополняющих традиционную ТЛБАП. Разработанные приспособления стали называть устройствами второго поколения.
Идея о возможности использования чрескожно вводимых устройств-протезов (стентов) для поддержания просвета пораженного кровеносного сосуда впервые была предложена Ch. Dotter и соавт. в 1964 г.
Первое стентирование коронарной артерии у человека выполнили J. Puel и соавт. в марте 1986 г. в Тулузе (Франция), и практически одновременно с ними U. Sigwart и соавт. в Лозанне (Швейцария) сообщили о результатах стентирования 24 коронарных артерий у 19 пациентов. Опираясь на результаты опытов чрескожной имплантации металлических стентов в сосуды животных и затем в периферические артерии человека, авторы произвели первую чрескожную имплантацию металлического стента в коронарную артерию человека. Этим вмешательством открылась новая эра дистанционного проведения постоянных коронарных эндопротезов (стентов) в рентгенооперационной с использованием техники коронарной ангиопластики.
Американская администрация по продовольствию и лекарствам — Food and Drug Administration (FDA) — в 1987 г. дала разрешение на проведение в США исследований по применению баллонорасширяемых интракоронарных стентов Gianturco—Roubin и Palmaz—Schatz. Потенциальное преимущество интракоронарного стентирования для лечения острых и угрожающих окклюзии, осложняющих коронарную баллонную ангиопластику, было продемонстрировано G. Roubin и соав. В 1987—1989 гг. баллонорас-ширяемые стенты Gianturco—Roubin, произведенные компанией «СООК», были успешно имплантированы всем 115 пациентам, включенным в исследование. Хороший непосредственный результат процедуры был достигнут в 93% случаев. Экстренное аортокоронарное шунтирование потребовалось в 4,2% случаев, общая частота инфаркта миокарда составила 16%, частота подострого тромбоза стента — 7,6%, госпитальная летальность — 1,7%. Эти данные показали, что стентирование при острой или угрожающей окклюзии сосуда снижает необходимость в аортокоронарном шунтировании и частоту инфарктов миокарда. Вместе с тем в связи с высокой частотой возникновения рестеноза, составившей 41% (сходной с частотой рестеноза после баллонной ангиопластики в случае острой или угрожающей диссекции), стало ясно, что стентирование не имеет преимуществ в плане отдаленных результатов. В 1993 г. FDA разрешила применение стента Gianturco—Roubin для лечения острых и угрожающих окклюзии коронарных артерий, осложняющих ТЛБАП; в 1994 г. было получено разрешение на применение стента Palmaz—Schatz для лечения первичных дискретных стенозов нативных коронарных артерий. К 1998 г. разрешение FDA было получено еще для трех стентов: Multi-Link, AVE GFX и NIR.
В период с 1986 по 2000 г. в клиническую практику были внедрены новые технологии коронарной ангиопластики: лазерная реканализация и ангиопластика эксимерным лазе-ром, направленная коронарная атерэктомия, основанная на разработках J. Simpson, транслюминальная экстракционная атерэктомия, ротаблаторная атерэктомия, коронарная ангиопластика фокусированной силы, использование радиоактивных стентов, систем интракоронарной тромбэктомии AngioJet и X-sizer и многое другое.
Девяностые годы XX столетия стали эпохой расцвета эндоваскулярной хирургии. В ближайшие годы мы можем ожидать совершенствования конструкции и технологии интервенционного оборудования. Катетерная техника достигла высокого уровня развития. Практически ежегодно возникают высокотехнологические новшества. Части из них суждено остаться в истории интервенционной кардиологии, а части — стать совершенным орудием оператора. И только большой экспериментальный и клинический опыт сможет определить место каждого метода в эндоваскулярной хирургии ишемической болезни сердца.
За последнее десятилетие коронарное стентирование стало новым ведущим стандартом в эндоваскулярном лечении ИБС. Однако долгосрочному успеху коронарного стентирования препятствовало развитие рестеноза внутри стента в отдаленном периоде. Это представляет основную проблему для современной интервенционной кардиологии, поскольку количество рестенотических поражений коронарных артерий постоянно увеличивается, параллельно устойчивому росту количества процедур стентирования в мире, а лечение таких поражений технически осложняет процедуру стентирования и ведет к значительному увеличению общей стоимости лечения пациентов.
Полученный за последние шесть лет опыт использования стентов с антипролиферативным покрытием показал их явное преимущество в борьбе с рестенозом. Сегодня растет количество клинических исследований, подтверждающих высокую эффективность различных стентов с антипролиферативным покрытием в предотвращении развития рестеноза внутри стента.
Хотя остается еще много вопросов, на которые предстоит ответить в будущем, но уже сейчас понятно, что данное направление в эндоваскулярной хирургии коронарных сосудов является перспективным и привлекательным для врачей и пациентов.
Рентгеноэндоваскулярная хирургия ишемической болезни сердца
Л. А. Бокерия, Б. Г. Алекян, С. П. Глянцев, Н. В. Закарян
Баллонная ангиопластика и стентирование: проблема атеросклероза решена!

Чурзин Олег Александрович
врач сердечно-сосудистый хирург высшей квалификационной категории к.м.н.
Атеросклероз сегодня является наиболее распространенной патологией крупных сосудов организма. Занимая первые позиции в структуре заболеваемости по всему миру, болезнь ежегодно уносит жизни тысяч людей в возрасте 35-70 лет. Почему болеют сосуды, и существует ли спасение от атеросклероза?
Более подробно об этой проблеме и эффективных методах борьбы с проявлениями атеросклероза рассказывает в интервью ведущий специалист отделения сосудистой хирургии госпиталя, врач сердечно-сосудистый хирург высшей квалификационной категории, кандидат медицинских наук, член всероссийского общества ангиологов, заслуженный врач РФ Чурзин Олег Александрович.
Олег Александрович, какие сосуды находятся под прицелом, и что происходит внутри?
Заболевание затрагивает крупные артерии эластического типа :
В процессе налипания на стенку сосуда холестериновых отложений происходит постепенное сужение его просвета, что может привести к полному перекрытию кровотока. Жировые отложения становятся причиной дефицита кислорода, что, в свою очередь, приводит к серьезной дисфункции органа. Атеросклеротическая болезнь имеет несколько последовательных стадий своего развития:
Каждая стадия может длиться по несколько лет и переходить одна в другую незаметно . Однако может развиваться и более интенсивно в связи с наличием факторов риска или пренебрежением своевременным лечением. В появлении атеросклероза решающее значение имеют множество факторов: курение, ожирение, постоянные стрессы, гормональный сбой, наследственная предрасположенность и другие.
Какие современные методы помогают справиться с этой проблемой сегодня?
Сегодня традиционные методы лечения атеросклероза заменяются более современными способами восстановления просвета суженного сосуда. Баллонная ангиопластика и стентирование – инновационная технология, что с успехом борется с такими осложнениями, как инсульт, инфаркт миокарда, ишемическая болезнь сердца, синдром диабетической стопы и др.
Что это за технология?
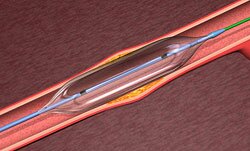
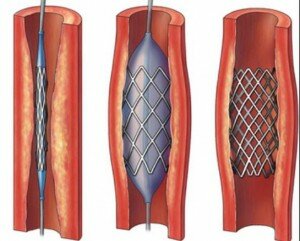
Термин “баллонная” обозначает, что просвет пораженного сосуда восстанавливается с помощью специального катетера с баллоном, который в процессе операции раздувается. В некоторых случаях в артерии устанавливается стент с тончайшим металлическим каркасом (стентом) для поддержания проходимости.
Стенты бывают саморасправляющимися и такими, что устанавливаются в просвете сосуда в момент надувания баллончика. В настоящее время также разработаны стенты со специальным покрытием из химиопрепарата, которое препятствует повторному сужению просвета сосуда (рестеноз). Ангиопластика со стентированием является во многих случаях альтернативой шунтированию и имеет большие преимущества.
Кому показана процедура?
Операцию баллонной ангиопластики и стентирования рекомендуют проводить в случаях сужения просвета церебральных, коронарных, почечных, брахиоцефальных сосудов, а также артерий нижних конечностей.
Кандидатом на операцию ангиопластики может быть любой пациент с объективным подтверждением выраженной ишемии органа. Перед процедурой такому больному в обязательном порядке проводится ангиографическое обследование с применением контрастного вещества под рентгеновским контролем.
Каковы противопоказания к проведению ангиопластики и стентирования?
В настоящее время существует только одно абсолютное противопоказание к проведению ангиопластики – это отказ пациента от операции. Остальные противопоказания носят относительный характер:
- Острые инфекционные заболевания
- Стойкая артериальная гипертензия
- Нарушение свертываемости крови
- Хроническая почечная недостаточность
- Декомпенсированная сердечная недостаточность
- Аллергия на контрастное вещество
- Обострение хронических заболеваний организма
- Отек легких
- Активный эндокардит и пр.
Подскажите, что необходимо при подготовке к операции?
Перед проведением операции ангиопластики следует выполнить все необходимые анализы крови (клинический анализ, биохимический анализ, коагулограмма), ЭКГ, ЭХО-кардиографию, дуплексное сканирование сосудов (при операции на брахиоцефальных артериях и сосудах нижних конечностей). Накануне, необходимо принять душ и сбрить волосы в паховой области. Ввод катетера будет осуществляться именно через бедренную артерию. От завтрака желательно отказаться.
Как проходит операция?
Продолжительность процедуры может быть разной, но в среднем она занимает 1-1,5 часа. После предварительной премедикации пациент доставляется в рентген-операционную, где его укладывают на хирургический стол. В вену руки устанавливается инфузионный катетер для проведения инфузии.
Для бесперебойного мониторинга ЭКГ на пальцы рук и ног накладываются специальные электроды. Место, где будет проводиться пункция, обрабатывается антисептическим средством и обкалывается анестетиком.
Легкое покалывание при проведении местной анестезии является нормальным явлением. В процессе процедуры пациент может общаться с доктором, сообщать об изменениях в состоянии и ощущениях, что является большим плюсом метода. При проведении ангиопластики катетер с баллоном постепенно движется по направлению к суженному участку. Весь процесс контролируется современной рентгенустановкой.
При достижении катетером места стеноза больной может почувствовать небольшой дискомфорт, а в момент раздувания баллона — болевая реакция. При этом врач, обычно, просит пациента задержать дыхание на несколько секунд. Баллонная ангиопластика и стентирование могут также проводится одномоментно с ангиографией, коронарографией (в случае коронарного стеноза).
По завершению манипуляции наблюдение за состоянием больного не прекращается. В этот период важно проследить за динамикой ЭКГ, показателями крови и реакцией в месте пункции. В течение нескольких часов в артерии будет находиться интродьюсер – гибкий катетер, который затем извлекается специалистом. На место прокола накладывается давящая повязка
Для лучшего выведения контрастного вещества пациенту рекомендуется постепенно выпить 1-1,5 литра минеральной воды. В дальнейшем необходимо ограничить физические нагрузки, в частности на нижние конечности.
Есть ли осложнения?
Риск развития осложнений после ангиопластики со стентированием минимален. Если следовать всем врачебным рекомендациям, то манипуляция пройдет легко и безболезненно. Возможными осложнениями могут стать:
- Гематома в месте прокола (пункции)
- Аллергическая реакция на контрастирующее вещество
- Нарушение сердечного ритма
- Тромбоз
Как упоминалось, процент развития этих осложнений у больных минимальный, но в случае появления неотложного состояния будет оказана экстренная помощь в полном объеме.
Операция баллонной ангиопластики и стентирования является наиболее безопасным методом решения проблем атеросклероза сосудов, лечения ишемической болезни сердца. На сегодняшний день процедура находит все более широкое распространение и ежедневно дает надежду на жизнь сотням пациентов.
Помните: Ваше здоровье — в Ваших собственных руках! Позаботьтесь о нем! Приходите на коронарографию. Чтобы записаться на проведение диагностики и лечения ишемической болезни сердца, звоните по телефону 8-911-225-7265 или пишите на почту: [email protected]
Коронарная ангиопластика
Коронарная ангиопластика (КА) — инвазивный способ лечения ИБС, направленный на восстановление суженного просвета коронарной артерии различными механическими устройствами, доставляемыми путем чрескожной пункции и катетеризации артериального русла.
Во многих странах основным методом лечения клинически выраженной ишемической болезни сердца является чрескожная чреспросветная коронарная ангиопластика. Это название было введено швейцарским кардиологом Andreas Gruentzig, который предложил принципиально новый способ устранения препятствия коронарному кровотоку. В 1977 г. он впервые расширил просвет суженной коронарной артерии с помощью баллонного катетера, проведенного к месту сужения чрескожно по сосудистому руслу.
В настоящее время имеется широкий спектр устройств и инструментов для коронарной ангиопластики:
• баллонные катетеры для проведения баллонной ангиопластики;
• атерэктомические катетеры;
• ротаблаторы для проведения мелкодисперсной ротационной абляции;
• лазер-баллоны для лазерной абляции;
• стенты для эндопротезирования коронарных артерий. Основным методом коронарной ангиопластики является баллонная ангиопластика. Остальные методы имеют ограниченное применение по специальным показаниям,
При баллонной ангиопластике баллонный катетер проводится по артериальной системе к коронарным сосудам. Баллон устанавливается в место сужения коронарной артерии и раздувается пол давлением, восстанавливая просвет сосуда.
Принципы отбора больных для коронарной ангиопластики
Для определения показаний к коронарной ангиопластике должны учитываться тяжесть клинических проявлений ИБС, выраженность функциональных тестов степени ишемии миокарда, состояние сократительной функции левого желудочка и анатомическая характеристика поражения коронарного русла, полученная при КВГ.
Клинически показанием для реваскуляризации миокарда являются все формы ишемической болезни сердца: стабильная и нестабильная стенокардия, острый инфаркт миокарда (ОИМ).
При стабильной стенокардии показанием для реваскуляризации служат:
• состояние, при котором медикаментозное лечение не позволяет добиться стойкого избавления от болей;
• положительный ишемический тест при нагрузочной пробе на фоне адекватной медикаментозной терапии;
• выявление зоны гипокинезии миокарда в бассейне пораженной коронарной артерии при отсутствии ОИМ в анамнезе.
Выбор метода реваскуляризации миокарда (эндоваскулярная операция или АКШ) основывается на морфологических особенностях поражения коронарных артерий, выявленных при КВГ.
Анатомическим субстратом ИБС является атеросклеротическое поражение коронарных артерий с сужением просвета до такой степени, когда ограничение кровоснабжения миокарда не может быть компенсировано механизмами регуляции коронарного кровотока. Обычно при этом сужение достигает 70% площади сечения просвета сосуда (гемодинамически значимый стеноз).
Принципиально эндоваскулярному вмешательству подлежат коронарные артерии достаточно большого диаметра — более 2 мм. Как правило, это эпикардиальные артерии, кровоснабжающие большие по объему участки миокарда.
Локализация, характер и распространенность поражения предопределяют успех и риск предполагаемой коронарной ангиопластики. В зависимости от анатомических особенностей поражения коронарных артерий, выявленных при КВГ, различают три типа стенозов:
Тип А. Включает в себя единичные, протяженностью менее 10 мм, концентрические стенозы, которые расположены в доступных не извитых участках артерии. Пораженная часть артерии имеет гладкие контуры, в стенке ее почти не определяется кальций, а в просвете нет признаков тромбоза. Такие сужения расположены на расстоянии от устья, и в этой зоне нет крупных боковых ветвей.
При таких поражениях коронарная ангиопластика эффективна у 85% больных и более. Вероятность осложнений низка.
Тип В. Этот вариант поражения характеризуется следующими особенностями: протяженность 10-20 мм, эксцентричность, нерегулярный контур, кальциноз стенки, признаки пристеночного тромбоза. Локализация стеноза близка к устью, в извитом участке сосуда (угол изгиба 45—90°), в сужение вовлечена крупная боковая ветвь, требующая мер защиты во время дилатации, полная окклюзия просвета, развившаяся в течение последних 3 мес.
У таких больных коронарная ангиопластика эффективна в 60-85% случаев. Проведение коронарной ангиопластики у них, хотя и связано с повышенным риском осложнений, все же имеет большие шансы на успех.
Тип С. Характеризуется диффузным поражением (протяженность более 20 мм), чрезмерной извитостью проксимального сегмента, локализацией в крайне изогнутом участке сосуда (угол изгиба более 90°), полной окклюзией длительностью более 3 мес, невозможностью защитить большую боковую ветвь, дегенерацией венозного шунта с наличием в его просвете рыхлого содержимого. Коронарная ангиопластика у таких больных эффективна менее чем в 60% случаев и риск осложнений высокий.
Поражения типа А характеризуются всеми перечисленными признаками, для типа В достаточно двух, для типа С — одного признака.
Абсолютным противопоказанием для коронарной ангиопластики являются:
• локализация стеноза в главном стволе левой коронарной артерии;
• наличие стеноза в коронарной артерии, снабжающей весь оставшийся живой миокард;
• отказ больного от лечения. Относительные противопоказания:
• тяжелая дисфункция левого желудочка;
• многососудистое окклюзирующее поражение со сложным коллатеральным снабжением миокарда, сопоставимое со стволовым стенозом;
• сложное, с точки зрения морфологии, поражение коронарной артерии, снабжающей значительный объем миокарда;
• невозможность достичь полной или почти полной реваскуляризации;
• нестабильное или неконтролируемое системное или метаболическое нарушение (например, почечная недостаточность, недавний инсульт, желудочно-кишечное кровотечение, лихорадка вследствие инфекции, неконтролируемая гипертензия, тяжелые электролитные нарушения, анафилаксия).
Следует отметить, что показания к проведению коронарной ангиопластики постоянно расширяются. Основной стратегический принцип — как можно дальше отсрочить необходимость проведения АКШ.
Поскольку коронарная ангиопластика может осложниться возникновением ситуаций, требующих срочного проведения хирургической операции, то если больной отказывается от АКШ, даже если выявленные сужения дилатируемы, коронарная ангиопластика не проводится.
Место коронарной ангиопластики в лечении больных с острыми формами ишемической болезни сердца
Одним из основных направлений в лечении острых форм ИБС (острый инфаркт миокарда, нестабильная стенокардия) является экстренная реваскуляризации миокарда. При этом восстановление кровотока по синдром зависимой коронарной артерии возможно используя системный тромболизис, баллонную ангиопластику и АКШ.
Необходимым условием для реализации этих технологий является ранняя госпитализация больных и наличие материально-технических возможностей их проведения.
Экстренная реваскуляризация миокарда при ОИМ эффективна в первые 6 ч от начала заболевания, но не позднее первых 12 ч. Она показана при появлении на ЭКГ стойкой элевации сегмента .5У как минимум в двух отведениях или блокады левой ножки пучка Гиса. Время от поступления больного в приемное отделение до принятия решения об экстренной реваскуляризации не должно превышать 30 мин, а от первичного осмотра больного до восстановления кровотока но инфаркт-зависимой артерии — 60 мин.
Проведение системного тромболизиса у больных ОИМ возможно при отсутствии признаков прогрессирования сердечной недостаточности и противопоказаний для выполнения тромболизиса.
Если после проведения тромболитической терапии у больного прогрессирует сердечная недостаточность или рецидивирует болевой синдром, тромболизис следует считать неэффективным. Причиной недостаточного восстановления коронарного кровотока после тромболизиса является гемодинамически значимое сужение просвета коронарной артерии атеросклеротической бляшкой или (и) остаточный тромбоз. Подобная ситуация возникает у 15—30% больных. Они составляют группу повышенного риска ранней летальности.
В этом случае показана КВГ для принятия решения о проведении коронарной ангиопластики или АКШ. Предпочтение следует отдавать проведению коронарной ангиопластики. АКШ проводится только при наличии прямых противопоказания для коронарной ангиопластики.
Коронарную ангиопластику, выполняемую сразу после системного тромболизиса, называют немедленной, а через 1—7 сут — поздней. Проведение немедленной коронарной ангиопластики сопряжено с высоким риском осложнений. Поэтому, если это возможно, предпочтительно ее выполнение после 4—7-дневной антикоагулянтной и антиагрегантной терапии. Целью поздней коронарной ангиопластики является устранение остаточного стеноза, профилактика реокклюзии, ускорение восстановления функции левого желудочка. При этом существенно снижается риск формирования аневризмы сердца и летальности больных ОИМ.
Широкое внедрение системного тромболизиса в практику лечения больных ОИМ позволило существенно уменьшить летальность при этой патологии. Однако тромболитическая терапия имеет целый ряд недостатков:
• только у трети больных с ОИМ нет противопоказаний к тромболизису;
• проходимость обтюрированной бляшкой и тромбом артерии восстанавливается только в 80% случаев и только у 55% больных кровоток в дистальных отделах артерии не остается редуцированным;
• после проведения системного тромболизиса кровоток в дистальных отделах коронарной артерии восстанавливается в среднем через 45 мин;
• перед началом тромболизиса невозможно прогнозировать эффективность терапии, т. к. отсутствует информация о характере поражения коронарной артерии, о соотношении размеров атеросклеротической бляшки и тромбоза в месте окклюзии;
• у 15-30% больных в течение нескольких часов после тромболизиса вновь возникает ишемия в бассейне инфаркт-зависимой артерии, а у 0,5-1,5% больных тромболизис осложняется геморрагическим инсультом.
В связи с этим многие считают рациональным проведение у больных ОИМ первичной коронарной ангиопластики без предварительной тромболитической терапии. Целью ее является восстановление кровотока в инфаркт-зависимой коронарной артерии, что достигается в 95-99% случаев. При этом использование современных медикаментозных средств профилактики тромбоза позволяет предотвратить повторную окклюзию артерии у 95% больных во время их пребывания в стационаре и в 87-91% случаев в течение шести месяцев после коронарной ангиопластики.
При поступлении больного с нестабильной стенокардией проводится интенсивная комплексная антиангинальная терапия (гепарин, аспирин, бета-адреноблокаторы, нитраты). Морфологическим субстратом этого состояния является нестабильная атеросклеротическая бляшка с элементами локального тромбоза. Состояние многих больных удается стабилизировать при помощи консервативной терапии.
Если в течение четырех часов не удается добиться стабилизации, то угроза развития ОИМ считается высокой и больным показано проведение КВГ для решения вопроса о первичной реваскуляризации миокарда.
Если консервативная терапия оказывается эффективной и угроза развития ОИМ отступает, решение вопроса о проведении КВГ принимается в более поздние сроки на основании результатов оценки функционального состояния коронарного кровотока при проведении нагрузочных тестов.
Непосредственные результаты коронарной ангиопластики
Приемлемый результат:
• диаметр остаточного сужения менее 40%. оцененный визуально в двух проекциях:
• отсутствие вызванных ангиопластикой признаков диссекции стенки сосуда (разрыв интимы).
Неудовлетворительный результат:
• остаточное сужение более 40% в двух проекциях;
• пассах контрастного вещества в трещину, появление туманности в области сужения;
• диссекция сосудистой стенки:
• нестабильная ЭКГ.
Чем лучше ангиографический результат коронарной ангиопластики, чем меньше остаточный стеноз артерии, тем дольше сохраняется клинический эффект вмешательства.
Осложнения коронарной ангиопластики
Осложнениями коронарной ангиопластики, возникающими сразу после ее проведения, являются:
• Спазм коронарных артерий. Различной степени выраженности он возникает почти в половине случаев ангиопластики. Чаще всего спазм купируется селективным введением нитратов или антагонистов кальция.
• Отсутствие возобновления кровотока. Это выявляемое ангиографически стойкое падение кровотока в бассейне венечной артерии и ее ветвей, возникающее сразу после успешного восстановления просвета сосуда. При этом не обнаруживается диссекции, тромба, спазма или большого остаточного стеноза. Частота этого осложнения варьирует по разным данным в пределах 0,6—12,2% случаев. Причиной его считают микроэмболизацию или стойкий спазм периферического сосудистого русла. Чаще всего отсутствие возобновления кровотока осложняет пластику сосудов, содержащих в своем просвете тромб, в том числе у больных после неэффективного тромболизиса.
• Диссекция и острая окклюзия венечной артерии. Острая окклюзия венечной артерии возникает в связи с развитием тромбоза, чаще всего вследствие диссекции стенки сосуда. Развивается это осложнение в 4—11% случаев.
• Перфорация стенки коронарной артерии. Чаще всего происходит при проведении ангиопластики в области изгибов венечных артерий, бифуркации, а также при их извилистости. Это осложнение развивается приблизительно в 0,1% случаев.
Подавляющее большинство осложнений коронарной ангиопластики удается успешно лечить эндоваскулярными катетерными способами. Значительно реже (1-3%) приходится прибегать к неотложному АКШ.
Проблема рестеноза
В течение 3-6 мес после баллонной коронарной ангиопластики у 30-40% больных развивается сужение коронарной артерии в месте воздействия баллона на стенку сосуда (рестеноз). Клинически это проявляется возобновлением стенокардитического синдрома.
В основе этого явления лежит избыточная пролиферативная реакция фибробластов с миграцией и пролиферацией гладкомышечных клеток в травмированном участке сосуда. Кроме того, происходит организация внутристеночных тромбов с последующим фиброзным утолщением внутренней оболочки артерии и вторичным сужением сосудистого просвета.
Рестеноз развивается тем чаше, чем травматичнее оказалась процедура ангиопластики. Чем выраженней исходный стеноз, чем ригиднее атеросклеротическая бляшка, чем сложнее морфология стеноза, тем вероятнее развитие рестеноза. При одномоментной ангиопластике многососудистого поражения частота рестеноза выше, чем при локальном стенозе одного сосуда.
Профилактика рестеноза заключается в выборе наиболее щадящей тактики проведения ангиопластики. При баллонной ангиопластике с имплантацией стента частота рестенозов уменьшается приблизительно до 20%. Применение разработанных в последнее время стентов с лекарственным покрытием, в частности обработанных иммуиосупрессантом сиролимусом, значительно уменьшается вероятность развития рестеноза. При травматичной коронарной ангиопластики, при выявлении участков диссекции стентирование сосуда наиболее показано.
При развитии рестеноза чаще всего прибегают к повторной коронарной ангиопластики.