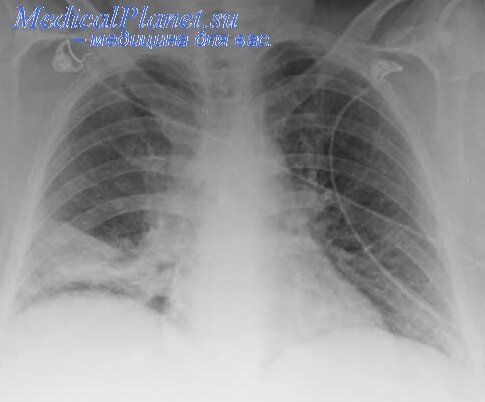
Изменения почек при сердечной недостаточности
Функциональные и морфологические изменения почек при сердечной недостаточности называются «сердечной», или «застойной», почкой.
Сердечная недостаточность развивается в результате нарушения основной функции сердца — насосной. Причиной могут явиться непосредственное поражение миокарда, клапанные пороки, гипертензия в большом или малом круге кровообращения и др. Недостаточность сердца сопровождается уменьшением ударного и минутного объема кровообращения. При этом включаются различные механизмы компенсации. При остром нарушении кровообращения, сопровождающемся падением артериального давления, основными компенсаторными механизмами являются рефлекторные реакции с рецепторов давления, прессорецепторов, расположенных в различных областях сосудистой системы. Возбуждение с этих рецепторов через симпатическую нервную систему приводит к повышению уровня среднего артериального давления и минутного объема кровообращения. При хроническом нарушении кровообращения основными механизмами компенсации являются задержка в организме жидкости для нормализации объема крови и давления, а также гипертрофия миокарда.
Снижение минутного объема кровообращения при сердечной недостаточности сопровождается уменьшением почечного кровотока и КФ. Этому способствуют компенсаторное сужение почечных артериол и повышение венозного давления. Снижение КФ приводит к уменьшению количества натрия, фильтрующегося в клубочке. Это стимулирует секрецию альдостероне надпочечниками и усиливает реабсорбцию натрия в канальцах. Содержание натрия в моче снижается, в тканях — увеличивается. Накопление натрия сопровождается увеличением осмотического давления в крови и тканях, что стимулирует секрецию АДГ и тем самым — реабсорбцию воды в почках. Накопление натрия и воды в организме приводит к образованию отеков. Повышенная реабсорбция натрия сопровождается усилением секреции калия клетками почечных канальцев и выбросом его в мочу. Явления электролитного дисбаланса приводят к потерям калия и накоплению натрия и ионов водорода в клетках организма.
Клиническая картина. Клинические признаки застойной почки обычно появляются при достаточно выраженных явлениях сердечной недостаточности. Уменьшается суточный диурез, часто с явлениями никтурии. Учет водного баланса необходимо проводить по количеству выпитой за сутки жидкости, включая жидкость, находящуюся в пище, и выделенной за это же время мочи. Больного необходимо периодически взвешивать. Реакция мочи обычно кислая, плотность ее увеличена из-за увеличенного содержания мочевины, цвет темный. В моче определяется белок, протеинурии редко превышает 1—3 г/сут. В осадке мочи имеются незначительное количество эритроцитов и лейкоцитов, гиалиновые и зернистые цилиндры.
Несмотря на снижение КФ, азотемия наблюдается редко, главным образом за счет повышения содержания в крови мочевины. Увеличение содержания мочевины обусловлено не только снижением клубочковой фильтрации, но и усилением катаболизма, распада белков, в результате дистрофических процессов в тканях при недостаточности кровообращения. Уменьшение признаков сердечной недостаточности приводит к исчезновению функциональных нарушений почек.
Лечение направлено на устранение сердечной недостаточности, улучшение сократительной работы сердца. Оно включает постельный режим, диету с ограничением жидкости и соли, назначение сердечных гликозидов и мочегонных средств и др.
Сердечная недостаточность, дыхательная, почечная: симптомы и лечение недостаточности
Сердечная недостаточность, дыхательная, почечная: симптомы и лечение недостаточности
Сердечной недостаточностью называется неспособность сердца выполнять полностью свою насосную функцию и снабжать организм нужным ему количеством кислорода, который присутствует в крови. Это заболевание не является самостоятельным. Оно в основном является результатом других заболеваний и состояний. Заболеваемость сердечной недостаточностью с возрастом увеличивается.
Диастолическая сердечная недостаточность – это нарушение расслабления левого желудочка и его наполнения, которое обуславливается его гипертрофией, инфильтрацией или фиброзом и которое способствует увеличению в желудочке диастолического конечного давления, а также проявлению сердечной недостаточности.
Острая почечная недостаточность – это нарушение гомеостатической почечной функции патологического характера, ишемического или же токсического происхождения, потенциально обратимое и развивающееся на протяжении нескольких часов, дней или недель.
Хроническая почечная недостаточность развивается при двусторонних хронических почечных заболеваниях по причине необратимой постепенной гибели нефронов. При ней нарушаются почечные гомеостатические функции.
Дыхательной недостаточностью называется нарушение обмена газами между циркуляцией крови и окружающим воздухом, характеризующаяся развитием гипоксемии или/и гиперкапнии.
Недостаточность клапана аорты – это патологическое состояние, при котором ретроградный ток крови из аорты проходит через аортальный дефектный клапан в полость левого желудочка.
Недостаточность клапана лёгочной артерии развивается при неспособности клапана лёгочной артерии стоять на пути обратного движения крови в правый желудочек из лёгочного ствола при его диастоле.
Митральная недостаточность – это когда левый предсердно-желудочковый клапан не в состоянии препятствовать обратному кровяному движению в левое предсердие из левого желудочка при систоле желудочков сердца.
Трикуспидальная недостаточность – это когда правый предсердно-желудочкового клапан не в состоянии препятствовать обратному кровяному движению в правое предсердие из правого желудочка при систоле желудочков сердца.
Печёночная недостаточность – это недостаточность разной выраженности функций печени. Нейропсихический синдром, развивающийся по причине нарушений печеночных функций и портально-системного шунтирования венозной крови, называется печёночной энцефалопатией.
Лечение сердечной недостаточности
Перед тем, как начать медикаментозное лечение сердечной недостаточности нужно устранить все причины, которые способствуют ее появлению (анемия, лихорадочные состояния, стресс, злоупотребление алкоголем, поваренной солью и средствами, которые способствуют задержке в организме жидкости и т.д.).
Общие мероприятия при лечении сердечной недостаточности: относительный покой (допустимы и даже желательны физические нагрузки, но они не должны вызывать большой усталости), прогулки на воздухе во время отсутствия отеков и выраженной одышки, диета с пониженным содержанием поваренной соли, избавление от лишнего веса, так как он дает дополнительную нагрузку на сердце.
Действие лекарственных препаратов, которые применяются при лечении сердечной недостаточности, направлено на повышение сократимости миокарда, уменьшение задержки в организме жидкости, снижение тонуса сосудов, устранение синусовой тахикардии и профилактику образования в полостях сердца тромбов.
Сердечно-сосудистая система при хронической почечной недостаточности
С. П. Боткин (1890) в лекции, посвященной нефриту, говорил: «Итак, повторяю, что возможно думать, не лежат ли эти различные исходы и разнообразное течение всех этих форм заболевания почек, ведущее за собой и различные анатомические картины в неодинаковом отношении к почечному процессу вообще других органов и, в частности, сердца, разнообразные изменения мышцы которого, совпадая с различными анатомическими исходами почечного процесса, и составляют, может быть, существенную причину последних» (разрядка С. П. Боткина).
Прошло достаточно много времени с того момента, когда была высказана эта мысль, и накопилось много новых фактов для того, чтобы считать сами почки главным органом, виновным в развитии хронической почечной недостаточности (ХПН). Однако справедливость высказанного С. П. Боткиным суждения о роли изменений сердечной мышцы в судьбе больных с ХПН и сегодня сохраняется в полной мере. Присоединение сердечной недостаточности изменяет ход уремии, и тогда возникает так называемый «кардио-ренальный синдром» (М. С. Вовси, Г. Ф. Благман, 1955; Е. М. Тареев, 1958). При этом сердечная недостаточность может протекать не только по левожелудочковому, но и по смешанному типу, плохо поддаваясь кардиальной терапии (Б. В. Петровский, 1968). Амбурже и др. (1965), разбирая осложнения со стороны сердечнососудистой системы при ХПН, делят их на 2 группы: вызванные самой ХПН и обусловленные гипертензией. ХПН, по мнению авторов, помимо перикардита, вызывает уремический миокардит; гипертензия сопровождается циркуляторными расстройствами. Поскольку в основе миокардита авторы видят нарушения метаболизма в сердечной мышце, то, по-видимому, эти изменения правильнее называть не воспалением, а дистрофией. Развитие сердечной недостаточности при ХПН, ухудшая кровоснабжение почек, само по себе способно ускорить прогрессирование ренальной инсуфициенции (Г. Ф. Ланг, 1950; О. Шик, 1967). Современные методы терапии ХПН, включая программированный гемодиализ и трансплантацию почек, к сожалению, отнюдь не сняли остроты вопроса о сердечной недостаточности у этих больных: во-первых, потому, что даже многократный гемодиализ, продлевая жизнь больным, не спасает их в ряде случаев от смерти, наступающей в результате необратимых изменений в сердечной мышце (А. Я. Пытель, И. Н. Кучинский, 1968), во-вторых, в связи с тем, что само наличие сердечной недостаточности является противопоказанием к активной терапии (В. И. Шумаков, Э. Р. Левицкий, 1974).
При решении вопросов генеза сердечной недостаточности у больных с ХПН наибольший интерес представляет проблема морфологических изменений в сердце.
С. М. Вовси (1960) указывает, что в стадии терминальной уремии на эндокарде и, в частности, на клапанах могут наблюдаться свежие воспалительные изменения; в миокарде— некробиотические очаги токсического происхождения. Амбурже и др. (1965) при изучении миокарда умерших от ХПН, страдавших при жизни повышением АД, находили гиалиноз интимы и явления склероза мышечного слоя в артериолах, ведущие к сужению их просвета. Указывают на возможность токсического миокардита (Б. Ионаш, 1963; Г. Маждраков, 1973) и выраженное прогрессирование коронарного атеросклероза (Б. В. Петровский, 1968). Подчеркивается
наличие дистрофических изменений в миокарде, которые Е. М. Тареев и В. М. Ермоленко (1974) называют уремической миокардиопатией.
Из 311 больных с различными заболеваниями почек, о которых мы будем говорить дальше, 40 умерло от ХПН (табл. 19). Среди них было 16 мужчин и 24 женщины, возраст больных колебался от 23 до 74 лет, преобладали больные с хроническим диффузным гломерулонефритом (ХДГН) — 30, больных с хроническим пиелонефритом было 4, с амилоидозом — 3, с поликистозом — 2 и с туберкулезом почек— 1.
Как видно из таблицы, более чем у 2/3 больных имелись признаки той или другой степени выраженности дистрофии миокарда (70%) и коронарного атеросклероза (77,5%). Коронарный атеросклероз в большинстве случаев (62,5 %) был умеренно выражен и не сопровождался кардиосклерозом (в 67,5%). Другими словами, частота и интенсивность атеросклеротических изменений в сердце у больных, умерших от ХПН, не превышает таковые для лиц того же возраста без почечной патологии (М. Плоц, 1961; А. М. Вихерт, 1971).
Известно, сколь большим субъективизмом в оценке гипертрофии желудочков страдает метод визуального измерения толщины их стенки (3. И. Янушкевичус, 3. И. Шилинскайте, 1973; Н. А. Левкова, 1974; М. П. Митрофанов, Sternby, 1974). Мы, согласно опыту прозектуры 1-го Ленинградского медицинского института, приняли считать за наличие гипертрофии левого желудочка сердца толщину его стенки 11 мм и более и за гипертрофию правого желудочка — толщину его стенки 3 мм и более, что согласуется с данными литературы (Grossman и др. 1974).
Признаки гипертрофии левого желудочка на секции имели место у подавляющего большинства больных (87,5%), хотя в целом гипертрофия и не носила катастрофического характера: в среднем толщина стенки равнялась 14 мм, с колебаниями от 11 до 18 мм. Столь часто встретившаяся гипертрофия левого желудочка, естественно, не вызывает удивления, учитывая наличие высокой гипертензии, которой страдали при жизни все эти больные.
Значительно больший интерес вызывает парадоксально часто (в 57,5%) наблюдавшаяся гипертрофия правого желудочка. Это, с одной стороны, можно, по-видимому, объяснить явлениями застоя в малом круге кровообращения, часто выявляемого у больных в терминальных стадиях ХПН (77,5%), с другой — той содружественной гипертрофией правого желудочка, которая возникает при наличии гипертрофии левого, на что указывал в свое время, еще С. П. Боткин и которую столь хорошо морфологически обосновал С. С. Вайль (1940) и было подтверждено в современных исследованиях (В. Н. Дзяк и др. 1973). Фибринозный и серозно-фибринозный перикардит наблюдался у 15% больных, т. е. у 1 из 6—7 умерших от ХПН.
У больных с ХПН очень часто возникает пневмония (57,5%), которая и является непосредственной причиной их гибели.
Таким образом, если кратко суммировать полученные данные, то мы должны подчеркнуть безусловное значение дистрофии миокарда как ведущего процесса изменений в сердечной мышце, на фоне гипертрофии и умеренно выраженного коронарного атеросклероза, способствующих абсолютному или относительному уменьшению кровоснабжения миокарда.
Дистрофический процесс, как известно, является общепатологической категорией. Он развертывается на различных уровнях от тканей до ультраструктуры клетки. Наиболее общим и стандартным выражением дистрофического процесса является нарушение обновляемости внутриклеточных структур (Г. Н. Крыжановский, 1974).
При длительном увеличении функции органов и систем в их клетках закономерно активизируется синтез нуклеиновых кислот и белков, что приводит к росту органа и развитию структурных изменений, составляющих основу адаптации к увеличенной нагрузке. Активизация такого синтеза в сердечной мышце может быть вызвана любым фактором, повышающим потенциал фосфорилирования в миокарде, например повышением артериального давления, умеренной ишемией и др. При этом увеличивается мощность системы транспорта 02 и преобразования энергии в доступную для функции миокарда форму — АТФ, увеличивается реактивность и мощность «кальциевого насоса», т. е. процесса, непосредственно ответственного за сокращение и расслабление миокарда (Ф. 3. Меерсон, В. И. Капелько, 1973; Ф. 3. Меерсон и др. 1973; Ф. 3. Меерсон и др. 1974).
В настоящее время с помощью коронарографии, скеннирования сердца и биохимического исследования притекающей и оттекающей от сердца крови (по артериовенозной разнице) установлены нарушения микроциркуляции в миокарде при процессах дистрофии и развивающейся сердечной недостаточности. Обнаружены изменения в углеводном и жировом обмене в виде появления избытка недоокисленных жирных кислот и их промежуточных продуктов, нарушение усвоения лактата; страдает азотистый метаболизм и увеличивается образование аммиака в миокарде (Е. И. Чазов и др. 1973; Е. Н. Meшалкин и др. 1973).
У больных с сердечной недостаточностью потребление 02 миокардом повышено и интенсивность окислительных процессов неадекватна оптимальной выработке аэробной энергии. Анаэробные процессы являются недостаточными для увеличения общей энергии сердца, что способствует понижению компенсации и прогрессированию сердечной недостаточности (Р. Бинг, 1959). Уменьшению энергетической энергии миокарда способствует и снижение при сердечной недостаточности окислительно-восстановительных ферментов, несмотря на имеющуюся гипертрофию мышечных волокон (Н. М. Мухарлямов, 1973; Р. И. Микунис, Р. 3. Морозова, 1973; И. И. Крыжановская, 1973),
У больных с ХПН в развитии сердечной недостаточности приобретают значение не только все перечисленные выше факторы, но и имеется ряд усугубляющих особенностей. К ним относится токсическое воздействие на миокард различных задержанных в организме и в основном неидентифицированных веществ, электролитный дисбаланс, в особенности нарушение обмена калия, накопление в крови катехоламинов и их абсорбция сердечной мышцей. Посмертный анализ сердца у больных, умерших от уремии, показал накопление катехоламинов в миокарде и частое наличие диссеминированных некротических поражений, подобных тем, которые вызываются высокими дозами адреналина (В. Рааб, 1959).
Как известно, анемия сама по себе вызывает явления дистрофии миокарда, и снижение гемоглобина ниже 30% в состоянии более или менее быстро вызвать появление сердечной недостаточности (Г. Ф. Ланг, 1957). Поскольку анемия является непременным спутником ХПН, то ее значение в прогрессировании недостаточности кровообращения по мере усугубления хронической почечной недостаточности является несомненным.
Все процессы, приведшие к возникновению дистрофии миокарда и явлениям застоя в нем крови, в состоянии вызвать диффузное развитие соединительной ткани в сердечной мышце, что Г. Ф. Ланг (1936) называл «застойно-дистрофическим кардиосклерозом». При этом активизируется процесс образования микрофибрилл и коллагена. Возможно, что в процессе фибриллогенеза, помимо фибробластов, участвуют и сами мышечные клетки миокарда (В. X. Анестиади, С. П. Руссу, 1973).
Данные о гемодинамике при ХПН, полученные разными авторами, нередко оказываются противоречивыми, что можно объяснить, по-видимому, неоднородностью исследуемых групп больных как по степени выраженности ХПН, так и по степени сердечной недостаточности. При различных заболеваниях почек, не сопровождающихся ХПН, минутный (МО) и ударный (УО) объемы и их производные — сердечный (СИ) и ударный (УИ) индексы меняются мало. Небольшое увеличение МО может происходить за счет тахикардии (А. Б. Рапопорт, 1973; Б. Г. Лукичев, 1974). При возникновении ХПН, уже в стадии ее компенсации, начинает увеличиваться общее периферическое сопротивление (ОПС), в то время как показатели МО и УО еще долгое время могут сохраняться в пределах нормы (Б. Г. Лукичев, 1974), хотя структура систолы левого желудочка оказывается измененной: увеличивается фаза изометрического сокращения, укорачивается период изгнания, уменьшается внутрисистолический показатель и др. (В. III. Гольдис, 1972; И. И. Вайнтрауб, 1974).
При выраженной ХПН, сопровождающейся повышением АД, происходит дальнейшее увеличение ОПС, которое может, однако, сохраняться нормальным у больных без повышения АД (В. М. Ермоленко, 1974). УО и УИ длительно сохраняются нормальными, что указывает на достаточные компенсаторные возможности миокарда; МО и СИ в связи с тахикардией увеличиваются. Указанные изменения гемодинамики не имеют четкой связи с выраженностью биохимических показателей (Bohm и др. 1974).
Прогрессирующая сердечная недостаточность в свою очередь значительно ухудшает почечную гемодинамику за счет снижения почечного кровотока. При этом падение почечного кровотока происходит в большей мере, чем снижение минутного объема (Nitter-Hauge и др. 1974).
Таким образом, сердечная недостаточность у больных с ХПН обусловлена своеобразной дистрофией миокарда, гемодинамические проявления при этом не отличаются существенным образом от изменений при застойной недостаточности кровообращения; степени сердечной и почечной недостаточности, судя по приведенным данным литературы, не являются в полной мере параллельными процессами.
Для выявления изменений сердечно-сосудистой системы на разных стадиях хронической почечной недостаточности нами были отобраны 311 историй болезни больных, находившихся на стационарном лечении в клинике е последние годы, Среди них у 68 установлена IA степень почечной недостаточности, у 35—IБ, у 70—IIA, у 41 — IIБ, у 49—IIIA, и у 48— IIIБ.
Динамическое наблюдение за состоянием сердечно-сосудистой системы в сроки от 0,5 до 6 лет проведено у 47 больных, которых в зависимости от течения почечной недостаточности разбили на 2 группы: без прогрессирования ХПН — 23, с прогрессированием — 24 человека. Клинико-анатомические параллели изучены у 40 больных, умерших от ХПН. Данные обработаны статистически методом биноминального распределения, при 95 и 99% уровне значимости. Изучаемые параметры были нами кодированы (табл. 20) по принятой в медицине системе (Т. Б. Постнова, 1972).
Анализ полученных данных .
По нашим данным, ХДГН составляет 53—74% среди больных с разной степенью хронической почечной недостаточности, в то время как пиелонефрит —17—36%, т. е. примерно в 2 раза реже, остальные заболевания (амилоидоз, поликистоз и др.) — около 10%. Эти клинические представления совпали с данными аутопсии: из 40 умерших ХДГН имел место у 30 (75%), пиелонефрит — у 4 (10%), на долю остальных заболеваний пришлось 15%.
По мере прогрессировали ХПН у больных с диффузным гломерулонефритом исчезают формы так называемого изолированного мочевого синдрома (при IIA ст. форма уже не встречается), и нефротический синдром (не встречается, начиная со IIБ ст.) и неуклонно нарастает число больных со смешанной формой нефрита, которая вместе с гипертонической в III ст. составляет 100%.
Обычно отмечают некоторое преобладание мужчин среди умерших от уремии (Schreiner, Maher, 1961). По нашим данным (табл. 21), среди больных с ХПНI—II количество мужчин и женщин было примерно одинаково; среди больных с ХПНIII отчетливо, хотя и не достоверно, преобладали женщины и соотношение мужчин и женщин было примерно 2 :3. Среди 40 больных, умерших от уремии, мужчин было 16, женщин — 24, т. е. соотношение тоже было 2:3.
Существует мнение, что средний возраст больных с уремией колеблется между 35—45 годами (Shreiner, Maher, 1961; Kwan Eun Kim и др. 1972). По нашим данным (рис. 22), у больных без клинических признаков почечной недостаточности (IA ст.) количество лиц до 30 и старше 30 лет было примерно одинаковым, но уже начиная с IБ ст. и дальше резко и достоверно преобладают больные в возрасте старше 30 лет, составляя 75—92,7% от общего количества в каждой группе. Среди этих больных очень интересна динамика возраста старше 50 лет: количество этих больных, составляя в IB и IIA ст. 20% и 25%, резко, более чем в 2 раза, увеличивается во IIБ и IIIА ст. (соответственно до 54% и 51%), а затем в IIIБ ст. вновь снижается в 2 раза
(до 27%).
Такой возрастной «скачок» в IIIБ ст. в сторону «омоложения» свидетельствует о значительно более раннем наступлении летального исхода в терминальной стадии ХПН. И действительно, средний возраст среди 40 больных, умерших от уремии, по нашим данным, был 46,7, т. е. менее 50 лет.
Определение длительности заболевания у больных с ХПН порой наталкивается на непреодолимые трудности.
По нашим данным, установить длительность заболевания оказалось невозможным в 2,9—16,3%, причем чем более выражена хроническая почечная недостаточность, тем выше процент неясных случаев. Это, вероятно, можно объяснить трудностью сбора анамнеза у больных в терминальной фазе заболевания.
Во всех группах с высокой степенью достоверности преобладали больные с длительностью заболевания свыше 3 лет (72,4—98%), при этом у половины больных длительность болезни превышала 10-летний период, а при IIIБ ст. такие больные составили почти 2/3 случаев (62,5%).
Определение длительности ХПН встречает не меньшие трудности, чем определение длительности самого заболевания. Темп развития ХПН у разных больных может оказаться самым различным.
Возникнув, ХПН может прогрессировать постепенно или скачкообразно, иногда бурно (С. Д. Рейзельман, 1949; О. Шик, 1967). В силу этого длительность уже имевшейся ХПН может варьировать в очень широких пределах: от 1—2 месяцев (Б. Б. Бондаренко, 1974) до ряда лет (Davson, Piatt, 1949; С. Д. Рейзельман, В. В. Сура, 1963).
По нашим данным, у больных с самыми начальными признаками хронической почечной недостаточности (IБ ст.) в 60% не удалось выяснить время начала развития недостаточности, что лишний раз подтверждает незаметность «вхождения» в это состояние. Начиная со IIА ст. количество больных с неизвестной длительностью почечной недостаточности во всех группах было довольно постоянно и колебалось от 16,7% до 24,3%. Короткая длительность ХПН (до 6 месяцев) прогрессивно и достоверно снижается от IIА к IIIБ ст. составляя в III ст. всего около 5%. В то же время резко увеличивается количество больных с длительностью ХПН более 1 года (в группах IIА—IIIБ ст. до 64,3—91,8%), но при этом % длительность ХПН свыше 5 лет во всех группах не превышает 4—14,3%. Обращает на себя внимание тот факт, что среди самых тяжелых больных (IIIБ ст.) 23% имели короткую, до 1 года, длительность почечной недостаточности. Другими словами, длительность существования ХПН у основной массы больных колеблется от 1 до 5 лет, что и составляет в большинстве случаев срок их жизни.
Рис. 22. Распределение обследованных больных с ХПН различной степени выраженности по возрасту (в %).
Светлые столбики — до 30 лет; косая штриховка — старше 30 лет; черная штриховка — старше 50 лет.
Состояние сердечно-сосудистой системы нередко имеет определяющее прогностическое значение в судьбе больных с ХПН. В основе развития сердечной недостаточности при ХПН, как показали данные патологоанатомического исследования, лежит дистрофия миокарда (у 70,7% больных), усугубленная коронарным атеросклерозом (78,1%). Представляет несомненный интерес, что, помимо гипертрофии левого желудочка (87,8%), более чем у 1/2 больных (57,5%) на аутопсии имелись признаки гипертрофии правого желудочка сердца.
Эволюция изменений сердечно-сосудистой системы по мере прогрессирования ХПН заключается в том, что нормальная частота ритма сменяется, начиная со IIA ст. тахикардией, возникает экстрасистолия (14,6%), растет количество больных с увеличенными размерами сердца (в IIIБ ст. — у 98%). Меняется и аускультативная картина: отчетливо увеличивается количество больных с приглушенными тонами сердца и наличием систолических шумов (в IIIБ ст. — до 80%), шум трения перикарда в терминальной стадии выслушивается у каждого третьего больного.
Число больных с гипертензией достоверно увеличивается от стадии к стадии, достигая максимума во IIБ ст. (95%) и несколько снижается в III ст. за счет усугубления сердечной недостаточности. В конечных стадиях ХПН увеличивается число больных, у которых гипотензивная терапия оказывается неэффективной (55%).
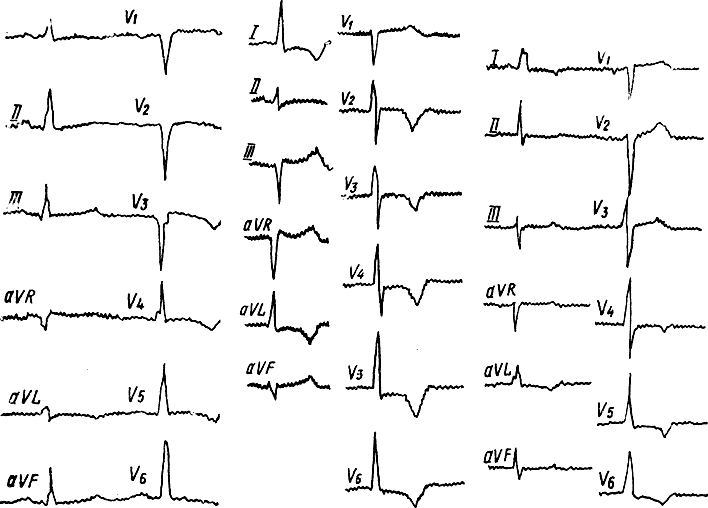
На ЭКГ у больных в терминальной стадии ХПН увеличивается частота атрио-вентрикулярных блокад (до 12,8%) и признаки местной внутрижелудочковой блокады (10,3%). Признаки гипертрофии левого желудочка на ЭКГ возникают уже у больных с ХПНI (24,2%), в дальнейшем их частота, так же как и частота коронарной недостаточности и электролитного дисбаланса, неуклонно возрастает.
Застойные явления в легких могут наблюдаться уже со IIA ст. количество таких больных достоверно увеличивается по мере прогрессирования почечного процесса. Указанные изменения в легких предрасполагают к развитию пневмонии, которая на аутопсии была выявлена у 57,5% больных.
Таким образом, состояние сердечно-сосудистой системы по мере прогрессирования ХПН претерпевает существенные изменения, которые предопределяют темпы развития сердечной недостаточности: сердечная недостаточность либо отсутствует, либо не превышает I степени у больных с ХПНI, сердечная недостаточность II степени может возникать уже у больных с ХПН IIA ст. (17,1%) и по мере дальнейшего прогрессирования ХПН число больных с СH2 неуклонно увеличивается; сердечная недостаточность III степени может возникать у больных с ХПН НБ ст. (4,9%) и на заключительном этапе, при ХПН IIIБ ст. Признаки сердечной недостаточности II и III степени наблюдаются более чем у 2/3 больных (68,7%).
Основу развития сердечной недостаточности при ХПН составляют функциональные и морфологические изменения в миокарде (дистрофия, гипертрофия, коронарный атеросклероз и др.), обусловленные глубокими нарушениями всех видов обменных процессов в организме.