Ингибиторы ангиотензинпревращающего фермента длительного действия в лечении артериальной гипертензии
РЕКЛАМА
Широкое распространение артериальной гипертензии (АГ) среди населения и ее роль в развитии сердечно-сосудистых осложнений определяют актуальность проведения своевременной и адекватной антигипертензивной терапии. Многочисленные контролируемые исследования показали высокую эффективность медикаментозных методов вторичной профилактики АГ в снижении частоты возникновения инсультов, сердечной и почечной недостаточности, в том числе и при мягкой АГ.
В клиническую практику для лечения АГ ингибиторы ангиотензинпревращающего фермента (иАПФ) широко вошли с 70-х годов прошлого века, став антигипертензивными препаратами первого ряда в лечении АГ.
Оригинальность препаратов данного класса состоит в том, что они впервые предоставили врачу возможность активно вмешиваться в ферментативные процессы, протекающие в ренин-ангиотензин-альдостероновой системе (РААС).
Действуя через блокаду образования ангиотензина II (АII), иАПФ оказывают влияние на систему регуляции артериального давления (АД) и в конечном итоге приводят к уменьшению отрицательных моментов, связанных с активацией рецепторов АII 1-го подтипа: они устраняют патологическую вазоконстрикцию, подавляют клеточный рост и пролиферацию миокарда и гладкомышечных клеток сосудов, ослабляют симпатическую активацию, уменьшают задержку натрия и воды.
Кроме воздействия на прессорные системы регуляции АД, иАПФ действуют и на депрессорные системы, повышая их активность за счет замедления деградации вазодепрессорных пептидов — брадикинина и простагландина Е2. которые вызывают релаксацию гладких мышц сосудов и способствуют продуцированию вазодилатирующих простаноидов и высвобождению эндотелийрелаксирующего фактора.
Эти патофизиологические механизмы обеспечивают основные фармакотерапевтические эффекты иАПФ: антигипертензивное и органопротекторное действие, отсутствие значимого влияния на углеводный, липидный и пуриновый обмен, уменьшение продукции альдостерона корой надпочечников, уменьшение выработки адреналина и норадреналина, подавление активности АПФ, снижение содержания АII и повышение содержания брадикинина и простагландинов в плазме крови.
В настоящее время в клиническую практику внедрены иАПФ 3-го поколения. Препараты из группы иАПФ отличаются между собой:
- по химической структуре (наличие или отсутствие сульфгидрильной группы);
- фармакокинетическим свойствам (наличие активного метаболита, особенность элиминации из организма, продолжительность действия, тканевая специфичность).
В зависимости от наличия в молекуле иАПФ структуры, взаимодействующей с активным центром АПФ, различают:
- содержащие сульфгидрильную группу (каптоприл, пивалоприл, зофеноприл);
- содержащие карбоксильную группу (эналаприл, лизиноприл, цилазаприл, рамиприл, периндоприл, беназеприл, моэксиприл);
- содержащие фосфинильную/фосфорильную группу (фозиноприл).
Наличие сульфгидрильной группы в химической формуле иАПФ может определять степень связывания его с активным центром АПФ. В то же время именно с сульфгидрильной группой связывают развитие некоторых нежелательных побочных эффектов, таких как нарушение вкуса, кожная сыпь. Эта же сульфгидрильная группа вследствие легкого окисления может быть ответственна за более короткую продолжительность действия препарата.
В зависимости от особенностей метаболизма и путей элиминации, иАПФ подразделяются на три класса (Opie L. 1992):
Класс I — липофильные лекарства, неактивные метаболиты которых имеют печеночный путь выведения (каптоприл).
Класс II — липофильные пролекарства:
- Подкласс IIА — препараты, активные метаболиты которых выводятся преимущественно через почки (квинаприл, эналаприл, периндоприл и др.).
- Подкласс IIВ — препараты, активные метаболиты которых имеют печеночный и почечный пути элиминации (фозиноприл, моэксиприл, рамиприл, трандолаприл).
Класс III — гидрофильные лекарства, не метаболизирующиеся в организме и выводящиеся почками в неизмененном виде (лизиноприл).
Большинство иАПФ (исключение — каптоприл и лизиноприл) являются пролекарствами, биотрансформация которых в активные метаболиты происходит главным образом в печени, в меньшей мере — в слизистой оболочке желудочно-кишечного тракта и внесосудистых тканях. В связи с этим у больных с печеночной недостаточностью образование активных форм иАПФ из пролекарств может существенно снижаться. Ингибиторы АПФ в виде пролекарств отличаются от неэстерифицированных препаратов несколько более отсроченным началом действия и увеличением продолжительности эффекта.
По продолжительности клинического эффекта иАПФ делятся на препараты:
- короткого действия, которые необходимо назначать 2–3 раза в сутки (каптоприл);
- средней продолжительности действия, которые необходимо принимать 2 раза в сутки (эналаприл, спираприл, беназеприл);
- длительного действия, которые в большинстве случаев можно принимать 1 раз в сутки (квинаприл, лизиноприл, периндоприл, рамиприл, трандолаприл, фозиноприл и др.).
Гемодинамические эффекты иАПФ связаны с влиянием на сосудистый тонус и заключаются в периферической вазодилатации (cнижение пред- и постнагрузки на миокард), снижении общего периферического сопротивления сосудов и системного АД, улучшении регионарного кровотока. С ослаблением воздействия АII на системную и внутрипочечную гемодинамику связаны кратковременные эффекты иАПФ.
Долгосрочные эффекты обусловлены ослаблением стимулирующих эффектов АII на рост, пролиферацию клеток в сосудах, клубочках, канальцах и интерстициальной ткани почек при одновременном усилении антипролиферативных эффектов.
Важным свойством иАПФ является их способность оказывать органопротекторные эффекты . обусловленные устранением трофического действия АII и снижением симпатического влияния на органы-мишени, а именно:
- кардиопротекторное действие: регрессия миокарда левого желудочка, замедление процессов ремоделирования сердца, антиишемическое и антиаритмическое действие;
- ангиопротекторное действие: усиление эндотелийзависимой вазодилатации, торможение пролиферации гладкой мускулатуры артерий, цитопротекторное действие, антитромбоцитарный эффект;
- нефропротекторное действие: увеличение натрийуреза и уменьшение калийуреза, снижение внутриклубочкового давления, торможение пролиферации и гипертрофии мезангиальных клеток, эпителиальных клеток почечных канальцев и фибробластов. Ингибиторы АПФ превосходят другие антигипертензивные средства по нефропротекторной активности, которая, по крайней мере, частично, не зависит от их антигипертензивного эффекта.
Преимуществом иАПФ перед некоторыми другими классами антигипертензивных лекарственных средств являются их метаболические эффекты, заключающиеся в улучшении метаболизма глюкозы, повышении чувствительности периферических тканей к инсулину, антиатерогенных и противовоспалительных свойствах.
В настоящее время накоплены данные о результатах многочисленных контролируемых исследований, подтверждающих эффективность, безопасность и возможность благоприятных защитных эффектов долгосрочной терапии иАПФ у больных с сердечно-сосудистыми заболеваниями в отношении органов-мишеней.
Ингибиторы АПФ характеризуются хорошим спектром переносимости. При их приеме могут возникать специфические (сухой кашель, «гипотония первой дозы», нарушение функции почек, гиперкалиемия и ангионевротический отек) и неспецифические (нарушение вкуса, лейкопения, кожная сыпь и диспепсия) побочные эффекты.
На кафедре клинической фармакологии и фармакотерапии факультета послевузовского профессионального образования врачей ММА им. И. М. Сеченова накоплен большой опыт изучения различных иАПФ у больных АГ, в том числе при сочетании ее с другими заболеваниями внутренних органов.
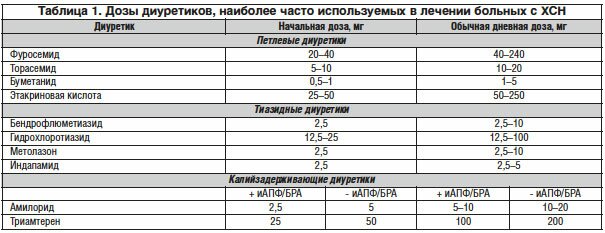
Особого внимания заслуживают иАПФ пролонгированного действия лизиноприл и фозиноприл. Первый из них — активный препарат, который не подвергается биотрансформации и выводится почками в неизмененном виде, что имеет значение у больных с заболеваниями желудочно-кишечного тракта и печени. Второй препарат (фозиноприл) имеет активные липофильные метаболиты, позволяющие ему хорошо проникать в ткани, обеспечивая максимальную органопротекторную активность препарата. Двойной путь (печеночный и почечный) элиминации метаболитов фозиноприла имеет значение у больных с почечной и печеночной недостаточностью. Накоплены результаты многочисленных клинических исследований, продемонстрировавших эффективность, хорошую переносимость, безопасность и возможность улучшения прогноза заболевания у больных АГ (табл. 1 ).
Эффективность и переносимость лизиноприла у больных АГ
Препараты лизиноприла, имеющиеся в аптечной сети РФ, представлены в табл. 2 .
Антигипертензивная эффективность и переносимость иАПФ лизиноприла в суточной дозе 10–20 мг изучена у 81 больного АГ I–II степени, в том числе в сочетании с хроническими обструктивными заболеваниями легких (ХОБЛ). Лизиноприл применялся в таблетках по 10 и 20 мг. Начальная доза составила 10 мг однократно в сутки. При недостаточной антигипертензивной эффективности по данным амбулаторных измерений АД доза лизиноприла повышалась до 20 мг однократно в сутки; в дальнейшем при необходимости дополнительно назначали гидрохлортиазид по 25 мг/сут (однократно утром). Продолжительность лечения — до 12 нед.
Всем больным проводилось суточное мониторирование АД (СМАД) с использованием осциллометрических регистраторов Schiller BR 102 по общепринятой методике. По данным СМАД рассчитывали усредненные показатели систолического АД (САД) и диастолического АД (ДАД) в дневные и ночные часы, частоты сердечных сокращений (ЧСС). Вариабельность АД оценивали по стандартному отклонению варьирующей величины. Для оценки суточных изменений АД рассчитывали степень ночного снижения АД, равную процентному отношению разницы среднедневного и средненочного уровня АД к среднедневному. В качестве показателей нагрузки давлением оценивали процент гипертонических величин АД в различные периоды суток (в период бодрствования — более 140/90 мм рт. ст. в период сна — более 125/75 мм рт. ст.).
Критериями хорошей антигипертензивной эффективности лизиноприла служили: снижение ДАД до 89 мм рт. ст. и менее и нормализация среднесуточного ДАД по результатам СМАД; удовлетворительной — снижение ДАД на 10 мм рт. ст. и более, но не до 89 мм рт. ст.; неудовлетворительной — при снижении ДАД менее чем на 10 мм рт. ст.
По данным опроса, осмотра, лабораторных и инструментальных (ЭКГ, исследование функции внешнего дыхания — ФВД) методов исследования у всех больных оценивалась индивидуальная переносимость и безопасность лизиноприла, анализировалась частота развития и характер побочных реакций, время их возникновения в процессе долгосрочной терапии.
Переносимость препаратов оценивалась как хорошая при отсутствии побочных эффектов; удовлетворительная — при наличии побочных эффектов, не потребовавших отмены препарата; неудовлетворительная — при наличии побочных явлений, потребовавших отмены препарата.
Статистическая обработка результатов проводилась с использованием программы Еxcel. Достоверность измерений оценивалась по парному t-критерию Стьюдента при р < 0,05.
На фоне монотерапии лизиноприлом в суточной дозе 10 мг антигипертензивный эффект был отмечен у 59,3% больных. При увеличении дозы лизиноприла до 20 мг/сут эффективность составила 65,4%.
По данным СМАД при длительной непрерывной терапии наблюдалось достоверное снижение среднесуточного АД и показателей гипертонической нагрузки. Снижение показателей гипертонической нагрузки является немаловажным, если принимать во внимание подтвержденную прогностическую значимость этих показателей в отношении поражения органов-мишеней, включая гипертрофию миокарда левого желудочка. Сопоставление результатов, полученных при СМАД, через 4 и 12 нед терапии позволяет сделать вывод о том, что при долгосрочной терапии лизиноприлом не наблюдается развития толерантности к препарату и снижения его антигипертензивной эффективности.
Важным является то, что на фоне терапии лизиноприлом увеличилось число лиц с нормальным суточным профилем АД, значительно снизилось количество больных с профилем АД типа non-dipper. Ни у одного больного не отмечалось чрезмерного снижения САД или ДАД в ночные часы.
Переносимость терапии лизиноприлом в целом была хорошей. У большинства больных на фоне лечения улучшалось самочувствие: уменьшились головные боли, повысилась толерантность к физическим нагрузкам, улучшилось настроение, что свидетельствует о повышении качества жизни больных. Сухой кашель был отмечен в 11,1% случаев, диспепсия — в 1,2%, преходящие умеренные головные боли — в 4,9%. Отмена препарата из-за плохой переносимости потребовалась в 2,4% случаев.
Клинически значимых изменений по данным лабораторных методов исследования на фоне терапии лизиноприлом не отмечено.
Для больных АГ в сочетании с ХОБЛ важным является факт отсутствия негативного влияния антигипертензивных средств на показатели ФВД. Ухудшения показателей ФВД не отмечено, что свидетельствует об отсутствии негативного влияния препарата на тонус бронхов.
Итак, лизиноприл в суточной дозе 10–20 мг характеризуется хорошей переносимостью, низкой частотой побочных эффектов, отсутствием влияния на процессы метаболизма, благоприятным действием на суточный профиль АД. Возможность применения лизиноприла 1 раз в день повышает приверженность больных к терапии и снижает стоимость лечения.
Эффективность и переносимость фозиноприла у больных АГ
Торговые названия препаратов фозиноприла, доступных в аптечной сети РФ, представлены в табл. 2 .
Антигипертензивная эффективность и переносимость иАПФ фозиноприла в суточной дозе 10–20 мг была изучена у 26 больных АГ I–II степени. Фозиноприл применялся в таблетках по 10 и 20 мг. Начальная доза составила 10 мг однократно в сутки с последующим повышением до 20 мг/сут при недостаточной антигипертензивной эффективности по данным амбулаторных измерений АД. В дальнейшем при необходимости дополнительно назначали гидрохлортиазид по 25 мг/сут (однократно утром). Продолжительность лечения составила 8 нед.
Методы оценки эффективности и переносимости длительного лечения больных мягкой и умеренной АГ фозиноприлом были сравнимы с методами, перечисленными выше в исследовании лизиноприла.
СМАД проводилось больным с использованием портативных регистраторов TONOPORT IV, осуществляющих регистрацию АД, либо аускультативным, либо осциллометрическим методом до начала лечения и через 8 нед терапии фозиноприлом по общепринятой методике и с последующим анализом полученных результатов.
На фоне терапии фозиноприлом через 2 нед антигипертензивный эффект был отмечен у 15 (57,7%) больных: у 5 (19,2%) — АД нормализовалось, у 10 (38,5%) — ДАД снизилось более чем на 10% от исходного уровня. Недостаточную эффективность антигипертензивной терапии наблюдали у 11 больных (42,3%), что послужило поводом для увеличения первоначальной дозы фозиноприла. Через 8 нед монотерапии фозиноприлом нормализация ДАД была отмечена у 15 (57,7%) больных. Комбинированная терапия фозиноприлом и гидрохлортиазидом позволила достаточно контролировать АД еще у 8 (30,8%) больных. Неудовлетворительный эффект отмечен у 3 (11,6%) больных. По нашим данным, эффективность монотерапии фозиноприлом зависела от длительности и степени АГ. Так, в группе с низкой эффективностью монотерапии преобладали пациенты с более длительным анамнезом АГ.
По данным СМАД терапия фозиноприлом у больных АГ в течение 2 мес приводила к достоверному уменьшению среднесуточных показателей САД и ДАД без изменения ЧСС. Характер суточных кривых АД после лечения фозиноприлом не изменился. Показатели нагрузки «гипертоническими» величинами в период бодрствования достоверно снизились: для САД — на 39%, для ДАД — на 25% (p < 0,01). В период сна данные показатели уменьшились на 27,24 и 23,13% соответственно (p < 0,01).
В процессе лечения фозиноприлом у больных зарегистрированы следующие побочные эффекты: изжога при приеме фозиноприла в дозе 10 мг на 7-е сутки лечения — у одного больного (3,9%); головокружение и слабость через 1–2 ч после первого приема 10 мг фозиноприла — у одного больного (3,9%); головная боль, слабость после увеличения дозы фозиноприла до 20 мг — у одного больного (3,9%); крапивница, зуд кожных покровов, развившиеся на 11-й день лечения фозиноприлом в дозе 10 мг — у одной больной (3,9%). Эти побочные эффекты, за исключением последнего случая, не потребовали отмены фозиноприла. Жалобы на изжогу отмечены у одного пациента, принимавшего 10 мг фозиноприла утром натощак. После изменения времени приема препарата (после завтрака) изжога больного не беспокоила.
Анализ безопасности терапии фозиноприлом свидетельствует об отсутствии клинически значимых изменений функции почек и печени на фоне терапии фозиноприлом.
Результаты нашего исследования согласуются с данными многочисленных контролируемых исследований эффективности и переносимости терапии фозиноприлом в суточной дозе 10–20 мг и в сочетании с гидрохлортиазидом у больных АГ.
Поиск индивидуального подхода к лечению АГ остается актуальной проблемой кардиологии.
Для практикующего врача важно уметь правильно применить тот или иной препарат в той или иной клинической ситуации. Пролонгированные иАПФ удобны для длительного лечения больных АГ, так как возможность однократного приема препарата в сутки значительно повышает приверженность больных к выполнению назначений врача.
Результаты многочисленных исследований показали, что комбинация иАПФ с диуретиком (либо гипотиазид, либо индапамид) позволяет увеличить эффективность антигипертензивной терапии, особенно у больных с умеренной и выраженной АГ, без ухудшения ее переносимости, при этом возможно снижение суточных доз обоих препаратов.
Достоинствами иАПФ являются мягкое постепенное снижение АД без резких колебаний антигипертензивного эффекта в сочетании с широким спектром органопротекторных эффектов и положительным влиянием на степень сердечно-сосудистого риска.
По вопросам литературы обращайтесь в редакцию.
Ж. М. Сизова. доктор медицинских наук, профессор
Т. Е. Морозова. доктор медицинских наук, профессор
Т. Б. Андрущишина
ММА им. И. М. Сеченова, Москва
Фозиноприл в лечении и профилактике хронической сердечной недостаточности у больных артериальной гипертензией: проблема оптимального выбора ингибитора ангиотензинпревращающего фермента
Е.В. Отрохова
Применение ингибиторов ангиотензинпревращающего фермента при хронической сердечной недостаточности (ХСН) и артериальной гипертензии (АГ) имеет достаточно четкое патогенетическое обоснование. Благодаря удачным клинико-фармакологическим характеристикам фозиноприл является одним из наиболее эффективных и безопасных препаратов этого класса. Проведенные рандомизированные клинические исследования убедительно свидетельствуют о том, что с помощью фозиноприла можно не только успешно лечить самых тяжелых пациентов с АГ и ХСН (пожилых, с сахарным диабетом и/или нарушением функции почек), но и предупреждать развитие сердечно-сосудистых осложнений, в т. ч. ХСН, у лиц с множественными факторами риска.
Введение
В новом тысячелетии проблемы артериальной гипертензии (АГ) и хронической сердечной недостаточности (ХСН) приобрели неожиданную остроту. Эти грозные заболевания связаны общностью причинно–следственных взаимоотношений. Доказано, что АГ является одной из важнейших причин развития ХСН. По данным Фремингемского исследования, среди факторов риска ХСН, таких как гипертрофия левого желудочка (ЛЖ), перенесенный инфаркт миокарда (ИМ), стенокардия напряжения, сахарный диабет (СД), клапанные пороки сердца, повышенное артериальное давление (АД) является наиболее точным предиктором развития этого патологического состояния [1]. В западных странах роль АГ как причины развития ХСН становится ведущей в старших возрастных группах, приводя к нарушению диастолической, а в дальнейшем – и систолической функции миокарда. В нашей стране АГ занимает 80 % в структуре причин ХСН и способствует ее декомпенсации в основном за счет диастолической дисфункции [2]. Так, по данным Российского эпидемиологического исследования ЭПОХА–О–ХСН, доля амбулаторных больных с ХСН и сохраненной фракцией выброса (ФВ) ЛЖ (> 40 %) превышает 80 % [3]. Это связывают не с увеличением числа пожилых лиц, как в Европе, а с широким распространением и неэффективным лечением АГ. В Европейском исследовании EuroHeart Survey HF аналогичный показатель составляет 53 % [4].
В настоящее время не вызывает сомнений прямая взаимосвязь патогенетических механизмов развития и прогрессирования АГ и ХСН. Декомпенсация сердечной деятельности является одним из наиболее опасных осложнений АГ. При АГ гемодинамическая перегрузка приводит к ремоделированию как сердца, так и периферических сосудов. В итоге формируется гипертоническое сердце, что проявляется развитием диастолической, а затем и систолической дисфункции ЛЖ со снижением сердечного выброса. Ремоделирование периферических сосудов сопровождается повышением пред– и постнагрузки, включением почечных механизмов развития ХСН. С современных позиций сердечно–сосудистого континуума ремоделирование сердечно–сосудистой системы рассматривается, во–первых, как осложнение АГ и предвестник клинических проявлений ХСН, а во–вторых, как фактор прогрессирования АГ и предиктор декомпенсации сердечной деятельности [5]. Принимая во внимание, что АГ – один из основных факторов риска сердечно–сосудистого континуума, а ХСН – один из его заключительных этапов, успешное лечение с воздействием на их общую патогенетическую основу, т. е. на ремоделирование, можно рассматривать как профилактику развития сердечной декомпенсации. Помимо гемодинамических механизмов важную роль в прогрессировании как АГ, так и ХСН играет хроническая гиперактивация нейрогормональных систем, которая является не только связующим звеном в патогенезе обоих заболеваний, но и главной составляющей процессов ремоделирования [6]. Поэтому в лечении обеих патологий наиболее оправданно использование нейрогормональных модуляторов, в первую очередь ингибиторов ангиотензинпревращающего фермента (ИАПФ).
Настоящий бум в области изучения различных аспектов АГ и ХСН, а также проведение многоцентровых плацебо–контролируемых клинических испытаний лекарственных средств привели к кардинальному пересмотру национальных и международных рекомендаций по диагностике и лечению АГ и ХСН. Но, несмотря на многочисленные публикации и монографии, изданные в последние годы и посвященные этим проблемам, практикующие врачи по–прежнему испытывают определенные трудности при выборе лекарственных средств, особенно при сочетании нескольких сердечно–сосудистых заболеваний, например АГ и ХСН.
Роль ИАПФ в терапии АГ и ХСН
ИАПФ и в XXI в. остаются одними из наиболее эффективных средств лечения кардиологических больных. Убедительно доказана польза их применения в профилактике сердечно–сосудистых заболеваний, включая ХСН, у больных как с наличием, так и с отсутствием АГ. Лечение ИАПФ у больных АГ ассоциируется со снижением риска развития ХСН в среднем на 16 % [7]. Этот класс препаратов занимает лидирующее положение среди средств лечения ХСН, оказывая модулирующее действие на общие патофизиологические механизмы АГ и ХСН за счет снижения активности ренин–ангиотензин–альдостероновой системы (РААС) путем блокады образования активного ангиотензина–II (А–II), а также активации системы брадикинина. Оценивая роль ИАПФ в терапии ХСН, Braunwald E. (1991) называл их “краеугольным камнем в лечении ХСН”, альфа Cohn J. (1998) – “золотым стандартом терапии”. Четверть века, прошедшую со времени создания первого ИАПФ – каптоприла, ныне называют “эрой ИАПФ”. Фармакологические эффекты ИАПФ при АГ и ХСН качественно одинаковы. В то же время артериальная вазодилатация со снижением постнагрузки и АД играет важную роль при АГ, а венозная вазодилатация со снижением преднагрузки – при ХСН. Замедление процессов ремоделирования сердца имеет особое значение при обоих заболеваниях. Для АГ в первую очередь необходимо улучшение диастолической функции, для ХСН – как диастолической, так и систолической функции ЛЖ. Нефропротективные свойства ИАПФ имеют значение при обоих патологических состояниях, а антиаритмический эффект этого класса препаратов – при ХСН.
Эффективность ИАПФ доказана при любой степени тяжести (функциональном классе – ФК) ХСН: исследования SOLVD–prevention (I ФК), SOLVD–treatment (II ФК), V–HeFT II (III ФК), CONSENSUS (IV ФК). Показано, что ИАПФ снижают риск смерти у больных с ХСН на 23 %. Они являются препаратами первого ряда для лечения ХСН с систолической дисфункцией ЛЖ, т. к. это единственная группа лекарственных средств, способных не только уменьшать проявления ХСН, но и значительно замедлять прогрессирование ремоделирования, улучшать отдаленный прогноз [6]. Подтверждено главенствующее положение ИАПФ в предотвращении и замедлении ремоделирования ЛЖ и у больных с диастолической дисфункцией (исследование PREAMI) [8]. Они положительно влияют на такие параметры ремоделирования, как индексы сферичности и относительной толщины стенок, миокардиальный стресс [9], способствуют поддержанию нормальных ФВ и массы миокарда ЛЖ [10] за счет торможения активации РААС, стабилизации уровня брадикинина и высвобождения оксида азота [11]. Показан и более значительный регресс гипертрофии ЛЖ при лечении ИАПФ по сравнению с другими препаратами [12], обусловленный не только снижением системного АД, но также их антипролиферативным действием на кардиомиоциты и фибробласты миокарда. Поскольку частота ритма, сердечный выброс и давление заклинивания легочных капилляров на фоне применения ИАПФ изменяются незначительно, предполагают их вероятное воздействие непосредственно на расслабление миокарда. Эффект улучшения диастолической функции под влиянием ИАПФ связывают с уменьшением гипертрофии и увеличением “податливости” стенок ЛЖ, снижением постнагрузки и подавлением аномального коллагенообразования в интерстиции путем нейрогуморального воздействия (снижение активности
А–II, альдостерона, блокирование деградации брадикинина, улучшение функции эндотелия). Однако ряд вопросов, касающихся механизмов их положительного влияния при АГ и ХСН, остается открытым.
В серии исследований (AIRE, SAVE, SOLVD, TRACE, V–HeFT и др.) показано антиишемическое действие ИАПФ. Механизмы его еще уточняются, но определенную роль отводят замедлению ремоделирования коронарных артерий, улучшению перфузии субэндокарда при уменьшении конечного диастолического давления ЛЖ или изменении нейрогормональных влияний, стабилизации атеросклеротических бляшек и улучшению эндотелиальной функции вследствие прямого тканевого эффекта ИАПФ [13, 14]. В эксперименте показана возможность новообразования капиллярной сети в миокарде за счет влияния ИАПФ на метаболизм брадикинина.
Считают, что у больных ХСН с сохраненной систолической функцией, как правило, не происходит заметного повышения системного уровня ренина и А–II, но отмечается активация локальной РААС, поэтому у них перспективны ИАПФ с высоким сродством к тканевому АПФ [13]. Однако доказательств эффективности ИАПФ при диастолической ХСН в настоящее время мало. Всего в нескольких исследованиях (HOPE, EUROPA) подтвержден их эффект у больных ИБС без дисфункции ЛЖ [7, 14], а влияние на диастолическое наполнение ЛЖ у больных ХСН изучалось лишь в небольших клинических работах. При этом авторы чаще отмечали благоприятное действие ИАПФ в виде перераспределения кровотока с увеличением в раннюю и уменьшением в позднюю фазы диастолы, что свидетельствует об улучшении активной релаксации миокарда ЛЖ [15, 16].
В то же время имеются указания на противоположные изменения трансмитрального диастолического потока [10] и даже на отсутствие положительной динамики диастолических индексов при длительной терапии эналаприлом, каптоприлом, лизиноприлом, периндоприлом и другими ИАПФ [17, 18]. Вероятным объяснением подобных расхождений может быть разнонаправленный характер изменений трансмитрального диастолического потока в силу наличия исходно не только “гипертрофического”, но и псевдонормального или рестриктивного типов диастолической дисфункции. Полагают также, что эффективность влияния ИАПФ на гипертрофию миокарда и диастолическую релаксацию зависит от наличия у пациентов гена полиморфизма АПФ [19].
Проблема оптимального выбора ИАПФ
В связи с наличием на рынке различных ИАПФ (в России зарегистрировано 12 оригинальных молекул разных препаратов этого класса) возникает вопрос об их оптимальном выборе. При этом для обоснования пользы того или иного ИАПФ необходима вдумчивая и всесторонняя оценка врачом диапазона не только фармакологических свойств, но и имеющихся доказательств его клинической эффективности и безопасности. “Идеальный” ИАПФ должен сочетать высокую, доказанную в клинических исследованиях эффективность и максимальную безопасность, иметь минимум побочных эффектов. Известно, что большое влияние на выбор ИАПФ оказывают привычка и вера врача, социально–экономические факторы (включая стоимость лечения), тяжесть состояния больного, индивидуальная переносимость и т. п.
Хотя принципиальных различий между отдельными ИАПФ не обнаружено, достоверное влияние на симптоматику заболевания, качество жизни, прогноз и безопасность при ХСН доказано в международных исследованиях только для шести препаратов (каптоприл, эналаприл, фозиноприл, лизиноприл, рамиприл, периндоприл) и еще для двух (спираприл, квинаприл) – в многоцентровых российских программах ВНОК и ОССН. В данном обзоре анализируются имеющиеся данные по оценке фармакологических и клинических особенностей фозиноприла, благодаря которым он имеет ряд преимуществ перед другими ИАПФ в лечении и профилактике ХСН у больных с наличием АГ. Не так давно на отечественном фармацевтическом рынке появился препарат Фозикард ® (компания Актавис), который стал первым качественным генерическим аналогом фозиноприла. Высокое качество, эффективность и безопасность Фозикарда ® подтверждены результатами исследования по оценке его биоэквивалентности оригинальному фозиноприлу. Несмотря на то что данный препарат – типичный представитель класса ИАПФ, он имеет определенную структурную особенность – содержит в химической формуле фосфонильную группу. Эта особенность придает ему ряд уникальных свойств, выгодно отличающих его от других препаратов этого класса и позволяющих отнести к третьей (наиболее современной) генерации ИАПФ [20].
Клинико–фармакологические свойства фозиноприла
Фозиноприл является пролекарством, т. е. действует после всасывания и трансформации в активный метаболит – фозиноприлат, который циркулирует в связанном с белками плазмы крови (95–98 %) состоянии с периодом полувыведения (у здоровых лиц) около 12 часов. К достоинствам фозиноприла относят высокое сродство к липидам – индекс липофильности фозиноприлата составляет более 2,0 ЕД, тогда как у периндоприлата он равен 0,872; а у эналаприлата – 0,108 ЕД [21]. Это облегчает проникновение фозиноприлата через клеточные мембраны и позволяет подавлять активность не только циркулирующей, но и тканевой РААС в сердце, легких, почках и головном мозге. Экспериментально показано, что фозиноприлат ингибирует АПФ в сердечной мышце в большей степени, чем рамиприлат и эналаприлат [22], что лежит в основе более выраженного (по сравнению с другими ИАПФ) гипотензивного и кардиопротективного эффектов.
Еще одним важным свойством фозиноприла, нашедшим реальное применение в клинике, является двойной взаимокомпенсирующий путь элиминации. В отличие от каптоприла, эналаприла, лизиноприла и периндоприла, которые выводятся из организма преимущественно почками, для фозиноприла характерны два основных пути элиминации – почечный и печеночный (с желчью) в соотношении 1. 1. Причем при снижении функции почек увеличивается выведение активного метаболита с желчью и, наоборот, при печеночной недостаточности возрастает его экскреция с мочой. По данным специальных фармакокинетических исследований, у пациентов с циррозом печени экскреция фозиноприлата с мочой возрастает в 1,5–2 раза по сравнению со здоровыми лицами, а у больных с почечной недостаточностью в 2–3 раза усиливается печеночный путь выведения. Описанная особенность предопределяет безопасное использование фозиноприла у больных и с печеночной недостаточностью (при алкогольном и особенно билиарном циррозе печени), и с нарушенной функцией почек. Даже при снижении скорости клубочковой фильтрации ниже 15 мл/мин концентрация фозиноприла достоверно не увеличивается, что позволяет рассматривать этот препарат как средство выбора при клинических состояниях, чреватых ухудшением функции почек (тяжелой АГ, сопутствующем СД, метаболическом синдроме), и у пожилых лиц, имеющих в большинстве случаев сопутствующую патологию, включая диабетическую нефропатию. Это свидетельствует о важном практическом преимуществе фозиноприла перед другими ИАПФ – отсутствии необходимости контроля функции почек при назначении и увеличении дозировок, что делает его оптимальным препаратом для амбулаторного лечения. Кроме того, не требуется адаптации и снижения дозы фозиноприла у пожилых пациентов, поскольку у больных 65–74 лет с клинически нормальной функцией печени и почек не отмечено изменений в фармакокинетике фозиноприлата по сравнению с молодыми пациентами (20–35 лет).
Наибольшее значение имеет высокая безопасность фозиноприла.
Как известно, основными побочными эффектами, ограничивающими назначение ИАПФ и снижающими приверженность лечению, наряду с ухудшением функции почек являются кашель и гипотония первой дозы, особенно у больных, перенесших острый ИМ и имеющих симптомы ХСН. Кашель у лиц, получающих ИАПФ, обусловлен блокадой разрушения брадикинина и некоторых других нейромедиаторов в слизистой оболочке бронхов. Его появление, непосредственно связанное с приемом ИАПФ, обычно служит показанием к замене ИАПФ препаратом из группы блокаторов рецепторов к А–II. Реальной альтернативой в данном случае также может служить фозиноприл. Имеются доказательства того, что сухой кашель, вызываемый другими ИАПФ, ослабевает или даже полностью исчезает при переходе на фозиноприл. Например, в двойном слепом сравнительном исследовании с эналаприлом показано достоверно более редкое возникновение кашля при назначении фозиноприла. В это исследование были включены 179 больных, уже прекративших прием ИАПФ из–за развития кашля. Попытка возобновления лечения была гораздо более успешной при выборе фозиноприла – повторное развитие кашля наблюдалось более чем вдвое реже по сравнению с эналаприлом [20]. При применении фозиноприла реже встречаются и другие нежелательные явления.
Еще в одном двойном слепом исследовании проводилось прямое сравнение одинаковых дозировок фозиноприла и эналаприла (5–20 мг однократно в сутки) при лечении больных ХСН. При этом число пациентов с гипотонией первой дозы, получавших фозиноприл, было в четыре раза меньше, чем при терапии эналаприлом. Кроме того, при применении фозиноприла в этом исследовании выявлено достоверно большее снижение риска комбинированной конечной точки (смерть + утяжеление декомпенсации).
Фозиноприл отличает и удобный режим дозирования – однократный прием обеспечивает 24–часовой контроль АД (соотношение остаточного к пиковому эффекту – 64 %) и предотвращает его повышение в ранние утренние часы. Начальная суточная доза фозиноприла при АГ составляет 10 мг однократно с возможным последующим увеличением до 20–40 мг. При ХСН начальная суточная доза – 5–10 мг (у больных с гипотонией – 2,5–5 мг), средняя терапевтическая – 10–20 мг, максимальная – 20–40 мг.
Клинические исследования эффективности фозиноприла
Высокая эффективность фозиноприла при АГ подтверждена в международных и российских исследованиях. По данным исследования FOPS, он эффективно снижает АД у 80 % больных, причем у пациентов с мягкой и умеренной АГ это не сопровождается компенсаторной тахикардией. Проведенный мета–анализ показал, что антигипертензивная активность фозиноприла прогрессивно увеличивается на протяжении первых нескольких недель лечения вплоть до достижения целевых уровней АД без проявления элементов компенсаторных нарушений сердечного ритма, а отмена препарата не вызывает быстрого подъема АД. Эффективность фозиноприла, как правило, не зависит от возраста, пола и массы тела [23, 24].
По гипотензивной активности фозиноприл достоверно не уступает диуретикам, бета–адреноблокаторам, антагонистам кальция и другим ИАПФ, но отличается лучшей переносимостью и меньшим числом клинических и биохимических побочных эффектов, особенно в “группах риска” – у пожилых лиц или больных СД, что было продемонстрировано в исследовании FACET, в котором эффективность и безопасность фозиноприла и антагониста кальция амлодипина сопоставлялись у больных с инсулиннезависимым СД и АГ [25]. За три года терапии при удовлетворительном и примерно равном контроле АД в группе фозиноприла было достоверно меньше летальных исходов, ИМ и инсультов, чем на фоне терапии амлодипином (14 против 27 %; p = 0,027). В исследовании FLIGHT по изучению эффективности фозиноприла у 19 432 больных АГ (989 из них старше 75 лет) целевое АД через 12 недель от начала лечения достигнуто у 79,8 % пациентов [26].
В рамках российской программы ФЛАГ (Фозиноприл при Лечении Артериальной Гипертонии) оценивалась вероятность достижения целевых уровней АД у больных с мягкой и умеренной АГ в амбулаторных условиях при монотерапии фозиноприлом (10–20 мг/сут) или его сочетании с гидрохлоротиазидом. Всего в исследование были включены 2557 пациентов, из которых 26,7 % составили лица старше 60 лет. Целевое АД достигнуто у 62,1 % пациентов. Побочные эффекты отмечены у 8,3 % больных, причем только у 5,2 % потребовалась отмена препаратов [27].
В исследование ФАГОТ (Фармакоэкономическая оценка использования ИАПФ фозиноприла в амбулаторном лечении больных Артериальной Гипертонией Осложненного Течения) были включены 2596 пациентов с мягкой или умеренной АГ и наличием двух факторов риска сердечно–сосудистых осложнений. Сравнивалась эффективность монотерапии фозиноприлом или его сочетания с гидрохлоротиазидом и общепринятой терапии (диуретиками, бета–адреноблокаторами, антагонистами кальция) у пациентов разного возраста. Целевое АД при приеме фозиноприла и гидрохлоротиазида достигнуто у 67,8 % пациентов. Показано, что скорость достижения гипотензивного эффекта и его выраженность при применении фозиноприла не различаются у пациентов пожилого и молодого возраста, но выше, чем при использовании традиционной схемы лечения. По сравнению с другими препаратами фозиноприл выгодно отличала простота приема и затратная экономичность [28].
Во многих исследованиях эффективность фозиноприла доказана и при ХСН. Показано, что фозиноприл не только повышает толерантность к нагрузкам и снижает ФК декомпенсации (исследование FEST), но и существенно замедляет прогрессирование ХСН. Терапия фозиноприлом ассоциируется с большей эффективностью, безопасностью и наилучшим соотношением стоимость–эффективность, чем применение других ИАПФ, в частности эналаприла. В исследовании ФАСОН (Фармакоэкономическая оценка использования ИАПФ в Амбулаторном лечении больных с Сердечной Недостаточноcтью), которое включало 1945 больных ХСН II–III ФК, в группе пациентов с сочетанием АГ и ХСН снижение систолического АД составило 12,5 %, диастолического – 11 %, а целевое АД достигнуто у 72 % пациентов [29]. При этом затраты на лечение снижались на 54 %.
К факторам, обеспечивающим преимущество фозиноприла перед другими ИАПФ у больных ХСН, относят и его уникальную способность снижать уровень эндотелина – вазоконстрикторного нейропептида, являющегося предиктором неблагоприятного прогноза больных с декомпенсацией [20]. Возможно, что этот механизм наряду с известными “классическими” путями воздействия ИАПФ (блокадой синтеза А–II, замедлением разрушения брадикинина) обеспечивает фозиноприлу высокую эффективность при применении у больных острым ИМ. В рандомизированном плацебо–контролируемом исследовании FAMIS показано, что раннее (менее 24 часов) присоединение фозиноприла к тромболитической терапии у пациентов с передним острым ИМ приводит к достоверному снижению частоты смертельных исходов и случаев развития тяжелой ХСН (III–IV ФК) на 36,2 % [30].
В результате проведенных клинических исследований получены доказательства возможности использования фозиноприла не только в лечении АГ и ХСН, связанных общностью патогенетических механизмов развития, но и в профилактике прогрессирования сердечной декомпенсации у больных с высоким риском сердечно–сосудистых осложнений. Высокая липофильность фозиноприла, позволяющая ему хорошо проникать в ткани, способность влиять на уровень вазоконстрикторных субстанций (эндотелина) обеспечивают максимальную органопротекторную активность фозиноприла. Как следствие этого – проявляются дополнительные эффекты, отличающие этот препарат от других ИАПФ. Например, в исследовании PHYLLIS доказана способность фозиноприла достоверно замедлять развитие атеросклероза сонных артерий и предотвращать увеличение соотношения интима–медиа стенки сонных артерий у больных АГ с бессимптомным атеросклеротическим поражением каротидного бассейна [31]. Это открывает перспективы к применению данного ИАПФ в лечении больных с атеросклерозом и для снижения риска мозгового инсульта у лиц с АГ и поражением сонных артерий.
Особый интерес представляет исследование PREVEND–IT, в котором доказано, что благодаря нефропротективным свойствам фозиноприл может использоваться в качестве средства первичной профилактики у больных АГ с микроальбуминурией. Кроме того, он предотвращает риск сердечно–сосудистых осложнений: его применение в течение 4 лет у пациентов с микроальбуминурией > 50 мг/24 часа приводило к достоверному снижению риска мозгового инсульта и комбинированной точки, включавшей сумму смертей и госпитализаций в связи с ухудшением состояния [32].
Заключение
Таким образом, с помощью фозиноприла, одного из наиболее эффективных и безопасных представителей класса ИАПФ, можно не только успешно лечить самых тяжелых пациентов с АГ и ХСН (пожилых, с СД, нарушенной функцией почек), но и предупреждать развитие сердечно–сосудистых осложнений, в т. ч. ХСН, у лиц с множественными факторами риска. Поэтому с целью эффективного замедления неуклонного движения больных по сердечно–сосудистому континууму необходимо как можно более раннее назначение этого препарата больным АГ для лечения и профилактики прогрессирования ХСН. Крайне интересной представляется возможность применения фозиноприла с целью воздействия на диастолические расстройства и ремоделирование как процессы, лежащие в основе развития и прогрессирования ХСН у больных АГ. Несмотря на имеющуюся доказательную базу и уникальные фармакокинетические особенности, данный препарат пока мало изучен в этом плане, что может определить перспективы дальнейших исследований его эффектов у больных с сочетанием АГ и ХСН.
Эффективность фозиноприла в лечении артериальной гипертензии
История антигипертензивной терапии насчитывает более 50 лет. За этот период трансформировались взгляды на стратегию и тактику лечения гипертонической болезни, постоянно совершенствовались препараты, появлялись новые классы антигипертензивных средств.
Изучение влияния ренин-ангиотензиновой системы (РАС) на различные заболевания сердечно-сосудистой системы положило начало новым фармакологическим исследованиям. Поиск вещества, которое способно блокировать ангиотензин II – основной компонент РАС – увенчался успехом, и в 1975 г. под руководством D. Cushman и M. Ondetti был синтезирован каптоприл. Каптоприл стал основным препаратом нового класса – ингибиторов ангиотензинпревращающего фермента (АПФ), который кардинально изменил терапевтические возможности кардиологии.
За 30 лет использования в кардиологии ингибиторы АПФ стали одним из основных средств лечения и профилактики артериальной гипертензии (АГ), сердечной недостаточности, инфаркта миокарда, диабетической нефропатии. Область применения ингибиторов АПФ постоянно расширяется за счет новых перспективных направлений. Главное преимущество ингибиторов АПФ – способность снижать смертность и увеличивать продолжительность жизни больных с сердечно-сосудистыми заболеваниями.
Ингибиторы АПФ обладают особой химической структурой, позволяющей им взаимодействовать с атомом цинка в молекуле АПФ и тормозить активность превращения ангиотензина I в биологически активный ангиотензин II в плазме и тканях, чем и обусловлено фармакологическое действие всех ингибиторов АПФ на функциональное состояние РАС.
Ингибиторы АПФ, уменьшают образование ангиотензина II, что приводит к устранению его неблагоприятного действия на сердечно-сосудистую систему. Антигипертензивное действие ингибиторовАПФ, с одной стороны, связано с уменьшением образования вазоконстрикторных веществ (ангиотензина II, а также норадреналина, аргинин-вазопрессина, эндотелина-1), с другой – с увеличением образования или уменьшением распада вазодилатирующих веществ (брадикинина, ангиотензина-(1-7), оксида азота, простагландинов Е2 и I2), таким образом, происходит изменение баланса вазоактивных соединений в пользу сосудорасширяющих биологически активных веществ.
Ингибиторы АПФ являются не только эффективными антигипертензивными средствами, но и благоприятно влияют на внутрипочечную гемодинамику. При длительном применении эти препараты оказывают позитивное действие на два основных фактора прогрессирования почечной патологии до стадии терминальной почечной недостаточности – внутриклубочковую гипертонию и тубулоинтерстициальный фиброз. Они ослабляют вазоконстрикторное влияние ангиотензина ІІ на эфферентные (выносящие) артериолы почечных клубочков, что ведет к увеличению почечного плазмотока и снижению повышенного внутриклубочкового давления. Кроме того, уменьшая проницаемость стенки клубочковых капилляров, ингибиторы АПФ способствуют снижению экскреции альбуминов с мочой. Они уменьшают реабсорбцию натрия и воды в проксимальных почечных канальцах. Снижая секрецию альдостерона, ингибиторы АПФ косвенным образом уменьшают реабсорбцию натрия в обмен на ионы калия в дистальных почечных канальцах [2, 5].
Ингибиторы АПФ вызывают структурные изменения стенки артерии: уменьшение гипертрофии гладкомышечных клеток с ограничением количества избыточного коллагена. На фоне лечения ингибиторами АПФ достоверно увеличивается просвет периферических артерий, обратному развитию подвергается гипертрофия мышечной оболочки артерий и артериол, что связано с торможением миграции ипролиферации гладкомышечных клеток, со снижением образования в эндотелии сосудов эндотелина, оказывающего влияние на продукцию фактора роста эндотелия. Тканевые эффекты ингибиторов АПФ проявляются уменьшением гипертрофии миокарда с изменением соотношения миоцитов и коллагена в пользу миоцитов [8].
Многогранность положительного воздействия ингибиторов АПФ на сердечно-сосудистые заболевания и другие патологические состояния определяет их широкое использование в клинической практике.
В настоящее время известно уже около 50 химических соединений, относящихся к классу ингибиторов АПФ, которые отличаются по содержанию определенных химических групп в молекуле, по месту биотранстформации, по фармакокинетическим свойствам и пути элиминации.
Большинство ингибиторов АПФ, синтезированных после каптоприла не содержат SH-группы, и связываются с активным центром ангиотензинпревращающего фермента своей карбоксильной группой. Поиск более эффективных, безопасных и экономичных ингибиторов АПФ привел к созданию в середине 80-х годов в Научно-исследовательском институте американской фармацевтической компании “Bristol-Myers Squibb” под руководством D. Cushman фозиноприла натрия (моноприла). Кардинальным отличием фозиноприла от других ингибиторов АПФ является наличие в химической формуле остатков фосфинильной кислоты. Эта особенность структуры придает препарату ряд уникальных свойств, отличающих его от других препаратов этого класса, и позволяет отнести его к третьей, наиболее современной генерации ингибиторов АПФ [3].
Фозиноприл является пролекарством и действует после всасывания и трансформации (в печени, слизистой желудочно-кишечного тракта, почках, кровяном русле) в активный метаболит – фозиноприлат, который связывается с белками плазмы крови (95–98 %). Конечный период полужизни фозиноприла в плазме составляет 12–15 ч, что обусловливает его длительное антигипертензивное действие [1].
Препарат отличается чрезвычайно высокой липофильностью, что позволяет подавлять чрезмерную активность РАС – не только циркулирующей, но и тканевых РАС.
Важной отличительной особенностью фозиноприла является сбалансированный двойной путь выведения из организма – почечная экскреция с мочой и печеночная деградация активных метаболитов с последующим их удалением с желчью через кишечник. Оба пути примерно одинаково участвуют в выведении фозиноприла и компенсируют друг друга: при снижении функции почек возрастает печеночная фракция выведения и, наоборот, уменьшение печеночного клиренса компенсируется увеличением печеночной экскреции препарата. Такой механизм выведения обеспечивает безопасность применения у всех категорий больных, в том числе у пожилых и у пациентов с сопутствующей почечной и печеночной недостаточностью [4, 9, 10].
Нефросклероз является одним из тяжелых осложнений АГ. Развиваясь постепенно, поражение почек при АГ долгое время остается незамеченным, поскольку клинически не вызывает у больного ощущений дискомфорта. И только на выраженной (нередко терминальной) стадии патологии почек у больного появляются жалобы, связанные с интоксикацией организма продуктами метаболизма белков. Трудности лечения гипертонической почки на поздних стадиях ее развития побудили искать методы ранней диагностики поражения почек у больных с гипертонической болезнью. Существуют два показателя повышенного риска развития гипертонического ангионефросклероза – клубочковая гиперфильтрация и микроальбуминурия.
На сегодняшний день микроальбуминурия должна рассматриваться не только как маркер повреждения почек, но и как фактор, определяющий прогноз. Появление протеинурии указывает на значительный деструктивный процесс в почках, при котором около 50–75 % клубочков уже склерозированы, а морфологические и функциональные изменения приняли необратимый характер. Убедительные данные современных исследований не оставляют сомнений в том, что риск возникновения смерти от сердечно-сосудистых заболеваний тесно связан с наличием микроальбуминурии. Вот почему основная задача заключается в своевременной диагностике нефроангиосклероза и проведении адекватной патогенетической терапии. Подтверждением этого положения служит двойное слепое плацебо-контролированное исследование PREVEND-IT с 4-факториальным дизайном, целью которого было показать взаимосвязь уменьшения микроальбуминурии и замедления прогрессирования сердечно-сосудистых и почечных заболеваний [6]. Под наблюдением в течение 4 лет находились 864 пациента в возрасте 28–75 лет, с уровнем артериального давления (АД) менее 160/100 мм рт. ст. не получавшие ранее антигипертензивную терапию, с уровнем общего холестерина менее 8,0 ммоль/л (у пациентов, перенесших инфаркт миокарда, – менее 5,0 ммоль/л) и не принимавшие статины. Проводили сравнение эффективности правастатина и плацебо и фозиноприла и плацебо по влиянию на микроальбуминурию и первичную конечную комбинированную точку (смерть, госпитализация по поводу сердечно-сосудистых заболеваний и терминальная стадия почечной недостаточности). Выделенные группы статистически достоверно не различались по возрасту, полу, основным факторам риска развития ишемической болезни сердца и исходному уровню альбуминурии.
Результаты исследования показали, что уменьшение экскреции альбумина с мочой в группе пациентов, принимавших фозиноприл, по сравнению с контрольной группой, достигалось быстро – уже через 3 мес лечения. Это уменьшение было статистически достоверно и составило 29,5 %. Статистически достоверно сниженный уровень экскреции альбумина поддерживался в группе фозиноприла на протяжении всех 4 лет наблюдения, различие по группам к окончанию исследования составило 31,4 % (Р<0,05). Значимых изменений микроальбуминурии у пациентов, принимавших правастатин и плацебо, выявить не удалось. В группе фозиноприла было зарегистрировано значительно меньшее количество случаев сердечно-сосудистой смерти и повторных госпитализаций по поводу инфаркта миокарда, сердечной недостаточности и других сердечно-сосудистых осложнений. У пациентов, получавших правастатин, число случаев сердечно-сосудистых осложнений, смертей и повторных госпитализаций было на 13 % ниже, чем в группе контроля, но выше, чем у больных, принимавших фозиноприл. Корреляционный анализ показал, что данное снижение числа сердечно-сосудистых осложнений не может быть обусловлено разницей в снижении уровней систолического (САД) и диастолического (ДАД) АД в группе больных, принимавших фозиноприл, по сравнению с группой больных, принимавших правастатин. Выявленная высокая эффективность ингибитора АПФ фозиноприла у больных с АГ и сахарным диабетом при наличии микроальбуминурии подтверждает обоснованность его использования как препарата первого ряда.
Фозиноприл обладает хорошей переносимостью, его применение характеризуется минимальной частотой возникновения побочных эффектов, в том числе кашля.
Основная цель лечения больного с АГ – достижение целевого уровня АД. При этом предполагается, что адекватный контроль АД в течение 24 ч приведет к значительному снижению риска развития любого сердечно-сосудистого исхода. Одним из подтверждений теоретического обоснования такого подхода явились результаты исследованияHOT, которые показали, что при должном контроле со стороны врача и использовании комбинированного лечения достижение целевого (необходимого) уровня снижения АД – во многих случаях вполне реальная задача [7].
Изучение возможности контроля АД в соответствии с рекомендациями ВОЗ (1999) у больных с АГ (мягкой и умеренной степени) в амбулаторных условиях с помощью фозиноприла стало основной целью программы “Фозиноприл при лечении АГ” по оценке практического достижения целевых уровней АД (исследование “ФЛАГ–Украина”). В исследовании участвовали 586 больных из 8 регионов Украины (Киев, Винница, Донецк, Днепропетровск, Луганск, Львов, Одесса, Харьков).
Целью нашего исследования в рамках проведения проекта “ФЛАГ– Украина” было изучение клинической эффективности и переносимости фозиноприла при лечении больных с мягкой и умеренной артериальной гипертензией по результатам суточного мониторирования артериального давления.
Материал и методы
Под наблюдением находились 30 больных с мягкой и умеренной АГ, в возрасте в среднем (53,08±8,19) года, с длительностью заболевания (8,50±5,84) года. Согласно критериям исключения больных из исследования, не допускалось наличие острых и хронических заболеваний бронхолегочной системы, желудочно-кишечного тракта, нервной системы, гематологических, эндокринологических и аутоимунных заболеваний, тяжелых расстройств функции печени, почек, тяжелой или злокачественной АГ, всех форм вторичных АГ, инфаркта миокарда, острого нарушения мозгового кровообращения, сердечной недостаточности, стеноза устья аорты, нарушений ритма сердца, злокачественных новообразований.
Оценивали исходную тяжесть гипертонической болезни и соответствие критериям включения в исследование и исключения из него, подтверждающее возможность проведения монотерапии. За 7 дней до включения в исследование пациентам отменяли предшествующую антигипертензивную терапию.
Исследование было разделено на 4 периода. Всем больным до начала лечения, а также через 4, 8 и 12 нед проводили суточное мониторирование АД (СМАД) с помощью аппарата “Мeditech” (Венгрия). Анализировали следующие показатели СМАД: среднее САД и ДАД за сутки, в дневное и ночное время; вариабельность АД во время бодрствования и сна. Нагрузку давлением оценивали по индексу времени (ИВ) гипертензии (проценту измерений АД выше 140/90 мм рт. ст. в дневное время и 120/80 мм рт. ст. в ночное) и индексу площади (ИП), определяемому по площади фигуры между кривыми повышенного и нормального АД. Вариабельность АД в периоды бодрствования и сна определяли по индексу вариабельности, рассчитанному в виде среднеквадратичного значения разности между последовательными измерениями АД. Выраженность двухфазного ритма оценивали по суточному индексу (СИ) – проценту снижения АД в период сна по сравнению с периодом бодрствования.
Основным критерием нормализации АД по данным СМАД считали снижение среднесуточного ИВ ниже 25 %, критерием удовлетворительного эффекта – снижение среднесуточного ИВ на 50 % и более по сравнению с исходным.
Фозиноприл назначали перорально в дозе 10 мг/сут, коррекцию дозы проводили через 4 нед. При недостаточном антигипертензивном эффекте дозу увеличивали до 20 мг/сут и/или добавляли гидрохлоротиазид в дозе 12,5 мг/сут. Курс лечения составил 12 нед.
Результаты и их обсуждение
Через 4 нед лечения, когда доза фозиноприла составляла у всех больных 10 мг/сут, достоверно (Р<0,05) уменьшилось среднее САД в дневные часы. Ночью и в течение суток отмечали недостоверную тенденцию к уменьшению САД. Снижение ДАД было аналогичным. В конце периода наблюдения в исследуемой группе наблюдали достоверное (Р<0,05) снижение САД и ДАД как в целом за сутки, так в дневное и ночное время (рис. 1, 2).

Рис. 1. Динамика систолического АД под влиянием фозиноприла по результатам суточного мониторирования АД. сут – средние показатели за сутки, д – в дневное время, н – в ночное время.

Рис. 2. Динамика диастолического АД под влиянием фозиноприла по результатам суточного мониторирования АД.
Согласно критериям эффективности лечения степень снижения среднедневного АД через 3 мес приема фозиноприла была наиболее выраженной, и показатели среднедневного АД соответствовали норме – менее 135/85 мм рт. ст. причем целевой уровень в разные периоды суток был достигнут и у больных с исходно более тяжелой степенью повышения АД.
Исследования последних лет показали, что не только абсолютные значения АД, но и длительность его повышения в течение суток являются важными факторами риска развития сердечно-сосудистых осложнений. W. White и соавторы установили, что корреляционная связь индекса массы миокарда левого желудочка, максимальной скорости наполнения левого желудочка, размера левого предсердия с показателями нагрузки давлением была более тесной, чем с абсолютными показателями АД.
При проведении СМАД эффективность лечения антигипертензивными препаратами оценивается не только по степени снижения уровня АД, но и по динамике ИВ и ИП. На фоне проводимого лечения через 4 нед эти показатели достоверно (Р<0,05) уменьшились, однако на этом этапе лечения не достигли полной нормализации, в связи с чем у 36,6 % пациентов к терапии фозиноприлом был добавлен гидрохлоротиазид в дозе 12,5 мг/сут.
После индивидуальной коррекции дозы фозиноприла к концу исследования показатели нагрузки давлением – ИВ и ИП достоверно и значительно уменьшились (рис. 3, 4).

Рис. 3. Динамика индекса времени по систолическому АД под влиянием фозиноприла.

Рис. 4. Динамика индекса площади по диастолическому АД под влиянием фозиноприла.
По ДАД за все периоды суток ИВ и ИП полностью нормализовались, что очень важно для снижения риска повреждения органов-мишеней. По САД эти показатели уменьшились более чем на 50 %, однако не достигли нормальных значений при адекватной антигипертензивной коррекции, особенно в период бодрствования. На протяжении всего периода наблюдения частота сокращений сердца практически не изменилась.
Важным позитивным свойством препарата является то, что фозиноприл не оказывал негативного влияния на физиологический двухфазный циркадный ритм АД, который оценивали по СИ, и корригировал нарушения циркадного ритма АД.
Высокая вариабельность АД является независимым фактором риска поражения органов-мишеней, в связи с чем одним из требований к антигипертензивному препарату является отсутствие неблагоприятного влияния на вариабельность АД. На фоне лечения фозиноприлом индекс вариабельности по САД достоверно уменьшился: до лечения составлял (16,92±0,69), после лечения – (12,36±0,59). По ДАД индекс вариабельности не изменился.
Многочисленные исследования свидетельствуют о том, что большинство сердечно-сосудистых катастроф приходится на ранние утренние часы, когда отмечается физиологическая активация симпатоадреналовой и РАС, повышение агрегационной cпособности тромбоцитов, снижение фибринолитической активности крови, повышение тонуса сосудов, в том числе венечных и мозговых артерий. Эти физиологические реакции, безопасные для здорового человека, приобретают критическое значение у больных с сердечно-сосудистыми заболеваниями. Выраженное повышение АД в утренние часы, являясь закономерным у нелеченных больных, в сочетании с нейрогуморальными изменениями повышает у пациентов с АГ риск возникновения тромбозов и ишемических осложнений со стороны головного мозга и сердца. Поэтому важно при проведении антигипертензивной терапии адекватное назначение препарата в течение суток с обязательным контролем величины утреннего подъема АД.
Анализ результатов исследования показал, что величина утреннего подъема САД через 12 нед приема фозиноприла достоверно уменьшилась с (55,43±3,86) до (42,38±3,05) мм рт. ст. ДАД – с (41,76±3,28) до (33,86±2,42) мм рт. ст. (рис. 5).

Рис. 5. Величина утреннего подъема АД под влиянием фозиноприла. ВУП – величина утреннего подъема.
В течение всего периода наблюдения отмечали хорошую переносимость препарата, побочных реакций не было ни у одного больного.
Таким образом, проведенное клиническое исследование показало высокую эффективность фозиноприла в снижении АД у пациентов с АГ, как мягкой, так и умеренной степени, что в сочетании с уменьшением показателей нагрузки давлением является свидетельством адекватного 24-часового контроля уровня АД и способствует уменьшению риска возникновения сердечно-сосудистых катастроф. Важным свойством фозиноприла является его способность обеспечивать выраженный антигипертензивный эффект на протяжении суток и, что особенно важно, контролировать АД в ранние утренние часы. Для достижения целевого уровня АД у 36,6 % пациентов на фоне приема фозиноприла в дозе20 мг/сут потребовалось добавление гидрохлоротиазида – в дозе 12,5 мг/сут.
К концу 90-х годов прошлого века были накоплены убедительные доказательства эффективности использования комбинации двух антигипертензивных препаратов с разным механизмом действия для начальной терапии АГ вместо монотерапии. Крупные рандомизированные исследования (HOT, LIFE, INVEST) показали, что для достижения целевого уровня и контроля за АД у большинства больных потребовалась комбинация двух, а иногда и трех антигипертензивных средств.
Наиболее оптимальный способ проведения комбинированной терапии – применение фиксированных комбинаций антигипертензивных средств. Такая форма назначения имеет несомненные преимущества: простота и удобство применения пациентом; повышение приверженности пациентов к лечению; снижение числа побочных эффектов за счет снижения дозы препарата и компенсирования нежелательного действия одного препарата другим; исключение из лечения нерациональных комбинаций; снижение стоимости лечения; простота титрования.
Наиболее часто назначаемая и рациональная комбинация при лечении АГ – комбинация ингибитора АПФ и диуретика. В рекомендациях ВОЗ (1999), МОГ/МОК (2003) отмечается высокая эффективность и безопасность данной комбинации. Ингибитор АПФ индуцирует большее снижение АД тогда, когда происходит активация РАС. Диуретики способствуют уменьшению объема циркулирующей плазмы крови, увеличивая натрийурез, что вызывает повышение продукции ренина, а ингибитор АПФ помогают преодолеть реактивный выброс ренинав ответ на прием диуретика. В число известных комбинаций ингибитора АПФ и диуретика входит фиксированная комбинация 20 мг фозиноприла и 12,5 мг гидрохлоротиазида. Таким образом, перед практическими врачами открывается возможность использования комбинированной антигипертензивной терапии в ее новой, оптимальной форме.
Литература
- Агеев Ф.Т. Мареев В.Ю. Моноприл (фозиноприл) в лечении сердечно-сосудистых заболеваний // Рус. мед. журн. – 2000. – Т. 8. – С. 11-16.
- Преображенский Д.В. Сидоренко Б.А. Романова Н.Е. Шатунова И.М. Клиническая фармакология основных классов антигипертензивных препаратов // Consilium medicum. – 2000. – Т. 2, № 3. – С. 99-127.
- Преображенский Д.В. Савченко М.В. Кектев В.Г. Сидоренко Б.А. Фозиноприл – первый представитель нового поколения ингибиторов ангиотензинпревращающего фермента // Кардиология. – 2000. – № 5. – C. 75-81.
- Преображенский Д.В. Сидоренко Б.А. Ингибиторы АПФ в лечении поражений почек различной этиологии // Рус. мед. журн. – 1998. – № 24. – С. 19-25.
- Чернов Ю.Н. Батищева Г.А. Проворотов В.М. и др. Ингибиторы АПФ: особенности клинического применения // В мире лекарств. – 1999. – С. 13-21.
- Folkert W. et al. Effects of fosinopril and pravastatin on cardiovascular events in subjects with microalbuminuria // Circulation. – 2004. – Vol. 2. – P. 110.
- Hansson L. et al. for the HOT Study Group. Effects of intensive blood pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial // Lancet. – 1998. – Vol. 351. – P. 1755-1762.
- Johnston C.I. Tissue angiotensin-converting enzyme in cardie and vascular hypertrophy, repair and remodeling // Hypertension. – 1994. – Vol. 23. – P. 258-268.
- Levinson B. Graney W.F. De Vault A.R. et al. Age is not reason for dose adjustment for fosinopril in hypertension // Amer. J. Hypertension. – 1989. – Vol. 2. – P. 8.
- Me Areavey D. Robertson J.I.S. Angiotensin-converting enzyme inhibitors and moderate hypertension // Drugs. – 1990. – Vol. 40. – P. 326-345.