Физиологические причины
Любое увеличение нагрузки на организм приводит к возрастанию частоты сердечных сокращений, в этом случае речь идет о физиологической аритмии, которая не требует вмешательства. Ее может вызывать:
- физическая активность;
- эмоциональное напряжение и волнение;
- обильная еда и прием алкоголя;
- курение;
- употребление напитков, содержащих кофеин;
- повышение температуры тела.

В некоторых случаях частота сердечных сокращений изменяется в зависимости от дыхательного цикла, это состояние называется дыхательной аритмией и является вариантом нормы.
Идиопатическая аритмия
Опасность идиопатической аритмии заключается в том, что она может развиться внезапно, на фоне полного здоровья. Как правило, в ее основе лежит наличие дополнительных путей проведения нервного импульса, которые невозможно определить при обычном обследовании. Под действием каких-либо внешних факторов запускается патологический механизм и возникает нарушение ритма. Обсуждается и роль наследственной предрасположенности.
Аритмии могут быть вызваны заболеваниями сердца или патологией любых других органов. В некоторых случаях они связаны с приемом лекарственных препаратов или употреблением алкоголя и кофеин-содержащих напитков. Вне зависимости от механизма развития нарушения ритма, лечение, прежде всего, направлено на устранение провоцирующего фактора. Если это оказывается неэффективным, назначают специальные лекарственные препараты.
От «идиопатических» аритмий к синдрому ДКМП: единство нозологической структуры и подходов к лечению
Недоступ А.В. Благова О.В.
Введение
Два синдрома. которые вынесены в название статьи, на первый взгляд могут представляться весьма далекими друг от друга. Действительно, больных с «идиопатическими» аритмиями нередко называют пациентами «со здоровым сердцем», в то время как под дилатационной кардиомиопатией (ДКМП), несмотря на все терминологические дискуссии, на практике часто подразумевают терминальную стадию различных заболевания сердца с дилатацией его полостей и падением сократимости, т.е. по сути «большое сердце». Однако при ближайшем рассмотрении между указанными группами больных оказывается много общего.
При современной узкой специализации даже внутри одной терапевтической дисциплины (здесь – кардиологии) этими проблемами нередко занимаются разные специалисты. Если в первом случае это аритмологи. в т.ч. интервенционные, которые во многих российских центрах располагают специализированными отделениями. то в случае синдрома ДКМП ситуация сложнее. Крупных центров и институтов, которые на современном уровне занимались бы проблемой некоронарогенных заболеваний миокарда (НКЗМ), в России практически нет; отделения со специализацией в этом направлении единичны. Такие больные попадают в общекардиологические стационары либо в отделения. которые занимаются лечением хронической сердечной недостаточности (ХСН) как общего исхода многих заболеваний.
Вместе с тем, уровень развития проблемы требует, с одной стороны, определенной специализации (не только возможности выполнения морфологического, вирусологического, иммунологического и ряда других исследований, но и опыта в работе с подобными больными), с другой, что не менее важно, – целенаправленного объединения усилий разных специалистов: терапевтов-кардиологов, кардиохирургов, реаниматологов, инфекционистов, генетиков, иммунологов, морфологов, специалистов по лучевой диагностике и др. В данной работе мы проводим анализ собственного опыта работы с двумя полярными группами больных с НКЗМ, накопленного в ходе такого сотрудничества, и касаемся некоторых общих вопросов.
Вопросы терминологии и классификации
Понятию «идиопатические аритмии» ; более 50 лет; закрепился термин «lone (изолированная) atrial fibrallation» [W. Evans и P. Swann, 1954]. Под идиопатическими понимают аритмии у больных (как правило, моложе 60 лет) без структурных изменений сердца; аритмии с неустановленной этиологией. Наиболее строгое определение подразумевает, что исчерпаны все возможности для диагностики причины аритмии. Но и в этом случае предлагаются определения «аритмия неясной этиологии» либо «первичная электрическая болезнь сердца». Мы берем термин «идиопатические» в кавычки, поскольку он отражает лишь нераспознанность, но не отсутствие причины аритмии.
Термин «синдром ДКМП» ; пока широкого распространения не получил и требует объяснения. В России общепринятой остается классификация НКЗМ Н.Р. Палеева и соавт. выделяют миокардиты, миокардиодистрофии и кардиомиопатии (КМП) [2]. Наиболее устоявшимся термином является миокардит [I.F. Sobernheim, 1837]: пережив периоды излишне широкого применения (диагноз «хронический миокардит» был популярнейшим диагнозом второй половины XIX и первой четверти XX вв. [1]) и спада после выделения коронарной и гипертонической болезней (P. White), он снова (со времен работы I. Gore и O. Saphir, 1947) находится на волне интереса, что во многом связано с внедрением биопсии миокарда.
Для выделения невоспалительных поражений сердечной мышцы в 1928 г. Riseman использовал термин «миокардоз», а в 1935 г. Г.Ф. Ланг – «дистрофия миокарда». Наконец, термином «кардиомиопатии» W. Brigden в 1957 г. обозначил заболевания миокарда неизвестной природы (не связанные с воспалением, ИБС, гипертонией и др.); однако в дальнейшем природа КМП стала частично выясняться. В 1996 г. в классификации ВОЗ все КМП с установленной этиологией были названы специфическими (в т.ч. метаболическая, воспалительная, клапанная, ишемическая, гипертензивная). Определенный смысл в этом был: КМП развивается лишь у некоторой части пациентов с ИБС, гипертонией и др. имеющих, видимо, генетическую предрасположенность. Однако исходный смысл понятия КМП оказался полностью утрачен.
Понятие «воспалительная КМП» характеризует миокардит с дисфункцией миокарда и включает в себя случаи постмиокардитического кардиосклероза, точно указывая на природу (но не стадию) процесса, его необратимость и серьезный прогноз. Вместе с тем, все варианты миокардита без декомпенсации остались вне классификации 1996 г. Ее положительным аспектом стало выделение структурно-функциональных вариантов КМП: дилатационной, гипертрофической, рестриктивной. Европейская классификация 2007 г. сохранила эти варианты, выделив среди них идиопатические и генетические [3].
Наконец, в американской классификации 2006 г. КМП разделены на первичные и вторичные по принципу избирательности поражения сердца [8]. К ним перестали относить синдром ДКМП в рамках ИБС, гипертонии и пороков, но отнесли каналопатии (с нарушением одной из функций сердца – электрической), что вполне закономерно и закрепляет обозначенное нами в заглавии сближение разных по своим проявлениям НКЗМ. Эта классификация во многом противоречива: к примеру, две лизосомальные болезни (Данона и Фабри) разнесены по разным группам. ДКМП выделена как смешанная (генетическая и негенетическая) первичная КМП, миокардиты (воспалительная КМП) отнесены к группе приобретенных первичных КМП, а саркоидоз и миокардит при диффузных болезнях соединительной ткани – к вторичным КМП.
На наш взгляд, классификация НКЗМ Н.Р. Палеева является фундаментальной и неоспоримой, не допуская смешения нозологий с различными этиологией и патогенезом. Столь же обоснованным считаем выделение этими авторами инфекционно-иммунного варианта миокардита (в зарубежной литературе присутствуют лишь инфекционный и идиопатический ). Термин отражает представления о трудноразделимых фазах единого процесса: инфекционной, иммунной и дистрофической; в то же время понятие идиопатического миокардита ушло из отечественной классификации (он «разошелся» по другим рубрикам). Применение биопсии миокарда дает основания для дальнейшего подразделения миокардита (на вирус-позитивный и вирус-негативный и др.); отметим также, что далласские критерии миокардита (инфильтрация) не охватывают паренхиматозного и иммунокомплексного вариантов и требуют дополнений.
Далее мы будем различать понятия «синдром ДКМП» ; и собственно ДКМП. С нашей точки зрения, в настоящее время правильно понимать под собственно ДКМП дилатацию камер сердца, как минимум левого желудочка, со снижением его сократимости (ФВнозологическую форму случаи синдрома ДКМП воспалительного, ишемического, гипертонического, метаболического, клапанного и др. генеза. С другой стороны, в клинической практике отправной точкой в диагностике чаще всего становится выделение структурно-функционального типа поражения сердца, за которым следуют попытки выявить воспалительную и иную специфическую этиологию, отсутствие которой позволяет ставить диагноз первичной КМП.
Соответственно, удобным и заслуживающим «легализации» нам кажется рабочий термин «синдром ДКМП». По сути, это «входной диагноз», наподобие острого коронарного синдрома. «идиопатических» аритмий. Вынося в диагноз слово «синдром», мы указываем на неясность его этиологии и берем на себя обязательства по ее выяснению. В то же время диагноз ДКМП, который почти тотально ставится больным с увеличенным сердцем, подразумевает чаще всего не болезнь (первичную КМП как таковую), но лишь наличие кардиомегалии, и с нозологической точки зрения во многих случаях не оправдан. Это нашло отражение даже в таких хорошо известных руководствах, как «The Merck Manual», где в качестве первой причины ДКМП назван коронарный атеросклероз, и «Myocarditis: from Bench to Bedside», где термин «острая ДКМП» использован для описания тяжелого дебюта лимфоцитарного миокардита [9].
Комплексных работ по изучению этиологии «идиопатических» аритмий и синдрома ДКМП (тем более в сравнении) практически нет. Характерно, что даже к моменту пересадки сердца диагноз при синдроме ДКМП остается неустановленным: при изучении 296 эксплантированных сердец расхождение морфологического диагноза с клиническим при НКЗМ отмечено в 30%, наблюдений в т.ч. при лимфоцитарном (вирусном) миокардите – в 15%, гиперсенситивном – в 25%, гигантоклеточном – в 25%, при саркоидозе – в 83%, при АДПЖ и гемахроматозе – в 100% случаев [7]. Важно, что часть из этих неустановленных причин потенциально курабельна.
Морфологическое исследование миокарда (в подавляющем большинстве случаев – прижизненная эндомиокардиальная или интраоперационная биопсия), с 2007 г. проводимое в Факультетской терапевтической клинике им. В.Н. Виноградова и на кафедре патологической анатомии Первого МГМУ им. И.М. Сеченова (проф. Е.А. Коган), легло в основу нашего изучения нозологической природы «идиопатических» аритмий и синдрома ДКМП (у 19 и 42 больных соответственно). Пациентам с упорными аритмиями (преимущественно мерцательной) биопсия выполнялась лишь при высокой вероятности латентного миокардита либо при необходимости отдифференцировать его от генетических КМП, когда точный диагноз определял тактику лечения (в т.ч. показания к радиочастотной аблации, имплантации кардиовертера). Рефрактерный к лечению синдром ДКМП сам по себе является показанием к биопсии.
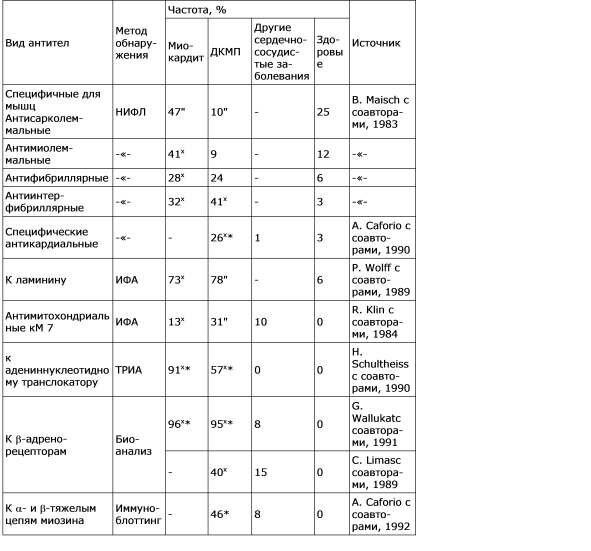
Отметим, что критериев неинвазивной дифференциальной диагностики миокардита/генетических КМП ни при аритмиях, ни при ДКМП не существует. Мы ориентировались в первую очередь на повышение в крови титров антител к различным антигенам сердца (кардиомиоцитов, эндотелия, волокон проводящей системы), определение которых проводится в лаборатории иммуногистохимии ФНЦ трансплантологии им. акад. В.И. Шумакова методом иммуноферментного анализа. Несмотря на отсутствие четких литературных данных на этот счет, такой подход себя оправдал: нормальной гистологической картины не получено ни разу. У больных с аритмиями различные морфологические варианты миокардита диагностированы в 78,9%, с синдромом ДКМП – в 66,7% случаев (табл. 1). В остальных случаях выявлены признаки генетических КМП либо их сочетание с миокардитом. Больных с ДКМП отличали существенно более частое обнаружение вирусного генома в миокарде (66,7%) в сравнении с пациентами с аритмиями (17,6%), наличие крупноочагового кардиосклероза – в 19%, более выраженная дистрофия и гипертрофия кардиомиоцитов.
Сопоставление данных биопсии и целого спектра неинвазивных методик позволило нам оценить значение последних в диагностике миокардита при аритмиях/ДКМП и разработать критерии нозологической диагностики. Наибольшей значимостью обладали титры антител к различным структурам сердца, в т.ч. к ядрам кардиомиоцитов (АНФ). Диагноз миокардита мог быть определенным или вероятным, в случае морфологического подтверждения он становился достоверным. Базовыми для миокардита признаками являются:
1. Наличие полной анамнестической триады (острое начало, связь дебюта/обострений аритмии с инфекцией, давность менее года).
2. Повышенные в 3–4 раза титры антикардиальных антител.
3. Наличие в крови генома кардиотропных вирусов, менее значимо – обнаружение IgM или 5–10-кратного повышения IgG к вирусам. Кроме того, при постановке диагноза миокардита должно учитываться наличие дополнительных критериев (табл. 2):
• отдельные компоненты анамнестической триады; системные иммунные проявления; ангины, герпес в анамнезе; клинические признаки иммунодефицита (частые инфекции); сочетание различных нарушений ритма и проводимости; эффект от стероидной терапии в анамнезе;
• повышение уровня анти-О-стрептолизина; острофазовые показатели в крови (особенно в сочетании с субфебрилитетом); повышение неспецифических иммунных маркеров (РФ, антитела к ДНК, кардиолипину), снижение уровня комплемента;
• лабильные/отрицательные зубцы Т, патологические Q, комплексы QS в различных отведениях (II, III, aVF, V1-6); атриомегалия; стенокардия/положительные нагрузочные тесты при неизмененных коронарных артериях; локальные гипокинезы (для ДКМП), диффузное неравномерное/очаговое нарушение перфузии (сцинтиграфия); субэпикардиальное отстроченное контрастирование (КТ/МРТ); выпот в полости перикарда/ спайки перикарда.
Диагноз генетической КМП мы расценивали как достоверный при выявлении патогенной мутации либо биохимических признаков болезней накопления, определенный – при наличии критериев конкретных КМП (АДПЖ, синдрома Бругады и др.), отягощенного семейного анамнеза, некомпактного миокарда, периферической миопатии или иных генетических маркеров. Вероятный диагноз генетической КМП ставился при изолированном характере «идиопатической» аритмии (особенно желудочковой экстрасистолии и АВ-блокады), возрасте до 40 лет, наличии синдрома ранней реполяризации, патологического зубца Q/комплексов QS (для ДКМП), отдельных критериев (нейтропения, повышение уровня КФК/лактата в крови, малые критерии АДПЖ и пр.). Любая генетическая КМП может сочетаться с миокардитом, поэтому ее диагностика проводится независимо. В то же время отсутствие признаков миокардита расценивается в пользу первичной КМП, возраст старше 60 лет – воспалительной природы болезни (особенно у больных с синдромом ДКМП).
Применение этих критериев позволило с той или иной степенью достоверности поставить нозологический диагноз абсолютному большинству из 320 пациентов с «идиопатическими» аритмиями и синдромом ДКМП (соответственно 95 и 89%), причем спектр диагнозов оказался у них сходным (рис. 1). Имелись различия в этиологии конкретных аритмий: доля миокардита оказалась максимальной при наджелудочковой экстрасистолии и мерцательной аритмии, генетических КМП – при желудочковой тахикардии, АВ-блокадах 2–3 степени. Распределение по нозологиям было достаточно близким к результатам биопсии. Эти данные отражают одну из наиболее общих тенденций в современной клинике внутренних болезней: постоянный рост числа инфекционных, иммунных и генетически детерминированных болезней.
Основное отличие пациентов с ДКМП состоит в большей частоте выявления генетических форм, причем вполне определенных, хотя можно с уверенностью предполагать, что истинный процент генетических вариантов занижен не только у больных с «идиопатическими» аритмиями, но и с синдромом ДКМП. Сочетание двух и более причин выявлено у 25,0% больных с аритмиями и у 36,2% – с синдромом ДКМП. К примеру, с миокардитом сочетались дисгормональная миокардиодистрофия, синдром мезенхимальной дисплазии (пролапс митрального клапана без регургитации), нетяжелый синдром обструктивного апноэ во сне и др.
Кроме того, у некоторой части больных как с миокардитом, так и с генетической КМП (в т.ч. морфологически подтвержденными) имелись артериальная гипертония без признаков гипертонического сердца, коронарный атеросклероз, которые не могли рассматриваться как ведущая причина аритмий/ДКМП, поскольку выраженность гипертонии и типичных ишемических симптомов, которые во многих случаях вообще отсутствовали, совершенно не соответствовала локализации и упорству аритмий либо выраженности синдрома ДКМП; нередко аритмии и клинические проявления ХСН возникали задолго до развития гипертонии или признаков стенокардии. Установлена высокая частота микроваскулярной стенокардии, наличие которой коррелировало с морфологическими признаками миокардита.
Важно отметить, что первично хроническое течение (отсутствие в анамнезе острого начала, связи яркого дебюта заболевания с перенесенной инфекцией) отмечено у 59,9% пациентов с аритмиями и 69,1% – с ДКМП. Вероятно, можно говорить об отдельном, самостоятельном варианте болезни, который обусловлен особенностями иммунного ответа. Напрашиваются аналогии с гломерулонефритом, который также может протекать в яркой острой форме (без хронизации во многих случаях) и хронической, без острого начала, но приводящей нередко к снижению почечной функции.
Пациенты с воспалительной ДКМП (миокардитом) отличались по характеру течения заболевания: выделены тяжелый миокардит с острым началом (28,2%); миокардит у больных с системными иммунными проявлениями (17,5%); хронический вирусный миокардит (18,4%); прочие миокардиты (35,9%). Характеризуясь разной долей вирусного и иммунного компонентов, эти варианты четко различались не только по клинике, но и прогнозу: в частности, летальность при первых двух вариантах составила 44,8 и 5,6% соответственно. У больных с аритмиями наибольшие различия (по тяжести течения и ответу на лечение ) выявлены между пациентами с анамнестической триадой и первично хроническим течением миокардита.
Отдельного упоминания заслуживают отнюдь не редкие случаи сочетания генетических КМП и миокардита, часть из которых также верифицирована морфологически. Генетически дефектный миокард, видимо, представляет собой удобную «площадку» для развития миокардита, который, в свою очередь, способствует реализации аномальной генетической программы. Главными особенностями таких пациентов были стабильное до присоединения миокардита течение генетического заболевания, необъяснимо тяжелый и быстрый характер декомпенсации (значительное нарастание тяжести аритмий, ХСН) и, с другой стороны, необычно упорные для миокардита нарушения ритма, в первую очередь желудочковые (включая устойчивую тахикардию). К примеру, обоснованные срабатывания кардиовертеров-дефибрилляторов отмечены нами лишь при наличии генетической основы аритмий/ДКМП.
Как представляется, взаимодействие генетической предрасположенности (далеко не всегда очевидной) и вирусной инфекции (не всегда уловимой) составляет основу развития миокардита. Современная генетика почти ничего не знает об этом, однако само разнообразие вариантов миокардита при одних и тех же этиологических факторах – от латентного аритмического до фульминантного – подтверждает положение о том, что «патогенез есть свойство реагирующего субстрата» (И.В. Давыдовский). Лишь в небольшом числе случаев генетическая составляющая может быть идентифицирована. При этом целый ряд дополнительных факторов (в т.ч. вторичная клапанная дисфункция) вносит вклад в патогенез дисфункции миокарда (рис. 2).
В соответствии с выявленной нозологией проблема этиотропной и патогенетической терапии у больных рассматриваемой группы является проблемой терапии миокардита (мы не касаемся здесь лечения достаточно редких – в наших наблюдениях и, вероятно, вообще – болезней накопления, некоторых каналопатий, различных генетических вариантов ДКМП, а также чаще встречающихся случаев АДПЖ и некомпактного миокарда; не обсуждаем и проблемы антиаритмической терапии и лечения ХСН). Таким образом, речь идет о базисной противовирусной и иммуносупрессивной терапии (ИСТ). Нами использовались в качестве противовирусных препаратов ганцикловир, вальганцикловир, ацикловир, а также в/в вливания иммуноглобулина, в качестве иммуносупрессивных препаратов – преднизолон, азатиоприн и гидроксихлорохин.
Мы не рассматриваем здесь подробно принципы назначения этих препаратов, отметим лишь, что их выбор обусловливался вариантом и степенью активности миокардита, а длительность терапии (от полугода до 3-х лет и более) – эффективностью лечения. Коснемся лишь выявленных нами общих закономерностей, отмеченных при лечении миокардита, лежащего в основе «идиопатических» аритмий и синдрома ДКМП. У большинства из них миокардит носил вирусно-иммунный (15,4% при аритмиях и 39,8% – при ДКМП) или иммунный характер (81,5 и 55,3%), причем у больных с ДКМП был достоверно выше, чем при аритмиях, титр антител к кардиомиоцитам. Высокая иммунная активность коррелировала с более тяжелым течением аритмий, но с менее выраженной сердечной недостаточностью при ДКМП.
Вирус оказался одним из важных индукторов иммунного ответа: в частности, АНФ у вирус-позитивных больных выявлялся существенно чаще, особенно при аритмиях. Вирусный миокардит без антикардиальных антител в крови отмечен лишь у 16,7% вирус-позитивных больных с аритмиями (3,1% всех пациентов с миокардитом) и 10,9% вирус-позитивных больных с ДКМП (4,9% всех пациентов с миокардитом). Этот факт принципиален при выборе лечения: в исследованиях эффективности стероидов при воспалительной ДКМП хорошо отвечали на лечение вирус-негативные пациенты с антикардиальными антителами в крови, не отвечали – вирус-позитивные без антител [4, 5].
Но если последние встречаются достаточно часто, то первые составляют абсолютное меньшинство среди больных миокардитом; у значительной части пациентов со смешанным (вирусно-иммунным) вариантом эффект стероидов остается неизученным. Наши данные говорят о том, что исключительно подавления активной вирусной инфекции недостаточно: высокая иммунная активность в большинстве случаев сохраняется. В то же время назначенная с учетом тяжести течения, иммунной активности, резистентности к лечению ИСТ (аминохинолины, различные дозы стероидов, в отдельных случаях азатиоприн), независимо от наличия вирусного генома, оказывала отчетливый эффект в обеих подгруппах.
У больных с аритмиями базисная терапия миокардита почти в 17% случаев позволила полностью отменить антиаритмик, в сравнении с другими нозологическими подгруппами у них чаще удавалось добиться полного антиаритмического эффекта, оказалась наименьшей потребность в хирургическом лечении. У пациентов с ДКМП только ИСТ сопровождалась достоверным повышением ФВ, уменьшением размеров левого желудочка и давления в легочной артерии. При этом исходное наличие вируса у пациентов с аритмиями ассоциировалось с несколько лучшими результатами лечения, в то время как при ДКМП наличие вируса ослабляло, но не нивелировало эффект стероидной терапии. Наибольшие различия при ДКМП отмечены между вирус-негативными больными, получавшими ИСТ, и вирус-позитивными, не получавшими ее: смертность составила 6,1 и 40,0% (р=0,002, ОР 1,82), потребность в хирургическом лечении – 24,2 и 64,0% (р=0,003, ОР 1,30).
Благоприятно влияли на результат лечения изолированный характер миокардита, его высокая иммунная активность, компоненты анамнестической триады, системные иммунные проявления, микроваскулярная стенокардия, т.е. наличие субстрата для лечения. В то же время ухудшали ответ на комплексное лечение и при аритмиях, и при ДКМП возраст менее 40 лет, значительная давность болезни, наличие необратимых морфологических (фиброз, субэндокардиальный липоматоз) и структурных (низкая ФВ, митральная и трикуспидальная регургитация III степени) изменений миокарда, резистентность к 4 и более антиаритмикам.
Летальность при ДКМП за год наблюдения составила 20,8% (в ее структуре преобладала терминальная ХСН). С неблагоприятным прогнозом ассоциировались, наряду с известными факторами, возраст менее 40 лет (ОР 2, 26), связь дебюта заболевания с инфекцией (ОР 1,61), вирусный геном в крови/миокарде (ОР 2,10), геном вируса герпеса 6 типа в миокарде (ОР 3,61), крупноочаговый кардиосклероз (ОР 2,98), отсутствие специфического АНФ (ОР 1,31), γ-глобулины 2,0 (ОР 2,26), VTI
Достаточно длительное наблюдение за нашими пациентами говорит о том, что исходно разные по клиническим проявлениям и тяжести варианты миокардита не склонны переходить друг в друга: в частности, аритмический вариант практически ни в одном случае не привел к развитию застойной ХСН или достоверной динамике ЭхоКГ-параметров; миокардит среднетяжелого течения с ХСН не приобретал черты тяжелого и фульминантного. Для всех вариантов миокардита было весьма характерно волнообразное течение, при этом картина обострения, как правило, копировала дебют болезни, иногда в более тяжелой форме. Обострения особенно ярко проявлялись у пациентов, которые исходно нуждались в средних и высоких дозах иммуносупрессивных препаратов.
В связи с этим хотелось бы подчеркнуть, что термин «постмиокардитический кардиосклероз» должен использоваться с большой осторожностью, особенно в качестве нозологического диагноза: полное стихание активного воспалительного процесса так же труднодоказуемо без биопсии, как и его наличие. Этот диагноз (как, впрочем, и воспалительная КМП), точно указывая на характер заболевания, не дает оснований для проведения базисной терапии. В большинстве случаев гораздо корректнее, на наш взгляд, было бы говорить о временной или стойкой ремиссии миокардита или о сопутствующем ему миокардитическом склерозе.
Основными причинами обострений были интеркуррентные и активная вирусная инфекции (в т.ч. на фоне ИСТ) с появлением генома кардиотропного вируса в крови, снижение доз или отмена иммунодепрессантов, амиодарониндуцированный тиреотоксикоз при аритмиях. На фоне высоких доз стероидов инфекции могли протекать тяжелее, но не приводили, как правило, к декомпенсации миокардита. Весьма типичным было развитие обострений через 2–3 года после постановки диагноза и активного лечения, на фоне полной стабилизации состояния и отмены базисной терапии. Это убеждает нас в том, что поддерживающее лечение хронического миокардита (любой его формы) должно быть длительным и непрерывным, по аналогии с нефритом, системной красной волчанкой и прочими иммунными заболеваниями.
Литература
1. Палеев Н.Р. Одинокова В.А. Гуревич М.А. Найшут Г.М. Миокардиты. М. Медицина, 1982. 272 с.
2. Палеев Н.Р. Палеев Ф.Н. Классификация некоронарогенных заболеваний миокарда // Кардиология. 2008. № 48 (9). С. 53–58.
3. Elliott P. The 2006 American Heart Association classification of cardiomyopathies is not the gold standard // Circ. Heart Fail. 2008. Vol. 1(1). P. 77–79; discussion 80.
4. Frustaci A. Chimenti C. Calabrese F. et al. Immunosuppressive therapy for active lymphocytic myocarditis: virological and immunologic profile of responders versus nonresponders // Circulation. 2003. Vol. 107(6). P. 857–863.
5. Frustaci A. Russo M.A. Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study // Eur. Heart J. 2009. Vol. 30(16). P. 1995–2002.
6. Kuhl U. Pauschinger M. Seeberg B. et al. Viral persistence in the myocardium is associated with progressive cardiac dysfunction // Circulation. 2005. Vol. 112(13). P. 1965–1970.
7. Luk A. Metawee M. Ahn E. et al. Do clinical diagnoses correlate with pathological diagnoses in cardiac transplant patients? The importance of endomyocardial biopsy // Can. J. Cardiol. 2009. Vol. 25(2). e48–54.
8. Maron B.J. Towbin J.A. Thiene G. et al. Contemporary definitions and classification of the cardiomyopathies // Circulation. 2006. Vol. 113(14). P. 1807–1816.
9. Myocarditis. From Bench to Bedside. Ed. by L.T. Cooper. New Yersey: Humana Press, 2003, 634 p.
Идиопатическая мерцательная аритмия
Как правило, лишь при наличии определенных условий в предсердиях развитие МА могут непосредственно спровоцировать злоупотребление крепким чаем, кофе, употребление психостимуляторов и наркотических веществ, а также ряда медикаментов (эуфиллин и другие метилксантины, ингаляционные адреноми-метики, орициклические антидепрессанты, тиазидные и петлевые диуретики, некоторые гормональные контрацептивы и др.); больной сам может отметить связь перебоев в работе сердца с одним из этих факторов, однако, наряду с недооценкой, возможно и преувеличение их роли;
— в специальном исследовании показано, что у пациентов с МА, но без тяжелых органических заболеваний сердца частота развития пароксизмов максимальна в зимние месяцы и снижается в период с мая по август; заметное влияние на частоту пароксизмов оказывают также холодные атмосферные фронты.
При отсутствии явной причины аритмии ставится диагноз «идиопатическая мерцательная аритмия» (lone atrial fibrillation). Термин «идиопатическая МА» имеет много определений, но в общем случае применяется к МА, возникающей у людей молодого и среднего возраста (моложе 60 лет) без клинических или эхокардиографических признаков сердечно-легочного заболевания.
Истинная распространённость этой формы, по-видимому, существенно ниже тех 20-40%, о которых сообщается в литературе. На сегодняшний день условность термина достаточно очевидна, поскольку с каждым годом открываются все новые причины МА, которая ранее расценивалась как идиоматическая.