Окклюзионный тромбоз
02 Дек 2014, 06:22, автор: admin
ИЗ варикозно расширенных вен желудка
Гарбузенко Д.В. Лечебная тактика при кровотечениях из варикозно расширенных вен желудка // Анналы хирургической гепатологии — 2007. — Т. 12, № 1. — С. 96-103.
При цитировании статьи ссылка на автора обязательна!
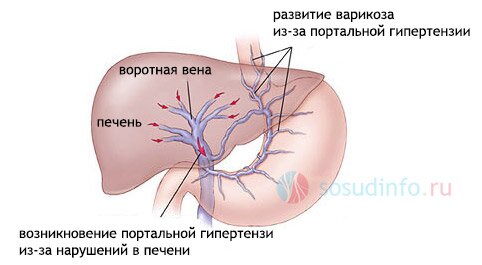
Несмотря на то, что варикозное расширение вен желудка (ЖВ) относительно редкая патология и встречается примерно у 20 % больных с портальной гипертензией (ПГ) [1], высокая летальность при кровотечениях из них, а также отсутствие единого стандарта лечебно-профилактических мероприятий делает проблему чрезвычайно актуальной.
классификация варикозного расширения вен желудка
Наибольшее распространение получила классификация ЖВ, в основу которой положена их локализация и связь с варикозно расширенными венами пищевода (ПВ). Кроме того, ЖВ может быть первичным и вторичным. В последнем случае они развиваются, как правило, после эндоскопического лечения ПВ [1].
Варикозно расширенные вены, переходящие из пищевода в желудок, определяются как гастроэзофагеальные (гэв) и бывают двух типов:
1) гэв первого типа (гэв 1) продолжаются от ПВ вдоль малой кривизны желудка на 2-5 см ниже кардии;
2) гэв второго типа (гэв 2) проходят от пищевода по направлению к дну желудка.
Изолированные ЖВ (ижв) формируются при отсутствии ПВ. Среди них различают:
1) ижв первого типа (ижв 1), которые расположены в дне желудка;
2) ижв второго типа (ижв 2), представляющие собой эктопические флебэктазии привратника, антрального отдела и тела желудка. Они, как правило, вторичные.
Японское общество по изучению ПГ классифицирует ЖВ по цвету (белый [Cw] и голубой [Cb]), форме (прямой [F1], узловой [F2] и извитой [F3]), наличию красных цветовых признаков (RC0-3), локализации (кардиальные [Lg-c], фундальные [Lg-f] и варикозы, занимающие оба отдела [Lg-cf]) [2].
механизм формирования
варикозного расширения вен желудка
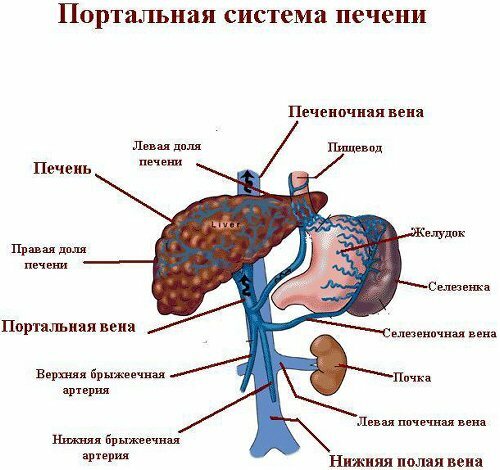
гэв, преимущественно первого типа, в большинстве случаев наблюдается у больных с внепечёночной ПГ, вызванной нарушением проходимости воротной вены, реже при циррозе печени [3]. Причиной ижв часто является сегментарная (левосторонняя) ПГ, развивающаяся вследствие тромбоза или сужения селезёночной вены, как правило, на фоне патологии поджелудочной железы [4].
гэв 1 как и ПВ дренируются преимущественно через левую желудочную и коронарную вены. Термином “коронарная вена” обозначают анастомозы между левой и правой желудочными венами. Левая желудочная вена восходит по малой кривизне желудка влево в малый сальник к пищеводному отверстию диафрагмы, где сообщается с венами пищевода, и затем, изгибаясь обратно вниз и вправо позади сальниковой сумки, впадает в воротную вену или, когда кровоток меняет свое направление, в систему непарной вены. ижв образуются в результате реверсии кровотока через селезёночную, желудочно-сальниковые и заднюю желудочную вены. При этом под термином “задняя желудочная вена” подразумевают анастомозы между левой и короткими венами желудка. ижв 2 часто сочетаются с расширением ветвей желудочно-сальниковых вен. ЖВ, как правило, дренируются посредством спонтанных гастроренальных шунтов, которые формируются между венами желудочно-селезёночной сосудистой территории и левой почечной веной, через нижнюю диафрагмальную, либо надпочечниковую вены [5]. Описан случай образования гастроперикардиального шунта при участии задней желудочной вены [6].
Эндоскопическое лечение ПВ нередко способствует развитию вторичного, преимущественно изолированного ЖВ [7]. С другой стороны, склеротерапией ПВ, при каудальном направлении тока препарата, можно добиться стойкой эрадикации гэв, особенно первого типа [8].
диагностика варикозного расширения вен желудка
И факторы риска кровотечений ИЗ них
ЖВ наиболее часто диагностируют во время скрининга больных с ПГ, обследуемых на наличие варикозов, либо в случае желудочного кровотечения. Вместе с тем стандартное эндоскопическое исследование не всегда позволяет точно оценить подлинную распространённость данной патологии из-за глубокого расположения расширенных вен в подслизистой основе желудка и отличить их от складок бывает трудно. Повысить качество диагностики можно посредством компьютерной томографии [9] и эндоскопической ультрасонографии [10].
Тем не менее, информация о размере и локализации ЖВ, наличии воспалительных изменений слизистой оболочки желудка, полученная во время эндоскопического исследования, имеет существенное значение для оценки опасности геморрагических осложнений. При этом факторами риска кровотечений являются крупноузловой варикоз голубого цвета, его фундальная локализация, красные пятна на слизистой оболочке желудка в сочетании с выраженным нарушением функции печени [11].
Считается, что ведущим механизмом, способствующим разрыву варикозных узлов, является комбинация повышения давления внутри их просвета и слабости стенки сосуда. По закону Лапласа напряжение сосудистой стенки (T) пропорционально величине внутрисосудистого давления (P), диаметру сосуда (D) и обратно пропорционально толщине его стенки (W):
T = P D / W
Хотя фундальные варикозы расположены в подслизистой основе, при больших размерах они пронизывают мышечную пластинку слизистой оболочки желудка, проходят в собственной пластинке и выступают в просвет желудка, становясь уязвимыми к повреждению. В этом случае резко повышается риск их разрыва [12].
Из-за формирования спонтанных гастроренальных шунтов показатели портопечёночного градиента давления у больных с ЖВ ниже, чем при ПВ, ввиду чего большинство кровотечений развивается при значениях менее 12 мм рт.ст. [13].
лечебно-профилактические мероприятия
при кровотечениях
ИЗ варикозно расширенных вен желудка
Важную роль в комплексе консервативных мероприятий по остановке кровотечений из ЖВ играют зонды-обтураторы. При разрыве фундальных и эктопических варикозов используют зонд Linton-Nachlas. В этом случае гемостаз достигается раздуванием единственного желудочного баллона до 600 см3. Трёхпросветный зонд Sengstaken-Blakemore применяют в случае разрыва ПВ или гэв 1. Однако их эффект кратковременный и перманентный гемостаз наблюдается менее чем в 50 % случаев [14].
Фармакотерапия
В отличие от ПВ, данных об использовании вазоактивных препаратов (аналогов вазопрессина, соматостатина, нитроглицерина) при острых кровотечениях из ЖВ мало. Однако, учитывая схожесть формирования и клинического течения, можно предположить, что подобное лечение может быть эффективно при гэв 1 [15]. Антибиотикотерапия должна быть проведена как можно раньше, т.к. было показано, что присоединение бактериальной инфекции, особенно у больных циррозом печени, увеличивает частоту осложнений и летальность, а при применении цефалоспоринов краткосрочный прогноз значительно улучшается [16].
Роль неселективных β-адреноблокаторов и нитратов в первичной профилактике кровотечений из ЖВ, так и их рецидивов окончательно не установлена и требует дальнейшей оценки.
Эндоскопическое лечение
Стандартная эндоскопическая склеротерапия ПВ и гэв 1 заключается в инъекции препаратов, вызывающих повреждение эндотелия, тромбоз и в последующем — склероз варикозных узлов, как непосредственно в расширенные вены (5 % р-р этаноламина олеата, 5 % р-р морруата натрия, 1,5-3 % р-р тетрадецила сульфата натрия), так и паравазально (1 % р-р полидоканола (этоксисклерола)). С целью облитерации ЖВ, как правило, применяют гистоакрил (N-бутил-2-цианоакрилат). Введение препарата малыми дозами посредством интраварикозных инъекций приводит к мгновенной реакции полимеризации. При смешивании с кровью он трансформируется из своего естественного жидкого состояния в твёрдое и перекрывает просвет вены. Это позволяет в большинстве случаев быстро останавливать активные кровотечения из ЖВ. Несмотря на то, что частота рецидивов достигает 40 %, данный метод более эффективен, чем стандартная эндоскопическая склеротерапия [17] и в настоящее время рассматривается не только как терапия “первой линии“ кровотечений из фундальных ЖВ, но и как способ вторичной их профилактики [18].
Наиболее распространёнными и, как правило, преходящими побочными эффектами при облитерации варикозных узлов гистоакрилом являются лихорадка и умеренные боли в животе. Тяжёлые осложнения встречаются редко. К ним относятся эмболия легочной артерии и сосудов головного мозга, тромбоз воротной и селезёночной вен, забрюшинный абсцесс, инфаркт селезёнки [19]. Вероятность развития эмболий выше у больных с большими гастроренальными шунтами и гепатопульмональным синдромом, который характеризуется артериальной гипоксемией и внутрилегочной сосудистой дилатацией с наличием прямых артериовенозных анастомозов, что облегчает попадание полимеризующего вещества в системную циркуляцию. Следовательно, у данной категории пациентов от проведения облитерации варикозных узлов гистоакрилом следует воздержаться и заменить склеротерапией, например 5 % р-ром этаноламина олеата, сочетая её с инфузией вазопрессина [20], либо прибегнуть к другим методам лечения.
При эндоскопическом лигировании, в отличие от индукции химического воспаления и тромбоза, вызванных введением склерозирующих агентов, эластичное кольцо, захватывая участки слизистого и подслизистого слоя желудка в области варикозного узла, приводит к странгуляции и последующему его фиброзу. Однако в ряде случаев в зоне лигирования могут образовываться глубокие и обширные язвы. Учитывая, что фундальные ЖВ обычно крупные и непосредственно связаны со значительно расширенными левой желудочной или задней желудочной венами, объём кровотока по ним больше, чем через ПВ. В связи с этим, в местах повреждённой слизистой оболочки желудка кровотечения нередко рецидивируют [21], снижая эффективность эндоскопического лигирования, по сравнению с облитерацией варикозных узлов гистоакрилом, являющейся в данной ситуации “золотым стандартом” лечения [22].
Методы интервенционной радиологии
В 1969 году J. Rosh et al. выдвинули идею создания внутрипеченочной фистулы между ветвями печёночной и воротной вен для лечения ПГ. В настоящее время трансюгулярное внутрипечёночное портосистемное шунтирование (tips) получило широкое клиническое применение [23]. Главным его достоинством является меньшая инвазивность, чем при хирургических способах декомпрессии портальной системы.
Публикаций, касающихся использования этого метода, у больных с ЖВ немного. Указывается, что у абсолютного большинства из них tips эффективен как в случаях острых кровотечений, так и при применении его с профилактической целью. При этом частота рецидивов после достижения первичного гемостаза составляет 15-30 % в течение 1 года [24]. Причиной их в отдалённом периоде, как правило, является стеноз или окклюзия шунта в результате гиперплазии интимы участка печёночной вены или тромбоза эндопротеза из-за низкого кровотока по нему. Это осложнение наблюдается у не менее трети пациентов и служит показанием к повторному вмешательству. Серьёзную проблему представляет постшунтовая энцефалопатия, которая развивается в 20-30 % случаев и может плохо поддаваться лечению.
В течение первого года после вмешательства летальность варьирует от 10 до 50 %, при этом наиболее частой её причиной могут быть сепсис, мультиорганная системная дисфункция, повторные кровотечения. Прогноз хуже у больных циррозом печени, относящихся в соответствии с критериями Child-Pugh к классу С. Однако именно они и являются основными кандидатами для tips. К другим неблагоприятным факторам относятся высокий уровень сывороточного билирубина, креатинина, аланин-аминотрансферазы, наличие энцефалопатии, вирусная природа заболевания [25].
Британское общество гастроэнтерологов рекомендовало tips больным циррозом печени с ЖВ как лечение “второй линии” при острых кровотечениях, так и для профилактики их рецидивов в случае неэффективности эндоскопических мероприятий [15]. Вместе с тем необходимы дальнейшие исследования роли этого метода, особенно при значениях портопечёночного градиента давления менее 12 мм рт.ст. и наличия больших гастроренальных шунтов.
Метод баллонно-окклюзионной ретроградной трансвенозной облитерации (brto), предложенный H. Kanagawa et al. в 1996 г. для лечения ЖВ, достаточно эффективен и безопасен и является хорошей альтернативой tips [26]. Данное вмешательство технически выполнимо только при наличии функционирующих гастроренальных шунтов, которые имеют место почти у 85 % больных с ЖВ [27]. Склерозирующее вещество (как правило, 5 % р-р этаноламина олеата с йопамидолом) через катетер с раздуваемым баллончиком, проведённый в бедренную или внутреннюю ярёмную вены, а далее — в левую надпочечниковую вену через гастроренальный шунт вводится в варикозы фундального отдела желудка и питающие их вены. Чтобы предотвратить вытекание склерозанта в системную циркуляцию, небольшие коллатерали эмболизируются микроспиралями.
При острых кровотечениях из ЖВ brto применяется как самостоятельно, так и в дополнение к эндоскопическим методам, повышая их эффективность [28; 29]. Гемостаз достигается почти у 100 % больных при отсутствии рецидивов в течение трёх лет и уровнем выживаемости, достигающим 70 %. brto не менее эффективна и при профилактике повторных кровотечений из ЖВ [30].
Потенциальной проблемой является развитие или прогрессирование ПВ [31], что может быть связано с повышением портального давления после данного вмешательства [32]. Среди других побочных эффектов описаны гемоглобинурия, боль в животе, преходящая лихорадка, плевральный выпот, асцит, временное ухудшение печёночных биохимических показателей. Серьёзные осложнения встречаются редко. К ним, прежде всего, относятся инфаркт лёгкого, шок, фибрилляция предсердий [33].
Ещё одним видом транскатетерной эмболотерапии является чрескожная эндоваскулярная облитерация ЖВ. Она заключается в транспортальном введении в левую желудочную вену металлической спирали или эмбола из тефлонового фетра, как правило, из чреспечёночного, либо чрезселезёночного доступа, что способствует разобщению пищеводно-кардиальной и воротно-селезёночной сосудистых территорий. Отмечена высокая эффективность данного метода при острых кровотечениях. Однако из-за формирования новых путей коллатерального кровотока в отдалённом периоде часто возникают рецидивы, что отражается на общей летальности. В связи с этим предлагается чрескожную эндоваскулярную облитерацию ЖВ сочетать с эндоскопической склеротерапией [34], или с brto [35].
Существуют отдельные сообщения о достижении стойкого гемостаза при кровотечении из ЖВ у больных с сегментарной (левосторонней) ПГ вследствие тромбоза селезёночной вены исключительно эмболизацией селезёночной артерии с установкой спирали Гиантурко [36], либо сочетая её с лапароскопической спленэктомией [37].
Чрескожная транспечёночная пластика воротной вены с имплантацией саморасширяющегося металлического стента, описанная в 2001 г. K. Yamakado et al. применяется у больных с внепечёночной ПГ, вызванной стенозом или окклюзией воротной вены, как доброкачественного [38], так и злокачественного [39] генеза. Немногочисленные публикации свидетельствуют об эффективности этого метода как профилактического мероприятия при ЖВ.
Хирургическое лечение
По мнению отечественных авторов при наличии кровотечения из пищеводно-желудочных варикозов показанием к срочному хирургическому вмешательству у больных циррозом печени, относящихся в соответствии с критериями Child-Pugh к классу А и В, а также с внепечёночной ПГ служит неэффективность консервативных и эндоскопических способов гемостаза. При этом методом выбора является операция, предложенная М. Д. Пациора (1959) [40].
Хирургические способы профилактики рецидивов варикозных кровотечений условно можно разделить на шунтирующие (различные варианты портокавальных анастомозов) и нешунтирующие (деваскуляризирующие пищевод и желудок операции, а также другие вмешательства, не связанные с отведением портальной крови в систему нижней полой вены). Последние не нарушают функцию печени, однако, в большинстве своём сопровождаются высокой частотой рецидивов кровотечений. Наиболее эффективна из них — операция, описанная в 1973 г. M. Sugiura и S. Futagawa, являющаяся модификацией метода M. Hassab (1967). Она требует одновременно трансторакального и трансабдоминального доступа и включает в себя пересечение и сшивание пищевода в нижней трети, обширную деваскуляризацию пищевода и желудка от левой нижней легочной вены до верхней половины желудка, спленэктомию, селективную ваготомию и пилоропластику. M. Tomikawa et al. исследовали эффективность данного вмешательства у 42 больных с ЖВ. При отсутствии операционной летальности пятилетняя выживаемость составила 76,2 %. Стойкая эрадикация варикозов наблюдалась во всех случаях [41]. Вместе с тем, следует отметить, что подобных уникальных результатов другими клиниками получено не было.
Операции, связанные с декомпрессией портальной системы, способствуют надёжной профилактике рецидивов варикозных кровотечений и заключаются в тотальном, селективном или парциальном шунтировании крови из воротной в систему нижней полой вены. За почти 60 лет, прошедших с тех пор, как A.O. Whipple et al. выполнили прямое портокавальное шунтирование, вопросы о его целесообразности в настоящее время решены. Существенным недостатком вмешательства является тотальная диверсия портального кровотока. Между тем, сохранение его постоянства, так же как и венозной гипертензии в кишечном русле необходимо для поддержания нормальных метаболических процессов в печени. Следствием этого является прогрессирующая печёночная недостаточность, кото-рая сопровождается высокой послеоперационной летальностью, а возникшая энцефалопатия имеет более тяжелое течение, чем исходная. Несмотря на то, что были предложены разнообразные оригинальные модификации операции, результаты их клинического применения в большинстве случаев оказались неудовлетворительными [42].
W.D. Warren et al. в 1967 г. описали метод, который мог бы свести к минимуму осложнения, свойственные тотальным шунтам. Он заключается в селективной чрезселезёночной декомпрессии пищеводно-желудочных варикозов посредством создания дистального спленоренального анастомоза. Уменьшая давление в шунтированном участке селезёночной вены, операция эффективно разгружает гастроспленальную сосудистую территорию. Однако в гепатопортальной зоне развиваются более сложные гемодинамические изменения. Так как портальное давление остаётся повышенным, даже если его начальные значения уменьшаются при снижении селезёночного кровотока, достичь длительного разделения двух венозных систем высокого и низкого давления посредством селективного шунтирования практически невозможно. Гипертензия в портомезентериальной зоне спустя некоторое время способствует формированию выраженной коллатеральной циркуляции через поджелудочную железу по направлению к области низкого давления — гастроспленальной сосудистой территории. Это приводит к уменьшению портального кровотока с высокой вероятностью тромбоза воротной вены [43]. Развитие так называемого “панкреатического сифона” между воротной и селезёночной венами ухудшает результаты операции, прежде всего за счёт прогрессирования печёночной энцефалопатии, уровень которой в ряде случаев оказывается аналогичным тотальному шунтированию. Скрупулёзное разъединение коллатералей даёт возможность избежать этих нежелательных последствий [44].
Парциальное (частичное) шунтирование подразумевает анастомоз “бок в бок” через Н-образный политетрафлюороэтиленовый протез диаметром 8 мм между воротной или верхней брыжеечной и нижней полой веной. Это позволяет достичь эффективной декомпрессии портальной системы при сохранении адекватного проградиентного кровотока. В результате значительно снижается риск развития энцефалопатии, а количество рецидивов кровотечения сопоставимо с тотальным или селективным шунтированием [45].
Вместе с тем, роль шунтирующих операций у больных с ЖВ в настоящее время оценена недостаточно, особенно при наличии спонтанных гастроренальных анастомозов. Британское общество гастроэнтерологов предлагает рассматривать их как альтернативу tips, т.е. лечебным мероприятием “второй линии” для профилактики рецидивов кровотечений из ЖВ при неэффективности эндоскопических методов гемостаза [15].
заключение
Лечение больных с кровотечениями из ЖВ остаётся важной клинической проблемой, далёкой от своего решения. Ряд вызывающих оптимизм методик ещё не получили широкого практического применения. Так большинство описанных способов интервенционной радиологии распространены главным образом в Японии. На всемирной согласительной конференции в Бавено (Италия, 2005 г.), посвящённой методологии диагностики и терапии ПГ, была определена следующая концепция по данному вопросу [18]. Для лечения острых кровотечений и предотвращения их рецидивов рекомендуется облитерация ЖВ гистоакрилом (N-бутил-2-цианоакрилатом). Кроме того, с целью вторичной профилактики кровотечений из ЖВ могут быть применены неселективные β-адреноблокаторы, у больных с гэв 2 и ижв 1 выполнено tips, гэв 1 – эндоскопическое лигирование. Было отмечено, что требуются дальнейшие рандомизированные контролируемые испытания каждого из предлагаемых методов, чтобы определить оптимальную тактику ведения больных с ЖВ.
Источник: http://garbuzenko62.ru/varikoz_zheludka.htm
Источник: http://varikozwiki.ru/wiki/chto-takoe-okklyuzionnyy-tromboz-varikoznyh-uzlov/
Источник: http://varikozoplus.ru/newsid/lechenie-okklyuzionnyy-tromboz/
Хирург → Консультации
Всем, кто перенес радикальное оперативное вмешательство по поводу эпителиального копчикового хода, желательно соблюдать следующие рекомендации: 1. В течение.
Здравствуйте! Этот вопрос Вы можете задать специалисту на очном приеме. Все, что касается консультации, Вы можете узнать по телефону +7(495) 215-04-22. Мы сотрудничаем.
Причин несколько. Заочно сказать сложно. Необходим личный осмотр. Мы сотрудничаем с Комплексной Клиникой — частной клиникой Москвы. В ее отделениях Вы.
К сожалению, ничем не можем Вам помочь дистанционно. Мы сотрудничаем с Комплексной Клиникой — частной клиникой Москвы. В ее отделениях Вы можете получить квалифицированную.
Окклюзионные заболевания сосудов
Краткое описание: Окклюзионные заболевания сосудов: Тромбофлебиты и флеботромбозы. Облитерирующий эндартериит, атеросклеротический тромбангиит. Клиника, диагностика. Современные методы исследования артерий. Принципы консервативного и оперативного лечения. Диабетическая ангиопатия: патогенез, методы лечения
Клиника острых нарушений артериального кровоснабжения
Региональные нарушения периферического кровообращения составляют значительный процент в структуре заболеваний и травм и зачастую приводят к формированию так называемых циркуляторных некрозов, что, в свою очередь, обусловливает большие цифры летальности и инвалидизации больных.
Основными причинами развития циркуляторных некрозов являются:
1. Нарушение артериальной проходимости
2. Нарушение венозного оттока
3. Нарушение микроциркуляции
Нарушение притока артериальной крови является наиболее частой причиной развития циркуляторных некрозов, так как недостаток поступления к тканям кислорода и питательных веществ довольно быстро вызывает гибель клеток.
Нарушения артериальной проходимости могут возникать остро и развиваться постепенно. Острое нарушение артериального кровообращения наиболее опасно в плане развития массивного некроза тканей. Основными причинами острого нарушения артериального кровообращения являются:
4. повреждение магистрального сосуда
5. тромбоз
6. эмболия кровяным тромбом, воздушная и жировая эмболия, эмболия инородными телами
Повреждение магистрального сосуда
При травме может произойти пересечение или разрыв артерии, сдавление ее костными отломками, образование гематомы, сдавливающей магистральный сосуд. К травматическим повреждениям артерий условно можно отнести наложение жгута на конечность на длительный срок, а также перевязку артерии во время операции (как правило случайную). Так, например, при удалении желчного пузыря вместо пузырной артерии можно лигировать аномально расположенную печеночную артерию, что может вызвать развитие некрозов в печени и привести к гибели больного.
Тромбоз
Закрытие магистральной артерии кровяным тромбом обычно происходит на фоне предшествующего поражения сосудистой стенки вследствие хронического сосудистого заболевания, а также при заболеваниях, связанных с повышением вязкости крови и гиперкоагуляцией. Выраженность клинических пролявлений, характер некроза зависит от уровня тромбоза и его протяженности. Иногда эти проявления выражены умеренно или сглажены, что объясняется предшествующим хроническим поражением магистральной артерии с компенсаторным развитием коллатерального кровотока органа.
Эмболия
Эмболия – закупорка сосуда принесенным током крови тромбом, реже воздухом (при ранении крупных вен, нарушении техники внутрисосудистых вливаний), жиром (при переломе костей), крайне редко — инородным телом. В зависимости от локализации эмбола различают тромбоэмболию легочной артерии и тромбоэмболию артерий большого круга кровообращения (сонной, мезентериальной, бедренной и пр.). Причинами тромбоэмболии легочной артерии чаще всего являются тромбофлебит и флеботромбоз вен большого круга кровообращения, в частности вен нижних конечностей и малого таза. Тромбоэмболии артерий большого круга кровообращения встречаются при заболеваниях сердца (септический эндокардит, пороки, мерцательная аритмия, а также при атеросклерозе аорты и ее ветвей).
Клиника острых нарушений регионального артериального кровообращения
Клиническим проявлением острого нарушения артериального кровотока является развитие синдрома острой ишемии. Наиболее известна классификация стадий острой ишемии, предложенная В.С.Савельевым
Стадия 1 – стадия функциональных расстройств. Продолжается в течение нескольких часов. При этом наблюдаются сильнейшие, с трудом купируемые боли в органе. Отмечается побледнение и похолодание конечности, кожные покровы приобретают мраморную окраску. Пульс на периферических артериях отсутствует. Болевая и тактильная чувствительность сохранена, активные движения в суставах возможны, хотя и ограничены. Восстановление кровотока в этой стадии позволяет спасти конечность с полным восстановлением функции.
Стадия 2 – стадия органических изменений. Болевая и тактильная чувствительность отсутствуют, активные и пассивные движения в суставах резко ограничены, развивается мышечная контрактура, кожа синюшная. Продолжительность стадии – 12-24 часов. При восстановлении проходимости сосуда в этой стадии можно сохранить конечность, но отмечается ограничение функции, полное или частичное.
Стадия 3 – некротическая. Обычно наступает через 24-48 часов. Характеризуется развитием гангрены, начиная с самых дистальных отделов конечности. В этой стадии конечность утрачивает все виды чувствительности и возможность движения. Восстановление кровотока в этой стадии не спасает конечность от развития гангрены, но нередко снижает уровень демаркации и соответственно уровень ампутации конечности.
Следует отметить, что исход острой ишемии зависит от калибра обтурированного сосуда, уровня его закупорки, состояния коллатерального кровообращения и времени, прошедшего с момента закупорки.
Патогенез острой ишемии органа связан со следующими факторами. Закупорка или повреждение магистральной артерии приводят к острому растяжению сосуда над местом окклюзити с последующим рефлекторным спазмом всей артериальной системы органа – закупоренного сосуда, его ветвей, коллатералей ниже места закупорки. В дальнейшем образуется продолженный тромб ниже места закупорки.
Особенности клиники различных видов острого нарушения регионального
артериального кровообращения
При травматическом повреждении магистральной артерии интенсивный болевой синдром и изменение окраски кожи в зоне повреждения, связанные непосредственно с травмой, могут затруднить диагностику нарушения кровообращения. В связи с этим обязательным при исследовании пострадавшего с травмой является определение пульсации периферических артерий, а при необходимости и применение специальных методов диагностики. При этом перестает определяться пульсация артерии дистальнее зоны повреждения и развивается характерная клиника острой ишемии.
При тромбозе в клинике также преобладают классические симптомы острой ишемии, но зачастую они выражены умеренно, что объясняется тем, что в результате предшествующего хронического заболевания магистральной артерии (воспаление, обменные поражения стенки артерии и пр.) хорошо развитый коллатеральный кровоток компенсирует в какой-то степени острую недостаточность артериального кровообращения. Поскольку развитие тромбоза происходит постепенно, то расстройство кровообращения наступает менее быстро, чем при эмболии. В магистральных артериях (аорта, подвздошные и подключичные артерии) и в артериях конечностей все симптомы сводятся к развитию ишемических явлений, развивающихся чаще подостро. Явления гангрены наступают редко.
Особенностью клиники тромбоэмболии является внезапность появления симптомов острой ишемии, причем выраженность симптомов, как и частота развития обширных некрозов, большие, чем при тромбозе. Это связано с тем, что в большинстве случаев эмболы перекрывают неизмененные магистральные артерии, приводя к одномоментному прекращению мощного нормального притока крови, в то время как коллатерали обычно еще не развиты. Боль является первым и постоянным признаком тромбоэмболии. Она появляется внезапно, может быть столь интенсивной, что в некоторых случаях развивается шок. Боль редко бывает локализованной, она распространяется вниз от места поражения и связана со спазмом расположенного ниже сосудистого русла. Полную непроходимость артерии вызывает присоединившийся вторичный тромбоз с развитием симптомов ишемии конечности. Такое подострое течение заболевания встречается у 1 из 10 больных с тромбоэмболией крупных артерий.
Кроме общеклинических методов обследования, таких как опрос, осмотр, пальпация, перкуссия, аускультация необходимо исследовать пульсацию периферических артерий в стандартных точках как на пораженной конечности, так и на здоровой. Необходимо измерить окружность конечности, для диагностики ишемического отека. Измеряют окружность конечности на разных уровнях и сравнивают с данными, полученными при измерении здоровой конечности на том же уровне. При аускультации можно выявить систолический шум артерии, который появляется при ее стенозе.
Из специальных методов исследований, применяющихся при острых нарушениях периферического артериального кровотока, следует отметить осциллографию (регистрация пульсовых колебаний), реовазографию (графическая регистрация кровенаполнения тканей), ультразвуковую допплерографию (ультразвуковая графическая регистрация кровотока), термометрию и термографию (используют электротермометры и инфракрасное тепловидение), рентгенконтрастное исследование, капилляроскопию и лазерную допплерфлоуметрию (оценка периферического кровотока).
Л ечение острых нарушений регионального артериального кровообращения.
Первая помощь при тромбозе и тромбоэмболии включает введение обезболивающих и сердечно-сосудистых средств, транспортную иммобилизацию конечности стандартными или импровизированными шинами, обкладывание конечности пузырями со льдом и быструю транспортировку больного в хирургическое отделение. Первая помощь при травматическом повреждении артерий дополняется временной остановкой кровотечения и наложением асептической повязки.
Квалифицированная помощь при повреждении магистральных артерий заключается в хирургическом восстановлении кровотока по поврежденной артерии – наложении сосудистого шва, протезирования или шунтирования поврежденного сосуда.
Лечение тромбоза в остром периоде в основном консервативное. Применяют антикоагулянты прямого действия (гепарин), фибринолизин, спазмолитики и сосудорасширяющие средства. Свежий тромб легко растворяется под воздействием фибринолизина и гепарина, если подвести их непосредственно к тромбу. Современные возможности сосудистой, и рентгенинтервенционной хирургии позволяют это сделать. При остром тромбозе необходимо улучшить микроциркуляцию и корригировать реологические свойства крови. Одновременно с этими мероприятиями проводят дообследование больного и подготовку его к последующей реконструктивной операции на сосудах. Восстановление кровотока при тромбозе осуществляется путем тромбинтимэктомии, протезирования сосуда, или обходного шунтирования.
Консервативная терапия показана в ранней стадии (до 6 часов) заболевания, при очень тяжелом общем состоянии больного, при эмболии мелких артерий (голени, предплечья), неясной клинике заболевания, а так же как вспомогательное лечение при оперативном лечении.
Консервативное лечение включает антикоагулянты и фибринолитические средства (гепарин, стрептодеказа, стрептокиназа, урокиназа) – для предотвращения образования или лизиса продолженного тромба; спазмолитическую и сосудорасширяющую терапию, новокаиновые блокады, средства, улучшающие коллатеральное кровообращение. По необходимости назначают наркотические анальгетики, сердечные средства, кортикостероидные гормоны.
Хирургическое лечение эмболий включает радикальные операции – эмболэктомию, пластику артерий, протезирование и шунтирование сосудов. Эти операции направлены на восстановление проходимости сосудов.
Паллиативные операции (симпатэктомия) направлены на улучшение коллатерального кровообращения и снятия патологического спазма без восстановления проходимости магистрального сосуда. Различают прямую и непрямую эмболэктомию. При прямой делают разрез в области локализации тромба, вскрывают артерию, механически удаляют эмбол и накладывают сосудистый шов. Иногда применяют вакуум — аспирацию эмбола или его ретроградное вымывание. Непрямая эмболэктомия предусматривает применение катетера со специальным резиновым баллончиком на конце. (катетер Фогарти). После осуществления типичного доступа к соответствующей артерии последнюю вскрывают и в ее просвет вводят катетер, который продвигают за зону локализации тромба. Затем, с помощью шприца с инертным раствором раздувают баллончик и вытягивают зонд, удаляя при этом находящийся в артерии эмбол и восстанавливая кровоток.
В случае поступления больного с явными признаками гангрены необходима ампутация конечности.