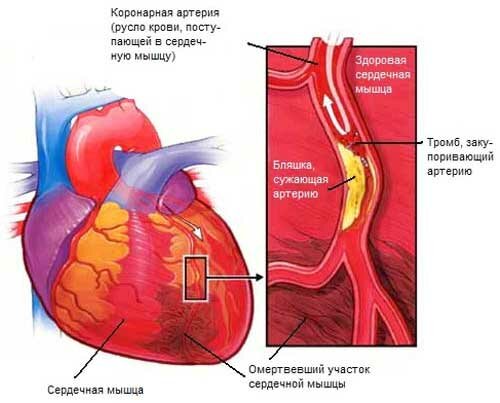
Патогенез основных клинических проявлений сердечной недостаточности: тахикардия, одышка, цианоз, отеки.
Одышка (dyspnoA; от греч. dyspnoia — затрудненное дыхание, одышка) — «затрудненное дыхание, характеризующееся нарушением его частоты, глубины и ритма, сопровождающееся комплексом неприятных ощущений в виде стеснения в груди, недостатка воздуха, могущих доходить до мучительного чувства удушья».
Одышка инспираторного характера (или, по Джеймсу Макензи, — «жажда воздуха») у больных с ХСН имеет сложное происхождение (значение каждого фактора в отдельности неодинаково у различных больных и при разных заболеваниях сердечнососудистой системы) и до сих пор имеются неразрешенные вопросы относительно ее генеза. По-видимому, в формировании одышки помимо застоя крови «выше» ослабленного отдела сердца (ЛЖ) с повышением давления в легочных капиллярах, за счет которых традиционно объясняется ее появление, могут принимать участие и другие, не до конца изученные факторы. В частности, восприятие затрудненного дыхания во многом зависит от диффузионной способности легких (одышка тем резче, чем сильнее выражена гипоксемия), реакции центральной нервной системы на изменение состава крови (гипоксемия, гиперкапния, ацидоз и др.), состояния периферической и дыхательной мускулатуры и массы пациента. Способствует появлению одышки скопление жидкости в плевральной и брюшной полостях, затрудняющей дыхательную экскурсию легких. Возможно, также в основе этого симптома лежит снижение растяжимости легких и повышение внутриплеврального давления, что приводит к повышению работы дыхательных мышц и вспомогательной мускулатуры. К этому следует добавить, что у больных с длительно существующим полнокровием легких развивается их застойный (индуративный) склероз — бурое уплотнение (индурация) легких.
О чувствительности, специфичности и прогностической значимости одышки речь шла уже. Главное о чем необходимо помнить — это низкая специфичность данного симптома.
Естественно, в начальной стадии ХСН одышка в покое отсутствует и появляется только при интенсивном мышечном напряжении (подъем по лестнице или в гору, при быстрой ходьбе на большие дистанции). Пациенты свободно передвигаются по квартире и могут занимать любое удобное для себя положение. С прогрессированием сердечной недостаточности одышка наблюдается уже при незначительных нагрузках (даже при разговоре, после еды, во время ходьбы по комнате), затем — становится постоянной. И, наконец, больной получает некоторое облегчение только в вынужденном вертикальном положении — состояние ортопноэ. При этом одышка становится для больного самым тяжким симптомом заболевания сердца. Для тяжелых форм ХСН характерно развитие мучительной одышки по ночам (см. ниже «ортопноэ» и «сердечная астма»). Очень часто пациенты избегают положения на левом боку, так как при этом возникают неприятные ощущения со стороны сердца, которые они обычно не могут хорошо описать, и усиливается одышка (предполагают, что в таком положении происходив более тесное прилегание дилатированного сердца к передней грудной стенке). Многим больным с ХСН облегчение приносит пребывание перед открытым окном.
С развитием гипоксии центральной нервной системы при тяжелой ХСН и особенно в случаях, осложненных атеросклерозом мозговых артерий, может возникнуть периодическое дыхание Чейна-Стокса (Cheyne-Stokes).
Ортопноэ (orthopnoji от греч. orthos — «прямой» и рnоае — «дыхание» — высокая степень одышки с вынужденным (полусидячее или сидячее) положением больного. Ортопноэ является не только высокоспецифичным симптомом ХСН, но и ее объективным признаком, обнаруживаемым при осмотре пациента. Больные с тяжелой ХСН чаще сидят в кресле, на кровати (если у них остаются силы сесть), опустив ноги, наклонившись вперед, опираясь на спинку стула, придвинутый стол или полулежат, опустившись на подушки (высокое изголовье создается с помощью нескольких подушек или свернутого матраца). Любая попытка лечь вызывает у них резкое усиление одышки. Иногда (в случаях нелеченной или «рефрактерной» ХСН) сильная одышка заставляет больного проводить все время — днем и ночью (только так он может на короткое время забыться сном) — сидя. Он просыпается от чувства нехватки воздуха, если голова соскальзывает с подушек. Бессонные ночи могут продолжаться неделями, пока пациент не получит облегчение от терапии ХСН. Этот феномен особенно характерен для недостаточности левого сердца. Ортопноэ объясняется тем, что в вертикальном положении больного происходит перемещение крови (депонирование в венах нижней части туловища и конечностях) с уменьшением венозного возврата к правому предсердию, и, следовательно, малый круг кровообращения становится менее полнокровным. Улучшению дыхательной функции в вертикальном положении способствует создание лучших условий для движения диафрагмы, а также для работы вспомогательных дыхательных мышц. Ортопноэ обычно исчезает (или становиться значительно менее выраженным) при нарастании правожелудочковой сердечной недостаточности, вторичной по отношению к левожелудочковой.
Сердцебиение (palpitatio cordis — «сердечная гонка») — третий по частоте выявления симптом ХСН, который выражается в ощущении больным каждого сокращения своего сердца. Чаще сердцебиение ощущается при тахикардии (отсюда синоним — сердечная «гонка»), но может быть и при нормальной частоте сердечных сокращений и даже брадикардии. По-видимому, для ощущения сердцебиения имеет значение не только частота сокращений сердца, но и их характер и состояние нервной системы (лица сповышенной возбудимостью нервной системы жалуются на сердцебиение чаще). Известно, что в нормальных условиях человек не ощущает деятельности своего сердца, как и моторной активности других внутренних органов, так как большинство рефлексов со стороны соматических органов замыкается в рефлекторных дугах областей центральной нервной системы, расположенных ниже коры больших полушарий, и поэтому не осознается человеком в чувственном восприятии. Изменение силы и качества этих рефлексов при заболеваниях сердечно-сосудистой системы приводит к тому, что они доходят до коры головного мозга. Однако иногда при тяжелых поражениях сердца, учащенные и сильные его сокращения, которые видно по сотрясению стенки грудной клетки, жалобы на сердцебиение отсутствуют.
В начальных стадиях ХСН частота ритма сердца в состоянии покоя не отклоняется от нормы, и тахикардия возникает лишь при физической нагрузке, но в отличие от физиологического учащения пульса у больных с сердечной недостаточностью он нормализуется не по прекращении нагрузки, а через 10 мин и позже. При прогрессировании ХСН сердцебиение и тахикардия отмечаются и в покое. Тахикардия является компенсаторной гемодинамической реакцией, направленной на поддержание на достаточном уровне ударного (механизм Боудича) и минутного объема крови, эффективности которой большинством исследователей дается низкая оценка (за исключением ситуаций с недостаточностью клапанов сердца) — быстро становится несостоятельной, приводя к еще большему переутомлению миокарда. У больных ХСН тахикардия объясняется гуморальными (активация симпатоадреналовой системы и др.), рефлекторными (рефлекс Бейнбриджа с растягивающихся от полнокровия устьев полых вен) влияниями на сердце, но иногда может быть связана с приемом лекарственных препаратов (например, нитратов или антагонистов кальция короткого действия дигидропиридинового ряда), злоупотреблением крепким кофе, чаем, курением табака.
Больные с ХСН могут ощущать также «перебои» в работе сердца, остановку сердца с его последующим сильным ударом, внезапное учащение сердечного ритма и другие субъективные проявления нарушений ритма и проводимости.
Отеки (от греч oidax — «пухну» в лат. oedema — «опухоль, отек»), обнаруживаемые больными с ХСН, свидетельствуют о том, что объем внеклеточной жидкости увеличен более чем на 5 л. и этап «скрытых отеков» уже пройден. Скрытые отеки можно выявить путем взвешивания или с помощью пробы Мак-Клюра-Олдрича (McClure-Aldrich) по увеличению скорости (в норме составляет 40—60 мин) рассасывания 0,2 мл физиологического раствора (в классическом варианте 0,8% раствора NaCl), введенного внутрикожно тонкой иглой в самый поверхностный слой эпидермиса (кончик иглы должен просвечиваться!) с образованием «лимонной корки» обычно на волярной поверхности предплечья. Также о скрытых отеках свидетельствует резкое увеличение диуреза после применения диуретиков или сердечных гликозидов.
Отмечается выраженная зависимость отеков от положения тела: они распространяются снизу вверх. Сердечные отеки локализуются сначала только в отлогих местах — симметрично, на участках, расположенных наиболее низко. На ранних стадиях при вертикальном расположении больного (у лежащего больного отеки дебютируют с поясницы!) имеется лишь отечность тыльной поверхности стоп, возникающая к вечеру и исчезающая к утру (характерная жалоба — «обувь к вечеру становится тесной»). По мере развития они распространяются на голеностопные суставы (у мыщелков), затем поднимаются на голень и выше, захватывают руки и половые органы. В дальнейшем отеки ног становятся постоянными и они распространяются на нижнюю часть живота и поясницу вплоть до анасарки (на лице, шее и груди отеков обычно не бывает!). Если пациента при уже развитых стойких отеках ног перевести на постельный режим, то они могут значительно уменьшиться и даже исчезнуть, но они появляются или увеличиваются (перемещаются) на пояснично-крестцовой области. При длительном существовании отеков возникают трофические изменения кожи, трещины (при массивных отеках кожа нередко лопается и из разрывов вытекает жидкость), дерматит.
Патогенез отеков у пациентов с ХСН может быть удовлетворительно объяснен на основе гидродинамических представлений Старлинга. Однако механический (гидродинамический) фактор не является единственным, а иногда, по-видимому, и главным. Причины возникновения отеков у этих больных весьма разнообразны — имеет значение целый комплекс нейрогуморальных, гемодинамических и метаболических факторов.
Отеки традиционно связывают с недостаточностью правого желудочка, но они могут быть и при снижении сократимости левого желудочка. Отеки, обусловленные преимущественно правожелудочковой недостаточностью и венозным застоем, обычно появляются позже, чем увеличивается печень, они обширны, плотны на ощупь, кожа над ними истончена, цианотична, с трофическими изменениями. Отеки при дисфункции левого желудочка возникают раньше, чем венозный стаз, невелики, мягки, смещаемы, расположены на удаленных от сердца участках тела, кожа над ними бледная. Если первого рода отеки зависят от венозного застоя, то отеки второго рода являются результатом гипоксемических нарушений, порозности стенок капилляров в результате замедления циркуляции крови.
Отеки (и в анамнезе и по данным физического обследования) являются малочувствительным признаком ХСН и могут быть связаны с нарушениями местного венозного или лимфатического оттока (в частности, варикозное расширение вен с венозной недостаточностью II—III степени), заболеваниями печени и почек и др. Поэтому сердечный генез отеков устанавливается только на основании всестороннего обследования больного.
Изменения массы тела. Внезапная прибавка в весе (иногда на 2 кг и более за 2-3 дня) является признаком нарастающей декомпенсации сердечной деятельности. Многообразные изменения обмена веществ у больных с ХСН, едва заметные в начале, в III стадии приводят к исключительно тяжелым нарушениям питания всех тканей и органов — наблюдается прогрессирующее снижение массы тела (развивается так называемая сердечная кахексия, которая некоторое время маскируется наличием отеков).
Цианоз (лат. cyanosis — «синюха» от греч. kyaneos — «темносиний») — синюшное окрашивание кожных покровов считается частым признаком ХСН. Тем не менее, о качественных исследованиях, в которых были бы точно установлены чувствительность и специфичность этого клинического признака, нам не известно. Появление цианоза у больных с ХСН связывают со снижением скорости кровотока и повышением поглощения кислорода в тканях, а также с недостаточной артериализацией крови в легочных капиллярах, в результате чего повышается содержание в крови восстановленного гемоглобина (имеет синий цвет). Степень выраженности цианоза и его характер зависят также от функциональных и органических изменений мелких артерий (ангиоспазм, облитерирующий эндартериит и др.), диаметра мелких венул, активности функционирования артерио-венозных анастомозов (феномен «короткого замыкания»). Первые проявления цианоза у больных ХСН носят название акроцианоза (от греч. асгоп — край, конечность + kyaneos — темно-синий), то есть цианоза участков тела, наиболее далеко расположенных от сердца (кончик носа, мочки ушей, губы, ногти руки ног). Возникновение акроцианоза обуславливается главным образом замедлением кровотока и поэтому он носит периферический характер (его часто называют периферическим цианозом). Отличить периферический цианоз от центрального, обусловленного заболеванием органов дыхания (необходимо помнить о функциональных и структурных изменениях в легких у пациентов с хронической левожелудочковой недостаточностью, приводящих к нарушению насыщения крови кислородом, что существенным образом затрудняет дифференциальную диагностику), можно с помощью двух приемов:
1) делают массаж мочки уха до появления «капиллярного пульса» — в случае периферического цианоза синюшность мочки исчезает, а при центральном — сохраняется;
2) дают больному дышать чистым кислородом в течение 5—12 мин — если после этого цианоз не исчезнет, значит, он носит периферический (сердечный) характер.
При нарастании сердечной слабости и кислородной недостаточности цианоз увеличивается (от едва заметной синюшности до темно-синей окраски) и приобретает распространенный характер (вся кожа и слизистые приобретают синюшный оттенок) — центральный цианоз, когда насыщение артериальной крови кислородом падает до 80% и ниже. По своей патофизиологической сущности (нарушение артериализации крови) и клиническим проявлениям последний очень близок к таковому, наблюдающемуся у пациентов с заболеваниями органов дыхания. Особенно резкий центральный цианоз наблюдается у больных с врожденными пороками сердца при наличии артерио-венозного сообщения («черные сердечные больные»). К так называемым порокам «синего типа» относят тетраду Фалло (стеноз выходного отдела легочной артерии, дефект межжелудочковой перегородки, декстропозиция аорты, гипертрофия правого желудочка), комплекс Эйзенменгера (субаортальный дефект межжелудочковой перегородки, «верхом сидящая» над этим дефектом аорта, гипертрофия и расширение правого желудочка, нормальная или расширенная легочная артерия), болезнь Эбштейна (дисплазия и смещение трехстворчатого клапана в полость правого желудочка), стеноз легочной артерии, общий артериальный (аортопульмональный) ствол, атрезию трехстворчатого клапана, варианты транспозиции магистральных сосудов, дефекты межпредсердной и межжелудочковой перегородки. Цианоз может также возникать и при отравлении веществами, образующими метгемоглобин, сульфагемоглобин (сульфаниламиды, фенацетин, анилин, нитробензол, бертолетова соль, мышьяковистый водород, нитраты и нитриты и др.).
Бледность кожных покровов и слизистых оболочек у больных с ХСН может сочетаться с цианозом (так называемый «бледный цианоз») при аортальных пороках сердца (стеноз устья аорты, недостаточность аортальных клапанов), коллапсе, обильных кровотечениях, инфекционном эндокардите. При стенозе митрального отверстия бледность сочетается с фиолетово-красным «румянцем» на щеках — «митральная бабочка».
Аритмия сердца. Сердечная недостаточность
18 января, 2009
Аритмия сердца – это нарушения периодичности возбуждения и сокращения сердца, его ритмичности.
Аритмия, болезнь широко распространённая, она может возникнуть во время любого сердечного заболевания и под воздействием вегетативного, эндокринного и прочих метаболических нарушений. Серьёзное значение имеют электролитные расстройства, а именно, отклонения от нормы калия и кальция. содержащихся в клетке. Аритмия может возникнуть при интоксикации организма и при некоторых действиях лекарства, она может быть связана с врождёнными особенностями проводящей системы.
В основе аритмии лежит нарушение электрофизиологических качеств проводящей системы и сократительного миокарда. Диагностируют аритмии, как правило, по ЭКГ, в виде: синусовой аритмии, пароксизмальной тахикардии. экстрасистолии, трепетания предсердий, мерцания предсердий, трепетания и мерцания желудочков, атриовентрикулярной блокады, синоатриальной блокады, блокады ножек пучка Гисса и т.д.
Сердечная недостаточность
Это недостаточность кровообращения. Хронической сердечной недостаточностью называют состояние, при котором сердце не может справиться со своими насосными функциями, то есть, оно не обеспечивает нормального кровообращения. Причин появлению такого состояния довольно много: это и ишемическая болезнь сердца, и его пороки, и артериальная гипертензия, а также диффузные заболевания лёгких, дистрофия миокарда, миокардит и пр.
Симптомы и течение хронической сердечной недостаточности.
Симптомы различают в зависимости от поражённого отдела сердца. Так, при недостаточности работы левого желудочка у больного появляется одышка, при сидении наблюдается упор рук в колени, в целом сердцебиение учащенное. Параллельно может наблюдаться проявление недостаточности мозгового кровообращения – головокружения. потемнение в глазах и даже обмороки. Недостаточность работы правого желудочка сердца проявляется в набухании вен шеи, синюшностью кончиков пальцев, губ и носа, увеличением печени, различными отёками тела и полостей организма. При длительном течении сердечной недостаточности кожа больного становится тонкой, дряблой, она блестит, отёки покрывают все тело, происходит постепенное истощение организма.
Нормальный ритм сердцебиения обеспечивается автоматически синусовым узлом, он так и называется — синусовый. Частота синусового ритма у большинства взрослых здоровых людей, находящихся в состоянии покоя, составляет 60-75 ударов в минуту.
Синусовая аритмия – это синусовый ритм, при котором превышена разница между интервалами R-R на ЭКГ на 0,1 с. Дыхательная синусовая аритмия – это физиологичное явление, которое более заметно у молодых людей и при медленном глубоком дыхании по пульсу или ЭКГ. Среди факторов, учащающих синусовый ритм, можно отметить физические и эмоциональные нагрузки, симпатомиметики. Они способны уменьшить или полностью устранить дыхательную синусовую аритмию. Синусовая аритмия, которая не связанна с дыханием, встречается крайне редко. Сама по себе она лечения не требует.
Синусовая тахикардия – это синусовый ритм с частотой ударов свыше 90-100 в 1 минуту. У здоровых людей она проявляется во время физических нагрузок и эмоциональных возбуждениях. Явная склонность к синусовой тахикардии есть проявление нейроциркуляторной дистонии. Тахикардия в таком случае заметно уменьшается, если задержать дыхание.
Временные проявления синусовой тахикардии возникают под влиянием симпатомиметиков, атропина, при быстром снижении артериального давления любого происхождения, после приёма алкогольных напитков. Стойкая синусовая тахикардия возникает во время лихорадки, тиреотоксикоза. миокардита. при сердечной недостаточности, проявлении анемии и тромбоэмболии легочной артерии. Она может сопровождаться ощущением собственного сердцебиения.
Лечение аритмии и сердечной недостаточности должно быть направлено на устранение основного заболевания. При проявлении тахикардии, которая обусловлена тиреотоксикозом, вспомогательное значение имеет использование бета-адреноблокаторов. Синусовая тахикардия, связанная с нейроциркуляторной дистонией, лечится применением в малых дозах седативных средств и бета-адреноблокаторами. При тахикардии, обусловленной сердечной недостаточностью, врач назначает сердечные гликозиды.
Перед применением необходимо проконсультироваться со специалистом.
Автор: Пашков М.К. Координатор проекта по контенту.
ПАТОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПАТОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ — раздел Философия, ПАТОЛОГИЯ По Данным Всемирной Организации Здравоохранения В Экономически Развитых Стран.
По данным Всемирной Организации Здравоохранения в экономически развитых странах сердечно-сосудистые заболевания являются причиной смертности людей в 45-52%. Не зря за ними закрепился термин «убийца № 1». Кроме того, заболевания сердечно-сосудистой системы характеризуются высокой инвалидизацией трудоспособного населения, а также лиц молодого возраста и детей, отмечается тенденция увеличения заболеваемости, в том числе и в сельской местности.
Кровообращение — один из важнейших физиологических процессов, поддерживающих гомеостаз, обеспечивающих непрерывную доставку органам и тканям необходимых питательных веществ и кислорода, удаление углекислого газа и продуктов обмена, осуществляющих иммунную защиту и гуморальную регуляцию физиологических функций.
Недостаточность кровообращения — это такое состояние, при котором система кровообращения не обеспечивает потребность тканей и органов в кровоснабжении, адекватном уровню их функции и пластических процессов в них.
Недостаточность кровообращения обычно подразделяют на сердечную, сосудистую и смешанную (сердечно-сосудистую). В свою очередь, каждая из этих форм может быть верифицирована:
• по особенностям возникновения и характеру течения — острой (возникает внезапно, развивается в течение нескольких часов и суток) и хронической
• по компенсированности гемдинамических расстройств — компенсированной (признаки нарушения кровообращения выявляются при нагрузке) и некомпенсированной (субкомпенсированной, декомпенсированной), для которой характерно то, что признаки нарушения кровообращения наблюдаются в покое.
Основные причины, вызывающие недостаточность кровообращения:
— расстройство сердечной деятельности;
— нарушение тонуса стенок кровеносных сосудов;
— изменение объема циркулирующей крови и (или) нарушение ее
реологических свойств.
Острая недостаточность кровообращения возникает при инфаркте миокарда, острой сердечной недостаточности, аритмиях сердца (пароксизмальная тахикардия, выраженная брадикардия), шоке, острой кровопотере.
Хроническая недостаточность кровообращения формируется при перикардитах, длительно текущих миокардитах, миокардиодистрофиях, кардиосклерозе, артириальной гипер- и гипотензии, анемиях, гиперволемии.
Известно около 50 факторов риска, существенно влияющих на возникновение кардио-васкулярной патологии. Основными являются: повторные и затяжные стрессорные воздействия, хроническая гиподинамия, интоксикация алкоголем, курение, так называемые «бытовые допинги» (избыточное употребление чая, кофе и др.), некачественное и несбалансированное питание, систематическое переедание и как результат ожирение.
Сердечная недостаточность — это неспособность сердца обеспечивать адекватное кровоснабжение органов без участия компенсаторных механизмов, не приводимых в действие при тех же обстоятельствах, если функциональные возможности сердца находятся в пределах нормы.
Профессор Ф.З. Меерсон рекомендовал под сердечной недостаточностью понимать такое состояние, при котором нагрузка, подающая на сердце, превышает его способность совершать работу, адекватную нагрузке.
Недостаточность сердца может выражаться в следующих формах:
• по механизмам возникновения:
— метаболическая (или первично-миокардиальная);
— от перегрузки давлением;
— от перегрузки объемом;
— смешанная;
• в зависимости от того, в какую фазу сердечного цикла наблюдаются первичные нарушения функций сердца:
— систолическая;
— диастолическая;
— хроническая;
• в зависимости от того, в каком отделе сердца имеются первичные нарушения:
— преимущественно левожелудочковая;
— преимущественно правожелудочковая;
— тотальная;
• в зависимости от состояния защитно-компенсаторных механизмов:
— начальная (компенсированная);
— выраженная (декомпенсированная обратимая);
— конечная (декомпенсированная необратимая).
Сгруппировав причины сердечной недостаточности, Г.Ф.Ланг и А.Л. Мясников предложили следующие варианты недостаточности сердца (по причинам):
1 группа — переутомление миокарда (пороки клапанного аппарата
сердца, артериальные гипертензии, пневмосклероз и др.);
2 группа — нарушение кровоснабжения сердечной мышцы (тромбоз,
эмболия коронарных артерии и др.);
3 группа — инфекционные и токсические (скарлатина, дифтерия, яды,
иммунные повреждения сердца, алкоголь и др.)
4 группа — нарушения обмена веществ в миокарде (вегетативные
нарушения нервной системы, гормональные расстройства,
нарушение метаболизма в организме);
В дальнейшем появилась рекомендация выделить еще группу причин (соответственно и видов) сердечной недостаточности:
5 группа — нарушение функционирования перикарда (перикардиты, тамионада сердца).
Недостаточность сердца приводит к нарушению гемодинамики в организме. Основными показателями являются: повышение конечно- диастолического давления в желудочках сердца и увеличение их конечно- диастолического объема, снижение систолического и минутного объемов сердца, повышение центрального венозного и венозного давлений, нередко наблюдается снижение артериального давления. Ранними гемодинамическими признаками формирующейся сердечной недостаточности являются: снижение фракции выброса и повышение конечно-диастолического давления в желудочках сердца.
Компенсаторные механизмы гемодинамических нарушений при сердечной недостаточности могут быть срочными (включаются быстро, но действуют непродолжительно) и долговременными (включаются постепенно, но действуют длительно), кардиальными (связаны с изменением сердца) и экстракардиальными (зависят от изменений функций других органов и систем, а не сердца).
К срочным кардиальным механизмам относят: тахикардию, гетерометрический механизм Франка-Старлинга и гомеометрический механизм.
Гетерометрический механизм включается, если увеличивается объем крови в желудочках сердца, что приводит, естественно, к большему растяжению мышечных волокон этой полости сердца и, как следствие, по закону Франка- Старлинга развивается более сильное мышечное сокращение. Увеличение сердечного выброса (так называемого минутного объема) происходит за счет ударного объема (т.е. количества крови, выбрасываемое за одно сокращение, а при другом механизме — за счет более высокой частоты сердечных сокращений (тахикардии).
Гомеометрический механизм включается тогда, когда повышается давление в кровеносных сосудах (гипертоническая болезнь, гипертензия большого или малого круга кровообращения), либо возникает препятствие, затрудняющее выброс крови из полости сердца (например, при стенозах клапанных отверстий). Происходит резкое увеличение напряжения мышечных волокон сердца. Гомеометрический механизм (в отличие от гетерометрического) требует в 7-10 раз больше энергии (АТФ).
Срочные экстракардиальные механизмы представлены повышением активности симпатического отдела вегетативной нервной системы (что выражается в положительных батмо-, хроно-, дромо- и инотропном эффектах в деятельности сердца); увеличении объема циркулирующей крови (включает механизм Франка-Старлинга); повышении способности потребления кислорода тканями из единицы объема притекающей крови.
Срочные кардиальные и экстракардиальные механизмы включаются при формировании острой сердечной недостаточности, а долговременный кардиальный механизм — при хронической недостаточности сердца. И этим механизмом является гипертрофия (увеличение массы) миокарда (см. в разделе хроническая сердечная недостаточность).
Для нормальной функции сердца, прежде всего, необходима хорошая энергетика. Именно она (достаточный уровень АТФ) обеспечивает работу мембранной К+-№+ АТФ-азы, восстанавливая деполяризацию и создавая готовность кардиомиоцитов к сокращению. От количества АТФ зависит активность Ca++-Mg++ АТФ-азы, обеспечивая полноту расслабления мышцы сердца. Да и в основе мышечного сокращения, как известно, лежит взаимодействие миозина с актином при участии АТФ (на что тратится до 90% всей энергии миокарда). Поэтому нарушение энергоснабжения сердца является инициальным и ведущим фактором его повреждения в патогенезе коронарной и сердечной недостаточности.
Расстройства энергетического обмена в миокарде приведут к энергодефициту, который может быть обусловлен нарушениями на любом этапе биоэнергетики миокарда: образования и накопления энергии; транспорта энергии; преобразования макроэргов в энергию напряжения миофибрилл; преобразования энергии напряжения миофибрилл в общую работу сердца; преобразования работы сердца в его внешнюю работу.
Основными клиническими проявлениями сердечной недостаточности являются: тахикардия, одышка, цианоз и отеки.
Тахикардия, как срочный кардиальный механизм компенсации, поддерживает на должном уровне минимальный объем крови, но одновременно и укорачивает диастолу, тем самым ухудшая кровоток в сердечной мышце. Тахикардия должна быть обеспечена дополнительной энергией макроэргов и приводит к утомлению сердца. Тахикардия при сердечной недостаточности возникает в результате включения нейрогенного и гуморального механизмов. Нейрогенный связан с включением рефлекса Бейнбриджа (в результате венозного застоя крови, повышения венозного давления, раздражения барорецепторов в устьях полых вен и рефлекторно — увеличение частоты и силы сердечных сокращений). Гуморальный механизм тахикардии при сердечной недостаточности включается в результате изменений газового и химического состава крови. Тахикардия субъективно воспринимается пациентами как ощущение сердцебиения.
Одышка при сердечной недостаточности формируется в результате застоя крови в сосудах малого круга кровообращения (повышается кровенаполнение легких) и изменения газового и химического состава крови.
Цианоз может быть центральным, периферическим и смешанным. Центральный возникает в результате недостаточного насыщения крови кислородом в легких. Периферический — в результате замедления тока крови по капиллярам, что ведет к более полному использованию кислорода тканями. Основным механизмом цианоза при сердечной недостаточности является недостаточное насыщение крови кислородом.
Отеки являются клиническим проявлением сердечной недостаточности (патогенез сердечного отека изложен в лекции «Нарушения водного обмена»).
1. Острая сердечная недостаточность
Острая сердечная недостаточность — это внезапное нарушение насосной функции сердца, приводящее к невозможности обеспечения адекватного кровообращения, несмотря на включение компенсаторных механизмов.
По этиологии, патогенезу и клиническим проявлениям острую сердечную недостаточность подразделяют на:
• острую правожелудочковую недостаточность сердца;
• острую левожелудочковую недостаточность сердца;
• тотальную.
По центральной гемодинамике выделяют острую сердечную недостаточность:
• с низким сердечным выбросом;
• с относительно высоким сердечным выбросом.
Причинами острой сердечной недостаточности с низким сердечным
выбросом являются: инфаркт миокарда, декомпенсация хронической сердечной недостаточности, аритмии сердца, недостаточность митрального и аортального клапанов сердца, миокардиты, тромбоэмболия легочной артерии, «легочное сердце», артериальная гипертензия, тампонада сердца.
Несколько иные причины вызывают развитие острой недостаточности сердца с относительно высоким сердечным выбросом: анемии, тиреотоксикоз, острый гломерулонефрит, артериоло-венулярное шунтирование.
Острая левожелудочковая недостаточность сердца формируется у пациентов с митральной недостаточностью, аортальным стенозом, коронарокардиосклерозом, инфарктом миокарда левого желудочка. Основное звено патогенеза — застой в малом круге кровообращения. Проявлением острой левожелудочковой недостаточности сердца могут быть: церебральный синдром (симптоматика связана с острым нарушением мозгового кровотока); легочный синдром (сердечная астма и отек легких); кардиогенный шок.
Сердечная астма и отек легких при острой левожелудочковой сердечной недостаточности формируется в результате снижения систолического объема (т.к. угнетается сократительная функция левого желудочка сердца), что приводит к застою крови в малом круге кровообращения и повышению давления в легочных венах, в результате чего вода из сосудистого русла (водного раздела крови) устремляется в легкие. Сердечная астма и отек легких имеют один патогенез и отличаются только степенью оводнения легочной ткани. При отеке легких количество воды, поступившей в легкие, больше. Таким образом, можно отметить, что сердечная астма — это только интерстициальный отек легких.
Кардиогенный шок — это остро развивающийся патологический процесс, возникающий при инфаркте миокарда и характеризующийся нарушением системной, региональной гемодинамики и жизнедеятельности организма. Пусковым патогенетическим фактором кардиогенного шока является снижение сократительной функции миокарда, что приводит к уменьшению минутного объема кровообращения и, как результат — снижается артериальное давление и уменьшается объем циркулирующей крови, что через раздражение баро- и волюморецепторов способствует выбросу катехоламинов в кровь, вызывая спазм периферических сосудов и расширение сосудов жизненноважных органов (головной мозг, сердце и др.). Спазм периферических сосудов приведет к гипоксии тканей, нарушит микроциркуляцию и метаболизм, вызовет метаболический тканевой ацидоз.
Присоединение к кардиогенному шоку ДВС-синдрома (диссеменированное внутрисосудистое свертывание крови) делает кардиогенный шок необратимым.
Таким образом, при кардиогенном шоке главные события разворачиваются на периферии, и лечить пациентов при наличии у них кардиогенного шока надо, в первую очередь, восстанавливая микроциркуляцию. Исходами острой сердечной недостаточности являются: полное выздоровление, летальный исход и переход в хроническую форму недостаточности сердца.
2. Хроническая сердечная недостаточность
Хроническая сердечная недостаточность, в отличие от отстрой, формируется постепенно, по этапам и чаще всего самостоятельно, т.е. у практически здоровых лиц, но может формироваться и как исход острой.
Согласно Нью-Йоркской функциональной классификации, выделяют следующие стадии хронической недостаточности сердца:
1. Стадия I характеризуется тем, что только чрезмерная физическая нагрузка вызывает проявления хронической недостаточности сердца (одышка, сердцебиение, боли в области сердца).
2. Стадия II — пациенты чувствуют себя комфортно только в покое, обычные физические нагрузки дают проявления хронической сердечной недостаточности.
3. Стадия III — любые физические нагрузки вызывают проявления хронической недостаточности сердца.
4. Стадия IV — симптомы хронической сердечной недостаточности проявляются и в покое.
В динамике развития хронической недостаточности сердца выделяют три этапа:
• первый — компенсаторная гиперфункция сердца;
• второй — гипертрофия миокарда;
• третий — декомпенсация гипертрофированного сердца.
Компенсаторная гиперфункция сердца, как первый этап развивающейся
хронической сердечной недостаточности, является вариантом патологической гиперфункции сердца, так как она длительна, непрерывна и необратима (в отличие от физиологической гиперфункции сердца).
В зависимости от того, какой тип мышечного сокращения обеспечивает гиперфункцию миокарда (изотоническое сокращение характеризуется уменьшением длины мышечных волокон при неизменяющемся напряжении, а изометрическое — длина мышечных волокон не изменяется, в то время как напряжение повышается), выделяют изотоническую и изометрическую гиперфункции. Изотоническая гиперфункция достигается за счет увеличения конечно-диастолического объема желудочков при неизмененной сократимости миокарда, а изометрическая гиперфункция достигается за счет увеличения сократимости миокарда при неизмененном конечно-диастолическом объеме желудочков.
Основными причинами изотонической гиперфункции миокарда являются: тяжелая мышечная работа, высотная гипоксия, клапанная недостаточность. Изометрическую гиперфункцию сердца вызывают артериальные гипертензии и пороки клапанов сердца в виде стенозов. Изометрическая гиперфункция более энергозатратна, чем изотоническая, и быстрее приводит ко второму этапу хронической сердечной недостаточности — гипертрофии миокарда.
Гипертрофия миокарда, как этап развития хронической сердечной недостаточности (по Ф.З. Меерсону), осуществляется в три стадии. Аварийная стадия характеризуется тем, что повышенный синтез белка идет на образование новых митохондрий в миокарде. В стадию завершившейся гипертрофии и относительно устойчивой гиперфункции повышенный синтез белка переключается на образование сократительных белков. В эту стадию масса миокарда увеличивается, тем самым относительно уменьшается нагрузка на единицу массы миокарда. Начинают появляться и прогрессировать микроочаги кардиосклероза (образование соединительной ткани в сердечной мышце в результате тканевого ацидоза). В стадию прогрессирующего кардиосклероза продолжающийся повышенный синтез белка переключается на образование соединительной ткани. По мере развития хронической недостаточности кардиосклероз возрастает.
Однако, гипертрофия, являющаяся долгосрочным механизмом компенсации сердца, при хронической его недостаточности, приводит к несбалансированному росту гипертрофированного сердца на различных уровнях. На уровне органа наблюдается отставание в развитии нервного аппарата от мышечной массы сердца, что приводит к нарушению регуляторного обеспечения гипертрофированного сердца. На уровне ткани отмечается существенное отставание роста артериол и капилляров от увеличенной мышечной массы. Этот дисбаланс приводит к ухудшению доставки кислорода и питательных субстратов и нарушает энергетическое обеспечение миокарда. На уровне клетки дисбаланс выражается, с одной стороны, в том, что более значительно увеличивается масса клеток, по сравнению с их поверхностью, а с другой — объем клетки увеличивается в большей степени, чем ее поверхность. Дисбалансы на клеточном уровне приводят к нарушению функционирования клеточных ионных насосов. На уровне внутриклеточных органелл имеет место увеличение миофибрилл, которое отстает от возрастания количества митохондрий. Этот дисбаланс приводит к ухудшению энергетического обеспечения гипертрофированного сердца. На молекулярном уровне имеет место значительное увеличение сократительных белков, однако снижается АТФ-азная активность миозина, что нарушает использование макроэргов.
Таким образом, несбалансированные формы роста на разных уровнях лежат в основе патогенеза декомпенсации гипертрофированного сердца при хронической сердечной недостаточности.
Исходы хронической сердечной недостаточности:
• декомпенсация, приводящая к летальному исходу,
• осложнение хронической недостаточности сердца в форме острой сердечной недостаточности (внезапная сердечная смерть).
Функции сердца существенно могут нарушаться при расстройствах коронарного кровотока. Ишемия миокарда — это состояние относительного дефицита поступления кислорода с кровью, не соответствующее потребностям сердца в кислороде.
3. Нарушения коронарного кровообращения
Ишемическая болезнь сердца — это клинический синдром, вызванный сужением просвета коронарных (венечных) артерий сердца вследствие нарастающих атеросклеротических изменений в их стенке, что ведёт к уменьшению или прекращению доставки крови к миокарду. При этом возникает несоответствие между потребностью миокарда в кислороде и его реальным обеспечением. Ишемическая болезнь сердца по клиническим проявлениям включает:
• внезапную коронарную смерть;
• стенокардию (болевой синдром, обусловленный преходящей локальной ишемией миокарда);
• инфаркт миокарда (ишемический некроз миокарда);
• хронические формы (например, постинфарктный, атеросклеротический кардиосклероз, некоторые формы нарушения ритма сердца).
Факторы риска ишемической болезни сердца подразделяются на экзогенные (избыточное потребление высококалорийной, насыщенной жирами и холестерином пищи; гиподинамия; психоэмоциональные стрессы; курение; алкоголизм) и эндогенные (артериальная гипертензия, гиперлипопротеинемия, ожирение, гипотиреоз, сахарный диабет, наследственная предрасположенность и др.)
Кратковременная и выраженная ишемия миокарда приводит к его дисфункции, после этого сократимость постепенно (в течение нескольких дней) восстанавливается. Такое состояние называется оглушённый миокард. Причинами оглушенного миокарда могут стать физический стресс, а также спазм коронарных артерий. Патогенетическими факторами являются: нарушение перфузии миокарда, снижение энергообразования в митохондриях миокарда, перегрузка кардиомиоцитов кальцием, нарушение использования энергии миофибриллами, накопление свободных радикалов кислорода и их токсическое действие на миокард.
Длительная дисфункция миокарда в результате его хронической гипоперфузии приводит к состоянию, которое получило название бездействующий миокард (англ. муосагЛа1 hibernation). Это обратимое состояние при возобновлении кровообращения (ангиопластика, аорто- коронарное шунтирование).
Восстановление кровотока после ишемии миокарда в пределах 20 мин предупреждает гибель кардиомиоцитов. Однако может вызвать реперфузионные повреждения миокарда (реперфузионную аритмию, в том числе и фибрилляцию желудочков сердца), пролонгирование и даже потенцирование состояния оглушенности ишемизированного участка миокарда. Основными патогенетическими факторами реперфузионного повреждения сердца являются: усугубление нарушений энергетического обмена в миокарде, интенсификация липопереоксидационных процессов активация кальцием протеиназ, липаз, фосфолипаз и других гидролаз, увеличение дисбаланса ионов и жидкости (избыток натрия и кальция и как следствие воды в клетках), снижение эффективности регуляторных (нервных и гуморальных) воздействий на клетки.
А бсолютная коронарная недостаточность — это состояние коронарного кровотока, при котором к миокарду по системе венечных артерий доставляется крови меньше, чем в норме, а если доставляется нормальное (или даже увеличенное) количество крови, но оно не обеспечивает потребность миокарда, работающего в условиях повышенной нагрузки — это относительная коронарная недостаточность.
Основными причинами абсолютной коронарной недостаточности являются: нейрогенный спазм венечных сосудов, тромбоз и эмболия коронарных артерий, атеросклероз сосудов сердца. Абсолютная коронарная недостаточность, как правило, вызывает формирование одного, нередко, обширного некроза миокарда, в то время, как относительная вызывает
формирование в сердечной мышце большого количества мелких некрозов.
Инфаркт миокарда — это гибель участка миокарда вследствие прекращения коронарного кровотока продолжительностью 20 мин и более. Поражение 20-25% массы миокарда левого желудочка приведет к левожелудочковой недостаточности, правого — правожелудочковой недостаточности сердца. Если объем поражения достигает 40% и более, то присоединяется кардиогенный шок.
Абсолютная или относительная коронарная недостаточность вызывают формирование коронар о генных некрозов миокарда, а некоронарогенные некрозы миокарда возникают благодаря локальным нарушениям метаболизма миокарда.
Даже ишемизированный, тем более некротизированный, участок миокарда теряет сократительную способность, что ведёт к ослаблению контрактильной функции всей сердечной мышцы, снижению минутного объёма крови. Это, в свою очередь, приводит к уменьшению коронарного кровотока, что вызывает расширение зоны некроза.
Ишемия миокарда в кардиомиоцитах пробуждает их способность к автоматизму, что ведет к появлению эктопического очага возбуждения, приводящего к экстраситолии. Кроме того, в некротизированных участках сердца может нарушаться проводимость, что обусловливает развитие блокад, а при появлении эктопических очагов и рециркуляции волны возбуждения развиваются пароксизмальная желудочковая тахикардия или фибрилляция миокарда — наиболее частые причины смерти в ранние сроки инфаркта миокарда.
Возникшие аритмии (экстрасистолии, пароксизмальная тахикардия) создают дополнительную нагрузку на поврежденный миокард, что приводит к расширению зоны инфаркта. При инфаркте миокарда нередко наблюдаются признаки острой или хронической недостаточности сердца, причём ухудшение гемодинамики тем отчетливее, чем обширнее инфаркт.
Инфаркт миокарда создает повышенную нагрузку на сохранившийся миокард, что приводит к его компенсаторной гиперфункции. В результате чего постепенно улучшаются показатели центральной гемодинамики.
Ремоделирование сердца — это изменение размера, формы желудочка, толщины его стенки с вовлечением неизмененных и пораженных сегментов миокарда. Наиболее важными процессами, лежащими в основе ремоделирования, являются дилатация желудочков сердца и гипертрофия неповрежденных участков миокарда. Ремоделирование начинается вскоре после возникновения инфаркта миокарда (обычно на 3-5-й день) и продолжается в течение многих месяцев.
Некоронарогенные некрозы миокарда возникают в результате нарушения обменных процессов в сердечной мышце под воздействием электролитов, гормонов, токсинов, метаболитов, аутоиммунных процессов, не связанных с кровотоком в венечных сосудах.
Электролитно-стероидные некрозы описаны Г.Селье. Механизм этих некрозов до настоящего времени окончательно не выяснен. С одной стороны, кортикостероиды повышают проницаемость кардиомиоцитов к ионам натрия, последние в избытке поступают в клетку, увеличивая в ней осмотическое давление, вызывая «осмотический взрыв» в клетке, ее гибель и возникновение очага некроза. С другой стороны, кортикостероиды, увеличивая содержание ионов натрия в плазме крови, повышают чувствительность адренорецепторов к катехоламинам, и обычные концентрации адреналина в крови, а тем более повышенные (при эмоциональных возбуждениях), приводят к формированию некроза.
Катехоламиновый некроз описан благодаря экспериментальным исследованиям и клиническим наблюдениям W. Raab. При эмоциональных возбуждениях в крови повышается содержание катехоламинов. Захватывая катехоламины из циркулирующей крови, в сердечной мышце исчезают запасы гликогена, усиливается потребление кислорода миокардом, увеличивается расход гликогена. Концепция объясняет развитие инфаркта миокарда у лиц интеллектуального труда, чья профессиональная деятельность связана с эмоциональными переживаниями.
Токсический некроз возникает в результате воздействия кардиотропных ядов, а также токсического повреждения миокарда (так, токсическое повреждение антрациклиновыми антибиотиками, дауномицином и адриомицином состоит в том, что они вызывают хронический кардиотоксикоз, приводящий к некрозу, как результат кумулятивного действия).
Воспалительный некроз может быть вызван некоторыми микроорганизами (вирусы, бактерии и др.) способными вызвать миокардиты. В воспалении, как типовом патологическом процессе, имеется альтерация. Повреждение может быть в результате воспалительного отека, экссудации и экссудата.
Аутоиммунный некроз может иметь место в патогенезе острого ревматизма и хронического ревматоидного заболевания сердца. Антигены, взаимодействуя с антителами в миокарде, повреждают его. Продукты некротизированной ткани сенсибилизируют организм (на них иммунная система синтезирует специфические антитела). Повторное развитие некробиотического процесса запускает аутоиммунную реакцию взаимодействия антигенов с антителами во многих участках сердечной мышцы, что приводит к образованию множественных некрозов и массовому тромбозу в капиллярах и мелких артериях.
Таким образом, некоронарогенные и коронарогенные некрозы миокарда имеют много общего в механизмах формирования (патогенетические факторы одни и те же) и нарушениях на клеточном уровне (разрушаются мембранные структуры, повреждаются митохондрии и, как следствие, нарушается энерогообразование и др.).
Различают две основные формы некроза миокардиальных клеток: коагуляционный некроз и некроз с полосами пересокращения, который характеризуется пересокращением миофибрилл, отложением солей кальция в
митохондриях, разрушением миофибрилл, приводящим к миоцитолизису.
Исходы инфаркта миокарда различны. Благоприятный заключается в том, что в стадию организации инфаркта вокруг участка некроза вначале формируется лейкоцитарный вал, гиперемия и диапедезные кровоизлияния, а затем принимают участие фибробласты. Лейкоциты обеспечивают «рассасывание» мертвых тканей, а фибробласты — формирование рубца. Процесс рубцевания длится 2 месяца. Неблагоприятный исход инфаркта миокарда заключается в том, что смерть может наступить на любом этапе заболевания. Летальный исход при инфаркте миокарда может возникнуть из- за кардиогенного шока и фибрилляции желудочков сердца. При рубцевании под давлением крови в зоне некроза может произойти растяжение стенки сердца и возникнуть острая аневризма сердца. Стенка аневризмы может разорваться, кровь изливается в полость сердечной сорочки, и развивается тампонада сердца, приводящая к смерти.
Таким образом, правильное понимание вопросов кровообращения, знание причин и условий, вызывающих формирование того или иного вида недостаточности кровообращения и/или сердечной недостаточности, понимание механизмов, лежащих в основе формирования патологии, позволит осуществлять профилактику, правильно диагностировать, обоснованно определять лечебные мероприятия и прогнозировать исход патологического процесса.