Э.Д. Петерсон, Л.Д. Шоу, Р.М. Калифф
ОЦЕНКА СТЕПЕНИ РИСКА ПРИ ИНФАРКТЕ МИОКАРДА. ЧАСТЬ I. ОБЗОР
Translated, with permission of the American College of Physicians, from: Peterson E.D. Shaw L.J. Califf R.M. Risk stratification after myocardial infarction. Ann Intern Med 1997;126:561—82.
Цель
Проанализировать литературу, посвященную оценке степени риска при остром инфаркте миокарда (ИМ) в эпоху реперфузионной терапии, и разработать алгоритм такой оценки при первом обследовании больного и в ходе дальнейшего наблюдения.
Источники информации
База данных MEDLINE — поиск литературы на английском языке по ключевым словам: инфаркт миокарда, человек, проспективные исследования, прогноз; дополнительный более узкий поиск по ключевым словам: кардиогенный шок, тромболитическая терапия, нагрузочные пробы; списки литературы в обзорных статьях и книгах по соответствующей тематике.
Отбор исследований
Публикации, посвященные прогнозу при ИМ (за 1981—1996 гг.). Исследования, посвященные нагрузочным пробам, не включались в обзор, если больных включали в них либо до 1980 г. либо по иным показаниям, нежели ИМ; если обследование проводили позднее, чем через 6 нед после ИМ; если отсутствовали данные о клинических исходах или наблюдение за больными было неполным.
Выбор данных
Поскольку число рандомизированных испытаний оказалось слишком небольшим для проведения перекрестного сравнения методов оценки степени риска, клинические рекомендации разрабатывались на основе обобщения и последующего критического обсуждения всех имеющихся результатов наблюдений.
Основные результаты
Оценивать степень риска следует с момента установления диагноза острого ИМ. При наличии условий для оказания высококвалифицированной экстренной помощи, необходимо немедленно выявлять больных с высокой степенью риска (например, с кардиогенным шоком), и тех, кому показана реперфузионная терапия. На определенных этапах стационарного лечения возможно применение специальных диагностических методов, если они позволяют получить информацию, дополняющую данные клинического обследования. Больным с высокой степенью риска, имеющим осложнения ИМ или значительное нарушение функции левого желудочка, возможно, показана ранняя ангиография; у остальных больных вероятность повторного ИМ невелика, и для дальнейшей оценки степени риска им следует проводить нагрузочные пробы.
Заключение
В период пребывания больного в стационаре врачи должны регулярно оценивать степень риска, что позволит улучшить клинические исходы ИМ и снизить затраты на лечение.
1. Состояние вопроса и цели исследования
Оценка степени риска при остром инфаркте миокарда (ИМ) необходима для выявления тех больных, у кого определенные медицинские вмешательства могут улучшить клинические исходы. Например, более интенсивная лекарственная терапия или реваскуляризация миокарда показаны при высоком риске повторных приступов ишемии. Назначение таких препаратов, как b- блокаторы или аспирин, снижает относительный риск (качественная эффективность лечения) одинаково во всех группах риска. Однако даже при использовании этих препаратов снижение абсолютного риска (количественная эффективность лечения) различно, поскольку для предотвращения равного числа случаев смерти во всех группах риска количество больных, которых следует пролечить, в группе высокого риска ниже. Таким образом, важнейший компонент клинической тактики — количественная оценка раннего и отдаленного риска у конкретного больного. У больных с самой высокой степенью риска наиболее эффективно интенсивное лечение. В группе низкого риска лечение может быть более избирательным, что позволяет экономить ресурсы. Хотя необходимо большее количество информации, уже сейчас имеющиеся литературные данные могут помочь врачам при оценке степени риска и выработке тактики лечения у больных с ИМ во время их пребывания в стационаре.
Обсуждение вопроса об оценке степени риска после ИМ в большей степени касается периода, предшествующего выписке из стационара [1]. Предлагаемые варианты включают в себя целый ряд неинвазивных и инвазивных методов, позволяющих выявлять больных с максимальным риском смерти после выписки. Хотя обследование перед выпиской остается важным компонентом оценки степени риска, необходимо также подчеркнуть значение ранней и динамической оценки, которую можно проводить несложными методами непосредственно у постели больного. Тому есть много причин. Во-первых, около 25% случаев смерти в течение первого года после ИМ отмечаются в первые 48 ч пребывания в стационаре (рис. 1) [2]. Восстановление кровотока в артерии, кровоснабжающей зону инфаркта, может спасти жизнь и снизить число отдаленных осложнений, но для этого необходимо как можно раньше поставить диагноз и определить тактику лечения уже при поступлении в стационар. Алгоритмы оценки степени риска, разработанные только для выживших в первые 5 дней пребывания в стационаре, не позволяют предотвращать случаи ранней смерти.

Рис. 1. Смертность в различные сроки после инфаркта миокарда
Данные испытания GUSTO-I — Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries — приводятся по N.S. Kleiman et al. [2].
Оценивая степень риска только перед выпиской, врачи теряют возможность экономии средств, которой можно добиться при ранней и динамической оценке. Раннее выявление больных с высоким риском позволяет быстро направлять их на катетеризацию сердца, сокращая как сроки пребывания в стационаре, так и общие затраты на лечение. Больных с низким риском, подтвержденным при сборе анамнеза и анализе клинического течения ИМ, можно быстрее переводить из блока интенсивной терапии, менее интенсивно обследовать и раньше выписывать из стационара без ухудшения клинических исходов.
Кроме того, данные диагностических исследований следует рассматривать как дополнение, уточняющее впечатление врача о степени риска, которое изначально формируется на основании анамнеза, собранного при поступлении, результатов физикального обследования больного и электрокардиографии (ЭКГ). Раннее развитие таких осложнений, как рецидив ишемии, аритмия или застойная сердечная недостаточность, может повлиять на эту оценку степени риска. О прогнозе у многих больных можно судить достаточно точно на 4—5-й день с момента госпитализации, т.е. еще до традиционного обследования перед выпиской из стационара.
Мы разработали научно обоснованный алгоритм оценки степени риска для определения тактики лечения после ИМ; этот алгоритм базируется на клинических критериях, позволяющих прогнозировать ранние и отдаленные исходы заболевания. Необходимая информация была получена в основном при анализе данных клинических испытаний и различных регистров, проведенном для отдельных подгрупп больных. Такой подход сопряжен со значительными ограничениями. Больные, включаемые в клинические испытания и различные регистры, часто не отражают особенностей всей популяции больных, перенесших ИМ. Например, в большинстве выборок недостаточно представлены женщины, представите ли этнических меньшинств и старших возрастных групп [3—5]. В клинические испытания включаются прежде всего больные, не имевшие в анамнезе ИМ или реваскуляризации миокарда, и те, у кого диагноз очевиден с самого начала (например, повышен сегмент ST). Как было отмечено недавно [6], результаты ЭКГ или определения ферментов крови в 25—35% случаев не позволяют выявить ИМ. Вид и качество медицинской помощи, получаемой больными при проведении клинических испытаний, также может отличаться от применяемых в обычной практике. Наконец, для предварительных исследований новых методов лечения и лечебных вмешательств часто характерны небольшой размер выборки и недостаточно строгий протокол, что снижает достоверность выводов о практической целесообразности применения изучавшихся методов. Если о неэффективности диагностического метода свидетельствуют результаты, полученные на малых выборках, это должно стимулировать дальнейшие исследования. Точно так же результаты небольших исследований, показавших значительные преимущества нового метода перед применяемыми, должны пройти повторную проверку, прежде чем этот метод будет признан и внедрен в широкую клиническую практику.
При изучении проблемы оценки риска после ИМ с позиций современной клинической практики мы не дублировали работу R.F. DeBusk [1], результаты которой представлены в его обзоре о специальных методах исследований при ИМ; наше внимание было сосредоточено на изменениях степени риска в динамике, начиная с первого обследования больного и заканчивая рекомендациями при выписке. Мы сделали акцент на том, каким образом различные диагностические методы могут помочь врачу в принятии определенных клинических решений. Наш алгоритм оценки степени риска включает в себя четыре фазы (рис. 2 и 3): фазу первичной оценки состояния, фазу блока интенсивной терапии, фазу инфарктного отделения и фазу перед выпиской из стационара. Эти фазы отражают важную преемственность принятия клинических решений о ведении больных при ИМ.
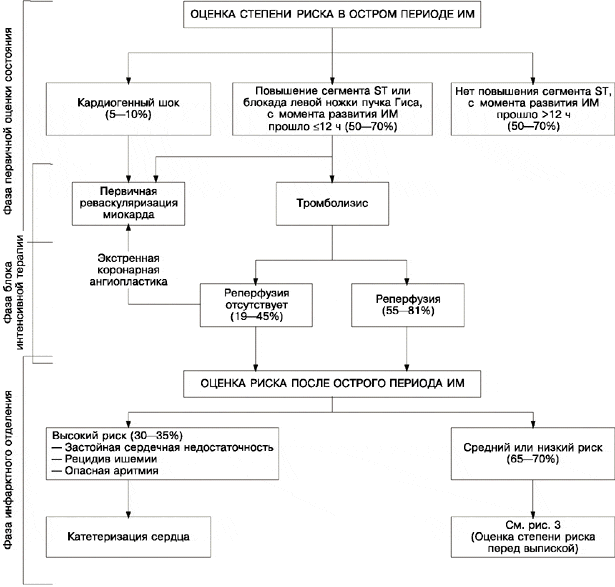
Рис. 2. Алгоритм оценки степени риска при инфаркте миокарда (ИМ).
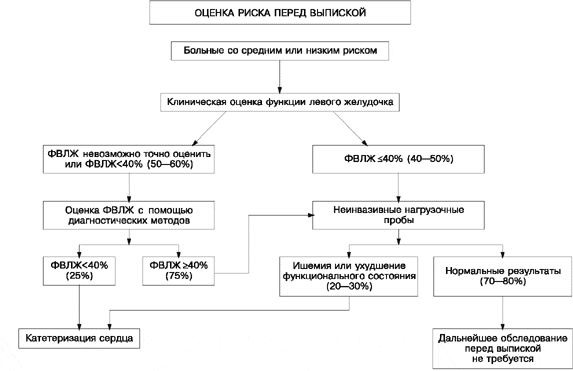
Рис. 3. Алгоритм оценки степени риска перед выпиской из стационара. ФВЛЖ — фракция выброса левого желудочка.
2. Обзор литературы
Были обобщены все опубликованные данные, относящиеся к проблеме ИМ у человека [7]. В обзоре использовано 267 публикаций на английском языке за 1981—1994 гг. выявленных при комбинированном поиске по следующим ключевым словам: инфаркт миокарда, прогноз, проспективные исследования. Кроме того, просматривались списки литературы в обзорных, обобщающих и мета-аналитиче ских статьях по соответствующей тематике, опубликованных с 1991 по 1996 г. [8—10]. Наконец, было проведено несколько избирательных поисков литературы с помощью дополнительного использования уточняющих ключевых слов (например, кардиогенный шок).
Осуществлен также специальный мета-анализ литературы, посвященной применению неинвазивных методов исследования перед выпиской. Проведя комбинированный поиск по ключевым словам: проба с физической нагрузкой, радиоизотопная визуализация, эхокардиография (ЭхоКГ); ИМ, прогноз, мы выявили 115 сообщений, опубликованных в 1980—1994 гг. Этот поиск был ограничен публикациями на английском языке об исследованиях, проведенных на человеке, или о сериях клинических случаев. Исследования не включались в обзор, если больных обследовали позднее чем через 6 нед после возникновения ИМ (n=12) или включали в исследование до 1980 г. (n=10); когда состав групп был смешанным (например, больные с нестабильной стенокардией и больные с ИМ) (n=3); наблюдение осуществлялось менее чем за 80% больных (n=1); отсутствовали данные о развитии повторного ИМ или о смертности от заболеваний сердца (n=4).
Для анализа фазы перед выпиской из стационара использовали 54 из 115 публикаций: 28 об использовании ЭКГ с физической нагрузкой, 8 — о сцинтиграфии миокарда с физической нагрузкой, 10 — о визуализации функции желудочков на фоне физической нагрузки (8 — методом изотопной ангиографии, 2 — ЭхоКГ) и 8 сообщений о визуализации желудочков на фоне фармакологической нагрузки (4 — методом сцинтиграфии, 3 — ЭхоКГ, 1 — обоими методами). Для каждой статьи определяли качество отбора больных, методологии исследования, описания частоты и причин выбывания из исследования, критериев оценки клинических исходов и степень учета факторов, которые могли бы повлиять на конечные результаты. Из каждого сообщения отбирали данные о частоте развития определенных исходов ИМ при положительном или отрицательном результате теста и сводили их в таблицу сопряженности 2 ґ 2 (например, “Показатели смертности через 1 год после ИМ среди больных со снижением сегмента ST или без него”). После обобщения данных о частоте определенных клинических исходов рассчитывали показатели чувствительности, специфичности, прогностической ценности положительных и отрицательных результатов для различных методов [11]. Кроме того, было проведено сравнение прогностической ценности положительных результатов определенных тестов у больных, получавших или не получавших первичную тромболитическую терапию.
3. Фаза первичной оценки состояния больного
3.1. Исходные клинические и демографические факторы риска
Оценку степени риска при остром ИМ начинают со сбора анамнеза и физикального обследования больного в отделении неотложной помощи. В табл. 1 представлены основные демографические и клинические факторы, ухудшающие краткосрочный и отдаленный прогноз у этих больных [12—17]. К наиболее важным факторам риска смерти в течение 30 дней после развития ИМ относятся возраст, систолическое АД и частота сердечных сокращений во время первого осмотра, выявление признаков застойной сердечной недостаточности при физикальном обследовании, локализация ИМ и наличие ИМ в анамнезе [12, 18]. Важность этих факторов риска подтверждена результатами многих клинических испытаний и согласованным мнением экспертов [14, 17, 19—22].
Таблица 1. Прогностическое значение факторов повышенного риска, выявляемых при сборе анамнеза и физикальном обследовании (по данным 6 исследований)
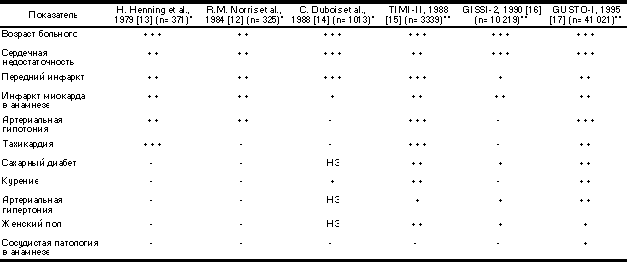
Примечание. * — включались все больные с ИМ; ** — включались только больные, которым показано проведение тромболизиса. + — однофакторный прогностический критерий, ++ — многофакторный прогностический критерий; +++ — самый сильный прогностический критерий; НЗ — статистически незначимый прогностический критерий. GISSI — Gruppo Italiano per lo studio della Sopravivinenza nell’Infarto Miocardio; GUSTO — Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries; TIMI — Thrombolysis in Myocardial Infarction
Значение возраста как фактора риска смерти очень велико, что подтверждено в различных популяционных и клинических исследованиях [6, 23]. Например, при анализе данных Национального регистра [6] было показано, что уровень внутрибольничной смертности при ИМ варьирует в широком диапазоне — от 3% у лиц моложе 55 лет до 28% у лиц 85 лет и старше. Чем старше больной, тем выше вероятность нарушения функции левого желудочка (что связано с предшествующими заболеваниями сердца) и более тяжелого течения ишемической болезни сердца (ИБС), лежащей в основе ИМ. Развитие застойной сердечной недостаточности и кардиогенного шока после ИМ также чаще наблюдается у пожилых больных [24].
Вероятность смерти повышают и другие факторы. Риск ранней смерти после ИМ выше у женщин, но это частично может объясняться не половой принадлежностью, а другими клиническими факторами риска, например, пожилым возрастом и наличием сопутствующей патологии [25—32]. Повышенный риск смерти у больных с ИМ в анамнезе обусловлен остаточным повреждением левого желудочка. Наличие сахарного диабета, артериальной гипертонии или поражения не коронарных артерий также повышает риск смерти из-за более тяжелого течения ИБС у этих больных. Как это ни парадоксально, риск ранней смерти после ИМ у курящих относительно низок, прежде всего потому, что ИБС (и связанный с ней ИМ) развивается у них в более молодом возрасте [33, 34].
Физикальное обследование больных обеспечивает дополнительную информацию, крайне важную для первоначальной оценки степени риска. Клинические признаки дисфункции левого желудочка (артериальная гипотония, тахикардия, ритм галопа в сочетании с появлением третьего тона, ухудшение периферической перфузии, застой в малом круге кровообращения) позволяют выявлять больных с высоким риском смерти. Степень сердечной недостаточности, определяемая по классификации Киллипа, которая основана на наличии застоя в малом круге кровообращения, ухудшения периферической перфузии или их сочетания, — надежный прогностический критерий исхода при ИМ [17, 35, 36]. При первичном физикальном обследовании можно также выявить признаки таких крайне тяжелых осложнений ИМ, как острая дисфункция митрального клапана и разрыв миокарда.
3.2. Исходные факторы риска, выявляемые при электрокардиографии
Результаты ЭКГ не только помогают в диагностике ИМ, но содержат также очень важную прогностическую информацию. Наиболее ценным считается наличие или отсутствие повышения сегмента ST, определяющего возможность успешного применения реперфузионной терапии. Кроме того, имеет значение локализация ИМ: среди больных с повышением сегмента ST риск смерти при передней локализации ИМ вдвое выше, чем при нижней [17, 37, 38]. Количественная оценка распространенности и выраженности отклонения сегмента ST от изолинии (повышения или снижения, измеряемого через 60 мс после точки J) позволяет более точно определять степень риска. Эффективность тромболитической терапии прямо коррелирует с числом отведений ЭКГ, в которых отмечено повышение сегмента ST, и с суммарным отклонением сегмента ST от изолинии во всех отведениях [37, 39]. Так, у больных, умерших в первые 30 дней после ИМ, суммарное отклонение сегмента ST (медиана — 16 мм при межквартильном диапазоне от 10 до 23 мм) было больше, чем у выживших в эти сроки (медиана — 12 мм при межквартильном диапазоне от 8 до 18 мм). Медиана числа отведений, в которых отмечалось повышение сегмента ST по крайней мере на 1 мм, у этих больных составляла соответственно 4 (при межквартильном диапазоне от 3 до 5) и 3 (при межквартильном диапазоне от 3 до 5).
О повышенном риске смерти свидетельствуют также выявляемые при ЭКГ нарушения проводимости, атриовентрикулярная блокада высокой степени [40—43] и мерцательная аритмия [44]. Кроме того, данные ЭКГ могут способствовать выявлению подгрупп больных, подверженных наиболее высокому риску. Например, хотя в целом нижний ИМ характеризуется более благоприятным прогнозом, чем передний, однако его сочетание со значительным снижением сегмента ST в прекордиальных отведениях или с признаками поражения правого желудочка повышает частоту развития застойной сердечной недостаточности, повторного ИМ и смерти в 4 раза [45—48].
3.3. Факторы риска, выявляемые при исследовании крови
Повреждение миокарда приводит к высвобождению в кровь ферментов, которые можно выявить с помощью быстрых лабораторных методов. При повторном количественном определении соотношения активности общей креатинфосфокиназы с активностью ее миокардиального изофермента и изофермента лактатдегидрогеназы можно подтвердить или опровергнуть диагноз ИМ в течение 12 ч после появления симптомов [49]. Однако в остром периоде ИМ повышение активности этих ферментов наблюдает ся только у 34% больных ИМ (т.е. чувствительность метода крайне низка); кроме того, активность ферментов повышена также у 12% больных без ИМ (т.е. низка и специфичность) [50]. Таким образом, однократный ферментный анализ не позволит исключить ИМ. Недавно была изучена возможность применения других сывороточных маркеров повреждения миокарда для прогнозирования риска после ИМ [51—56]. У больных без повышения сегмента ST увеличение уровня тропонина Т в крови оказалось сильным прогностическим критерием внутрибольничной смертности (которая составила 9% при повышенном содержании тропонина Т и 1% при нормальном его уровне), развития шока (6 и 2% соответственно) и застойной сердечной недостаточности (16 и 7% соответственно).
3.4. Факторы риска, выявляемые при визуализации миокарда
Для диагностики и экстренной оценки степени риска при ИМ уже в отделении неотложной помощи предлагается использовать ряд методов визуализации, в том числе сцинтиграфию миокарда и ЭхоКГ [57—79]. При проведении тромболитической терапии эти методы позволяют получить информацию о процессе реперфузии, размерах зоны ИМ и жизнеспособности миокарда [60, 74, 80]. Они могут также помочь при диагностике в неясных случаях, например в отсутствие повышения сегмента ST [80]. В ряде предварительных исследований [81—86] оценивалось также значение ЭхоКГ для ранней оценки степени риска. В одной из работ [86] было показано, что при ишемических синдромах количественное эхокардио графическое определение функции левого желудочка и митральной регургитации позволяет получить прогностическую информацию, дополняющую данные анамнеза и ЭКГ. В другой работе [83] показано, что выявление участка гипокинезии (индекс нарушения сократимости миокарда і 2) в течение 12 ч с момента появления симптоматики ИМ позволяет выделить больных с повышенным риском сердечной недостаточности, злокачественных аритмий или смерти. Снижение фракции выброса левого желудочка (<40%) в течение 72 ч после появления симптомов ИМ также коррелирует с повышенным риском смерти [84].
Однако возможности визуализации миокарда в острой стадии ИМ ограничены тем, что участки развившегося ранее кардиосклероза практически не отличимы от участков нового ишемического поражения. Кроме того, до сих пор не доказано, что методы визуализации дают более ценную информацию, чем сбор анамнеза, физикальное исследование и ЭКГ, проведенные при первом обследовании больного. Наконец, использование методов визуализации ограничивается и тем, что во многих больницах число обученных специалистов недостаточно, чтобы результаты визуализирующих методов можно было получать и интерпретировать в любой момент.
Используя данные анамнеза, первичного физикального исследования и ЭКГ, можно в целом подразделить больных с ИМ на следующие категории: 1) больные, находящиеся в кардиогенном шоке, 2) больные, которым показана реперфузионная терапия и 3) больные, у которых отсутствует повышение сегмента ST или которые поступили позднее чем через 12 ч после первых клинических проявлений ИМ, в связи с чем тромболитическая терапия вряд ли будет эффективной.
3.5. Кардиогенный шок
Кардиогенный шок определяется как сочетание следующих гемодинамических признаков: систолическое АД ниже 90 мм рт. ст. в течение 30 мин и более, артериовенозная разница по кислороду превышает 5,5 мл/дл, сердечный индекс меньше 2,2 л/мин/м 2. а давление заклинивания легочных капилляров больше 18 мм рт. ст. [87, 88]. Поскольку при начальном обследовании обычно не удается оценить гемодинамические параметры, для клинической диагностики кардиогенного шока используется триада признаков: сочетание гипотонии (систолическое АД ниже 90 мм рт. ст. или по крайней мере на 30 мм рт. ст. ниже обычного), признаков снижения периферической перфузии (олигурия, цианоз или нарушения психики) и отека легких (в отсутствие других причин шока, например гиповолемии или сепсиса). При ИМ кардиогенный шок развивается в 5—15% случаев, а связанная с ним смертность составляет от 50 до 80% [36, 89—93].
Больным, выжившим в течение первых часов кардиогенного шока, предстоит длительная интенсивная и дорогостоящая терапия. По возможности, их следует срочно проконсультировать у опытного кардиолога, перевести в блок интенсивной терапии, оснащенный всем необходимым для постоянной регистрации гемодинамических параметров (например, катетеризации легочной артерии), обсудить возможность немедленного проведения ангиографии, установки в аорте катетера для баллонной контрпульсации, а также реваскуляризации миокарда. Хотя в целом при ИМ катетеризация легочной артерии не показана [94—96], у больных с кардиогенным шоком инвазивный мониторинг гемодинамических параметров может обеспечить максимальную эффективность лечения [88]. В нерандомизированном сравнительном исследовании [97] применение внутриаортальной баллонной контрпульсации у 85 больных с кардиогенным шоком снизило внутрибольничную смертность на 33%.
Тромболитическая терапия лишь в незначительной степени улучшает клинические исходы при кардиогенном шоке, что заставило изучать эффективность более интенсивных методов реваскуляризации [37, 98, 99]. В неконтролируемых исследованиях [100—104] показано, что после экстренной чрескожной транслюминальной коронарной ангиопластики у таких больных наблюдаются быстрая реперфузия миокарда, восстановление гемодинамики и снижение смертности на 50% по сравнению с обычными методами лечения. Результаты продолжающегося исследования SHOCK (SHould we revascularize Occluded Coronaries for cardiogenic shocK?) — рандомизиро ванного испытания первичной коронарной ангиопластики при кардиогенном шоке — позволят уточнить значение реперфузии в этой группе больных.
3.6. Выявление больных, которым показана срочная реперфузионная терапия
Первичная оценка состояния больных без кардиогенного шока должна быть ориентирована на выявление тех из них, кому показана срочная реперфузионная терапия. Мета-анализ рандомизированных испытаний тромболизиса [98] показал, что он безусловно эффективен, если у больных, госпитали зированных в течение 12 ч с момента появления болей, в двух смежных отведениях ЭКГ определяется блокада ножек пучка Гиса или повышение сегмента ST. Среди больных, которым показан тромболизис, важно сразу отобрать тех, у кого имеются противопоказания к его проведению, т.е. выявить наличие расслаивающей аневризмы аорты, беременности, внутричерепных сосудистых пороков или опухолей, нарушения свертывания крови, плохо поддающейся лечению артериальной гипертонии (систолическое АД і 200 мм рт. ст. или диастолическое АД і 120 мм рт. ст.), а также перенесших в течение предшествующих 6 мес массивное кровотечение, операцию или травму, длительную реанимацию или инсульт [105]. В нескольких недавно проведенных рандомизированных клинических испытаниях [106—109] было также показано, что после немедленной ангиопластики коронарной артерии, кровоснабжающей зону ИМ, клинические исходы аналогичны результатам тромболизиса или даже превосходят их. Если тромболизис показан, но не может быть проведен по определенным причинам, больным можно назначать первичную коронарную ангиопластику.
Данные об эффективности реперфузионной терапии в определенных группах больных, в том числе у пожилых больных, при нижнем ИМ или при поздней госпитализации, противоречивы. Пожилых больных нередко исключают из испытаний тромболизи са, частично из-за повышенного риска внутричерепных кровотечений [110]. Однако при анализе имеющихся данных выявлено одинаковое снижение относительного риска у пожилых и молодых больных [98, 111, 112], что может означать гораздо большую абсолютную эффективность тромболизиса у пожилых (т. е. большее число сохраненных жизней на 1000 больных, получавших лечение).
Как уже отмечалось выше, в целом риск смерти при нижнем ИМ меньше, чем при переднем; но даже с учетом этого проведение тромболизиса у пожилых больных связано со снижением смертности и улучшением функции левого желудочка [98, 113]. Наконец, хотя эффективность реперфузии снижается при более позднем ее проведении, недавно проведенный анализ 13 000 случаев показал, что даже при начале тромболизиса через 7—12 ч после появления симптомов ИМ он снижает смертность на 14% [98].
3.7. Больные, которым реперфузионная терапия не показана
К последней группе относятся больные с ИМ без повышения сегмента ST (т.е. с его снижением или неспецифическими изменениями) и больные, госпитализированные позднее чем через 12 ч после появления клинических симптомов. В эту группу входит от 50 до 75% всех больных с ИМ, хотя эти цифры могут отличаться в разных популяциях [6, 114]. Общая внутрибольничная смертность в этой группе несколько ниже, чем при повышении сегмента ST; однако прогноз на первый год для больных обеих групп одинаков. О специфических клинических маркерах риска при ИМ без повышения сегмента ST известно немного, отчасти потому, что таких больных не включали во многие крупномасштабные рандомизированные клинические испытания. Недавно завершенные исследования — GUSTO-IIb (Global Use of Strategies to Open Occluded Arteries in Acute Coronary Syndromes) [115] и TIMI-9B (Thrombolysis and Thrombin In Myocardial Infarction) [116] — должны дать нам много информации об этой категории больных.
Срочная тромболитическая терапия при ИМ без повышения сегмента ST неэффективна и может даже принести вред [98, 117]. Исключение составляют больные с изолированным задним ИМ, у которых иногда он проявляется только снижением сегмента ST в прекордиальных отведениях (V1 —V3 ). Эффективность применения первичной ангиопластики при ИМ без повышения сегмента ST или у поздно госпитализированных больных не изучалась в рандомизированных испытаниях; это вмешательство должно рассматриваться как крайняя мера для больных с максимальным исходным риском.
4. Фаза блока интенсивной терапии
После установления первичного диагноза и стабилизации состояния больного необходимо решить, в каком отделении следует продолжить лечение. При точно установленном ИМ больных следует направлять в такое отделение (например, блок интенсивной терапии), средний медицинский персонал которого обучен интерпретировать данные об аритмии и состоянии гемодинамики и может быстро провести дефибрилляцию при развитии фибрилляции желудочков. Ранее проведенные сравнительные исследования с историческим контролем [118, 119] показали, что лечение больных в блоке интенсивной терапии существенно снижает раннюю смертность от ИМ. В соответствии с практическими согласован ными рекомендациями [117] у больных без исходного повышения активности ферментов, свидетельст вующих о некрозе миокарда, степень риска (низкий, умеренный или высокий) ранних осложнений ИМ следует оценивать с учетом клинических данных и результатов ЭКГ. Больных с высоким риском (сохранение загрудинной боли и изменений ЭКГ, отек легких, артериальная гипотония, появление новых признаков митральной регургитации) следует направлять в блок интенсивной терапии. Больных с умеренным и низким риском развития осложнений (т.е. без указанных симптомов) вполне можно лечить в палате интенсивного наблюдения. В такой палате на одного больного может приходиться меньше персонала, чем в блоке интенсивной терапии, однако должна быть обеспечена возможность экстренной дефибрилляции [120—122].
После поступления больного в блок интенсивной терапии или палату интенсивного наблюдения необходимо постоянно отслеживать возможное появление стандартного комплекса клинических признаков, свидетельствующих о повышении риска смерти или необходимости экстренного вмешательства. К ним относятся рецидив ишемии миокарда [123, 124], повторный ИМ [125, 126], угрожающие жизни аритмии (стойкая желудочковая тахикардия или фибрилляция желудочков, атриовентрикулярная блокада высокой степени или тяжелые наджелудочковые аритмии), а также симптомы нарушения насосной функции сердца (появление хрипов в легких или артериальной гипотонии). Необходимо следить, не появились ли признаки тяжелых осложнений ИМ, требующих экстренной терапии (кардиогенного шока, разрыва межжелудочковой перегородки, острой митральной регургитации и разрыва стенки левого желудочка). Кроме того, у 1—3% больных после ИМ развивается инсульт. Многим больным назначают также антикоагулянты, что сопряжено с повышенным риском внутричерепного кровоизлияния. Поэтому при появлении признаков очаговых неврологических расстройств следует срочно провести компьютерную томографию мозга.
4.1. Выявление больных, которым показана экстренная терапия
В первые часы пребывания больного в блоке интенсивной терапии необходимо оценить эффективность начатого ранее лечения. Хотя современные схемы проведения тромболизиса позволяют добиться восстановления перфузии миокарда в течение 90 мин у 55—81% больных [127], у оставшейся части больных смертность в 2—3 раза выше [127—129]. Поэтому оценка восстановления перфузии после тромболитической терапии имеет существенное прогностическое значение. Для определения реперфузии часто достаточно клинических данных. Например, если суммарная величина повышения сегмента ST через 90 мин после начала терапии уменьшилась на 20—50%, то вероятность восстановления проходимости коронарной артерии, кровоснабжающей зону ИМ, составляет 88% [41, 130—137]. Уменьшение или исчезновение загрудинной боли — менее надежный прогностический признак (при этом восстановление проходимости артерии наблюдается в 60—84% случаев) [130]. Недавно показано, что постоянный ЭКГ-мониторинг повышает возможность выявления реперфузии и прогнозирования клинических исходов ИМ [138, 139].
Оценка восстановления проходимости артерии, кровоснабжающей зону ИМ, может повлиять на дальнейшее ведение больного. В нескольких нерандомизированных исследованиях [15, 38, 140—146] изучалась эффективность проведения экстренной ангиопластики или повторного тромболизиса после того, как первая попытка тромболизиса оказалась неудачной. В крупнейшем рандомизированном клиническом испытании RESCUE 150 больным после безуспешной попытки лизиса тромба в передней нисходящей ветви левой коронарной артерии назначали либо ангиопластику, либо консервативную терапию. Хотя после экстренной ангиопластики функция левого желудочка в покое не улучшалась, в этой группе отмечено достоверное снижение суммарной частоты случаев смерти и развития сердечной недостаточности по сравнению с больными, получавшими консервативную терапию [147].
4.2. Оценка степени риска через 24 часа
Примерно через 24 ч после поступления больного в стационар необходимо снова оценить его состояние. При повторном определении активности миокардиальных изоферментов можно достаточно точно выявить некроз миокарда в течение 18 ч с момента госпитализации; больных, у которых некроз не обнаружен, в это время уже можно переводить из блока интенсивной терапии [120, 121, 148]. Перевод большинства больных без признаков повторной ишемии, электрической нестабильности сердца, клинически значимых нарушений его насосной функции и других тяжелых осложнений также вполне безопасен [120]. Тем не менее T.H. Lee et al. [149] показали, что обеспечение врачей прогностической информацией не приводит к сокращению сроков пребывания больных в блоке интенсивной терапии.
5. Фаза инфарктного отделения
Применение ЭКГ-мониторинга в острой стадии ИМ необходимо из-за высокой вероятности развития ранних осложнений, однако целесообразность постоянной регистрации ритма сердца после перевода больного из блока интенсивной терапии до сих пор не изучалась. Например, в первые сутки фибрилляция желудочков развивается у 2,5% больных (в основном при крупноочаговом ИМ), а в последующие дни — только у 0,4% [150, 151]. Тем не менее определенный риск внезапного развития аритмий сохраняется и после первых 24 ч, поэтому до тех пор, пока не появятся новые, более определенные эмпирические данные, мониторинг ритма сердца еще в течение суток представляется вполне оправданным.
5.1. Выявление больных, которым показано более активное лечение
D.B. Mark et al. [152] проанализировали данные трех клинических испытаний TAMI (Thrombolysis and Angioplasty in Myocardial Infarction) и предложили шкалу для оценки риска, основанную на наличии или отсутствии у больных ранней стойкой желудочковой тахикардии или фибрилляции желудочков, ранней стойкой артериальной гипотонии или кардиогенного шока, поражения нескольких коронарных артерий и фракции выброса меньше 40%. При наличии хотя бы одного из этих факторов риска (n=149) риск поздних осложнений составлял 16%; отсутствие факторов риска (n=105) снижало риск поздних осложнений до 6%. Смертность и частота развития повторного ИМ в течение 30 дней были также значительно выше в группе высокого риска (6 и 0% соответственно). Эти данные подтверждены другими исследователями на более крупных выборках [153]. Хотя специальные рандомизированные испытания не проводились, больным с неблагоприятным прогнозом (при наличии рецидивирующей ишемии, электрической нестабильности, внутренних или внешних разрывов миокарда, митральной регургитации, нарушение насосной функции сердца) скорее всего показано более активное лечение, в том числе и катетеризация сердца [19, 117, 152, 154—168].
5.2. Оценка возможности ранней выписки из стационара
В отсутствие вышеперечисленных осложнений следует постоянно оценивать возможность ранней выписки больного из стационара. Хотя продолжительность пребывания в стационаре индивидуальна для каждого больного и определяется скоростью снижения вероятности развития осложнений со временем, на 4—5-й день после неосложненного ИМ целесообразно провести оценку степени риска для решения вопроса о выписке [153, 169, 170]. В это время уже можно повышать активность больного (при обязательном отслеживании признаков ишемии или нарушения функции левого желудочка), начинать его обучение и проведение мероприятий по вторичной профилактике (см. раздел 6.7).
На основании клинических данных был разработан ряд оценочных шкал, позволяющих среди больных с острым ишемическим синдромом выявить тех, кто имеет низкий риск ранних осложнений и смерти [170—173]. L.K. Newby et al. [153] проанализировали данные исследования GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) и обнаружили, что при неосложненном течении ИМ (т.е. в отсутствие повторного ИМ, ишемии, инсульта, шока, сердечной недостаточности, необходимости проведения аортокоронарного шунтирования, баллонной контрпульсации, экстренной катетеризации сердца, кардиоверсии или дефибрилляции в первые 4 дня после ИМ) выживаемость больных превысила 57%, а смертность составила 1% через месяц и 3,6% через год. Несмотря на столь низкий риск, средний срок пребывания в блоке интенсивной терапии при неосложненном ИМ был лишь немногим меньше, чем при осложненном (3 и 4 дня соответственно), а средняя продолжительность стационарного лечения в целом была одинакова. Общую стоимость стационарного лечения при неосложненном ИМ можно снизить на 25% за счет раннего выявления таких больных и их ранней выписки [174]. Недавно в исследовании PAMI-2 (Primary Angioplasty in Myocardial Infarction) было показано, что в группе низкого риска (возраст <70 лет при фракции выброса >45% и поражении одной или двух коронарных артерий) после срочной катетеризации и первичной ангиопластики смертность и частота повторного развития ИМ составили соответственно 0,65 и 3,9%. На основании этих результатов было предложено выписывать таких больных раньше (на 3-й день) [175].
6. Оценка степени риска перед выпиской
Как было отмечено выше, клинические признаки высокого риска часто проявляются на этапе выздоровления. Задача врача в фазе перед выпиской из стационара заключается в том, чтобы выявить небольшое число больных с высоким риском среди массы больных с относительно низким риском. Для решения этой задачи разработано множество тестов, однако для того, чтобы эти тесты могли эффективно применяться в клинической практике, они должны обладать высокой чувствительностью и специфичностью, так как общая частота неблагоприятных исходов у этих больных достаточно низка (смертность в течение первого года составляет от 2 до 5%).
К сожалению, проанализированные исследования по оценке эффективности неинвазивных тестов имели многие методологические ограничения, в частности, их статистическая мощность была недостаточна для достоверной оценки прогностических критериев. Так, из 54 исследований, опубликованных после 1984 г. и посвященных оценке прогностического значения неинвазивных нагрузочных проб после ИМ, только в 41% работ количество летальных исходов было больше 10 [7]. К другим ограничениям этих исследований относятся использование ретроспективного анализа (критерии положительного результата теста определялись уже после того, как был известен исход заболевания); предвзятость при отборе больных (изучаемый тест чаще назначался специально отобранным больным, а не рандомизированно); систематическая ошибка вследствие неопределенности клинического исхода (незавершенное наблюдение за больными); ограниченное время исследова ния (например, изучение только раннего прогноза) и использование таких исходов (включая реваскуля ризацию миокарда), на которые может влиять результат применения прогностического теста. Кроме того, лечащие врачи обычно знали о результатах теста, что влияло на дальнейшую тактику лечения и, возможно, на прогностическую точность теста. Например, если тест позволяет точно выявить поражение основного ствола левой коронарной артерии, и больным на основании результатов этого теста проводят реваскуляризацию миокарда (улучшая таким образом отдаленную выживаемость), то ценность теста для прогнозирования смерти может снизиться. Наконец, как отмечено выше, только в немногих исследованиях определяли, насколько изучаемые методы информативнее обычного клинического обследования.
6.1. Финансовые аспекты
Прежде чем обсуждать относительную клиническую ценность различных диагностических методов, читателю важно знать об экономических аспектах обследования больного перед выпиской. В табл. 2 затраты на проведение такого обследования с учетом стоимости расходных материалов и эксплуатации оборудования, а также оплаты работы персонала приведены согласно расценкам системы государственного страхования Medicare и расценкам лечебных учреждений на 1995 г. Хотя в разных учреждениях расходы могут отличаться и неточно отражать истинные затраты на выполнение этих диагностических тестов, цифры полезны для проведения сравнений.
Таблица 2. Затраты на проведение различных методов исследования (в долларах США на 1995 г.)
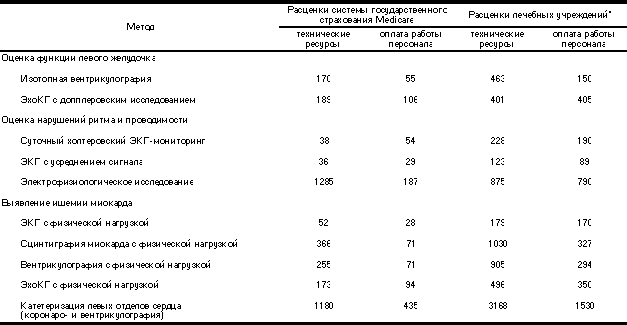
Примечание. * — в данном случае приведены расценки специализированного клинического центра (оплата производится третьими лицами или больным).
Наряду с затратами на проведение отдельных методов исследования необходимо учитывать и общие расходы по выполнению определенной диагности ческой тактики. Кроме того, положительные результаты первичных скрининговых методов (как истинноположительные, так и ложноположительные) приведут к дальнейшему обследованию, увеличивая последующие затраты. Например, если врач намерен оценить функцию левого желудочка и степень поражения коронарных артерий, он может назначить ЭхоКГ и сцинтиграфию миокарда с физической нагрузкой (расходы учреждения — 806 и 1350 долларов соответственно), ЭхоКГ или изотопную вентрикулографию в покое и с физической нагрузкой (846 и 1199 долларов соответственно), либо катетеризацию сердца (3168 долларов). Однако на практике врачи часто назначают несколько исследований, которые дают частично перекрывающуюся клиническую информацию. Например, при анализе данных Medicare [176] оказалось, что 57% больным кроме нагрузочной пробы проводили также катетеризацию сердца, 62% больным после катетеризации сердца по крайней мере однократно проводили ЭхоКГ.
К сожалению, финансовые аспекты различных подходов к лечению сравнивали лишь в небольшом числе исследований. При нерандомизированном экономическом анализе данных Регистра о первичной коронарной ангиопластике [177] различия в стоимости медицинской помощи только на 19% удалось объяснить демографическими, клиническими и ангиографическими факторами. Для сравнения, при использовании модели трехступенчатого регрессионного анализа было показано, что на 42% различия в затратах связаны с используемой процедурой и развитием осложнений. В рамках клинического испытания тромболизиса TIMI-IIb E.D. Charles et al. [178] провели небольшое дополнительное исследование (два лечебных учреждения, 310 больных), в котором сравнивали стоимость стационарного лечения. Авторы показали, что при рандомизированном назначении консервативного лечения (перед выпиской этим больным проводилась изотопная вентрикуло графия с физической нагрузкой) больные реже подвергались различным коронарным вмешательствам, чем при назначении инвазивных методов лечения, включая катетеризацию (21 и 58% соответственно), однако это лишь в незначительной степени снижало стоимость стационарного лечения (13 372 и 15 325 долларов соответственно). При использовании инвазивных методов лечения число дней пребывания в стационаре в связи с сердечно-сосудистой патологией на протяжении первого года наблюдения было меньше [179].
6.2. Функция левого желудочка
Показано, что смертность и риск ишемических осложнений обратно пропорциональны величине фракции выброса [180—183]. Более того, прогности ческая ценность этого показателя одинакова при лечении ИМ с использованием тромболизиса или без него (рис. 4) [180, 184]. Наконец, в ходе рандомизированных клинических испытаний [185—188] было отмечено, что правильно подобранное лечение (например, применение ингибиторов ангиотензинпрев ращающего фермента) позволяет улучшить отдаленный прогноз у больных с дисфункцией левого желудочка после ИМ. Таким образом, клиническая оценка функции левого желудочка при ИМ показана как для оценки прогноза, так и для выбора лечения.
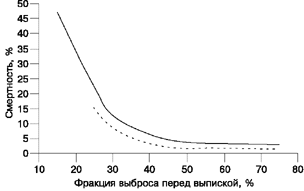
Рис. 4. Прогностическое значение величины фракции выброса левого желудочка, определяемой перед выпиской из стационара, у получавших и не получавших после инфаркта миокарда тромболитическую терапию.
Показатели общей смертности через 6 мес после инфаркта миокарда у получавших тромболитическую терапию (пунктирная линия) приводятся по данным исследования GISSI-2 [184], смертности от заболеваний сердца через год после инфаркта в отсутствие тромболизиса (сплошная линия) — по данным Multicenter Post-Infarction Research Group [180].
Нарушение функции левого желудочка легко выявить при физикальном исследовании (по хрипам в легких, диастолическому трехчленному ритму галопа, артериальной гипотонии). В свою очередь ЭКГ позволяет оценить распространенность повреждения миокарда [189, 190]. На основании клинических данных и результатов ЭКГ M.T. Silver et al. [191] разработали правило клинического прогнозирования, которое позволяет выявлять больных с сохраненной функцией левого желудочка, не нуждающихся в специальном обследовании. С помощью ретроспективного анализа авторы показали, что при переднем ИМ без признаков сердечной недостаточности и без застойной сердечной недостаточности в анамнезе, в отсутствие факторов, затрудняющих интерпретацию результатов ЭКГ (блокада левой ножки пучка Гиса, искусственный водитель ритма, гипертрофия и перегрузка левого желудочка), или без ИМ с патологическим зубцом Q в анамнезе прогнозируемая величина фракции выброса составляет 40% и более (прогностическая ценность положительного результата 0,98). Это прогностическое правило было недавно проверено на 10 756 больных, включенных в исследование GUSTO-I. Согласно данному правилу функция левого желудочка должна была быть сохранена у 46% больных, и в 94% случаев фракция выброса у них действительно была не ниже 40% [174].
Для количественной оценки фракции выброса можно проводить изотопную ангиографию, ЭхоКГ или левую вентрикулографию при катетеризации сердца. Эти методы позволяют также рассчитать объем желудочка; по данным двух исследований [192, 193] он оказался прогностически более ценным показателем, чем фракция выброса. Указанные методы позволяют получить также информацию о регионарных нарушениях сократимости миокарда, что может служить дополнительным независимым прогностическим критерием. Ни в одном из исследований при проведении прямого сравнения не было выявлено явных преимуществ какого-либо метода визуализации желудочков. Таким образом, выбор метода оценки функции левого желудочка должен основываться на возможностях и опыте данного учреждения, экономических соображениях и конкретной клинической ситуации.
6.3. Риск развития аритмии
Несколько клинических показателей свидетельствуют о повышенном риске внезапного развития аритмии после ИМ: дисфункция левого желудочка, передний ИМ или трансмуральный ИМ (ИМ с патологическим зубцом Q), сердечная недостаточность III или IV класса по Киллипу, поражение нескольких коронарных артерий, обширный ИМ [194—197]. Для более точной количественной оценки риска внезапной смерти предложено несколько неинвазивных методов. Один из самых простых — обнаружение полиморфных или частых желудочковых экстрасистол при мониторировании ЭКГ — в течение нескольких десятилетий используется для прогнозирования внутрибольничного развития аритмических осложнений. Так, увеличение частоты желудочковых экстрасистол (в особенности >6/ч) повышает риск смерти, рецидивирующей желудочковой тахикардии или фибрилляции в отдаленном периоде примерно на 60% [21, 198—203]. Правда, эти данные не подтверждаются другими авторами [150, 194, 204—211]. О повышенном риске внезапной смерти в последующем свидетельствует также развитие фибрилляции желудочков или стойкой желудочковой тахикардии позднее чем через 48 ч после начала ИМ [198, 207, 212, 213].
В качестве другого способа прогнозирования аритмических осложнений был предложен еще один неинвазивный метод — мониторирование ЭКГ с усреднением сигнала. Он позволяет выявлять признаки замедления проводимости (лежащего в основе стойких желудочковых аритмий с повторным входом возбуждения) и, по данным ряда исследователей, служит прогностическим маркером риска после ИМ [210, 214—218]. В подгруппы наиболее высокого риска входят больные, у которых патологические изменения при ЭКГ с усреднением сигнала сочетаются с дисфункцией левого желудочка или с нарушениями, выявляемыми при холтеровском ЭКГ-мониторинге [209, 210, 219]. Применение ЭКГ с усреднением сигнала для оценки степени риска после ИМ ограничено тремя основными моментами. Во-первых, в течение первых дней и даже недель после ИМ разброс результатов метода значителен. Во-вторых, хотя отрицательный (или нормальный) результат имеет высокую прогностическую ценность (вероятность выживания без осложнений в течение первого года после ИМ >90%), прогностическая ценность положительного результата невелика (<20%). В-третьих, в ходе клинических испытаний, например в испытании CAST (Cardiac Arrhythmia Suppression Trial), не удалось найти способ коррекции нарушений, выявляемых этим методом. Таким образом, влияние результатов данного метода на тактику ведения больных после ИМ в настоящее время невелико.
Методы исследования вариабельности частоты сердечных сокращений и ее чувствительности к состоянию барорецепторов (показателей, отражающих вегетативный тонус), по-видимому, также позволяют выявлять больных с высоким риском [198, 220—227]. Однако эти методы изучались на небольших, специально отобранных группах, при этом полная оценка дополнительной информативности методов не проводилась. Кроме того, остается неясным, насколько лечебные вмешательства, проводимые на основании результатов этих исследований, влияют на прогноз. Влияние кардиальных рефлексов блуждающего нерва на риск после ИМ в настоящее время изучается в испытании ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction), включающем 1200 больных. До получения результатов этого и других исследований вопрос о целесообразности применения указанных методов остается открытым.
Для оценки риска при ИМ использовался метод индукции стойкой желудочковой тахикардии, в частности, путем программируемой кардиостимуляции. К сожалению, почти в половине опубликованных работ показано, что программируемая кардиостиму ляция не позволяет прогнозировать смерть или развитие аритмий в отдаленном периоде после ИМ [228—239]. Кроме того, информативность данного метода при оценке риска не выше, чем у других неинвазивных тестов [237].
6.4. Риск повторной ишемии миокарда
Очевидно, что тяжесть поражения коронарных артерий и масса миокарда, подверженная риску повторной ишемии, имеют важнейшее значение для отдаленного прогноза. Для оценки этих факторов применяются два основных диагностических метода — неинвазивные нагрузочные пробы и катетериза ция сердца.
Проведение нагрузочных проб перед выпиской из стационара позволяет оценить степень ишемии миокарда, которую можно спровоцировать у данного больного. Оценка проводится по клиническим симптомам (например, возникновению загрудинной боли), изменениям ЭКГ (например, по степени снижения сегмента ST) или гемодинамических показателей при физической нагрузке (например, по снижению АД на пике нагрузки или ухудшению функционального состояния). Методы визуализации — сцинтиграфия миокарда, ЭхоКГ, изотопная ангиография — позволяют выявить дополнительные признаки ишемии, в том числе обусловленные физической нагрузкой гиперемию и дискинезию миокарда. Эти методы позволяют также определить локализацию и размеры участков миокарда, подверженных риску ишемии.
6.5. Meтa-анализ литературы, посвященной пробам с физической нагрузкой
При проведении мета-анализа всех исследований (1980—1994 гг.), посвященных ЭКГ, сцинтиграфии миокарда, изотопной ангиографии и ЭхоКГ на фоне физической нагрузки, определялась прогностическая ценность отдельных критериев ишемии миокарда или нарушения функционального состояния (табл. 3 и 4) [7]. Кроме того, был проведен дополнительный анализ в зависимости от проводившегося лечения (тромболитическая терапия в сравнении с другими способами лечения), чтобы выяснить, не снижает ли тромболизис точность метода.
Таблица 3. Информативность результатов различных неинвазивных методов, используемых для оценки степени риска перед выпиской из стационара*
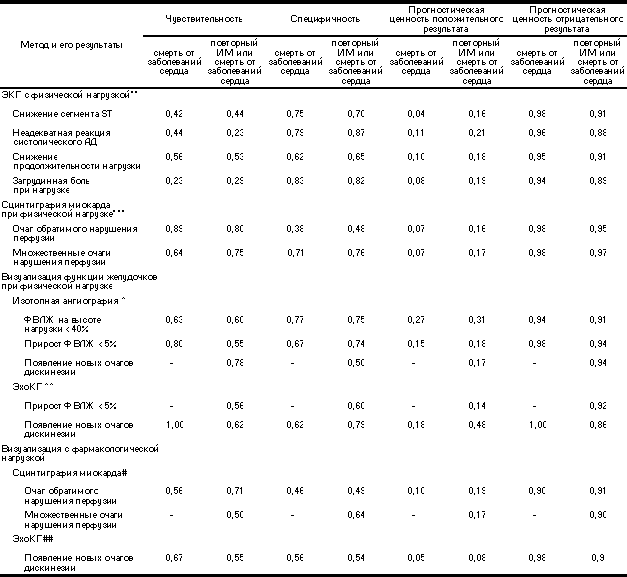
Примечание. * — частота всех неблагоприятных исходов оценивалась через 1 год после ИМ.
** — смертность от заболеваний сердца 3,3%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 7,8%.
*** — смертность от заболеваний сердца 4,6%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 13,1%.
^ — смертность от заболеваний сердца 9,3%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 13,2%.
^^ — смертность от заболеваний сердца 5,6%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 15,9%.
# — смертность от заболеваний сердца 6,6%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 15,0%.
## — смертность от заболеваний сердца 2,5%; комбинированный показатель частоты повторного развития ИМ или смерти от заболеваний сердца 5,0%.
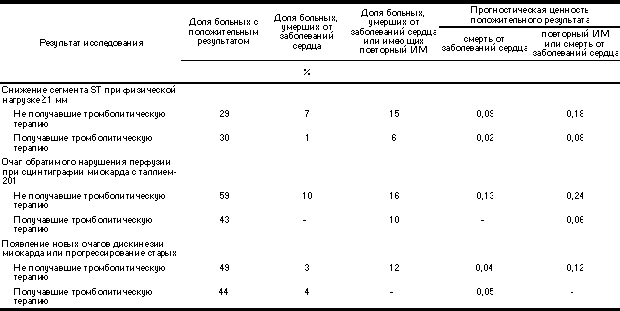
Хотя методы мета-анализа и позволяют объединять результаты многих исследований, провести полную сравнительную оценку и стандартизацию различных способов оценки риска в популяции на основании имеющихся литературных данных по неинвазивным методам достаточно трудно. Претестовый риск смерти, оцениваемый разными методами, различается в 3 раза: он колеблется от 2,5% для ЭхоКГ с дипиридамоловой нагрузкой до 9,3% для изотопной ангиографии с физической нагрузкой. Кроме того, недавние исследования (особенно рандомизированные испытания) показали, что смертность среди получавших тромболитическую терапию значительно ниже, чем у тех, кому тромболизис не проводился. Поскольку прогностическая ценность положительного результата теста зависит в первую очередь от претестовой (исходной) вероятности определенного исхода в определенной популяции, снижение прогностической ценности положительного результата теста у получавших тромболитическую терапию (см. табл. 4) отражает изменения в составе больных, а не изменения операционных характеристик диагности ческого метода.
Таблица 4. Результаты оценки степени риска перед выпиской из стационара у получавших и не получавших тромболитическую терапию
6.5.1. Электрокардиография с физической нагрузкой
К признакам ишемии при ЭКГ с физической нагрузкой относятся существенное снижение сегмента ST (горизонтальное или косонисходящее, не менее чем на 0,1 мВ по сравнению с его уровнем в покое) и боль за грудиной. Дополнительными косвенными признаками ишемии или связанного с ней нарушения функции миокарда могут служить неадекватная реакция систолического АД в ответ на нагрузку и малая продолжительность нагрузки (см. табл. 3). Однако прогностические возможности нагрузочной ЭКГ могут варьировать в зависимости от характеристик больного (например, возраста и пола), проводимого лечения (например, дигоксином и b- блокаторами) и протокола проведения пробы (вид нагрузки и ее продолжительность, планируется ли максимальная нагрузка или ее величина ограничивается появлением симптомов). Выявлению ишемии могут мешать такие исходные изменения ЭКГ, как наличие зубцов Q, остаточных изменений сегмента ST—T, признаков гипертрофии левого желудочка, блокады ножек пучка Гиса и идиовентрикулярного ритма [240, 241].
В целом результаты этой нагрузочной пробы, определяемые функцией левого желудочка (неадекват ная гемодинамическая реакция на физическую нагрузку или низкая продолжительность пробы), можно считать несколько более чувствительными прогностическими критериями смерти, чем только маркеры ишемии (снижение сегмента ST или боль за грудиной). Однако прогностическая ценность любого из положительных результатов пробы (доля больных с положительным результатом, у которых развился прогнозируемый исход) невелика из-за низкой частоты неблагоприятных исходов в обследован ных популяциях (общая смертность в течение первого года составляет 3,3%). Напротив, прогностиче ская ценность отрицательного результата ЭКГ с физической нагрузкой составляет примерно 0,90.
6.5.2. Сцинтиграфия миокарда с физической нагрузкой
Критериями ишемии при сцинтиграфии миокарда в основном считаются очаги нарушения перфузии в пределах зоны инфаркта и вне ее. При анализе обобщенных данных (894 больных) оказалось, что наличие обратимого нарушения перфузии более чувствительный, хотя и менее специфичный прогностиче ский критерий повторного ИМ или смерти от заболеваний сердца, чем обычно используемая ЭКГ с физической нагрузкой (см. табл. 3). Очаги обратимого нарушения перфузии вне зоны инфаркта чаще встречаются при поражении сразу нескольких коронарных артерий [242—247] и в одном исследовании их наличие оказалось прогностическим критерием смерти [248, 249].
6.5.3. Визуализация функции желудочков при физической нагрузке
Информация о снижении фракции выброса в покое очень важна для прогноза выживаемости. В нескольких работах [159, 250, 251] было показано, что определение фракции выброса на пике нагрузки позволяет получить независимую дополнительную информацию. Анализ имеющихся данных показал, что такой показатель, как фракция выброса на высоте нагрузки Ј40%, обладает наибольшей прогностической ценностью положительного результата (0,27) среди всех изученных тестов (см. табл. 3). Это, впрочем, отчасти объясняется высоким исходным риском в обследованной популяции (смертность в течение первого года составляла 9,3%). Предварительные исследования показали также, что важное диагностическое и прогностическое значение имеет обнаружение новых очагов дискинезии при изотопной ангиографии или ЭхоКГ, однако это необходимо подтвердить в крупномасштабных исследованиях.
6.5.4. Фармакологические нагрузочные пробы
Пробы с физической нагрузкой позволяют получить данные о функциональном состоянии миокарда, но не все больные способны выполнить их. Если это связано с состоянием сердечно-сосудистой системы, то такие больные явно принадлежат к группе высокого риска. Если им показана реваскуляриза ция миокарда, необходимо решать вопрос о катетеризации сердца. Другие больные не могут выполнять пробу с физической нагрузкой из-за сопутствующих заболеваний или иных причин (параплегии, перемежающейся хромоты, старческого возраста). В таких случаях можно применять различные препараты для фармакологической нагрузки (например, дипиридамол, аденозин или добутамин) и различные методы специальные протоколы визуализации (например, сцинтиграфия миокарда с таллием или технецием и метоксиизобутилизонитрилом, ЭхоКГ). Исследования, посвященные пробам с фармакологической нагрузкой, были небольшими и имели те же систематические ошибки, что и исследования по оценке проб с физической нагрузкой; в то же время чувствительность и специфичность проб с физической или фармакологической нагрузкой, похоже, не отличаются (см. табл. 3).
6.6. Выявление больных, которым перед выпиской из стационара показана катетеризация сердца
Решение вопроса о целесообразности проведения катетеризации сердца перед выпиской из стационара зависит от ряда факторов. Во-первых, эту процедуру (или неинвазивные нагрузочные пробы) не проводят при тяжелых сопутствующих заболеваниях или в тех случаях, когда больной предпочитает консервативное лечение. Во-вторых, среди больных, которым показана реваскуляризация миокарда, можно выделить особую подгруппу с явными показаниями к проведению катетеризации — это больные с осложнениями после ИМ, т.е. с высокой степенью риска. Напротив, в литературе отсутствует единое мнение по вопросу о том, какой из методов — катетеризацию сердца или неинвазивные нагрузочные пробы — следует использовать у больных с неосложненным ИМ.
6.6.1. Аргументы в пользу проведения неинвазивных нагрузочных проб
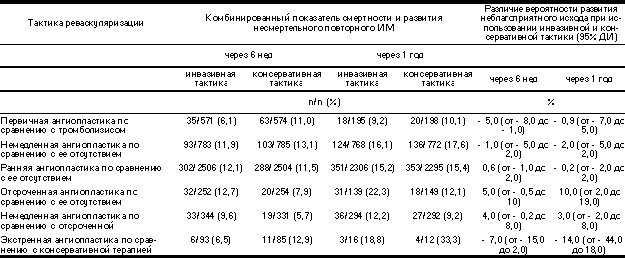
Сторонники провокационных проб утверждают, что с их помощью можно выявлять клинически значимую ишемию миокарда и дисфункцию левого желудочка в покое, что в большинстве случаев делает катетеризацию сердца (с присущими ей риском и затратами) ненужной. Главным аргументом в пользу применения после неосложненного ИМ выжидательной тактики в сочетании с неинвазивными провокационными пробами служат совокупные данные ряда рандомизированных клинических испытаний. В них сравнивали тактику, при которой катетеризация и реваскуляризация в разные сроки после ИМ были стандартными процедурами, с более консервативной тактикой, когда катетеризация выполнялась только при наличии ишемии после ИМ. Результаты этих испытаний недавно были обобщены (табл. 5) [252]. Катетеризация в качестве стандартной процедуры не повышает выживаемость и не снижает частоту развития повторных несмертельных ИМ. Так, в исследовании TIMI-IIb [38] стандартное проведение катетеризации почти в 3 раза повысило число реваскуля ризационных процедур, но не повлияло на смертность и частоту развития повторных ИМ в течение первого года после ИМ.
Таблица 5. Комбинированный показатель смертности и развития несмертельного повторного ИМ при использовании различной тактики реваскуляризации (по K.B. Michels and S.Yusuf [252])
6.6.2. Аргументы в пользу катетеризации как стандартной процедуры
Сторонники катетеризации сердца как стандартной процедуры приводят следующие соображения. Во-первых, точность неинвазивных диагностических исследований у больных, перенесших ИМ, низка. Во-вторых, хотя клинические испытания не выявили преимуществ стандартной катетеризации сердца с точки зрения снижения смертности или частоты повторных ИМ, в эти испытания включали только получавших тромболитическую терапию и имевших фракцию выброса в среднем выше 50%, а такие больные составляют меньшинство. К тому же, статистическая мощность этих комбинированных исследований была низка, в связи с чем можно было пропустить значительное (до 20%) снижение риска. В-третьих, частота повторных госпитализаций и последующих лечебных и диагностических процедур выше среди больных, которым сначала назначали консервативное лечение [38], особенно при ИМ без зубца Q [253]. Наконец, D.B. Mark et al. [254] недавно показали, что при нерандомизированном сравнении больных, которым проводили тромболизис в США и Канаде (частота последующей катетеризации 72 и 25% соответственно), у больных в США на протяжении первого года после ИМ симптомов ИБС было меньше, а функциональное состояние — лучше. Хотя это исследование не позволяет связать достигнутый эффект с каким-либо одним аспектом медицинской помощи, оно свидетельствует в пользу того, что более активное лечение может существенно улучшить качество жизни.
Доводы за и против катетеризации можно подразделить в зависимости от наличия или отсутствия дисфункции левого желудочка. Во-первых, при фракции выброса ниже 40% вероятность поражения сразу нескольких коронарных артерий значительно выше, чем при более высоких значениях фракции выброса, и имеются убедительные доказательства того, что аортокоронарное шунтирование может существенно повысить отдаленную выживаемость этих больных [255—257]. Хотя некоторые авторы утверждали, что реваскуляризация приносит пользу только больным с клиническими признаками и симптомами ишемии (например, с загрудинной болью), анализ объединенных данных семи самых крупных рандомизированных клинических испытаний, в ходе которых сравнивалась эффективность аортокоронарного шунтирования и консервативной терапии после ИМ [255], не подтвердил этого мнения. Показано, что при наличии дисфункции левого желудочка и незначительной стенокардии отдаленная смертность после аортокоронарного шунтирования была ниже (рис. 5). Таким образом, в качестве стандартной процедуры катетеризация может с успехом применяться у больных с дисфункцией левого желудочка, которым показана реваскуляризация.

Рис. 5. Кривые выживаемости при медикаментозном (сплошная линия) и хирургическом (пунктирная линия) лечении острого ИМ при наличии дисфункции левого желудочка и отсутствии признаков стенокардии. По данным S.Yusuf et al. [255].
В отсутствие признаков тотальной дисфункции левого желудочка (с фракцией выброса >50%) вероятность многососудистого поражения и, следователь но, вероятность улучшения прогноза в результате реваскуляризации более низка, чем при дисфункции левого желудочка. Действительно, ангиография, проводимая в качестве стандартной процедуры больным без дисфункции левого желудочка, выявляет множество больных без клинических признаков стенокардии, имеющих поражение одной коронарной артерии; выполнение реваскуляризации этим больным вряд ли повысит выживаемость. Таким образом, проведение неинвазивных нагрузочных проб в этой группе может снизить затраты без ухудшения клинических исходов. Анализ результатов клинических испытаний показал, что проведение ангиографии при неосложненном ИМ увеличивает срок пребывания в стационаре в среднем на один день.
6.7. Оценка необходимости воздействия на факторы риска ИБС
Хотя решение вопроса о проведении катетеризации сердца может быть различным, это и другие решения, принимаемые на этапе стационарного лечения, отражают лишь малую долю всех способов воздействия на факторы риска ИБС. Недавно появились доказательства того, что коррекция этих факторов может снижать частоту отдаленных осложнений, поэтому отбор больных для проведения мероприятий по вторичной профилактике следует рассматривать в качестве важного компонента оценки степени риска после ИМ.
Во многих случаях ИМ служит первым проявлением ИБС. Он не только указывает на наличие болезни, но и обеспечивает идеальную возможность побудить больных к изменению образа их жизни. Вторичная профилактика позволяет существенно снизить заболеваемость и смертность [258]. Так, мета-анализ результатов клинических испытаний по вторичной профилактике [259] показал, что активная гипохолестеринемическая терапия в значительной степени (на 22%) снижала общую частоту повторных смертельных и несмертельных ИМ. В недавно проведенном исследовании 4S (Scandinavian Simvastatin Survival Study) [260] частота основных осложнений ИБС у получавших гипохолестеринемический препарат симвастатин оказалась на 70% ниже, чем у получавших традиционное лечение.
Хотя уровень холестерина может быть ниже исходного даже через 2 мес после ИМ, липидный спектр, определяемый в течение 24—48 ч после ИМ, точно отражает состояние липидного обмена [261]. Повышенный уровень общего холестерина за пределами этого временного интервала сохраняет свое значение как критерий риска. Поэтому представля ется целесообразным у всех больных, госпитализированных в течение 24 ч с момента развития ИМ, при поступлении определять липидный спектр (включая определение общего холестерина и холестерина липопротеинов высокой плотности). В соответствии c рекомендациями, разработанными в рамках программы NCEP (National Cholesterol Education Program), коррекцию гиперхолестеринемии следует начинать немедленно [261].
У больных, бросивших курить после ИМ, уже в течение 3 лет риск повторного несмертельного ИМ может снизиться до такого же уровня, как у никогда не куривших больных [262]. Анализ обобщенных результатов нескольких клинических испытаний [263] показал, что программы по отказу от курения характеризуются минимальными затратами на 1 год сохраненной жизни. Определение АД и содержания сахара в крови входят в стандартное обследование больных с подозрением на ИМ при их поступлении в стационар и могут способствовать выявлению сопутствующей артериальной гипертонии и сахарного диабета. На прогноз при ИМ могут влиять и другие потенциальные маркеры риска, в частности, уровень некоторых факторов свертывания [264, 265]. Однако эффективных терапевтических методов коррекции этих факторов пока не предложено, поэтому специальные лабораторные тесты для выявления наследственных нарушений свертывания следует использовать только в научных исследованиях и необычных клинических ситуациях (например, при обследовании очень молодых больных с ИМ, у которых не удается выявить ни одного из известных факторов риска).
Гормональный статус может иметь большое значение, особенно при ИМ у женщин, поскольку этот фактор риска может поддаваться коррекции. Анализ обобщенных результатов 32 эпидемиологических исследований [266] показал, что проведение заместительной эстрогенотерапии в постменопаузе снижало риск развития сердечно-сосудистых осложнений на 30—40%. При этом защитное действие заместительной гормональной терапии было более выраженным у женщин, уже имеющих сердечно-со судистые заболевания [267]. Однако эти эпидемиологические доказательства базируются в основном на данных нерандомизированных исследований, их еще следует подтвердить в ходе рандомизированных клинических испытаний. Поэтому современные рекомендации предлагают врачу оценивать возможные благоприятные и неблагоприятные эффекты заместительной гормональной терапии и обязательно обсуждать их с пациентками [266]. Подобная тактика представляется особенно оправданной в отношении женщин, уже перенесших ИМ.
На отдаленный прогноз могут в значительной степени влиять также эмоциональное состояние больного и деятельность системы социальной поддержки [268—270]. Отсутствие социальной поддержки оказалось статистически значимым независимым фактором риска смерти; оценка производилась после внесения поправок на клинические факторы риска, анатомические особенности коронарных артерий и функцию левого желудочка [270]. Психологические вмешательства, которые уменьшают влияние стресса, связанного с ИМ, также могут снижать общую частоту развития последующих осложнений [271, 272]. В ходе проводимых в настоящее время рандомизированных клинических испытаний (включая одно с использованием ингибиторов обратного захвата серотонина) изучается, может ли фармакологическое воздействие на стресс и депрессию после ИМ также снижать этот риск. Пока же больных с депрессией или социально изолированных больных следует относить к группе высокого риска и решать вопрос о необходимых вмешательствах.
Комплексные программы кардиологической реабилитации (8—12-недельные программы обучения после выписки из стационара) включают в себя аэробные физические упражнения и коррекцию факторов риска. При анализе обобщенных результатов многих исследований [273] было показано, что лечебная физкультура, назначаемая после ИМ, снижает смертность на 20—25%. Кроме того, программы кардиологической реабилитации позволяют значительно улучшить качество жизни больных, не требуя таких значительных экономических затрат, как другие виды медицинской помощи [274, 275]. Решить вопрос о возможности включения больного в программу кардиологической реабилитации можно во время оценки риска ишемии перед выпиской.
Наконец, важным способом улучшения отдаленного прогноза после ИМ следует считать прием таких лекарственных препаратов, которые достоверно повышают выживаемость. К ним относятся аспирин [276, 277], b- блокаторы [278, 279] и ингибиторы ангиотензинпревращающего фермента (у больных с дисфункцией левого желудочка) [185—188]. Естественно было бы предположить, что почти все больные должны получать эти препараты в отсутствие противопоказаний, однако недавние популяционные исследования выявили иную картину. Так, E.F. Ellerbeek et al. [280] проанализировали данные системы государственного медицинского страхования Medicare и показали, что из 16 124 больных, которым следовало назначать такое лечение, только 83% получали аспирин, и только 45% — b- блокаторы.
Оценку степени риска после инфаркта миокарда традиционно проводили лишь с точки зрения возможных вмешательств, к которым прибегали в основном при появлении определенных признаков или симптомов. Однако за последнее время было проведено большое число исследований, послуживших эмпирическим обоснованием для новой, всеобъемлющей тактики — ранней и непрерывной оценки степени риска. Это позволяет как врачу, так и больному использовать преимущества целенаправленных, научно обоснованных методов лечения, снижения риска и увеличения выживаемости, основанных не только на клинических проявлениях, но и на известных или доступных выявлению факторах риска.
Оценку степени риска следует начинать уже при первом обследовании больного. Во многих случаях клинические признаки высокого риска (рецидивы ишемии миокарда, застойная сердечная недостаточность, злокачественные желудочковые аритмии и другие осложнения ИМ) появляются на более позднем этапе стационарного лечения. Таким больным можно рекомендовать более интенсивное лечение, включая катетеризацию сердца (если им показана реваскуляризация миокарда). При неосложненном ИМ, по данным рандомизированных исследований, катетеризация не более эффективна, чем консервативная терапия. Однако у этих больных степень риска зависит от функции левого желудочка. При фракции выброса ниже 40% риск смерти повышен, часто поражены сразу несколько коронарных артерий; прогноз у этих больных может улучшить катетериза ция сердца (если им показана реваскуляризация миокарда). При почти нормальной функции левого желудочка риск смерти очень низок, таким больным показана ранняя выписка из стационара; для дальнейшей оценки степени риска им следует перед выпиской проводить нагрузочные пробы. Наконец, оценивать степень риска, выявлять корригируемые факторы риска ИБС, а при наличии показаний проводить мероприятия по вторичной профилактике следует и после выписки из стационара.
Литература
1. DeBusk R.F. Specialized testing after recent acute myocardial infarction. Ann Intern Med 1989;110:470—81.
2. Kleiman N.S. White H.D. Ohman E.M. Ross A.M. Woodlief L.H. Califf R.M. et al. Mortality within 24 hours of thrombolysis for myocardial infarction. The importance of early reperfusion. The GUSTO Investigators, Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries. Circulation 1994;90:2658—65.
3. Cragg D.R. Friedman H.Z. Bonema J.D. Jaiyesimi I.S. Ramos R.G. Timmis G.C. et al. Outcome of patients with acute myocardial infarction who are ineligible for thrombolytic therapy. Ann Intern Med 1991;115:173—7.
4. Althouse R. Maynard C. Cerqueira M.D. Olsufka M. Ritchie J.L. Kennedy J.W. The Western Washington Myocardial Infarction Registry and Emergency Department Tissue Plasminogen Activator Treatment Trial. Am J Cardiol 1990;66:1298—303.
5. Low K.G. Joliceour M.R. Colman R.A. Stone L.E. Fleisher C.L. Women participants in research: assessing progress. Women Health 1994;22:79—98.
6. Gurwitz J.H. Gore J.M. Goldberg R.J. Rubison M. Chandra N. Rogers W.J. Recent age-related trends in the use of thrombolytic therapy in patients who have had acute myocardial infarction. National Registry of Myocardial Infarction. Ann Intern Med 1996;124:283—91.
7. Shaw L.J. Peterson E.D. Kesler K. Hasselblad V. Califf R.M. A meta-analysis of predischarge risk stratification after acute myocardial infarction with stress electrocardiographic, myocardial perfusion, and ventricular function imaging. Am J Cardiol 1996;78:1327—37.
8. Roubin G.S. Califf R.M. O’Neill W.W. Phillips H.R. 3d, Stack R.S., eds. Interventional Cardiovascular Medicine: Principles and Practice. New York: Churchill Livingstone; 1994.
9. Braunwald E., ed. Heart Disease: A Textbook of Cardiovascular Medicine. 4th ed. Philadelphia: WB Saunders; 1992.
10. Califf R.M. Mark D.B. Wagner G.S., eds. Acute Coronary Care. 2d ed. St. Louis, МО: Mosby-Year Book; 1995.
11. Eddy D.M. Hasselblad V. Shachter R. An introduction to a Bayesian method for meta-analysis: the confidence profile method. Med Decis Making 1990;10:15—23.
12. Morris R.M. Barnaby P.F. Brandt P.W. Geary G.G. Whitlock R.M. Wild C.J. et al. Prognosis after recovery from first acute myocardial infarction: determinants of reinfarction and sudden death. Am J Cardiol 1984;53:408—13.
13. Henning H. Gilpin E.A. Covell J.W. Swan E.A. O’Rourke R.A. Ross J. Jr. Prognosis after acute myocardial infarction: a multivariate analysis of mortality and survival. Circulation 1979;59:1124—36.
14. Dubois С. Pierard L.A. Albert A. Smeets J.P. Demoulin J.C. Boland J. et al. Short-term risk stratification at admission based on simple clinical data in acute myocardial infarction. Am J Cardiol 1988;61:216—9.
15. Immediate vs delayed catheterization and angioplasty following thrombolytic therapy for acute myocardial infarction. TIMI II A results. The TIMI Research Group. JAMA 1988;260:2849—58.
16. In-hospital mortality and clinical course of 20,891 patients with suspected acute myocardial infarction randomised between alteplase and streptokinase with or without heparin. The International Study Group. Lancet 1990;336:71—5.
17. Lee K.L. Woodlief L.H. Topol E.J. Weaver W.D. Betriu A. Col J. et al. Predictors of 30-day mortality in the era of reperfusion for acute myocardial infarction. Results from an international trial of 41,021 patients. GUSTO-1 Investigators. Circulation 1995;91:1659—68.
18. Norris R.M. Brandt P.W. Caughey D.E. Lee A.J. Scott P.J. A new coronary prognostic index. Lancet 1969;1:274—8.
19. Fallen E.L. Armstrong P. Cairns J. Dafoe W. Frasure-Smith N. Langer A. et al. Report of the Canadian Cardiovascular Society’s consensus conference on Management of the Postmyocardial Infarction Patient. Can Med Assoc J 1991;144:1015—25.
20. Madsen Е.В. Gilpin E. Henning H. Short-term prognosis in acute myocardial infarction: evaluation of different prediction methods. Am Heart J 1984;107:1241—51.
21. Mukharji J. Rude R.E. Poole W.K. Gustafson N. Thomas L.J. Jr. Strauss H.W. et al. Risk factors for sudden death after acute myocardial infarction: two-year follow-up. Am J Cardiol 1984;54:31—6.
22. Selker H.P. Griffith J.L. D’Agostino R.B. A time-insensitive predictive instrument for acute myocardial infarction mortality: a multicenter study. Med Care 1991;29:1196—211.
23. White H.D. Barbash G.I. Califf R.M. Simes R.J. Granger C.B. Weaver W.D. et al. Age and outcome with contemporary thrombolytic therapy: results from the GUSTO-I trial. Circulation 1996;94:1826—33.
24. Goldberg R.J. Gore J.M. Gurwitz J.H. Alpert J.S. Brady P. Strohsnitter W. et al. The impact of age on the incidence and prognosis of initial acute myocardial infarction: the Worcester Heart Attack Study. Am Heart J 1989; 117:543—9.
25. Weaver W.D. White H.D. Wilcox R.G. Aylward P.E. Morris D. Guerci A. et al. Comparisons of characteristics and outcomes among women and men with acute myocardial infarction treated with thrombolytic therapy. GUSTO-I Investigators. JAMA 1996;275:777—82.
26. Vaccarino V. Krumholz H.M. Berkman L.F. Horwitz R.I. Sex differences in mortality after myocardial infarction. Is there evidence for an increased risk for women? Circulation 1995;91: 1861—71.
27. Fiebach N.H. Viscoli C.M. Horwitz R.I. Differences between women and men in survival after myocardial infarction. Biology or methodology? JAMA 1990;263:1092—6.
28. Dittrich H. Gilpin E. Nicod P. Cali G. Henning H. Ross J. Jr. Acute myocardial infarction in women: influence of gender on mortality and prognostic variables. Am J Cardiol 1988;62:1—7.
29. Lincoff A.M. Califf R.M. Ellis S.G. Sigmon K.N. Lee K.L. Topol E.J. Thrombolytic therapy for women with myocardial infarction: is there a gender gap? Thrombolysis and Angioplasty in Myocardial Infarction Study Group. J Am Coll Cardiol 1993;22:1780—7.
30. Becker R.C. Terrin M. Ross R. Knatterud G.L. Desvigne-Nickens P. Gore J.M. et al. Comparison of clinical outcomes for women and men after acute myocardial infarction. The Thrombolysis in Myocardial Infarction Investigators. Ann Intern Med 1994;120:638—45.
31. Tofler G.H. Stone P.H. Muller J.E. Willich S.N. Davis V.G. Poole W.K. et al. Effects of gender and race on prognosis after myocardial infarction: adverse prognosis for women, particularly black women. J Am Coll Cardiol 1987;9:473—82.
32. Greenland P. Reicher-Reiss H. Goldbourt U. Behar S. In-hospital and 1-year mortality in 1,524 women after myocardial infarction. Comparison with 4,315 men. Circulation 1991; 83: 484—91.
33. Barbash G.I. Reiner J. White H.D. Wilcox R.G. Armstrong P.W. Sadowski Z. et al. Evaluation of the paradoxic beneficial effects of smoking in patients receiving thrombolytic therapy for acute myocardial infarction: mechanism of the "smoker’s paradox" from the GUSTO-I trial, with angiographic insights. Global Utilization of Streptokinase and Tissue-Plasminogen Activator for Occluded Coronary Arteries. J Am Coll Cardiol 1995;26:1222—9.
34. Grines C.L. Topol E.J. O’Neill W.W. George B.S. Kereiakes D. Phillips H.R. et al. Effect of cigarette smoking on outcome after thrombolytic therapy for myocardial infarction. Circulation 1995;91:298—303.
35. Forrester J.S. Diamond G. Chatterjee K. Swan H.J. Medical therapy of acute myocardial infarction by application of hemodynamic subsets. N Engl J Med 1976;295:1356—62.
36. Killip T. 3d, Kimball J.T. Treatment of myocardial infarction in a coronary care unit. A two year experience with 250 patients. Am J Cardiol 1967;20:457—64.
37. Effectiveness of intravenous thrombolytic treatment in acute myocardial infarction. Gruppo Italiano per lo Studio della Streptochinasi nell’infarto Mio-cardico (GISSI). Lancet 1986;1:397—402.
38. Comparison of invasive and conservative strategies after treatment with intravenous tissue plasminogen activator in acute myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) phase II trial. The TIMI Study Group. N Engl J Med 1989;320:618—27.
39. Zabel K.M. Hathaway W.R. Peterson E.D. Granger C.B. Armstrong P.W. Morris D. et al. Baseline electrocardiogram predicts 30-day mortality among 32,812 patients with acute myocardial infarction treated with thrombolysis [Abstract]. J Am Coll Cardiol 1995;25:342A.
40. Bilbao F.J. Zabalza I.E. Vilanova J.R. Froufe J. Atrioventricular block in posterior acute myocardial infarction: a clinicopathologic correlation. Circulation 1987;75:733—6.
41. Clemmensen P. Ohman E.M. Sevilla D.C. Peck S. Wagner N.B. Quigley P.S. et al. Changes in standard electrocardiographic ST-segment elevation predictive of successful reperfusion in acute myocardial infarction. Am J Cardiol 1990;66:1407—11.
42. Fisch G.R. Zipes D.P. Fisch C. Bundle branch block and sudden death. Prog Cardiovasc Dis 1980;23:187—224.
43. Mavric Z. Zaputovic L. Matana A. Kucic J. Roje J. Marinovic D. et al. Prognostic significance of complete atrioventricular block in patients with acute inferior myocardial infarction with and without right ventricular involvement. Am Heart J 1990;119:823—8.
44. Goldberg R.J. Seeley D. Becker R.C. Brady P. Chen Z.Y. Osganian V. et al. Impact of atrial fibrillation on the in-hospital and long-term survival of patients with acute myocardial infarction: a community-wide perspective. Am Heart J 1990;119:996—1001.
45. Bates E.R. Clemmensen P.M. Califf R.M. German L.E. Aronson L.G. George B.S. et al. Precordial ST segment depression predicts a worse prognosis in inferior infarction despite reperfusion therapy. The Thrombolysis and Angioplasty in Myocardial Infarction (TAMI) Study Group. J Am Coll Cardiol 1990;16:1538—44.
46. Lembo N.J. Starling M.R. Dell’ltalia L.J. Crawford M.H. Chaudhuri T.K. O’Rourke R.A. Clinical and prognostic importance of persistent precordial (V1-V4) electrocardiographic ST segment depression in patients with inferior transmural myocardial infarction. Circulation 1986;74:56—63.
47. Peterson E.D. Hathaway W.R. Zabel K.M. Pieper K.S. Granger C.B. Wagner G.S. et al. Prognostic significance of precordial ST segment depression during inferior myocardial infarction in the thrombolytic era: results in 16,521 patients. J Am Coll Cardiol 1996;28:305—12.
48. Zehender M. Kasper W. Kauder E. Schonthaler M. Geibel A. Olschewski M. et al. Right ventricular infarction as an independent predictor of prognosis after acute inferior myocardial infarction. N Engl J Med 1993;218:981—8.
49. Lee T.H. Goldman L. Serum enzyme assays in the diagnosis of acute myocardial infarction. Recommendations based on a quantitative analysis. Ann Intern Med 1986;105:221—33.
50. Lee T.H. Weisberg M.C. Cook E.F. Daley K. Brand D.A. Goldman L. Evaluation of creatine kinase and creatine kinase-MB for diagnosing myocardial infarction. Clinical impact in the emergency room. Arch Intern Med 1987;147:115—21.
51. Katus Н.А. Remppis A. Scheffold T. Diederich K.W. Intracellular compartmentation of cardiac troponin T and its release kinetics in patients with reperfused and nonreperfused myocardial infarction. Am J Cardiol 1991;67: 1360—7.
52. Adams J.E. 3d, Bodor G.S. Davila-Roman V.G. Delmez J.A. Apple F.S. Ladenson J.H. et al. Cardiac troponin I. A marker with high specificity for cardiac injury. Circulation 1993; 88: 101—6.
53. Wagner I. Mair J. Fridrich L. Artner-Dworzak E. Lechleitner P. Morass B. et al. Cardiac troponin T release in acute myocardial infarction is associated with scintigraphic estimates of myocardial scar. Coron Artery Dis 1993;4:537—44.
54. Ohman Е.М. Armstrong P.W. Christenson R.H. Granger C.B. Katus H.A. Hamm C.W. et al. Cardiac troponin T levels for risk stratification in acute myocardial ischemia. GUSTO IIA Investigators. N Engl J Med 1996;335:1333—41.
55. Remppis A. Scheffold T. Karrer 0. Zehelein J. Hamm C. Grunig E. et al. Assessment of reperfusion of the infarct zone after acute myocardial infarction by serial cardiac troponin T measurements in serum. Br Heart J 1994;71:242—8.
56. Abe S. Arima S. Yamashita T. Miyata M. Okino H. Toda H. et al. Early assessment of reperfusion therapy using cardiac troponin T. J Am Coll Cardiol 1994;23:1382—9.
57. Pellikka P.A. Behrenbeck T. Verani M.S. Mahmarian J.J. Wackers F.J. Gibbons R.J. Serial changes in myocardial perfusion using tomographic technetium-99m-hexakis-2-methoxy-2-methylpropyl-isonitrile imaging following reperfusion therapy of myocardial infarction. J Nucl Med 1990;31:1269—75.
58. Wackers F.J. Terrin M.L. Kayden D.S. Knatterud G. Forman S. Braunwald E. et al. Quantitative radionuclide assessment of regional ventricular function after thrombolytic therapy for acute myocardial infarction: results of phase I Thrombolysis in Myocardial Infarction (TIMI) trial. J Am Coll Cardiol 1989;13:998—1005.
59. McCallister B.D. Jr. Christian T.F. Gersh B.J. Gibbons R.J. Prognosis of myocardial infarctions involving more than 40% of the left ventricle after acute reperfusion therapy. Circulation 1993;88(4 Pt 1):1470—5.
60. Gibbons R.J. Verani M.S. Behrenbeck T. Pellikka P.A. O’Connor M.K. Mahmarian J.J. et al. Feasibility of tomographic 99mTc-hexakis-2-methoxy-2-methylpropyl-isonitrile imaging for the assessment of myocardial area at risk and the effect of treatment in acute myocardial infarction. Circulation 1989;80:1277—86.
61. Christian T.F. Schwartz R.S. Gibbons R.J. Determinants of infarct size in reperfusion therapy for acute myocardial infarction. Circulation 1992;86:81—90.
62. Lomboy C.T. Schulman D.S. Grill H.P. Flores A.R. Orie J.E. Granato J.E. Rest-redistribution thallium-201 scintigraphy to determine myocardial viability early after myocardial infarction. J Am Coll Cardiol 1995;25:210—7.
63. Cornel J.H. Arnese M. Forster T. Postma-Tjoa J. Reijs A.E. Fioretti P.M. Potential and limitations of Tc-99m sestamibi scintigraphy for the diagnosis of myocardial viability. Herz 1994;19:19—27.
64. Corbett J.R. Lewis S.E. Wolfe C.L. Jansen D.E. Lewis M. Rellas J.S. et al. Measurement of myocardial infarct size by technetium pyrophosphate single-photon tomography. Am J Cardiol 1984;54:1231—6.
65. Tamaki S. Kadota К. Kambara H. Suzuki Y. Nohara R. Murakami T. et al. Emission computed tomography with technetium-99m pyrophosphate for delineating location and size of acute myocardial infarction in man. Br Heart J 1984;52:30—7.
66. Huber К.С. Bresnahan J.F. Bresnahan D.R. Pellikka P.A. Behrenbeck T. Gibbons R.J. Measurement of myocardium at risk by technetium-99m sestamibi: correlation with coronary angiography. J Am Coll Cardiol 1992;19: 67—73.
67. De Coster P.M. Wijns W. Cauwe F. Robert A. Beckers C. Melin J.A. Area-at-risk determination by technetium-99m-hexakis-2-methoxyisobutyl isonitrile in experimental reperfused myocardial infarction. Circulation 1990; 82:2152—62.
68. Macieira-Coelho E. Cantinho G. da Costa B.B. Garcia-Alves M. Lacerda A.P. Dionisio I. et al. Minimal residual coronary obstructions in patients who suffered a first myocardial infarction. A prospective study comparing coronary angiography and exercise thallium scintigraphy. Clin Cardiol 1993; 16:879—82.
69. Fletcher W.O. Gibbons R.J. Clements I.P. The relationship of inferior ST depression, lateral ST elevation, and left precordial ST elevation to myocardium at risk in acute anterior myocardial infarction. Am Heart J 1993;126(3 Pt 1):526—35.
70. Christian T.F. Clements I.P. Behrenbeck T. Huber К.С. Chesebro J.H. Gersh B.J. et al. Limitations of the electrocardiogram in estimating infarction size after acute reperfusion therapy for myocardial infarction. Ann Intern Med 1991;114:264—70.
71. Silverman K.J. Becker L.C. Bulkley B.H. Burow R.D. Mellits E.D. Kallman C.H. et al. Value of early thallium-201 scintigraphy for predicting mortality in patients with acute myocardial infarction. Circulation 1980;61:996—1003.
72. Gibson W.S. Christian T.F. Pellikka P.A. Behrenbeck T. Gibbons R.J. Serial tomographic imaging with technetium-99m-sestamibi for the assessment of infarct-related arterial patency following reperfusion therapy. J Nucl Med 1992;33:2080—5.
73. Cerqueira M.D. Maynard C. Ritchie J.L. Davis K.B. Kennedy J.W. Long-term survival in 618 patients from the Western Washington Streptokinase in Myocardial Infarction trials. J Am Coll Cardiol 1992;20:1452—9.
74. Niemeyer M.G. Van der Wall Е.Е. Pauwels E.K. van Dijkman P.R. Blokland J.A. de Roos A. et al. Assessment of acute myocardial infarction by nuclear imaging techniques. Angiology 1992;43:720—33.
75. Shimada T. Tsuda N. Karnihata H. Suga Y. Kurimoto T. Iwasaka T. et al. Quantification of infarct size by thallium-201 single-photon emission computed tomography using the unfolded map method. Comparison with QRS score and angiographic infarct size at 4 weeks after infarction. Clin Cardiol 1994;17:184—90.
76. Howarth D. Coote D. "Window on the heart" technique for diagnosis of recent myocardial infarction using Tc-99m pyrophosphate SPECT subtraction imaging. Clin Nucl Med 1995;20:1—4.
77. Bostrom P.A. Diemer H. Freitag M. Juhlin P. Lilja B. Erhardt L. Myocardial reperfusion in thrombolysis A 99Tcm-Sestamibi SPECT study in patients with acute myocardial infarction. Clin Physiol 1992;12:679—84.
78. Walamies M. Virtanen V. Koskinen M. Uusitalo A. Patency of the infarct-related coronary artery—a pertinent factor in late recovery of myocardial fatty acid metabolism among patients receiving thrombolytic therapy? Eur J Nucl Med 1994;21:968—72.
79. Sridhara B.S. Dudzic E. Basu S. Senior R. Lahiri A. Reverse redistribution of thallium-201 represents a low-risk finding in thrombolysed patients following myocardial infarction. Eur J Nucl Med 1994;21:1094—7.
80. Christian T.F. Clements I.P. Gibbons R.J. Noninvasive identification of myocardium at risk in patients with acute myocardial infarction and nondiagnostic electrocardiograms with technetium-99m-sestamibi. Circulation 1991;83:1615—20.
81. St. John Sutton M. Pfeffer M.A. Plappert T. Rouleau J.L. Moye L.A. Dagenais G.R. et al. Quantitative two-dimensional echocardiographic measurements are major predictors of adverse cardiovascular events after acute myocardial infarction. The protective effects of captopril. Circulation 1994; 89:68—75.
82. Sabia P. Abbott R.D. Afrookteh A. Keller M.W. Touchstone D.A. Kaul S. Importance of two-dimensional echocardiographic assessment of left ventricular systolic function in patients presenting to the emergency room with cardiac-related symptoms. Circulation 1991;84:1615—24.
83. Nishimura R.A. Tajik A.J. Shub C. Miller F.A. Jr. Ilstrup D.M. Harrison C.E. Role of two-dimensional echocardiography in the prediction of in-hospital complications after acute myocardial infarction. J Am Coll Cardiol 1984;4:1080—7.
84. Berning J. Launbjerg J. Appleyard M. Echocardiographic algorithms for admission and predischarge prediction of mortality in acute myocardial infarction. Am J Cardiol 1992;69:1538—44.
85. Kan G. Visser C.A. Koolen J.J. Dunning A.J. Short and long term predictive value of admission wall motion score in acute myocardial infarction. A cross sectional echocardiographic study of 345 patients. Br Heart J 1986;56:422—7.
86. Fleischmann K.E. Goldman L. Robiolio P.A. Lee R.T. Johnson P.A. Cook E.F. et al. Echocardiographic correlates of survival in patients with chest pain. J Am Coll Cardiol 1994;23:1390—6.
87. Bengtson J.R. Kaplan A.J. Pieper K.S. Wildermann N.M. Mark D.B. Pryor D.B. et al. Prognosis in cardiogenic shock after acute myocardial infarction in the interventional era. J Am Coll Cardiol 1992;20:1482—9.
88. Califf R.M. Bengtson J.R. Cardiogenic shock. N Engl J Med 1994;330:1724—30.
89. Binder M.J. Ryan J.A. Marcus S. Mugler F. Strange D. Agress C.M. Evaluation of therapy in shock following acute myocardial infarction. Am J Med 1985;8:622—32.
90. Hands M.E. Rutherford J.D. Muller J.E. Davies G. Stone P.H. Parker C. et al. The in-hospital development of cardiogenic shock after myocardial infarction: incidence, predictors of occurrence, outcome and prognostic factors. The MILIS Study Group. J Am Coll Cardiol 1989;14:40—6.
91. Rackley C.E. Russell R.O. Jr. Mantle J.A. Rogers W.J. Cardiogenic shock. Cardiovasc Clin 1981;11:15—24.
92. Scheidt S. Ascheim R. Killip T. 3d. Shock after acute myocardial infarction. A clinical and hemodynamic profile. Am J Cardiol 1970;26:556—64.
93. Swan H.J. Forrester J.S. Danzig R. Alien H.N. Power failure in acute myocardial infarction. Prog Cardiovasc Dis 1970; 12: 568—600.
94. Robin E.D. The cult of the Swan-Ganz catheter. Overuse and abuse of pulmonary flow catheters. Ann Intern Med 1985;103: 445—9.
95. Eisenberg P.R. Jaffe A.S. Schuster D.P. Clinical evaluation compared to pulmonary artery catheterization in the hemodynamic assessment of critically ill patients. Crit Care Med 1984;12:549—53.
96. Connors A.F. Speroff T. Dawson N.V. Thomas C. Harrell F.E. Wagner D. et al. The effectiveness of right heart catheterization in the initial care of critically ill patients. JAMA 1996;276:889—97.
97. Waksman R. Weiss A.T. Gotsman M.S. Hasin Y. Intra-aortic balloon counterpulsation improves survival in cardiogenic shock complicating acute myocardial infarction. Eur Heart J 1993;14:71—4.
98. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomised trials of more than 1000 patients. Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Lancet 1994;343:311—22.
99. Bates E.R. Topol E.J. Limitations of thrombolytic therapy for acute myocardial infarction complicated by congestive heart failure and cardiogenic shock. J Am Coll Cardiol 1991;18:1077—84.
100. Meyer J. Merx W. Dorr R. Lambertz H. Bethge C. Effert S. Successful treatment of acute myocardial infarction shock by combined percutaneous transluminal coronary recanalization (PTCR) and percutaneous transluminal coronary angioplasty (PTCA). Am Heart J 1982;103:132—4.
101. Holmes D.R. Jr. Bates E.R. Kleiman N.S. Sadowski Z. Horgan J.H. Morris D.C. et al. Contemporary reperfusion therapy for cardiogenic shock: the GUSTO-I trial experience. The GUSTO-I Investigators. Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries. J Am Coll Cardiol 1995;26:668—74.
102. Lee L. Bates E.R. Pitt B. Walton J.A. Laufer N. O’Neill W.W. Percutaneous transluminal coronary angioplasty improves survival in acute myocardial infarction complicated by cardiogenic shock. Circulation 1988;78:1345—51.
103. Sotolongo R.P. Smith M.L. Margolis W.S. Coronary angioplasty in emergency treatment of myocardial infarction. Тех Heart Inst J 1990;17:31—6.
104. O’Neill W.W. Angioplasty therapy of cardiogenic shock: are randomized trials necessary? [Editorial] J Am Coll Cardiol 1992;19:915—7.
105. Wall T.C. Ohman Е.М. Califf R.M. Reperfusion therapy: significance of recent trials to the practicing cardiologist. In: Anderson J.L. ed. Modern Management of Acute Myocardial Infarction in the Community Hospital. New York: Marcel Dekker; 1991;103—18.
106. Stone G.W. Grines C.L. Browne K.F. Marco J. Rothbaum D. O’Keefe J. et al. Predictors of in-hospital and 6-month outcome after acute myocardial infarction in the reperfusion era: the Primary Angioplasty in Myocardial Infarction (PAMI) trial. J Am Coll Cardiol 1995;25:370—7.
107. de Boer M.J. Suryapranata H. Hoorntje J.C. Reiffers S. Liem A.L. Miedema K. et al. Limitation of infarct size and preservation of left ventricular function after primary coronary angioplasty compared with intravenous streptokinase in acute myocardial infarction. Circulation 1994;90:753—61.
108. Gibbons R.J. Holmes D.R. Reeder G.S. Bailey K.R. Hopfenspirger M.R. Gersh B.J. Immediate angioplasty compared with the administration of a thrombolytic agent followed by conservative treatment for myocardial infarction. The Mayo Coronary Care Unit and Catheterization Laboratory Groups. N Engl J Med 1993;328:685—91.
109. Ferguson J.J. American College of Cardiology 45th Annual Scientific Session, Orlando, Florida, March 24 to 27, 1996. Circulation 1996;94:1—5.
110. Brott T. Thalinger K. Hertzberg V. Hypertension as a risk factor for spontaneous intracerebral hemorrhage. Stroke 1986;17:1078—83.
111. Krumholz H.M. The clinical challenges of myocardial infarction in the elderly. West J Med 1989;151:304—10.
112. Grines C.L. Selection of patients for reperfusion therapy. In: Califf R.M. Mark D.B. Wagner G.S. eds. Acute Coronary Care. 2d ed. St. Louis, МО: Mosby; 1995;215—28.
113. Bates E.R. Reperfusion therapy in inferior myocardial infarction. J Am Coll Cardiol 1988;12:44A-51A.
114. Grines C.L. DeMaria A.N. Optimal utilization of thrombolytic therapy for acute myocardial infarction: concepts and controversies. J Am Coll Cardiol 1990;16:223—31.
115. A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes. The Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO) IIb investigators. N Engl J Med 1996;335:775—82.
116. Antman Е.М. Hirudin in acute myocardial infarction—thrombolysis and thrombin in myocardial infarction (TIMI) 9В trial. Circulation 1996;94:911—21.
117. Braunwald E. Mark D.B. Jones R.H. Cheitlin M.D. Fuster V. McCauley K.M. et al. Unstable Angina: Diagnosis and Management. Rockville, MD: U.S. Department of Health and Human Services, Public Health Service, Agency for Health Care Policy and Research, National Heart, Lung, and Blood Institute;1994:1—154.
118. Lown В. Fakho A.M. Hood W.B. Jr. Thorn G.W. The coronary care unit. New perspectives and directions. JAMA 1967;199:188—98.
119. Goldman L. Coronary care units. A perspective on their epidemiologic impact. Int J Cardiol 1982;2:284—7.
120. Lee T.H. Juarez G. Cook E.F. Weisberg M.C. Rouan G.W. Brand D.A. et al. Ruling out acute myocardial infarction. A prospective multicenter validation of a 12-hour strategy for patients at low risk. N Engl J Med 1991;324:1239—46.
121. Gibler W.B. Runyon J.P. Levy R.C. Sayre M.R. Kacich R. Hattemer C.R. et al. A rapid diagnostic and treatment center for patients with chest pain in the emergency department. Ann Emerg Med 1995;25:1—8.
122. Gaspoz J.M. Lee T.H. Weinstein M.C. Cook E.F. Goldman P. Komaroff A.L. et al. Cost-effectiveness of a new short-stay unit to "rule out" acute myocardial infarction in low risk patients. J Am Coll Cardiol 1994;24:1249—59.
123. Barbagelata A. Granger C.B. Topol E.J. Worley S.J. Kereiakes D.J. George B.S. et al. Isolated recurrent ischemia after thrombolytic therapy: incidence, importance, and cost. Am J Cardiol 1995;76:1007—13.
124. Betriu A. Heras M. Cohen M. Fuster V. Unstable angina: outcome according to clinical presentation. J Am Coll Cardiol 1992;19:1659—63.
125. Ohman Е.М. Topol E.J. Califf R.M. Bates E.R. Ellis S.G. Kereiakes D.J. et al. An analysis of the cause of early mortality after administration of thrombolytic therapy. The Thrombolysis Angioplasty in Myocardial Infarction Study Group. Coron Artery Dis 1993;4:957—64.
126. Roberts R. Rogers W.J. Mueller H.S. Lambrew C.T. Diver D.J. Smith H.C. et al. Immediate versus deferred beta-blockade following thrombolytic therapy in patients with acute myocardial infarction. Results of the Thrombolysis in Myocardial Infarction (TIMI) II-B Study. Circulation 1991;83:422—37.
127. The effects of tissue plasminogen activator, streptokinase, or both on coronary-artery patency, ventricular function, and survival after acute myocardial infarction. The GUSTO Angiographic Investigators. N Engl J Med 1993;329: 1615—22.
128. Kennedy J.W. Ritchie J.L. Davis K.B. Stadius M.L. Maynard C. Fritz J.K. The western Washington randomized trial of intracoronary streptokinase in acute myocardial infarction. A 12-month follow-up report. N Engl J Med 1985;312:1073—8.
129. The Thrombolysis in Myocardial Infarction (TIMI) trial. Phase I findings. TIMI Study Group. N Engl J Med 1985;312:932—6.
130. Califf R.M. O’Neil W. Stack R.S. Aronson L. Mark D.B. Mantell S. et al. Failure of simple clinical measurements to predict perfusion status after intravenous thrombolysis. Ann Intern Med 1988;108:658—62.
131. Shah P.K. Cercek B. Lew A.S. Ganz W. Angiographic validation of bedside markers of reperfusion. J Am Coll Cardiol 1993;21:55—61.
132. Schroder R. Dissmann R. Bruggemann T. Wegscheider K. Linderer T. Tebbe U. et al. Extent of early ST segment elevation resolution: a simple but strong predictor of outcome in patients with acute myocardial infarction. J Am Coll Cardiol 1994;24:384—91.
133. Saran R.K. Been M. Furniss S.S. Hawkins T. Reid D.S. Reduction in ST segment elevation after thrombolysis predicts either coronary reperfusion or preservation of left ventricular function. Br Heart J 1990;64:113—7.
134. Richardson S.G. Morton P. Murtagh J.G. Scott M.E. O’Keeffe D.B. Relation of coronary arterial patency and left ventricular function to electrocardiographic changes after streptokinase treatment during acute myocardial infarction. Am J Cardiol 1988;61:961—5.
135. Hogg K.J. Hornung R.S. Howie C.A. Hockings N. Dunn F.G. Hillis W.S. Electrocardiographic prediction of coronary artery patency after thrombolytic treatment in acute myocardial infarction: use of the ST segment as a noninvasive marker. Br Heart J 1988;60:275—80.
136. Barbash G.I. Roth A. Hod H. Miller H.I. Rath S. Har-Zahav Y. et al. Rapid resolution of ST elevation and prediction of clinical outcome in patients undergoing thrombolysis with alteplase (recombinant tissue-type plasminogen activator): results of the Israeli Study of Early Intervention in Myocardial Infarction. Br Heart J 1990;64:241—7.
137. Bossaert L. Conraads V. Pintens H. ST-segment analysis: a useful marker for reperfusion after thrombolysis with APSAC? The Belgian EMS Study Group. Eur Heart J 1991;12:357—62.
138. Krucoff M.W. Croll M.A. Pope J.E. Granger C.B. O’Connor C.M. Sigmon K.N. et al. Continuous 12-lead ST segment recovery analysis in the TAMI 7 Study: performance of a noninvasive method for real time detection of failed myocardial reperfusion. Circulation 1993;88:437—46.
139. Zabel M. Hohnloser S.H. Parussel A. Just H. ST segment analysis for assessment of coronary artery patency: comparison of surface ECG and Holter recordings. Eur Heart J 1992;13:1619—25.
140. Topol E.J. O’Neill W.W. Langburd A.B. Walton J.A. Jr. Bourdillon P.D. Bates E.R. et al. A randomized, placebo-controlled trial of intravenous recombinant tissue-type plasminogen activator and emergency coronary angioplasty in patients with acute myocardial infarction. Circulation 1987;75: 420—8.
141. Simoons M.L. Arnold A.E. Betriu A. de Bono D.P. Col J. Dougherty F.C. et al. Thrombolysis with tissue plasminogen activator in acute myocardial infarction: no additional benefit from immediate percutaneous coronary angioplasty. Lancet 1988;1:197—203.
142. SWIFT trial of delayed elective intervention v conservative treatment after thrombolysis with anistreplase in acute myocardial infarction. SWIFT (Should We Intervene Following Thrombolysis?) Trial Study Group. BMJ 1991;302:555—60.
143. Abbottsmith C.W. Topol E.J. George B.S. Stack R.S. Kereiakes D.J. Candela R.J. et al. Fate of patients with acute myocardial infarction with patency of the infarct-related vessel achieved with successful thrombolysis versus rescue angioplasty. J Am Coll Cardiol 1990;16:770—8.
144. White H.D. Cross D.B. Williams B.F. Norris R.M. Safety and efficacy of repeat thrombolytic treatment after acute myocardial infarction. Br Heart J 1990;64:177—81.
145. Barbash G.I. Hod H. Roth A. Faibel H.E. Mandel Y. Miller H.I. et al. Repeat infusions of recombinant tissue-type plasminogen activator in patients with acute myocardial infarction and early recurrent myocardial ischemia. J Am Coll Cardiol 1990;16:779—83.
146. Simoons M.L. Arnout J. van den Brand M. Nyssen K. Verstraete M. Retreatment with alteplase for early signs of reocclusion after thrombolysis. The European Cooperative Study Group. Am J Cardiol 1993;71:524—8.
147. Ellis S.G. da Silva E.R. Heyndrickx G. Talley J.D. Cernigliaro C. Steg G. et al. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation 1994;90:2280—4.
148. Puleo P.R. Meyer D. Wathen C. Tawa C.B. Wheeler S. Hamburg R.J. et al. Use of a rapid assay of subforms of creatine kinase-MB to diagnose or rule out acute myocardial infarction. N Engl J Med 1994;331:561—6.
149. Lee T.H. Pearson S.D. Johnson P.A. Garcia Т.В. Weisberg M.C. Guadagnoli E. et al. Failure of information as an intervention to modify clinical management. A time-series trial in patients with acute chest pain. Ann Intern Med 1995;122:434—7.
150. Heidbuchel H. Tack J. Vanneste L. Ballet A. Ector H. Van de Werf F. Significance of arrhythmias during the first 24 hours of acute myocardial infarction treated with alteplase and effect of early administration of a beta-blocker or a bradycardic agent on their incidence. Circulation 1994;89:1051—9.
151. Capone R.J. Pawitan Y. el-Sherif N. Geraci T.S. Handshaw K. Morganroth J. et al. Events in the cardiac arrhythmia suppression trial: baseline predictors of mortality in placebo-treated patients. J Am Coll Cardiol 1991; 18:1434—8.
152. Mark D.B. Sigmon K. Topol E.J. Kereiakes D.J. Pryor D.B. Candela R.J. et al. Identification of acute myocardial infarction patients suitable for early hospital discharge after aggressive interventional therapy. Results from the Thrombolysis and Angioplasty in Acute Myocardial Infarction Registry. Circulation 1991;83:1186—93.
153. Newby L.K. Califf R.M. Guerci A. Weaver W.D. Col J. Horgan J.H. et al. Early discharge in the thrombolytic era: an analysis of criteria for uncomplicated infarction from the Global Utilization of Streptokinase and t-PA for Occluded Coronary Arteries (GUSTO) trial. J Am Coll Cardiol 1996;27:625—32.
154. Moss A.J. Prognosis after myocardial infarction. Am J Cardiol 1983;52:667—9.
155. Gottlieb S. Moss A.J. McDermott M. Eberly S. Interrelation of left ven-tricular ejection fraction, pulmonary congestion and outcome in acute myocardial infarction. Am J Cardiol 1992;69:977—84.
156. Nicod P. Gilpin E. Dittrich H. Chappuis F. Ahnve S. Engler R. et al. Influence on prognosis and morbidity of left ventricular ejection fraction with and without signs of left ventricular failure after acute myocardial infarction. Am J Cardiol 1988;61:1165—71.
157. Gadsboll N. Hoilund-Carlsen P.F. Madsen E.B. Marving J. Pedersen A. Lonborg-Jensen H. et al. Right and left ventricular ejection fractions: relation to one-year prognosis in acute myocardial infarction. Eur Heart J 1987;8:1201—9.
158. Serruys P.W. Simoons M.L. Suryapranata H. Vermeer F. Wijns W. van den Brand M. et al. Preservation of global and regional left ventricular function after early thrombolysis in acute myocardial infarction. J Am Coll Cardiol 1986;7:729—42.
159. Taylor G.J. Humphries J.O. Mellits E.D. Pitt B. Schulze R.A. Griffith L.S. et al. Predictors of clinical course, coronary anatomy and left ventricular function after recovery from acute myocardial infarction. Circulation 1980; 62:960—70.
160. White H.D. Norris R.M. Brown M.A. Takayama M. Maslowski A. Bass N.M. et al. Effect of intravenous streptokinase on left ventricular function and early survival after acute myocardial infarction. N Engl J Med 1987;317:850—5.
161. Gunnar R.M. Bourdillon P.D. Dixon D.W. Fuster V. Karp R.B. Kennedy J.W. et al. ACC/AHA guidelines for the early management of patients with acute myocardial infarction. A report of the American College of Cardiology/ American Heart Association Task Force on Assessment of Diagnostic and Therapeutic Cardiovascular Procedures (subcommittee to develop guidelines for the early management of patients with acute myocardial infarction). Circulation 1990;82:664—707.
162. Bittl J.A. Indications, timing, and optimal technique for diagnostic angiography and angioplasty in acute myocardial infarction. Chest 1991;99(4 Suppl):150S-6S.
163. Braunwald E. Myocardial reperfusion, limitation of infarct size, reduction of left ventricular dysfunction, and improved survival. Should the paradigm be expanded? Circulation 1989;78:441—4.
164. Califf R.M. Granger C. TIMI IIB follow-up. Lessons for clinicians and investigators [Editorial]. Circulation 1992;85:839—41.
165. Kulick D.L. Rahimtoola S.H. Risk stratification in survivors of acute myocardial infarction: routine cardiac catheterization and angiography is a reasonable approach in most patients [Editorial]. Am Heart J 1991;121:641—56.
166. Wall T.C. Mark D.B. Califf R.M. Collins G. Burgess R. Skelton T.N. et al. Prediction of early recurrent myocardial ischemia and coronary reocclusion after successful thrombolysis: a qualitative and quantitative angiographic study. Am J Cardiol 1989;63:423—8.
167. Kleiman N.S. Terrin M. Mueller H. Chaitman B. Roberts R. Knatterud G.L. et al. Mechanisms of early death despite thrombolytic therapy: experience from the Thrombolysis in Myocardial Infarction Phase II (TIMI II) study. J Am Coll Cardiol 1992;19:1129—35.
168. Muller D.W. Topol E.J. Ellis S.G. Woodlief L.H. Sigmon K.N. Kereiakes D.J. et al. Determinants of the need for early acute intervention in patients treated conservatively after thrombolytic therapy for acute myocardial infarction. TAMI-5 Study Group. J Am Coll Cardiol 1991;18:1594—601.
169. Eisenstein E.L. Newby L.K. Knight J.D. Shaw L.J. Califf R.M. Topol E.J. et al. Cost avoidance through early discharge of the uncomplicated acute myocardial infarction patient [Abstract]. J Am Coll Cardiol 1996;27:244A-5A.
170. Topol E.J. Burek K. O’Neill W.W. Kewman D.G. Kander N.H. Shea M.J. et al. A randomized controlled trial of hospital discharge three days after myocardial infarction in the era of reperfusion. N Engl J Med 1988;318:1083—8.
171. Pryor D.B. Hindman M.C. Wagner G.S. Califf R.M. Rhoads M.K. Rosati R.A. Early discharge after acute myocardial infarction. Ann Intern Med 1983;99:528—38.
172. Goldman L. Cook E.F. Lee T.H. Rouan O.W. Weisberg M.C. Prospective validation of a simple algorithm to predict complications requiring intensive care among emergency room patients with acute chest pain [Abstract]. Clin Res 1989;37:524A.
173. Sanz G. Betriu A. Oller G. Matas M. Magrina J. Pare C. et al. Feasibility of early discharge after acute Q wave myocardial infarction in patients not receiving thrombolytic treatment. J Am Coll Cardiol 1993;22:1795—801.
174. Shaw L.J. Pieper K. Peterson E.D. Eagle K.A. Wagner G.S. Califf R.M. Optimization of resources by efficient use of readily available simple clinical measures in a high-risk post-myocardial infarction population. Presented at the 13th Annual Meeting of the Association for Health Service Research, Atlanta, GA, June 9-11, 1996.
175. Schreiber T. Marsalese D. Griffin J. Donohue B. Sampaolesi A. Con-stantini C. et al. Identification of ultra low-risk patients following primary angioplasty for acute myocardial infarction [Abstract]. J Am Coll Cardiol 1996;27:83A.
176. Peterson E.D. Jollis J.G. DeLong E.R. Stafford J.A. Muhlbaier L.H. Shaw L.J. et al. National patterns of post-MI noninvasive testing in the elderly: results in 190,237 patients [Abstract]. Circulation 1996;94:1—441.
177. Mark D.B. Granger C.B. Ellis S.G. Phillips H.R. Knight D. Davidson-Ray L. et al. Costs of direct angioplasty versus thrombolysis for acute myocardial infarction: results from the GUSTO II randomized trial [Abstract]. Circulation 1996;94:1—168.
178. Charles E.D. Rogers W.J. Reeder G.S. Chesebro J.H. Papapietro S.E. Economic advantages of a conservative strategy for AMI management: rt-PA without obligatory PTCA [Abstract]. J Am Coll Cardiol 1989;13:152A.
179. Mark D.B. Medical economics and health policy issues for interventional cardiology. In: Topol E.J. ed. Textbook of Interventional Cardiology, 2d ed. Philadelphia: WB Saunders; 1994;1323—53.
180. Risk stratification and survival after myocardial infarction. Multicenter Post-Infarction Research Group. N Engl J Med 1983;309:321—6.
181. Sanz G. Castaner A. Betriu A. Magrina J. Roig E. Coll S. et al. Determinants of prognosis in survivors of myocardial infarction: a prospective clinical angiographic study. N Engl J Med 1982;306:1065—70.
182. Harris P. The problem of defining heart failure. Cardiovasc Drugs Ther 1994;8:447—52.
183. Greenberg H. McMaster P. Dwyer E.M. Jr. Left ventricular dysfunction after acute myocardial infarction: results of a prospective multicenter study. J Am Coll Cardiol 1984;4:867—74.
184. Volpi A. De Vita C. Franzosi M.G. Geraci E. Maggioni A.P. Mauri F. et al. Determinants of 6-month mortality in survivors of myocardial infarction after thrombolysis. Results of the GISSI-2 data base. The Ad hoc Working Group of the Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardio (GISSI)-2 Data Base. Circulation 1993;88:416—29.
185. Pfeffer M.A. Braunwald E. Moye L.A. Basta L. Brown E.J. Jr. Cuddy Т.Е. et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992;327:669—77.
186. Konstam M.A. Kronenberg M.W. Rousseau M.F. Udelson J.E. Melin J. Stewart D. et al. Effects of the angiotensin converting enzyme inhibitor enalapril on the long-term progression of left ventricular dilatation in patients with asymptomatic systolic dysfunction. SOLVD (Studies of Left Ventricular Dysfunction) Investigators. Circulation 1993;88(5 Pt 1):2277—83.
187. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. Lancet 1995;345:669—85.
188. Oral captopril versus placebo among 13,634 patients with suspected acute myocardial infarction: interim report from the Chinese Cardiac Study (CCS-1). Lancet 1995;345:686—7.
189. Anderson W.D. Wagner N.B. Lee K.L. White R.D. Yuschak J. Behar V.S. et al. Evaluation of a QRS scoring system for estimating myocardial infarct size. VI: Identification of screening criteria for non-acute myocardial infarcts. Am J Cardiol 1988;61:729—33.
190. Hamby R.I. Murphy D. Hoffman I. Clinical predictability of left ventricular function post myocardial infarction from the electrocardiogram. Am Heart J 1985;109:338—42.
191. Silver M.T. Rose G.A. Paul S.D. O’Donnell C.J. O’Gara P.T. Eagle K.A. A clinical rule to predict preserved left ventricular ejection fraction in patients after myocardial infarction. Ann Intern Med 1994;121:750—6.
192. Corbett J.R. Dehmer G.J. Lewis S.E. Woodward W. Henderson E. Par-key R.W. et al. The prognostic value of submaximal exercise testing with radionuclide ventriculography before hospital discharge in patients with recent myocardial infarction. Circulation 1981;64:535—44.
193. White H.D. Norris R.M. Brown M.A. Brandt P.W. Whitlock R.M. Wild C.J. Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation 1987;76:44—51.
194. Bouwels L. Hertzberger D. How long should high-risk patients with acute anterior wall myocardial infarction be monitored? Int J Cardiol 1992;35:355—64.
195. McComb J.M. Gold H.K. Leinbach R.C. Newell J.B. Ruskin J.N. Garan H. Electrically induced ventricular arrhythmias in acute myocardial infarction treated with thrombolytic agents. Am J Cardiol 1988;62:186—91.
196. Kuchar D.L. Thorburn C.W. Sammel N.L. Late potentials detected after myocardial infarction: natural history and prognostic significance. Circulation 1986;74:1280—9.
197. Willems A.R. Tijssen J.G. van Capelle F.J. Kingma J.H. Hauer R.N. Vermeulen F.E. et al. Determinants of prognosis in symptomatic ventricular tachycardia or ventricular fibrillation late after myocardial infarction. The Dutch Ventricular Tachycardia Study Group of the Interuniversity Cardiology Institute of The Netherlands. J Am Coll Cardiol 1990;16:521—30.
198. Pedretti R. Etro M.D. Laporta A. Braga S.S. Caru B. Prediction of late arrhythmic events after acute myocardial infarction from combined use of noninvasive prognostic variables and inducibility of sustained monomorphic ventricular tachycardia. Am J Cardiol 1993;71:1131—41.
199. Vaage-Nilsen M. Rasmussen V. Hansen J.F. Hagerup L. Sorensen M.B. Bjergaard O.P. et al. Effect of verapamil on ischemia and ventricular arrhythmias after an acute myocardial infarction: prognostic implications. The Danish Verapamil In farction Trial II Study Group. J Cardiovasc Pharmacol. 1991;18:S26—9.
200. Maggioni A.P. Zuanetti G. Franzosi M.G. Rovelli F. Santoro E. Stas-zewsky L. et al. Prevalence and prognostic significance of ventricular arrhythmias after acute myocardial infarction in the fibrinolytic era. GISSI-2 results. Circulation 1993;87:312—22.
201. Bigger J.T. Jr. Fleiss J.L. Rolnitzky L.M. Prevalence, characteristics and significance of ventricular tachycardia detected by 24-hour continuous elec-trocardiographic recordings in the late hospital phase of acute myocardial infarction. Am J Cardiol 1986;58:1151—60.
202. Kostis J.B. Byington R. Friedman L.M. Goldstein S. Furberg C. Prognostic significance of ventricular ectopic activity in survivors of acute myocardial infarction. J Am Coll Cardiol 1987:10:231—42.
203. Zhang Y.Z. Wang S.W. Hu D.Y. Zhu G.Y. Prediction of life-threatening arrhythmia in patients after myocardial infarction by late potentials, ejection fraction and Holter monitoring. Jpn Heart J 1992;33:15—23.
204. Candell-Riera J. Permanyer-Miralda G. Castell J. Rius-Davi A. Domingo E. Alvarez-Aunon E. et al. Uncomplicated first myocardial infarction: strategy for comprehensive prognostic studies. J Am Coll Cardiol 1991;18:1207—19.
205. Currie P. Saltissi S. Transient myocardial ischaemia after acute myocardial infarction does not induce ventricular arrhythmias. Br Heart J 1993;69:303—7.
206. Connolly S.J. Cairns J.A. Prevalence and predictors of ventricular premature complexes in survivors of acute myocardial infarction. CAMIAT Pilot Study Group. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial. Am J Cardiol 1992;69:408—11.
207. Eldar M. Sievner Z. Goldbourt U. Reicher-Reiss H. Kaplinsky E. Behar S. Primary ventricular tachycardia in acute myocardial infarction: clinical characteristics and mortality. The SPRINT Study Group. Ann Intern Med 1992; 117:31—6.
208. Behar S. Rabinowitz В. Zion M. Reicher-Reiss H. Kaplinsky E. Abi-nader E. et al. Immediate and long-term prognostic significance of a first anterior versus first inferior wall Q-wave acute myocardial infarction. Secondary Prevention Reinfarction Israeli Nifedipine Trial (SPRINT) Study Group. Am J Cardiol 1993;72:1366—70.
209. McClements B.M. Adgey A.A. Value of signal-averaged electrocardiography, radionuclide ventriculography, Holter monitoring and clinical variables for prediction of arrhythmic events in survivors of acute myocardial infarction in the thrombolytic era. J Am Coll Cardiol 1993;21:1419—27.
210. Steinberg J.S. Regan A. Sciacca R.R. Bigger J.T. Jr. Fleiss J.L. Predicting arrhythmic events after acute myocardial infarction using the signal-averaged electrocardiogram. Am J Cardiol 1992;69:13—21.
211. Willems J.L. Willems R.J. Willems G.M. Arnold A.E. Van de Werf F. Verstraete M. Significance of initial ST segment elevation and depression for the management of thrombolytic therapy in acute myocardial infarction. European Cooperative Study Group for Recombinant Tissue-Type Plasminogen Activator. Circulation 1990;82:1147—58.
212. Kowey P.R. Friehling T. Meister S.G. Engel T.R. Late induction of tachycardia in patients with ventricular fibrillation associated with acute myocardial infarction. J Am Coll Cardiol 1984;3:690—5.
213. van Hemel N.M. Kingma J.H. Defauw J.A. Vermeulen F.E. Mast E.G. Ernst J.M. et al. Left ventricular segmental wall motion score as a criterion for selecting patients for direct surgery in the treatment of postinfarction ventricular tachycardia. Eur Heart J 1989;10:304—15.
214. Aguirre F.V. Kern M.J. Hsia J. Serota H. Janosik D. Greenwalt T. et al. Importance of myocardial infarct artery patency on the prevalence of ventricular arrhythmia and late potentials after thrombolysis in acute myocardial infarction. Am J Cardiol 1991;68:1410—6.
215. Hong M. Peter T. Peters W. Wang F.Z. Xiu Y.X. Vaughn C. et al. Relation between acute ventricular arrhythmias, ventricular late potentials and mortality in acute myocardial infarction. Am J Cardiol 1991;68:1403—9.
216. Denes P. el-Sherif N. Katz R. Capone R. Carlson M. Mitchell L.B. et al. Prognostic significance of signal-averaged electrocardiogram after thrombolytic therapy and/or angioplasty during acute myocardial infarction (CAST substudy). Cardiac Arrhythmia Suppression Trial (CAST) SAECG Substudy Investigators. Am J Cardiol 1994;74:216—20.
217. Gomes J.A. Winters S.L. Stewart D. Horowitz S. Milner M. Barreca P. A new noninvasive index to predict sustained ventricular tachycardia and sudden death in the first year after myocardial infarction: based on signal-averaged electrocardiogram, radionuclide ejection fraction and Holter monitoring.
J Am Coll Cardiol 1987;10:349—57.
218. Hohnloser S.H. Franck P. Klingenheben T. Zabel M. Just H. Open infarct artery, late potentials, and other prognostic factors in patients after acute myocardial infarction in the thrombolytic era. A prospective trial. Circulation 1994;90:1747—56.
219. Zaman A.G. Morris J.L. Smyllie J.H. Cowan J.C. Late potentials and ventricular enlargement after myocardial infarction. A new role for high-resolution electrocardiography? Circulation 1993;88:905—14.
220. Kleiger R.E. Miller J.P. Bigger J.T. Jr. Moss A.J. Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am J Cardiol 1987;59: 256—62.
221. Farrell T.G. Odemuyiwa O. Bashir Y. Cripps T.R. Malik M. Ward D.E. et al. Prognostic value of baroreflex sensitivity testing after acute myocardial infarction. Br Heart J 1992; 67: 129—37.
222. La Rovere M.T. Mortara A. Specchia G. Schwartz P.J. Myocardial infarction and baroreflex sensitivity. Clinical studies. G Ital Cardiol 1992;22:639—45.
223. Rich M.W. Saini J.S. Kleiger R.E. Carney R.M. teVelde A. Freedland K.E. Correlation of heart rate variability with clinical and angiographic variables and late mortality after coronary angiography. Am J Cardiol 1988;62(10 Pt 1):714—7.
224. Zbilut J.P. Lawson L. Decreased heart rate variability in significant cardiac events. Crit Care Med 1988;16:64—6.
225. Schwartz P.J. La Rovere M.T. Vanoli E. Autonomic nervous system and sudden cardiac death. Experimental basis and clinical observations for postmyocardial infarction risk stratification. Circulation 1992;85(1 Suppl):177—91.
226. Zabel M. Klingenheben T. Hohnloser S.H. Changes in autonomic tone following thrombolytic therapy for acute myocardial infarction: assessment by analysis of heart rate variability. J Cardiovasc Electrophysiol 1994;5:211—8.
227. Singh N. Mironov D. Armstrong P.W. Ross A.M. Langer A. Heart rate variability assessment early after acute myocardial infarction. Pathophysiological and prognostic correlates. GUSTO ECG Substudy Investigators. Global Utilization of Streptokinase and TPA for Occluded Arteries. Circulation 1996; 93: 1388—95.
228. Hamer A. Vohra J. Hunt D. Sloman G. Prediction of sudden death by electrophysiologic studies in high risk patients surviving acute myocardial infarction. Am J Cardiol 1989;50:223—9.
229. Marchlinski F.E. Buxton A.E. Waxton H.L. Josephson M.E. Identifying patients at risk of sudden death after myocardial infarction: value of the response to programmed stimulation, degree of ventricular ectopic activity and severity of left ventricular dysfunction. Am J Cardiol 1983;52:1190—6.
230. Richards D.A. Byth K. Ross D.L. Uther J.B. What is the best predictor of spontaneous ventricular tachycardia and sudden death after myocardial infarction? Circulation 1991;83:756—63.
231. Santarelli P. Bellocci F. Loperfido F. Mazzari M. Mongiardo R. Montenero A.S. et al. Ventricular arrhythmia induced by programmed ventricular stimulation after acute myocardial infarction. Am J Cardiol 1985;55:391—4.
232. Roy D. Marchand E. Theroux P. Waters D.D. Pelletier G.B. Bourassa M.G. Programmed ventricular stimulation in survivors of an acute myocardial infarction. Circulation 1985;72: 487—94.
233. Waspe L.E. Seinfeld D. Ferrick A. Kim S.G. Matos J.A. Fisher J.D. Prediction of sudden death and spontaneous ventricular tachycardia in survivors of complicated myocardial infarction: value of the response to programmed stimulation using a maximum of three ventricular extrastimuli. J Am Coll Cardiol 1985;5:1292—301.
234. Gonzalez R. Arriagada D. Corbalan R. Chamorro G. Fajuri A. Rodriguez J.A. Role of programmed electrical stimulation of the heart in risk stratification post-myocardial infarction. Pacing Clin Electrophysiol 1988;11: 283—8.
235. Denniss A.R. Baaijens H. Cody D.V. Richards D.A. Russell P.A. Young A.A. et al. Value of programmed stimulation and exercise testing in predicting one-year mortality after acute myocardial infarction. Am J Cardiol 1985;56:213—20.
236. Denniss A.R. Richards D.A. Cody D.V. Russell P.A. Young A.A. Cooper M.J. et al. Prognostic significance of ventricular tachycardia and fibrillation induced at programmed stimulation and delayed potentials detected on the signal-averaged electrocardiograms of survivors of acute myocardial infarction. Circulation 1986;74:731—45.
237. Cripps T. Bennett E.D. Camm A.J. Ward D.E. Inducibility of sustained monomorphic ventricular tachycardia as a prognostic indicator in survivors of recent myocardial infarction: a prospective evaluation in relation to other prognostic variables. J Am Coll Cardiol 1989;14:289—96.
238. Bhandari A.K. Hong R. Kotlewski A. Mclntosh N. Au P. Sankoorikal A. et al. Prognostic significance of programmed ventricular stimulation in survivors of acute myocardial infarction. Br Heart J 1989;61:410—6.
239. Richards D.A. Cody D.V. Denniss A.R. Russell P.A. Young A.A. Uther J.B. Ventricular electrical instability: a predictor of death after myocardial infarction. Am J Cardiol 1983;51:75—80.
240. Krone R.J. Friedman E. Thanavaro S. Miller J.P. Kleiger R.E. Oliver G.C. Long-term prognosis after first Q-wave (transmural) or non-Q-wave (non-transmural) myocardial infarction: analysis of 593 patients. Am J Cardiol 1983;52:234—9.
241. Klein J. Froelicher V.F. Detrano R. Dubach P. Yen R. Does the rest electrocardiogram after myocardial infarction determine the predictive value of exercise-induced ST depression? A 2 year follow-up study in a veteran population. J Am Coll Cardiol 1989;14:305—11.
242. Sutton J.M. Topol E.J. Significance of a negative exercise thallium test in the presence of a critical residual stenosis after thrombolysis for acute myocardial infarction. Circulation 1991;83:1278—86.
243. Mahmarian J.J. Pratt C.M. Boyce T.M. Verani M.S. The variable extent of jeopardized myocardium in patients with single vessel coronary artery disease: quantification by thallium-201 single photon emission computed tomography. J Am Coll Cardiol 1991;17:355—62.
244. Patterson R.E. Horowitz S.F. Eng C. Meller J. Goldsmith S.J. Pichard A.D. et al. Can noninvasive exercise test criteria identify patients with left main or 3-vessel coronary disease after a first myocardial infarction? Am J Cardiol 1983;51:361—72.
245. Pirelli S. Inglese E. Suppa M. Corrada E. Campolo L. Dipyridamole-thallium 201 scintigraphy in the early post-infarction period. (Safety and accuracy in predicting the extent of coronary disease and future recurrence of angina in patients suffering from their first myocardial infarction). Eur Heart J 1988;9:1324—31.
246. Valette H. Bourguignon M.H. Le Guludec D. Merlet P. Dove P.J. Kiger J.P. et al. ECG gated thallium 201 myocardial images: value in detecting multivessel disease in patients on anti anginal therapy 1-3 months after myocardial infarction. Eur J Nucl Med 1988:13:551—6.
247. Smeets J.P. Rigo P. Legrand V. Chevigne M. Hastir F. Kulbertus H.E. Prognostic value of thallium-201 stress myocardial scintigraphy with exercise ECG after myocardial infarction. Cardiology 1981;68(Suppl 2):67—70.
248. Gibson R.S. Watson D.D. Craddock G.B. Crampton R.S. Kaiser D.L. Denny M.J. et al. Prediction of cardiac events after uncomplicated myocardial infarction: a prospective study comparing predischarge exercise thallium-201 scintigraphy and coronary angiography. Circulation 1983;68:321—36.
249. Gibson R.S. Beller G.A. Gheorghiade M. Nygaard T.W. Watson D.D. Huey B.L. et al. The prevalence and clinical significance of residual myocardial ischemia 2 weeks after uncomplicated non-Q wave infarction: a prospective natural history study. Circulation 1986;73:1186—98.
250. Griffin B.P. Shah P.K. Diamond G.A. Berman D.S. Ferguson J.G. Incremental prognostic accuracy of clinical, radionuclide and hemodynamic data in acute myocardial infarction. Am J Cardiol 1991;68:707—12.
251. Nicod P. Corbett J.R. Firth B.G. Lewis S.E. Rude R.E. Huxley R. et al. Prognostic value of resting and submaximal exercise radionuclide ventriculography after acute myocardial infarction in high-risk patients with single and multivessel disease. Am J Cardiol 1983;52:30—6.
252. Michels K.B. Yusuf S. Does PTCA in acute myocardial infarction affect mortality and reinfarction rates? A quantitative overview (meta-analysis) of the randomized clinical trials. Circulation 1995;91:476—85.
253. Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-wave myocardial infarction. Results of the TIMI IIIB Trial. Thrombolysis in Myocardial Ischemia. Circulation 1994;89:1545—56.
254. Mark D.B. Naylor C.D. Hlatky M.A. Califf R.M. Topol E.J. Granger C.B. et al. Use of medical resources and quality of life after acute myocardial infarction in Canada and the United States. N Engl J Med 1994;331:1130—5.
255. Yusuf S. Zucker D. Peduzzi P. Fisher L.D. Takaro T. Kennedy J.W. et al. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet 1994;344:563—70,
256. Mark D.B. Nelson C.L. Califf R.M. Harrell F.E. Jr. Lee K.L. Jones R.H. et al. Continuing evolution of therapy for coronary artery disease. Initial results from the era of coronary angioplasty. Circulation 1994;89:2015—25.
257. Califf R.M. Harrell F.E. Jr. Lee K.L. Rankin J.S. Hlatky M.A. Mark D.B. et al. The evolution of medical and surgical therapy for coronary artery disease. A 15-year perspective. JAMA 1989;261:2077—86.
258. Siegel D. Grady D. Browner W.S. Hulley S.B. Risk factor modification after myocardial infarction. Ann Intern Med 1988;109:213—8.
259. Yusuf S. Lessem J. Jha P. Lonn E. Primary and secondary prevention of myocardial infarction and strokes: an update of randomly allocated, controlled trials. J Hypertens Suppl 1993;11:S61—73.
260. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383—9.
261. Summary of the second report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II). JAMA 1993;269:3015—23.
262. American Heart Association. Heart and Stroke Facts. Dallas: American Heart Assoc; 1994.
263. Krumholz H.M. Cohen B.J. Tsevat J. Pasternak R.C. Weinstein M.C. Cost-effectiveness of a smoking cessation program after myocardial infarction. J Am Coll Cardiol 1993;22:1697—702.
264. Meade T.W. Mellows S. Brozovic M. Miller G.J. Chakrabarti R.R. North W.R. et al. Haemostatic function and ischaemic heart disease: principal results of the Northwick Park Heart Study. Lancet 1986;2:533—7.
265. Meade T.W. Wilkes H.C. Stirling Y. Brennan P.J. Kelleher C. Browne W. Randomized controlled trial of low dose warfarin in the primary prevention of ischaemic heart disease in men at high risk: design and pilot study. Eur Heart J 1988;9:836—43.
266. Grady D. Rubin S.M. Petitti D.B. Fox C.S. Black D. Ettinger B. et al. Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med 1992;117:1016—37.
267. Sullivan J.M. Vander Zwaag R. Hughes J.P. Maddock V. Kroetz F.W. Ramanathan K.B. et al. Estrogen replacement and coronary artery disease. Effect on survival in postmenopausal women. Arch Intern Med 1990;150:2557—62.
268. Case R.B. Moss A.J. CaseN. McDermott M. Eberly S. Living alone after myocardial infarction. Impact on prognosis. JAMA 1992;267:515—9.
269. Frasure-Smith N. Lesperance F. Talajic M. Depression and 18-month prognosis after myocardial infarction. Circulation 1995;91:999—1005.
270. Williams R.B. Barefoot J.C. Califf R.M. Haney T.L. Saunders W.B. Pryor D.B. et al. Prognostic importance of social and economic resources among medically treated patients with angiographically documented coronary artery disease. JAMA 1992;267:520—4.
271. Friedman M. Thoresen C.E. Gill J.J. Ulmer D. Powell L.H. Price V.A. et al. Alteration of type A behavior and its effect on cardiac recurrences in post myocardial infarction patients: summary results of the recurrent coronary prevention project. Am Heart J 1986;112:653—65.
272. Blumenthal J.A. Bradley W. Dimsdale J.E. Kasl S.V. Powell L.H. Taylor C.B. Task Force III: Assessment of psychological status in patients with ischemic heart disease. J Am Coll Cardiol 1989;14:1034—42.
273. O’Connor G.T. Buring J.E. Yusuf S. Goldhaber S.Z. Olmstead E.M. Paffenbarger R.S. Jr. et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation 1989;80:234—44.
274. Oldridge N. Guyatt G. Jones N. Crowe J. Singer J. Feeny D. et al. Effects on quality of life with comprehensive rehabilitation after acute myocardial infarction. Am J Cardiol 1991;67: 1084—9.
275. Oldridge N. Furlong W. Feeny D. Torrance G. Guyatt G. Crowe J. et al. Economic evaluation of cardiac rehabilitation soon after acute myocardial infarction. Am J Cardiol 1993;72: 154—61.
276. Collaborative overview of randomised trials of antiplatelet therapy—II: Maintenance of vascular graft or arterial patency by antiplatelet therapy. Antiplatelet Trialists’ Collaboration. BMJ 1994;308:159—68.
277. Lotto A. Colombo A. Talarico G. Fratianni G. Lettino M. Heparin and secondary prevention of acute myocardial infarction. Haemostasis 1990;20(Suppl 1): 132—41.
278. Hampton J.R. Secondary prevention of acute myocardial infarction with beta-blocking agents and calcium antagonists. Am J Cardiol 1990;66:3C—8C.
279. Olsson G. Wikstrand J. Warnold I. Manger Cats V. McBoyle D. Herlitz J. et al. Metoprolol-induced reduction in postinfarction mortality: pooled results from five double-blind randomized trials. Eur Heart J 1992;13:28—32.
280. Ellerbeck E.F. Jencks S.F. Radford M.J. Kresowik T.F. Craig A.S. Gold J.A. et al. Quality of care for Medicare patients with acute myocardial infarction. A four-state pilot study from the Cooperative Cardiovascular Project. JAMA 1995;273:1509—14.
Распознанный текст
К АВТОРСКОМУ СВИДЕТЕЛЬСТВЪ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
(71) 2-й Московский ордена Ленина
государственный медицинский институт
им. Н. И. Пирогова
(72) А. В. Виноградов, Г. П. АрутюновИ. Н. Гельфанд, А. С. ГлазуновИ. А. Журавлева и Р, С. Алоев
(56) ЯИе11 У. Е, Ке1ея1шя, у, К, ЯоЬе1 В. Е. Ццап1йа1хче аззеяшеп4
о 1Ие ех1; еп1 оГ шуосагйда1 пГагеИоп п 1Ие согопагу сопяс1опя боя
Ьу шеапз оГ апа1уяЫ оГ геяа1 сИапяез п зегцш сгаМпе рИозрИоспазе
асЬ5лгИу, Т. 1пчея1, 1971, ч. 50р, 2614-2625.
(54)(57) СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ
ТЯЖЕСТИ ИНФАРКТА МИОКАРДА путем периодического забора проб венозной
крови, спектрофотометрического определения активности креатинфосфокиназы, о т л и ч а ю щ и й с я темчто, с целью повышения точности опре„, ЯО„„1219054 А
деления, больному вводят низкомолекулярный декстран Я-реополиглюкин133, 3-200 мл в течение первого часа„133, 3-200 мл в течение второго и третьего часов, 133, 3-200 мл в течение четвертого, пятого и шестого часов, забор крови проводят каждый час в течение первых 10-12 ч, определяют величину скорости образования массы некроза для каждой пробы по формуле
М КГМЕ( )-МЕЬ; -, )3
где 7; — скорость образования массы
некроза;
М вЂ” масса больного;
К вЂ” нормирующий множитель; н, — время предыдущего и последующего забора крови;
МŠ— биохимический эквивалент некрозаопределяют из найденных величин максимальную, сопоставляют ее с пороговым значением скорости образования массы некроза и констатируют высокую степень тяжести при превьппении указанного значения.
Изобретение относится к медицинеа именно к способам диагностики и
прогнозирования течения инфаркта миокарда на основе количественной оценки скорости образования очага некроза а
Цель изобретения — повьппение точности определения.
Способ осуществляют следующим образом. 1О
Больному острым инфарктом миокарда с первого часа наблюдения в клинике с целью улучшения дренирования
очага некроза производят внутривенную инфузию низкомолекулярного дек15
страна (р-р реополиглюкина по схеме
в среднем в первый час133, 3-200 млвторой, третий час133, 3-200, 0 мл).
На фоне инфузии ежечасно до 12-го
часа болезни производят забор кро20
ви в объеме 10 мл с последующим определением в них уровня активности
МВ фракции креатинфосфокинаэы и рассчитывают скорость прироста массы не-кроза в МВ КФК г-экв; С”. по формуле 25
МКЬИИ; ) -МЕ(; ) 3
где 7,— скорость образования массы
некроза;
К вЂ” экспериментально определенЗО
ный нормирующий множительучитывающий объем распределения изофермента, его концентрацию в нормальном и
инфарцированном миокарде З5
равный 0, 00362;
1; и 1;. — предыдущий и последующий
моменты забора крови;
МŠ— биохимическая мера массы
некроза. 40
Определено максимальное значение ско.
рости и при превьппении максимального
значения скорости прироста массьРнекроза величины 0, 85 МВ КФК г-экв, хч
(соответствующей, неосложненному те45
чению болезни) констатируют тяжелое
течение белезни.
П р и м е р. Больная 3. 62 гдиагноз: ИБС; острый передне-перего-родочный, области верхушки левого же5О
лудочка инфаркт миокарда, атеросклеротический кардиосклероз. Артериальная гипертония НК.
Больная поступила в клинику на
третий час от начала интенсивных эа. 55
грудинных болей сжимающего характеВНИИПИ 3 11786 Т
“. илйал ППП Патент, г. ужгород, ул. Проектная, 4
ра, иррадирующих в левую руку. При
поступлении состояние больной, тяжелое. Положение ортопное. Пианоз губ.
Акроцианоз. Периферические отеки.
Тоны сердца ритмичные. Пульс удовлетворительного наполнения 120 В 1
АД 10070 мм рт.ст.
Дыхание ритмичное 22 в одну минуту. В нижних отделах жесткое дыханиетак же влажные, мелкозырчатые хрипы.
У больной дренируют правую подключичную вену, устанавливают постоянный катетер. С момента установки катетера (на третий час развития болезни) внутривенно капельно вводят
раствор по следующей схеме: в первый
час 100 мл, во второй час 100 мл, в
третий, четвертый, часы 200 мл. Инфу. зию (объем и скорость) проводят под
контролем уровня центрального венозного давления. Через катетер проводят забор крови каждый час в количестве 10, 0 мл до 12-го часа болезниСпектрофотометрически определяют активность МФ фракции креатинфокинаэы
(КФК) в каждой пробе крови, по которой рассчитывают скорость образования массы некроза. Максимальное значение скорости образования массы
некроза. Максимальное значение скорости равно 1, 3 МВ КФК г-экв, Кч 1.
регистрируют на 9-й час болезни. Максимальную активность фермента в периферической крови, равную 24 МЕмлзафиксируют на 20-й час болезни. Масса. некроза равна 56 МВ КФК г. -эквБолевой синдром купируют на 3-й час
болезни. В последунпцие часы при постоянном монтировании нарушения ритма
не выявляют. Состояние больной расценивают как стабильное. Однако высокие значения скорости образования
очага некроза заставляют искать скрытые формы осложения инфаркта миокарда. При катетеризации (на 9-й час
болезни) легочной артерии определяют
давление заклинивания, равное 13 мм
рт.ст. Рентгенологическое и физикальное исследование подтверждает
развитие острой левожелудочковой недостаточности. Применение периферических вазодилетаторов, наркотиковоксигенотерапии купируют развитие
отка легких. В последующие дни течение болезнибез осложнений. Больнаявыписана на 46-й день болезни в санаторий. аказ ираж 659 Подписное
Инфаркт миокарда 2 степени. ВЛИЯНИЕ ГЛИЦИНА НА СТЕПЕНЬ ГИПОКСИИ В ОРГАНИЗМЕ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИНФАРКТЕ МИО

ВЛИЯНИЕ ГЛИЦИНА НА СТЕПЕНЬ ГИПОКСИИ В ОРГАНИЗМЕ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИНФАРКТЕ МИОКАРДА
Юлдашев Н.М. 1, Акбарходжаева Х.Н. 1, Зиямутдинова З.К. 1, Султанходжаев У.Л. 1, Сулайманова Г.Г. 1
1. Ташкентский педиатрический медицинский институт
Учитывая, что частота летальных исходов при остром инфаркте миокарда все еще остается высокой, поиск новых веществ, предупреждающих необратимые изменения миокарда при его инфаркте, остается актуальным. Известно, что решающим звеном в патогенезе стрессорных повреждений миокарда является активация перекисного окисления липидов [2]. При этом также известно, что стресс потенцирует гипоксическое повреждение сердца [1]. В то же время, активация перекисного окисления липидов является типовым процессом повреждения биологических мембран при гипоксии и ишемии. Все это наводит на мысль, что препараты, обладающие антистрессорными и антиоксидантными свойствами, должны обладать также антигипоксическим действием.
В этой связи представлял интерес влияние тормозного нейротрансмиттера ЦНС — глицина, обладающего и антистрессорным и антиоксидантным свойством, на степень гипоксии при инфаркте миокарда.
Целью настоящего исследования явилась оценка влияния глицина на степень гипоксии, оцененной по содержанию глюкозы, молочной и пировиноградной кислот, в динамике экспериментального инфаркта миокарда.
Материал и методы исследования. В опытах было использовано 10 кроликов-самцов массой 2,5-2,8 кг. Экспериментальный инфаркт миокарда вызывали путем перевязки нисходящей ветви левой коронарной артерии. После перевязки погиб 1 кролик, через час после перевязки еще 1 кролик (смертность составила 20%). Сразу после перевязки 5 кроликам через зонд перорально в желудок вводили водный раствор глицина (производство Медицинского научно-производственного комплекса «Биотики», Российская Федерация) в дозе 100 мг/кг массы тела. Далее животные каждые сутки перорально получали глицин в указанной дозе. 3 животные, не получавшие глицин, составили контрольную группу. Кровь из ушной вены животных получали до перевязки (исходная) и через 30 мин, 1, 3, 6, 12 час и на 1, 3 и 7 сутки течения экспериментального инфаркта миокарда в пробирки с гепарином. Кровь центрифугировали при 3000 об/мин 15 мин. О степени гипоксии судили по содержанию глюкозы, молочной и пировиноградной кислот в плазме крови, которых определяли на автоанализаторе “DAYTONA” фирмы Randox (Великобритания). Цифровые данные были обработаны статистически с использованием критерия t Стьюдента.
Результаты исследования и их обсуждение. Полученные результаты показали, что при экспериментальном инфаркте миокарда статистически значимое повышение содержания глюкозы на 49,0% наблюдается, начиная с 3 часа после перевязки (таблица 1.). На 6, 12 и 24 часа после окклюзии наблюдалось повышение содержания глюкозы на 62,4, 81,8, и 46,0% соответственно по сравнению с исходным показателем. При введении глицина статистически значимое повышение содержания глюкозы на 37,2% также наблюдалось через 3 часа. На 6, 12 и 24 часа после окклюзии содержание глюкозы оказалось повышенным от исходного значения соответственно на 37,2, 58,0 и 26,6%, что было значительно ниже по сравнению с контрольными значениями. Содержание глюкозы как в контроле, так и при лечении глицином оказалось на уровне исходного показателя уже на 3 сутки исследования.
Таблица 1.
Динамика содержания глюкозы (ммоль/л) в плазме крови кроликов при экспериментальном инфаркте миокарда и на фоне введения глицина
Сроки
Экспериментальный инфаркт миокарда