Интенсивная терапия острых нарушений мозгового кровообращения. Конспект врача

Конспект врача
Клиническая картина острых нарушений мозгового кровообращения детально описана в огромном количестве отечественных и переводных руководств и не претерпела существенных изменений за прошедшие десятилетия. В то же время внедрение новых методов нейровизуализации, прежде всего компьютерной и магнитно-резонансной томографии, принципиально изменило подходы к постановке диагноза инсульта, трансформировало тактику его ведения и лечения. Пересмотр в последние годы сложившихся ранее представлений о принципах интенсивного лечения прежде всего средних и тяжелых форм инсульта в его остром периоде все еще не стал достоянием широкой врачебной общественности. Поэтому именно это является основным предметом настоящей статьи. Однако прежде следует вспомнить о том, как диагностируется инсульт.

Диагностика
Диагноз инсульта методологически ставится в три этапа. Первоначально отграничивают инсульт от других острых состояний, связанных с поражением мозга. На втором этапе устанавливают характер самого инсульта — ишемический или геморрагический. В заключение уточняются локализация кровоизлияния и его возможные механизмы развития при геморрагическом инсульте или бассейн пораженного сосуда и патогенез инфаркта мозга при ишемическом инсульте.
I этап
Постановка диагноза инсульта как такового редко вызывает значительные сложности у врачей. Основную роль при этом играет анамнез, собранный со слов родственников, окружающих или самого больного. Внезапное и острое, в течение нескольких секунд или минут, развитие стойкого неврологического дефицита в виде двигательных, чувствительных и нередко речевых нарушений у лиц, как правило, старше 45 лет на фоне значительного эмоционального, физического напряжения, сразу после сна или приема горячей ванны, при высоком или низком артериальном давлении позволяет достаточно точно поставить диагноз острого нарушения мозгового кровообращения. Дополнительная информация о наличии у больного любых сосудистых заболеваний (недавно перенесенный инфаркт миокарда, мерцательная аритмия, атеросклероз сосудов нижних конечностей и т.д.) или факторов риска делают первоначальный диагноз более достоверным.
Наиболее часто ошибочный диагноз инсульта ставится при эпилептических припадках (правильной диагностике помогает тщательный сбор анамнеза, ЭЭГ, КТ мозга); опухолях мозга (постепенное нарастание клиники после появления первых неврологических симптомов, КТ с контрастом; следует иметь в виду, что часто возможны развитие кровоизлияния в опухоль или инфаркт в зоне опухоли — состояния, которые уверенно могут быть диагностированы лишь с помощью рентгено-радиологических методов); артериовенозных мальформациях (иногда эпилептические припадки в анамнезе, краниальный шум, геморрагическая телеангиэктазия, КТ или МРТ, церебральная ангиография); хронических субдуральных гематомах (травма головы в последние недели, тяжелая постоянная головная боль, прогрессирующее нарастание симптомов, применение антикоагулянтов, геморрагический диатез, злоупотребление алкоголем), а также при гипогликемических состояниях, печеночной энцефалопатии и др.
II этап
Наиболее сложной и ответственной задачей является точная и быстрая диагностика характера инсульта, так как в острый период заболевания именно эти моменты в значительной степени определяют дальнейшую тактику лечения, в том числе хирургического, а следовательно, и прогноз для больного. Следует подчеркнуть, что абсолютно точная диагностика характера инсульта — кровоизлияние или инфаркт мозга — только на основании клинических данных вряд ли возможна. В среднем у каждого четвертого-пятого больного клинический диагноз инсульта, поставленный даже опытным врачом, оказывается ошибочным, что в равной мере справедливо как для кровоизлияния, так и для инфаркта мозга. Поэтому наряду с данными клиники крайне желательно первоочередное проведение КТ мозга, поскольку от этого во многом зависят своевременность и эффективность оказываемой помощи. В целом компьютерная томография мозга является международным стандартом при постановке диагноза инсульта.
Точность диагностики кровоизлияний при КТ доходит практически до 100 проц. При отсутствии показаний за кровоизлияние на КТ и наличии соответствующих клинико-анамнестических данных, свидетельствующих об остром нарушении мозгового кровообращения ишемического характера, диагноз инфаркта мозга можно поставить с большой точностью даже в отсутствие каких-либо изменений плотности вещества головного мозга на томограммах, что часто наблюдается в первые часы после развития инсульта. Примерно в 80 проц. случаев КТ мозга обнаруживает зону пониженной плотности, клинически соответствующую инфаркту мозга, в течение первых же суток после начала заболевания.
Магнитно-резонансная томография более чувствительна, чем КТ, в первые часы инфаркта мозга и почти всегда выявляет изменения вещества мозга, невидимые при обычной КТ, а также изменения в стволе головного мозга. Однако МРТ менее информативна при кровоизлияниях в мозг. Поэтому метод КТ по-прежнему широко используется даже в наиболее хорошо оснащенных неврологических клиниках мира, занимающихся острой цереброваскулярной патологией.
III этап
Локализация кровоизлияния или инфаркта в головном мозге важна как в плане проведения неотложных медикаментозных, так и хирургических манипуляций, а также имеет значение для предсказания дальнейшего течения заболевания. Роль КТ здесь также трудно переоценить. Что касается механизмов развития острых нарушений мозгового кровообращения, то они, безусловно, имеют большое значение для правильного выбора тактики лечения больного с первых же дней инсульта, но примерно в 40 проц. случаев не удается точно установить патогенез инсульта, несмотря на тщательно проработанный анамнез, клиническую картину развития заболевания и всю мощь современных инструментальных и биохимических методов исследования. Прежде всего это касается инфаркта мозга, где стремление к определению его подтипа (атеротромботический, кардиоэмболический, лакунарный и др.) уже в острейшем периоде является необходимым, так как от этого зависит выбор терапии (тромболизис, регуляция общей гемодинамики, лечение мерцательной аритмии и т.д.). Это важно также и для предупреждения ранних повторных эпизодов инфарктов.

Подход к больным с острым инсультом
Организационные вопросы
Больные с острым инсультом должны быть госпитализированы в стационар так быстро, как это только возможно. Четко доказана прямая зависимость прогноза инсульта от времени начала его лечения. Сроки госпитализации в первые 1-3 часа после начала заболевания оптимальны, хотя обоснованное лечение эффективно и в более поздний период. Оптимальной является госпитализация больных в многопрофильный стационар с современной диагностической аппаратурой, включающей КТ или МР-томографы и ангиографию, где также имеются ангионеврологическое отделение с палатой интенсивной терапии и отделение реанимации со специально выделенным блоком (койками) и подготовленным персоналом для ведения этих больных. Непременным условием является также наличие в стационаре нейрохирургического отделения или бригады нейрохирургов, так как около трети больных нуждаются в консультации или оказании этого вида специализированной помощи. Пребывание в таких клиниках достоверно улучшает исходы острых нарушений мозгового кровообращения и эффективность последующей реабилитации.
Измененный уровень бодрствования (от оглушения до комы), нарастающая симптоматика, свидетельствующая о признаках вклинения ствола головного мозга, а также выраженные нарушения жизненно важных функций требуют госпитализации больного в отделение реанимации и интенсивной терапии (ОРИТ). Целесообразно нахождение в этих же отделениях и инсультных больных с тяжелыми нарушениями гомеостаза, декомпенсированной сердечно-легочной, почечной и эндокринной патологией.
Неотложные мероприятия при поступлении. Осмотр больного при поступлении в приемный покой следует начать с оценки адекватности оксигенации, уровня артериального давления, наличия или отсутствия судорог. Обеспечение оксигенации при необходимости осуществляется постановкой воздуховода и очищением дыхательных путей, а при показаниях и переводом больного на ИВЛ. Показаниями для начала ИВЛ являются: РаО2 — 55 мм рт. ст. и ниже, ЖЕЛ — менее 12 мл/кг массы тела, а также клинические критерии — тахипноэ 35-40 в минуту, нарастающий цианоз, артериальная дистония. Артериального давления не принято снижать, если оно не превышает 180-190 мм рт. ст. для систолического и 100-110 мм рт. ст. для диастолического давления, так как при инсульте нарушается ауторегуляция мозгового кровотока и церебральное перфузионное давление часто прямо зависит от уровня системного артериального давления. Гипотензивная терапия проводится с осторожностью малыми дозами бета-адреноблокаторов (обзидан, атенолол и др.) или блокаторами ангиотензинпревращающего фермента (ренитек и др.), не вызывающими существенных изменений в ауторегуляции мозгового кровотока. При этом АД снижают примерно на 15-20 проц. от исходных величин.
При корково-подкорковых очагах и прорыве крови в желудочковую систему нередко наблюдаются приступы судорог. Купирование их также необходимо еще до начала неврологического осмотра, так как они тяжело истощают нейроны мозга. С этой целью используется реланиум, вводимый внутривенно. В тяжелых случаях применяется тиопентал натрия. Далее у таких больных необходимо сразу же начать профилактический прием длительно действующих антиконвульсантов (финлепсин и др.).
Неврологический осмотр больного при поступлении должен быть кратким и включает в себя оценку уровня бодрствования (шкала комы Глазго), состояние зрачков и глазодвигательных нервов, двигательной, а если возможно, и чувствительной сферы, речи. Сразу же после осмотра проводится КТ головного мозга. В связи с тем, что определение характера инсульта часто имеет решающее значение для дальнейшего дифференцированного лечения, включая оперативное, больных с ОНМК рекомендуется госпитализировать в клиники, обладающие необходимой диагностической аппаратурой.
После проведения КТ выполняется необходимый минимум диагностических тестов: ЭКГ, уровень глюкозы в крови, электролиты плазмы (К, Na и др.), газы крови, осмолярность, уровень гематокрита, фибриногена, активированное частичное тромбопластиновое время, уровень мочевины и креатинина, общий анализ крови с подсчетом числа тромбоцитов, рентгенография органов грудной клетки.
При обнаружении на КТ признаков кровоизлияния в мозг и оценки его объема и локализации совместно с нейрохирургами обсуждается вопрос о целесообразности оперативного вмешательства. При ишемических инсультах рекомендуется проведение панартериографии магистральных артерий головы или артериографии на стороне поражения мозга (при подозрении на закупорку сосуда). Выявление окклюзии артерий, кровоснабжающих мозг, требует решения вопрос о тромболитической терапии. Обнаружение при КТ крови в субарахноидальном пространстве часто говорит о возможности субарахноидального кровоизлияния. В этих случаях следует обсудить возможность проведения ангиографии для определения локализации, размеров аневризмы и решения вопроса об операции. В сомнительных случаях может быть выполнена люмбальная пункция. Оптимальным является выполнение всех указанных мероприятий сразу же в приемном покое и рентгеновском отделении клиники.
Лечение больных в остром периоде инсульта (примерно первые три недели) складывается из общих мероприятий по терапии и профилактике разного рода соматических осложнений, развивающихся обычно на фоне острых нарушений мозгового кровообращения (ОНМК), а также из специфических методов лечения самого инсульта в зависимости от его характера.
Общие мероприятия: поддержание оптимального уровня оксигенации, артериального давления, мониторинг и коррекция сердечной деятельности, постоянный контроль основных параметров гомеостаза, глотания (при наличии дисфагии ставится назогастральный зонд для профилактики аспирационных бронхопневмоний и обеспечения адекватного питания больного), контроль за состоянием мочевого пузыря, кишечника, уход за кожными покровами. Необходимо с первых же часов проведение пассивной гимнастики и массажа рук и ног как непременное и наиболее эффективное условие профилактики одной из главных причин летальности при инсультах — тромбоэмболии легочной артерии (ТЭЛА), а также пролежней и ранних постинсультных контрактур.
Ежедневный уход за тяжелобольными должен включать в себя: каждые 2 часа повороты с боку на бок; каждые 8 часов протирание тела больного камфорным спиртом; клизмы (не реже чем через день); введение больному жидкости из расчета 30-35 мл на кг массы тела в сутки; каждые 4-6 часов туалет рото- и носоглотки с помощью отсоса с последующим промыванием теплым настоем 5-проц. раствора ромашки или его заменителями. Антибактериальная терапия при необходимости с обязательным приемом адекватных доз антигрибковых препаратов. При появлении признаков ДВС-синдрома — введение низкомолекулярного гепарина в дозах 7500 ЕД 2-3 раза в день подкожно. При переводе больного на ИВЛ — проведение в полном объеме мероприятий, детально изложенных в руководствах по реаниматологии и нейрореаниматологии.
Течение инсульта
Наиболее тяжело инсульт протекает в случаях развития выраженного отека головного мозга, острой обструктивной гидроцефалии, прорыва крови в желудочки и субарахноидальное пространство, вторичного кровоизлияния в ишемизированную ткань. Как следствие этих процессов, развивается повышение внутричерепного давления с дислокацией мозга и компрессией жизненно важных образований ствола или компрессионной ишемией коры мозга, резкое снижение уровня бодрствования и углубление неврологического дефицита с подчас прогностически неблагоприятным исходом, включая развитие персистирующего вегетативного состояния и смерти мозга.
Отек мозга определяется как избыточное накопление жидкости в ткани мозга, что приводит к увеличению объема последнего. Чем выраженнее отек мозга, тем тяжелее течение инсульта. Выделяют три типа отека мозга — цитотоксический, вазогенный и интерстициальный (гидростатический). Цитотоксический отек обусловлен нарушением активного транспорта ионов натрия через мембрану клетки, в результате чего натрий свободно входит в клетку и удерживает воду. Этот тип отека характерен для ранней (минуты) стадии церебральной ишемии и в большей степени выражен в сером веществе, чем в белом. Вазогенный отек обусловлен усилением проницаемости гематоэнцефалического барьера, увеличением вхождения в интрацеллюлярное пространство белковых макромолекул. Этот тип отека характерен для подострой (часы) стадии церебральной катастрофы и может наблюдаться как при инфарктах, так и при кровоизлияниях в мозг. Интерстициальный отек часто обусловлен острой обструктивной гидроцефалией и обычно виден на КТ в виде “перивентрикулярного свечения— (см. ниже).
Отек мозга достигает своего пика на 2-5-е сутки, а затем с 7-8-х суток начинает, если больной переживает этот период, медленно регрессировать. Как правило, чем больше размер очага тем сильнее выражен отек, хотя в известной мере это зависит от его локализации.
В настоящее время для лечения отека мозга наиболее широко используют гипервентиляцию и осмотические диуретики. Гипервентиляция (снижение РаСО 2 до уровня 26-27 мм рт. ст.) является наиболее быстрым и эффективным методом снижения внутричерепного давления, но ее действие непродолжительно и составляет около 2-3 часов. Среди осмотических диуретиков чаще всего применяется маннитол. Препарат рекомендуется вводить внутривенно в первоначальной дозе 0,5-1,5 г/кг массы тела в течение 20 минут, а затем в дозе, составляющей половину от первоначальной, каждые 4-5 часов с той же скоростью в зависимости от клинической ситуации и с учетом уровня осмолярности плазмы. Следует учитывать, что превышение уровня осмолярности свыше 320 мосм/л, равно как и длительное применение маннитола, опасно, так как при этом возникают электролитные изменения, почечная патология и другие нарушения, что прогностически крайне неблагоприятно для больного. Введение маннитола в данном режиме может продолжаться не более 3-4 суток. При отсутствии маннитола возможно использование глицерина в тех же дозировках перорально каждые 4-6 часов.
Кортикостероиды, равно как и барбитураты, не доказали свою эффективность в качестве средств лечения отека мозга при инсультах, хотя их цитопротекторное действие обсуждается.
Острая обструктивная гидроцефалия (ООГ). В ее основе лежит выраженная экстравентрикулярная компрессия ликворных путей или их закупорка свертками крови (интравентрикулярная окклюзия). Это состояние, которое возможно диагностировать только по данным КТ, развивается чаще всего в первые двое суток при субтенториальных и почти в одной трети супратенториальных кровоизлияниях, а также при инфарктах мозжечка, превышающих треть его полушария. При субтенториальных поражениях томографически выявляется компрессия IV желудочка, резкое увеличение III и боковых желудочков, при супратенториальных поражениях — сдавление III и гомолатерального бокового желудочка или заполнение их свертками крови со значительным увеличением контралатерального бокового желудочка. Нарастание ООГ ведет к увеличению объема мозга, повышению внутричерепного давления и углублению дислокации структур мозга, в том числе его ствола. Это, в свою очередь, обусловливает резкое нарушение ликворооттока и нарастание разности в давлении между супра- и субтенториальным пространством, что еще больше усиливает смещение и деформацию ствола. Происходит пропитывание вещества мозга ликвором из расширенных желудочков. На КТ при этом обнаруживается уже упоминавшийся рентгенологический феномен — “перивентрикулярное свечение” — зона пониженной плотности в белом веществе мозга вокруг расширенной части желудочковой системы.
Оптимальными методами лечения ООГ являются дренаж боковых желудочков, декомпрессия задней черепной ямы, удаление гематомы (при геморрагическом инсульте) или некротизированной ткани мозжечка (при ишемическом инсульте). Все они по сути своей жизнесберегающие операции. Применение только противоотечной терапии в этих ситуациях не оказывает должного эффекта.
Прорыв крови в желудочковую систему и субарахноидальное пространство ранее всегда считался прогностически плохим, зачастую фатальным признаком геморрагического инсульта. В настоящее время показано, что более чем в трети случаев кровоизлияний в мозг прорыв крови в желудочки не приводит к смерти, даже если он происходит в III и IV желудочки. Кровь проникает в желудочки с некоего “порогового” объема гематомы, характерного для той или иной ее локализации. Чем ближе к средней линии полушарий расположено кровоизлияние, тем выше риск проникновения крови в желудочки мозга и наоборот. Сочетание прорыва крови в желудочковую систему и субарахноидальное пространство наблюдается очень часто у больных с геморрагическим инсультом. Обычно это отмечается при объемах гематом свыше 30-40 см3. Каких-либо достоверно доказанных эффективных методов лечения этого осложнения пока нет.
Вторичное кровоизлияние в некротизированную ткань, как правило, наблюдается на 1-10-е сутки при обширных, больших и средних по размерам инфарктах мозга. Как и предыдущие два осложнения, достоверно устанавливается на основании данных КТ. Выявление геморрагической трансформации возможно только при повторных рентгенологических исследованиях. Нередко это является следствием неконтролируемого артериального давления и реперфузионной (в основном тромболитической) терапии, проведенной подчас без учета противопоказаний к ней.

Специфические методы лечения инсульта
Геморрагический инсульт
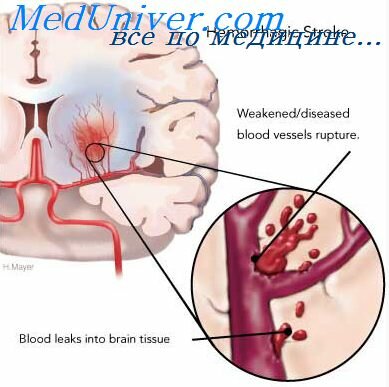
В каждом втором случае причиной внутримозгового нетравматического кровоизлияния является артериальная гипертония, около 10-12 проц. приходится на долю церебральной амилоидной ангиопатии, примерно 10 проц. обусловлено приемом антикоагулянтов, 8 проц. — опухолями, на долю всех остальных причин приходится около 20 проц. Патогенетически внутримозговые кровоизлияния могут развиваться либо вследствие разрыва сосуда, либо путем диапедеза, обычно на фоне предшедствующей артериальной гипертонии.
Специфических медикаментозных методов лечения геморрагического инсульта в настоящее время нет, применяются антигипоксанты и антиоксиданты. Основу лечения составляют общие мероприятия по поддержанию гомеостаза и коррекции основных осложнений (см. выше). Эпсилон-аминокапроновая кислота не показана, так как ее кровоостанавливающее действие не достигает цели, в то время как опасность ТЭЛА увеличивается. Важным и зачастую определяющим методом лечения геморрагического инсульта является оперативное вмешательство — удаление гематомы открытым или стереотаксическим методом с учетом ее объема, локализации и воздействия на структуры мозга.
Ишемический инсульт
Лечение ишемического инсульта гораздо сложнее, чем геморрагического. Прежде всего это связано с многообразием (гетерогенность) патогенетических механизмов, лежащих в его основе. Инфаркты мозга по механизму своего развития делятся на атеротромботические, кардиоэмболические, гемодинамические, лакунарные, гемореологические и другие. Разные подтипы ишемических инсультов отличаются друг от друга по частоте, причинам их вызывающим, клинической картине развития, прогнозу и, естественно, лечению.
В основе инфарктов мозга лежит развивающаяся ишемия, связанная со сложными каскадами взаимодействия компонентов крови, эндотелия, нейронов, глии и экстрацеллюлярных пространств мозга. Глубина таких взаимодействий порождает различную степень травматизации структур мозга и, соответственно, степень неврологического дефицита, а их продолжительность определяет временные границы для проведения адекватной терапии, т.е. “окно терапевтических возможностей”. Из этого следует, что различные по механизмам и точкам приложения препараты имеют и разные временные границы своего воздействия на пораженные участки мозга.
Основой специфической терапии при ишемическом инсульте являются два стратегических направления: реперфузия и нейрональная протекция, направленная на предохранение слабо или почти не функционирующих, однако все еще жизнеспособных нейронов, располагающихся вокруг очага инфаркта (зона “ишемической полутени”).
Реперфузия возможна путем тромболизиса, вазодилатации, увеличения перфузионного давления и улучшения реологических свойств крови.
Тромболитическая терапия
Основными церебральными тромболитиками признаны урокиназа, стрептокиназа и их производные, а также тканевой активатор плазминогена (ТАП). Все они действуют прямо или косвенно как активаторы плазминогена. В настоящее время эффективность применения тромболитиков, в частности ТАП, достоверно доказана, но рекомендуется только после проведения КТ и ангиографии, не позднее первых 3 часов (!) от начала развития инсульта в дозе 0,9 мг/кг массы тела внутривенно, при небольших очагах на КТ и АД не выше 190/100 мм рт. ст. отсутствии в анамнезе инсультов, язвенной болезни и др. Тромболитическая терапия, как правило, не устраняет изначальных причин, вызвавших закупорку сосудов, так как сохраняется резидуальный атеростеноз, однако восстанавливает кровоток. Геморрагические осложнения при применении различных тромболитиков составляют по разным данным, от 0,7 до 56 проц. (!), что зависит от времени введения и свойств препарата, размеров инфаркта, соблюдения всего комплекса противопоказаний к данному виду лекарственной терапии.
Вазодилататоры
Клиническое использование вазодилататоров не дает обычно положительных результатов, и, возможно, в силу того, что эти препараты увеличивают интракраниальное давление, снижают среднее АД и оказывают шунтирующий эффект, отвлекая кровь от зоны ишемии. Их реальная роль в развитии коллатерального кровоснабжения очага ишемии еще изучается (это касается прежде всего эуфиллина, положительный эффект которого нередко отмечается в клинической практике).
Увеличение церебрального перфузионного давления и улучшение реологических свойств крови
Один из наиболее известных методов, применяемых с этой целью — гемодилюция. В его основе лежат два принципа воздействия на микроциркуляцию ишемизированного мозга: снижение вязкости крови и оптимизация циркуляторного объема. Целесообразно проводить гиперволемическую гемодилюцию низкомолекулярными декстранами (реополиглюкин, реомакродекс и др.), только если уровень гематокрита у больного превышает 40 ЕД. в объемах обеспечивающих его снижение до 33-35 ЕД. При этом у лиц с выраженной кардиальной и/или почечной патологией следует следить за состоянием центральной гемодинамики для предотвращения развития отека легких, а также за уровнем креатинина, мочевины и глюкозы в крови. Введение реополиглюкина с целью коррекции гематокрита более 7-8 суток начиная с момента развития инсульта, кроме особых случаев, не оправдано.
Если эффективность метода гемодилюции доказана примерно в половине проведенных международных мультицентровых контролируемых исследований, то целесообразность других лекарственных препаратов, применяемых с этими целями, пока является предметом интенсивных исследований.
Антиагреганты
Аспирин является эффективным доказанным средством лечения в острый период инфарктов мозга. Возможно его применение в двух режимах — по 150-300 мг или в малых дозах по 1 мг/кг массы тела ежедневно. Риск кровоизлияний при этом практически отсутствует. Однако весьма часто аспирин не может использоваться у больных, имеющих проблемы со стороны желудочно-кишечного тракта. В этих случаях применяются его специальные лекарственные формы (тромбо-асс и др.) Целесообразность применения в острый период антиагрегантов иного действия, включая тиклопидин и дипиридамол (курантил), еще изучается, так же, как и пентоксифиллина (трентала).
Антикоагулянты прямого действия
До сих пор нет четких доказательств для широкого применения антикоагулянтов при остром инсульте, даже у больных с предсердными фибрилляциями. Антикоагулянтная терапия не имеет прямой связи с уменьшением смертности и инвалидизации больных. В то же время имеются серьезные доказательства, что гепарин (низкомолекулярный гепарин) действительно предотвращает глубокие венозные тромбозы и, следовательно, риск ТЭЛА (см. выше).
Нейропротекция
Это второе стратегическое направление в терапии ишемических инсультов. Тяжелые метаболические нарушения, быстрая деполяризация мембран, неконтролируемое высвобождение возбуждающих аминокислот и нейротрансмиттеров, свободных радикалов, развитие ацидоза, резкое вхождение кальция в клетки, изменение генной экспрессии — вот далеко не полный перечень точек приложения для нейропротекторных препаратов в условиях церебральной ишемии.
В настоящее время выделяется целый спектр лекарственных препаратов, обладающих нейропротекторными свойствами: постсинаптические антагонисты глутамата; пресинаптические ингибиторы глутамата (lubeluzolе); блокаторы кальциевых каналов (nimodipine, calcibindin); антиоксиданты (эмоксипин, L-токоферол); ноотропы (piracetam, cerebrolyzin) и другие. Целесообразность их применения доказана в экспериментальных условиях. В целом, высокая перспективность нейропротекции как метода лечения не вызывает сомнений. Ее широкое внедрение, безусловно, дело ближайшего будущего.
Хирургические методы лечения при инфарктах мозжечка на фоне острой обструктивной гидроцефалии, а также дренирование желудочков мозга в настоящее время применяются с высокой эффективностью. Целесообразность других оперативных вмешательств в остром периоде ишемического инсульта требует дополнительных доказательств.

Профилактика повторных нарушений мозгового кровообращения
В связи с большим разнообразием причин, лежащих в основе инсультов, необходимо уже в первые дни заболевания наряду с упомянутыми методами лечения принять меры, направленные на предупреждение рецидивов ОНМК.
При кардиоэмболических инсультах вследствие фибрилляции предсердий рекомендуется назначение непрямых антикоагулянтов. Если есть противопоказания к их применению, рекомендуется использовать аспирин. Оптимальные сроки для начала антикоагулянтной терапии после острого эпизода все еще не определены. Считается, что для уменьшения риска церебральной геморрагии первоначальное лечение должно начинаться с аспирина и проводиться до тех пор, пока произойдет разрешение основного дефицита, вызванного инсультом, или, если это тяжелый инсульт, спустя примерно две недели после его начала. Непрямые антикоагулянты и аспирин вместе применяются редко. Разумеется, необходим подбор и собственно кардиальной терапии.
При артерио-артериальных эмболиях, окклюзирующей патологии магистральных артерий головы эффективен прием аспирина, тиклопидина, дипиридамола. Наиболее оптимальным является индивидуальное тестирование реакции крови больного на тот или иной назначаемый препарат. Этот метод уже несколько лет с успехом используется в нашей клинике. Лечение и профилактика повторных кровоизлияний в мозг основывается прежде всего на тщательно подобранной антигипертензивной терапии, а предупреждение повторных ишемических инсультов — на мониторинге ЭКГ и артериального давления.
Определенное место в предупреждении ишемических инсультов занимают хирургические методы, особенно при грубом стенозе либо окклюзии сонных и позвоночных артерий, эмбологенных, гетерогенных атеросклеротических бляшках (эндартериоэктомия, реваскуляризация — см. “МГ”? 21 от 19.03.99).
В заключение следует еще раз подчеркнуть, что при инсультах нет и не может быть единого универсального средства или метода лечения, кардинально меняющего течение заболевания. Прогноз для жизни и восстановления определяется сочетанием своевременных и полноценных общих и специфических мероприятий в первые дни заболевания, включающих среди прочих постоянную коррекцию гомеостаза — определяющего фактора, без нормализации которого все последующее лечение становится неэффективным, а также активные нейрохирургические манипуляции наряду с ранней физической и психологической реабилитацией. Прежде всего это относится к инсультам средней и высокой степени тяжести. Четкое понимание патогенетических механизмов, лежащих в основе инсультов, является именно тем ключом, с помощью которого возможно подобрать обоснованное и эффективное лечение уже в первые часы от начала развития сосудистого поражения мозга, обеспечить благоприятный прогноз.

Базисная терапия ишемического инсульта у больных с артериальной гипертензией
Министерство здравоохранения РБ, Республиканский научно-практический центр неврологии и нейрохирургии
Проведенными международными популяционными исследованиями установлено, что ежегодно в мире от острого нарушения мозгового кровообращения (ОНМК) умирают 4,7 млн. человек [12]. В странах Восточной Европы инсульт занимает 2—3-е место в структуре общей смертности населения. При этом в течение года после перенесенной мозговой катастрофы умирает каждый второй заболевший [3]. По данным Г.К. Недзьведя и соавт. больные с ишемическими инсультами составили почти 70% всех госпитализированных в специализированное инсультное отделение [8].
В соответствии с критериями ВОЗ, ишемический инсульт определяют как «острое очаговое неврологическое нарушение с клиническими проявлениями, сохраняющимися в течение более 24 ч, вероятной причиной которого служит ишемия головного мозга» [13]. Для инфаркта мозга характерно быстрое развитие (в течение минут, реже нескольких часов или суток) неврологических нарушений, проявляющихся общемозговыми (расстройства сознания, рвота, интенсивная головная боль) и очаговыми нарушениями (двигательные, чувствительные, речевые, зрительные, координаторные и другие расстройства). Необходимо не только установить ишемический характер инсульта и его локализацию, но и выяснить его этиопатогенетический вариант. Для этого надо оценить наличие факторов риска сосудистой мозговой катастрофы, таких как артериальная гипертензия (АГ), заболевания сердца и сосудов, сахарный диабет, возраст пациента (старше 50 лет), курение, а также ранее перенесенный ишемический инсульт или транзиторная ишемическая атака [6]. Следует подчеркнуть, что АГ является одним из ведущих, но корригируемых факторов риска развития инфаркта мозга [9]. По данным РНПЦ неврологии и нейрохирургии МЗ РБ, артериальная гипертензия встречается у 75—80% больных, госпитализированных по поводу ишемического инсульта [5].
С целью ранней диагностики характера и локализации ишемического повреждения мозга используют нейровизуализационные методы обследования. При анализе результатов компьютерной и магнитно-резонансной томографии учитывают топику, возраст пациента, размер и количество очагов, принадлежность к определенному сосудистому бассейну, наличие геморрагического пропитывания и ряд других признаков. При проведении магнитно-резонансной ангиографии принимают во внимание наличие стеноза, окклюзии, ульцерации либо специфического неатеросклеротичекого поражения соответствующей крупной экстра- или интракраниальной артерии [1]. Информацию о характере церебральной гемодинамики получают с помощью ультразвукового исследования брахиоцефальных артерий и транскраниальной допплерографии.
Выделяют следующие периоды инфаркта мозга: острейший (первые 24 ч от начала инсульта), острый период (первые 3 сут), подострый период (3 сут — первые 3 нед.), период стабилизации мозгового кровотока и вторичной профилактики инсульта (после 3 нед.). В острейшем периоде заболевания тяжесть острой ишемии мозга тесно взаимосвязана со степенью редукции мозгового кровотока, продолжительностью дореперфузионного периода и протяженностью ишемии. В течение 6—8 мин с момента появления инициальных симптомов инсульта происходит ишемическое повреждение головного мозга [4]. «Точечная», или «ядерная», зона инфаркта формируется в области локального снижения церебрального кровотока до 10 мл/100 г/мин. Вокруг нее находится зона ишемической полутени, где мозговой кровоток составляет около 20—40 мл/100 г/мин. В течение «терапевтического окна» (3—6 ч) в этом участке мозга происходят лишь функциональные, а не структурные изменения, сохранен энергетический метаболизм, после чего формируется инфарктный очаг. «Доформирование» ишемического инсульта продолжается на протяжении 48 и более часов, в связи с чем интенсивную терапию необходимо начинать в первые 3 часа заболевания.
Общее (базисное) лечение ишемического инсульта при артериальной гипертензии
Базисная терапия должна быть ранней, разносторонней и комплексной. Проводят ее в палатах интенсивной терапии, в условиях динамического наблюдения за состоянием пациента. Основная (или базисная) терапия направлена на поддержание жизненно важных функций организма. Терапию проводят индивидуально, с учетом лабораторных показателей, данных клинических и параклинических методов обследования.
Базисное лечение больных с инсультом включает следующие мероприятия:
ИНСУЛЬТ. Интенсивная терапия ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ.
Общие положения:
1. Никакие лечебные действия не должны приводить к снижению САД 320 ммоль/л или САД 310 мосмоль/л
•Ожирение 3 степени
•Ацидоз
•Гипокалиемия
•Феномен отдачи (при повреждении ГЭБ)
Для профилактики осложнений:
•Использовать ректальный путь
•Контроль гематокрита
•Введение калий содержащих растворов
Глицерин (3 уровень)
Продолжительность эффекта 10 часов
Стандартная доза 0,5 – 1 г/кг per os или 4 х 250 мл 10% р-ра внутривенно более чем за 30-60 мин (Righetti, 2002; Bereczki, 2001)
10% маннитол — 0,5 г/кг — снижает ликворное давление на 35-40%, 10% глицерин- 0,5 г/кг — снижает ликворное давление на 35-45 %
Гипертонический раствор (3 уровень) 3%-20% (7,5%) 100 мл в/в 5 раз в сутки
•Поддерживает эуволемический гиперосмолярный статус мозга
•Уменьшает дислокацию при травме и у послеоперационных больных, но показан эффект и при инсульте
•Равномерно дегидратирует оба полушария мозга
•Модулирует воспалительный ответ на травму мозга
Фуросемид (3 уровень)
10-20 мг в/в каждые 6 часов при осмолярности >320 ммоль/л и гипернатриемии >150 ммоль/л
•Обладает синергизмом с маннитом,
•Замедляет продукцию спинномозговой жидкости
5) Ликворный дренаж:
(. ) При угнетении сознания не проводить
1.Не более 3-5 мл для контроля ВЧД
2. При геморрагическом инсульте возможны повторные пункции по 5-15 мл при условии стабильности состояния
При КТ контроле уточняется индивидуальный вариант дренирования (наружное, внутреннее)
6) Гипервентиляция:
Спонтанное тахипное до 30 в минуту является компенсаторной реакцией на отек и дислокацию мозга, до момента перевода в РАО не требует коррекции
Показания:
•На этапе транспортировки.
•Показана при явных признаках дислокации:
oпатологической реакции на боль
oнарастающем мидриазе
oпрогрессирующем угнетении сознания
•При неэффективности ликворного дренажа, осмотерапии, но рСО2 не ниже 32 мм рт. ст. (при этом желательна ТКДГ для профилактики ишемии)
Гипервентиляция (ГПВ) может быть применена у пациентов, чье состояние ухудшается вторично на фоне повышения внутричерепного давления, включая пациентов с дислокационным синдромом (4 уровень).
ГПВ снижает ВЧД путем уменьшения уровня СО2, что вызывает вазоконстрикцию и соответственно уменьшение объема внутричерепной фракции крови.
Избыточная вазоконстрикция может привести к ишемии в зонах с нарушенной ауторегуляцией мозгового кровообращения, если компенсаторно не возрастет экстракция О2.
Адверсивные эффекты ГПВ:
•Снижение порога судорожной активности
•Алкемия и увеличение сродства кислорода к гемоглобину
•Нарушение ауторегуляции мозгового кровотока
•Парадоксальное повышение ВЧД
При снижении СО2 до 30 мм рт ст ВЧД снижается на 25-30% через 30 секунд с максимумом на 8-10 минуте. Эффект сохраняется до часа. Переход на нормокапнию должен быть медленным (в среднем за 4-6 часов), чтобы избежать эффекта отдачи
7) Нейрохирургическое лечение:
Эффект нейрохирургического лечения обратно пропорционален времени от начала заболевания, поэтому очень важно как можно раньше сообщить в специализированную клинику о больном с клиникой ВЧГ, вызванной объемным процессом ЦНС
В перспективе, когда в крупных региональных больницах будет организована нейрохирургическая служба, данное лечение будет выполняться там
1. Радикальное лечение ВЧД возможно при ранней диагностике острого процесса (гематома, абсцесс, опухоль), имеющего масс-эффект
2. Решение о паллиативном нейрохирургическом лечении (декомпрессия) принимается в случае неэффективности полного объема консервативной терапии
Обоснованием для проведения декомпрессионного хирургического вмешательства является возможность расширения места для отечной ткани, что ведет к уменьшению внутричерепного давления, увеличению мозгового кровотока, предотвращая компрессию коллатеральных сосудов. В ряде случаев проведение декомпрессионного хирургического вмешательства при тяжелом полусферическом инфаркте, позволяет уменьшить смертность с 80% до 30% (Hacke and Schwab, 1995; Rieke, 1995; Mori, 2001), т.е. эта операция может быть жизненно-сохраняющей для ряда больных (3 уровень). Проведенная в ранние сроки (в первые 24 часа) декомпрессия позволяет уменьшить смертность даже в более значимых масштабах (Schwab, 1998). В настоящее время ожидаются результаты мультицентровых исследований.
При развитии инфаркта мозжечка со сдавлением ствола мозга, в качестве методик выбора рассматриваются наложение вентрикулостомии при развитии гидроцефалии и декомпрессионного хирургического вмешательства, хотя научное обоснование этих методов не более доказательно, чем для полусферического инфаркта (3 уровень). Известно, что пациенты с инфарктом мозжечка и развитием коматозного состояния, ведущиеся на консервативной терапии, имеют смертность около 80%. Эта высокая смертность может быть снижена до менее чем 30%, если выполняется декомпрессионная операция (Heros, 1992; Rieke et al 1993). Подобно случаям с супратенториальными инфарктами, операция должна проводиться прежде чем развиваются признаки дислокационного синдрома. Прогноз у оставшихся в живых среди прооперированных пациентов может быть благоприятен даже для пациентов в коматозном состоянии. Это должно быть отмечено, однако, это – результаты небольших исследований, имеющих предполагаемый результат (Rieke et al, 1993), в настоящее время еще не получены данные рандомизированных исследований
8) Кортикостероиды
(при подозрении на опухоль с инсультоподобным течением):
•8-24 мг дексаметазона экстренная доза, затем 4-8 мг каждые 4-6 часов;
•продолжительность 3-4 дня с последующей отменой в течение 2-3 дней.
1. При подтверждении церебральной опухоли
2. Церебральный васкулит
3. Инфаркт или кровоизлияние в мозжечке с масс-эффектом
Дексаметазон и другие кортикостероиды – бесполезны для лечения отека головного мозга после инсульта (Qizibash et al, 2002) и черепно-мозговой травмы (1 уровень). Тем не менее без дифференцированного диагноза ишемии и травмы от них отказываться не следует. Их эффективность показана (2 уровень) при отеке, вызванном опухолевым процессом. Есть мнение, что кортикостероиды увеличивают зону геморрагического пропитывания. Кроме того, для обеспечения достаточных показателей АД в случаях, требующих гипертензии, их использование в адекватных дозах целесообразно (3 уровень)
Вторая линия «Терапия отчаяния»
Решение о «терапии отчаяния» принимается консилиумом в составе: невролог, реаниматолог, нейрореаниматолог (заочно), нейрохирург (заочно) после оценки неврологического статуса вне седации на основании признания нетранспортабельности больного.
Цель терапии – попытаться скомпенсировать острые проявления ВЧГ (гипертермия, нестабильность гемодинамики, патологическое дыхание) и довести больного до состояния транспортабельности или операбельности ( по показаниям)
1) Барбитуровая кома:
Протокол «барбитуратовой комы»
1. Вводная доза тиопентала – 3-5 мг/кг в/в за 10 мин
2. Инфузия 5 мг/кг/час за 24 часа
3. Титрование дозы по клиническому эффекту или ЭЭГ — контролю («ЭЭГ-молчание»)
4. Через 24 часа – кумуляция – снижение дозы до 2,5 мг/кг/час
5. Через 48 часов – прекращение инфузии
6. Если возобновятся патологические мышечные феномены – пропофол ситуационно 5-10 мг/кг/мин
7. Оценка неврологического статуса через 24 часа после прекращения инфузии (желательно контроль концентрации в плазме)
Для профилактики кардиотоксического эффекта барбитуратов рекомендуется вводить малые дозы коллоидов в сочетании с дофамином (2-4 мкг/кг/мин).
Использование короткодействующих барбитуратов типа тиопентала 250-500 мг, введенного болюсно может быстро и значительно уменьшить внутричерепное давление, но эффект этот короток и может быть применен только при остром критическом состоянии.
Основной эффект барбитуратов – снижение потребности мозга в О2 (3 уровень), уменьшение внутриклеточного кальция, лизосомальная стабилизация (4 уровень). Лечение барбитуратами требует контроля внутричерепного давления, электроэнцефалограммы (ЭЭГ) и гемодинамических параметров, поскольку может произойти существенное снижение артериального давления за счет снижения симпатического тонуса, периферической вазодилатации и миокардиальной депрессии. Угнетение гемодинамики отмечается у 50% больных, несмотря на адекватное поддержание волемии и симпатомиметическую поддержку.
В случае отсутствия положительного эффекта при оценке статуса после выполнения протокола – неблагоприятный исход возможен в 75%
2) Гипотермия:
Обеспечение нормотермии
Аппаратное охлаждение до 34-360С
Осложнения:
•Снижение сердечного выброса
•Аритмия
•тромбоцитопения
Доказано, что гипотермия обладает нейропротективным эффектом после остановки сердца (Bernard et al 2002; The НАСА group 2002). Умеренная гипотермия (т.е. мозговая температура между 32 и 330С) уменьшает частоту неблагоприятных исходов у пациентов с тяжелым инфарктом бассейна СМА, но причиняет множество побочных эффектов, с которыми можно столкнуться при проведении этой терапии более чем несколько дней (Schwab et al, 1998; 2002) (Steiner, 2001). Число изученных пациентов еще слишком мало, чтобы сделать любые решающие заключения, однако этот метод выполним и будет изучен в будущих рандомизированных исследованиях
3) Артериальная гипертензия:
2Н – терапия: среднее артериальное давление повышают до 100 мм рт ст. (допмин см. выше) на фоне гиперволемии (3 уровень).
Введение вазопрессоров, вызывающих гипертонию, может быть предпринято при необходимости в тяжелых случаях, но с контролем гемодинамики и наблюдения в специализированной инсульт — палате (Kaste and Roine, 2002). Использование симпатомиметиков для поддержания артериальной гипертензии (см. выше) способствует поддержанию церебрального перфузионного давления (концепция Рознера), таким образом препятствуя прогрессированию ВЧГ.
4) Нейрохирургическое лечение:
Абсолютная терапия отчаяния. Резекция 4-5 см височной доли доминантного и 6-7 см недоминантного полушария
Практика декомпрессивной трепанации у больных с тяжелой ВЧГ, рефрактерной к консервативной терапии, независимо от этиопатогенеза ВЧГ не продемонстрировала однозначного эффекта. Даже радикальная операция, но выполненная после того, как больной пережил дислокационный синдром, не улучшает прогноз ( 4 уровень)
 Комментарии
Комментарии
#1 | admin 14 Декабря 2008, 13:01:54