Селен и спорт
Патология сердца очень часто сопровождает занятия спортом
Смерть спортсмена — это только крайний и трагический этап целого каскада нарушений, возникших в организме спортсмена в результате интенсивных занятий спортом. Как мы увидим далее — в совокупности с другими механизмами. Случаи спортивной смерти – это только «верхушка айсберга», крайняя степень проблемы, распространенной гораздо шире!
На самом деле эти вопросы уже больше сотни лет в поле зрения врачей и ученых в разных странах. Термин «спортивное сердце» введен в 1899 году для людей, активно занимающихся спортом. Основоположник советской кардиологии Г.Ф.Ланг в 1938 году подробно описал «сердце, патологически измененное в результате чрезмерных напряжений спортивного характера». Я не останавливаюсь на вопросах классификации, исследователи с разных сторон изучали «спортивное сердце», описывали его как напряжение сердца, миокардиальную дистрофию, перетренированное сердце, в последнее время чаще используют названия «кардиомиопатия напряжения», «стрессорная кардиомиопатия спортсменов». Общий итог этих исследований таков: патология сердца (чаще всего – в форме кардиомиопатии) – распространена очень широко, ее признаки в разной степени находят в 1/3 случаев уже у детей, занимающихся спортом! С повышением интенсивности тренировок, у профессиональных спортсменов, этот процент увеличивается (по некоторым данным – более 50%!). Поэтому все годы идет бурная дискуссия, является ли этот процесс патологией сердца, или это физиологическая ответная реакция здорового сердца на повышенную нагрузку. И непонятно, когда, в какой момент происходит переход от нормальной реакции к необратимым изменениям в миокарде.
И обратите внимание, как и в случае внезапной смерти спортсменов, здесь исследователи не находят ответ, почему у одних спортсменов сердце страдает, а у других нет. А если страдает – почему в ряде случаев гипертрофия миокарда нарастает, в других – успешно компенсируется при снижении нагрузок. Спортивные врачи не могут предложить спортсменам ничего, кроме прекращения занятий спортом при выявлении каких-то изменений миокарда. А причины патологии сердца так и остаются неизвестными.
Термин «кардиомиопатия» применяется для описания патологии сердца с невыясненной этиологией. Как пишут исследователи, «установление этиологии и уточнение патогенеза какого-либо заболевания, относящегося к кардиомиопатиям, способствовали бы выделению его из этой группы в ряд известных болезней либо в самостоятельную нозологическую форму».
Внезапная сердечная смерть в спорте
читайте также ► Сердце спортсмена
 Спорт — это особый вид деятельности человека, сопряженный с регулярными высокими (часто экстремальными) физическими и эмоциональными нагрузками, повышенными требованиями к здоровью. Внезапная смерть спортсмена, особенно хорошо известного, являющегося символом здоровья и силы, всегда имеет широкий общественный резонанс. Особую остроту эта проблема приобрела в марте 2005 г. когда FIFA распространила заявление о создании новых стандартов, касающихся медицинского обследования футболистов для профилактики внезапной сердечной смерти ( ► ВСС ). Накануне в один сезон прямо на соревнованиях на поле умерло три игрока: Миклош Фехер (игрок сборной Венгрии), Марк Вивьен Фоэ (полузащитник сборной Камеруна), Неджад Ботоньич (словенский голкипер).
Спорт — это особый вид деятельности человека, сопряженный с регулярными высокими (часто экстремальными) физическими и эмоциональными нагрузками, повышенными требованиями к здоровью. Внезапная смерть спортсмена, особенно хорошо известного, являющегося символом здоровья и силы, всегда имеет широкий общественный резонанс. Особую остроту эта проблема приобрела в марте 2005 г. когда FIFA распространила заявление о создании новых стандартов, касающихся медицинского обследования футболистов для профилактики внезапной сердечной смерти ( ► ВСС ). Накануне в один сезон прямо на соревнованиях на поле умерло три игрока: Миклош Фехер (игрок сборной Венгрии), Марк Вивьен Фоэ (полузащитник сборной Камеруна), Неджад Ботоньич (словенский голкипер).
Согласно легенде внезапная смерть, связанная с физической перегрузкой впервые была зафиксирована в 490 году до новой эры, когда молодой греческий солдат Фидипид умер сразу после преодоления бегом расстояния от Марафона до Афин (42 километра 195 метров), чтобы сообщить о победе греков над персами. Сегодня под ВС в спорте понимают смерть, наступившую непосредственно во время нагрузок, а также в течение 24-х часов с момента появления первых симптомов, заставивших изменить или прекратить спортивную деятельность.
По данным D.Corrrado с соавторами (2006) частота внезапная смерть (ВС) у спортсменов составляет 2,6 у мужчин и 1,1 у женщин на 100 000 спортсменов в год, что в 2,4 раза выше, чем в популяции. Проспективное исследование, проведённое во Франции, дало значительно более тревожный результат. ВС оказалась значительно выше — 6,5 на 100 000 (Chevalier L. 2009). На сегодняшний день на первом месте среди видов спорта по частоте случаев ВС стоит футбол. Трудность прогноза ВС в спорте состоит в том, что подавляющее большинство умерших (около 80% случаев), по данным предшествующих трагедии обследований не предъявляли жалоб накануне смерти и не имели семейного анамнеза высокого риска ВС. Более 90% случаев ВС составляет кардиальная патология, иными словами, в подавляющем большинстве случаев речь идет о внезапной сердечной смерти (ВСС).
В случаях ВСС в спорте обычно проводится судебно-медицинское вскрытие, поскольку смерть обычно наступает вне лечебного учреждения. Основной задачей судебно-медицинского эксперта является не только установление причины, но и исключение ее насильственного характера.
ВСС в спорте встречается с частотой 0,61 на 100 тыс. спортсменов, составляя в структуре общей смертности спортсменов 56% (Maron B.J. Doerer J.J. Haas T.S. et al.; 2009). Ежегодно на 1 млн атлетов приходится 1-5 случаев ВСС (Maron B.J. Shirani J. Poliac L.C. et al.; 1996).
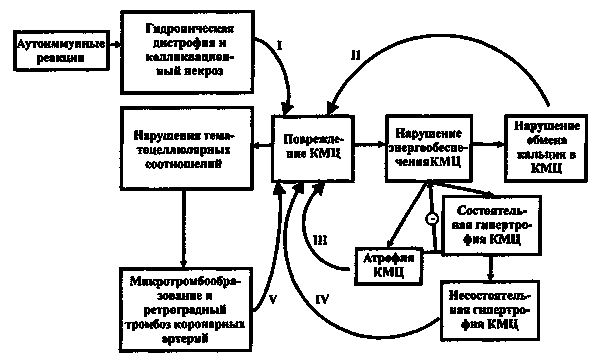
 При анализе причин ВСС можно объединить отдельные диагнозы в четыре группы. Первую группу (20% случаев) составляет ВСС, вследствие внезапно развившейся фибрилляции желудочков после тупой травмы прекардиальной области, так называемое сommotio сordis – сотрясение сердца. Эта причина смерти связанна со спортивной травмой и возможности ее профилактики весьма ограничены. Однако, остальные группы причин ВСС, а это более половины всех случаев ВСС, приходится ту часть ► кардиальной патологии, которую можно диагностировать при жизни. Нераспознанные заболевания миокарда (миокардит, ИБС) составляют вторую группу. Различные врожденные и наследственные нарушения и заболевания сердца, аорты и клапанного аппарата (синдром Марфана, дилатационная кардиомиопатия, аритмогенная кардиомиопатия, бикуспидальная аорта, сопровождающаяся стенозом аорты, «туннельные» коронарные артерии и прочее) составляют третью группу. Наконец, четвертая группа может быть составлена из случаев несбалансированной гипертрофии миокарда (ГМ), которую наши западные коллеги называют гипертрофической кардиомиопатией (ГКМП). Последняя, становится причиной ВСС в 26% случаев и более распространена у афроамериканских спортсменов. Если к этой категории добавить 7% случаев так называемой «недифференцированной гипертрофии», станет очевидным, что несбалансированная ГМ оказывается причиной ВСС у трети всех умерших спортсменов.
При анализе причин ВСС можно объединить отдельные диагнозы в четыре группы. Первую группу (20% случаев) составляет ВСС, вследствие внезапно развившейся фибрилляции желудочков после тупой травмы прекардиальной области, так называемое сommotio сordis – сотрясение сердца. Эта причина смерти связанна со спортивной травмой и возможности ее профилактики весьма ограничены. Однако, остальные группы причин ВСС, а это более половины всех случаев ВСС, приходится ту часть ► кардиальной патологии, которую можно диагностировать при жизни. Нераспознанные заболевания миокарда (миокардит, ИБС) составляют вторую группу. Различные врожденные и наследственные нарушения и заболевания сердца, аорты и клапанного аппарата (синдром Марфана, дилатационная кардиомиопатия, аритмогенная кардиомиопатия, бикуспидальная аорта, сопровождающаяся стенозом аорты, «туннельные» коронарные артерии и прочее) составляют третью группу. Наконец, четвертая группа может быть составлена из случаев несбалансированной гипертрофии миокарда (ГМ), которую наши западные коллеги называют гипертрофической кардиомиопатией (ГКМП). Последняя, становится причиной ВСС в 26% случаев и более распространена у афроамериканских спортсменов. Если к этой категории добавить 7% случаев так называемой «недифференцированной гипертрофии», станет очевидным, что несбалансированная ГМ оказывается причиной ВСС у трети всех умерших спортсменов.
T. Noakes в книге «Энциклопедия спортивной медицины и науки» (1998) приводит четыре группы причин ВСС: ишемическая болезнь сердца (ИБС), структурные патологии, аритмии и дефекты проведения, другие причины. Для предупреждения ВСС W. Hillis и соавт. (1994) приводят ► таблицу . в которой основные виды спорта классифицированы по степени интенсивности и требованиям динамической и статической работы. Лицам с патологией сердца противопоказаны занятия видами спорта, относящимися к группе А. Лишь после очной консультации, диагностики и лечения кардиолог в зависимости от поставленного диагноза может позволить заниматься видами спорта, относящимися к подгруппе А3 и группе Б. Рассмотрим более подробно «сотрясение сердца» и «ГКМП».
Сотрясение сердца (синдром commotio cordis). ВС в результате несильного удара в грудную клетку отмечается в 3% случаев (Maron B.J. Doerer J.J. Haas T.S. et al. 2009). Сотрясение сердца наиболее часто происходит в таких видах спорта, как бейсбол, хоккей, лакросс, софтбол, борьба, бокс и после ударов в туловище в других видах спорта. Люди, получившие сотрясение сердца, — молодые, здоровые, преимущественно мужчины. У пострадавших в анамнезе отсутствуют заболевания сердца или другие хронические заболевания. Удар приходится в область грудной клетки прямо на уровне сердца при обычной его скорости. Как правило, возникает потеря сознания, но иногда наступает прояснение, во время которого пострадавший жалуется на головную боль. Наиболее часто изначально возникает фибрилляция желудочков; однако описаны также полная блокада, учащенный идиовентрикулярный ритм и асистолия. На вскрытии отсутствует патология сердца или грудной клетки. Наиболее вероятный механизм внезапной смерти пострадавших — фибрилляция желудочков в результате удара в грудную клетку в уязвимый момент сердечного цикла. Другие возможные причины — полная блокада сердца, выраженный вагусный ответ, электромеханическая диссоциация (www.sportmedicine.ru; 2008). В эксперименте на свиньях было доказано, что фибрилляция желудочков индуцирована при попадании удара в интервал 15 мс во время подъема зубца T (от 30 до 15 мс до пика зубца T). В последующих экспериментах было установлено, что плотность ударяющего объекта прямо пропорционально коррелирует с риском возникновения фибрилляции желудочков. При очень мягком объекте фибрилляция желудочков возникала в 8% ударов в уязвимую зону сердечного цикла, при ударе стандартным бейсбольным мячом — в 35%, с деревянным блоком – в 90% (Link M.S.; 1999).
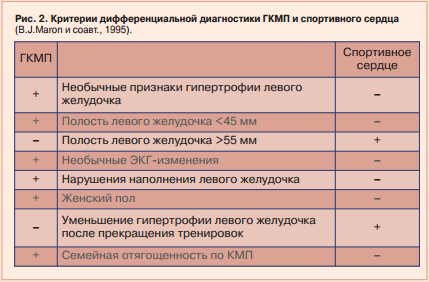
ГКМП сегодня определяется В.J. Maron (2006) как заболевание миокарда, сопровождающееся выраженным его утолщением без дилатации, при отсутствии других кардиальных или системных причин, способных вызвать гипертрофию (аортальный стеноз, системная гипертензия и спортивное сердце). В основе ГКМП лежит мутация генов, кодирующих протеины, входящие в состав саркомеров миокарда. По мнению уже упомянутого B.J. Maron, одного из крупнейших американских специалистов в области спортивного сердца, ГКМП у спортсменов это гипертрофия миокарда с толщиной стенок левого желудочка более 13 мм, симметричная, без нарушения путей оттока, с возможностью обратного развития после прекращения занятиями спортом. Строго говоря, речь идет не о типичной ГКМП, с характерной морфологической картиной дезорганизации мышечных волокон, а о несбалансированной ГМ, связанной с чрезмерными физическими нагрузками. Лучшим подтверждением прямой взаимосвязи между гипертрофией миокарда и физическими перегрузками является возможность ее обратного развития, что никак не свойственно ГКМП. B.J. Maron признает, что между спортивным сердцем и ГКМП существует т.н. «серая зона», включающая в себя пограничные значения массы миокарда, что не позволяет надежно отличить эти два состояния. Все изложенное делает весьма уязвимым для критики, используемый западными врачами подход, согласно которому гипертрофия миокарда, обнаруженная у спортсмена на аутопсии, расценивается как ГКМП. Представляется вполне разумным и аргументированным сложившийся в России клинический подход к оценке спортивного сердца, предложенный Г.Ф. Лангом. Он и его ученик А.Г. Дембо (1966) считали необходимым различать «физиологическое» и «патологическое» спортивное сердце, относя к последнему случаи несбалансированной ГМ. Ими было обосновано представление о дистрофии миокарда физического перенапряжения (ДМФП). Позднее, с широким внедрением в клиническую и спортивно-медицинскую практику эхокардиографии (ЭхоКГ) для приведения терминологии к требованиям МКБ-10 предложено заменить понятие ДМФП диагнозом «стрессорная кардиомиопатия» (СКМП) и выделен компенсаторно-гипертрофический (КГ) тип CКМП. Было предложено для оценки несбалансированной гипертрофии миокарда использовать не только абсолютные значения толщины стенок левого желудочка и расчет его массы миокарда, но и нарушение соотношения между массой миокарда и объемными показателями левого желудочка. Также в качестве основного дифференциально-диагностического критерия ГКМП и КГ СКМП предложена обратная динамика массы миокарда левого желудочка после прекращения интенсивных тренировок (Земцовский Э.В. и соавт. 1995).
► В 2002 году совместными усилиями НИИ спорта Италии (Рим) и Центра гипертрофической кардиомиопатии США (Миннеаполис) были разработаны нормы эхо-кардиографических параметров для спортсменов:
- у мужчин толщина миокарда не должна превышать 13 мм, а конечно-диастолический размер левого желудочка — не более 65 мм;
- у женщин — 11 и 60 мм (соответственно);
- у подростков 15-17 лет мужского пола — 12 и 60 мм;
- у подростков 15-17 лет женского пола — 11 и 55 мм.
► В настоящее время предложено несколько протоколов для профилактики внезапной смерти в спорте (американский, европейский и итальянский). Рекомендации группы экспертов American Heart Association «12 шагов» для предупреждения ВСС у спортсменов (2007) включают в себя сбор анамнеза и физикальное исследование (► см. рекомендации ).
► Европейский протокол кардиологического обследования молодых спортсменов включает также проведение электрокардиографии с последующим дополнительным обследованием в случае выявления на ЭКГ патологии. Итальянский протокол (Basso C. Corrado D. Thiene G.; 2009) включает также проведение ЭКГ и ЭхоКГ.
► В 2006 году Консенсус группы экспертов Отдела Спортивной Кардиологии Комиссии по Сердечно-сосудистой Реабилитации и Физиологии Спорта и Комиссии по Заболеваниям Миокарда и Перикарда Европейского Кардиологического общества разработал ► рекомендации по отбору и ведению спортсменов с сердечно-сосудистыми заболеваниями для профилактики у них ВСС. Согласно этим рекомендациям, отстранение от занятий спортом должно проводиться при изменении интервала QT на ЭКГ у спортсменов QT более 440 мс у мужчин и более 460 у женщин.
► Кроме того, спортивные нагрузки противопоказаны при следующих пороках сердца:
- аортальная недостаточность при наличии регургитации, гемодинамически значимых желудочковыхнарушений ритма в покое или во время нагрузочного теста, дилатации восходящего отдела аорты;
- недостаточность трикуспидального клапана при любой степени трикуспидальной регургитации;
- митральная недостаточность при наличии регургитации, нарушении функции левого желудочка (фракция выброса
дополнительная информация
статья: ► Остановка сердца у спортсменов с позиций практической кардиологии
АРИТМОГЕННАЯ КАРДИОМИОПАТИЯ ПРАВОГО ЖЕЛУДОЧКА
Определение
Аритмогенная кардиомиопатия ПЖ — заболевание мышцы сердца, характеризующееся частичным или полным прогрессирующим фиброзно-жировым замещением миокарда ПЖ, позднее — вовлечением в процесс ЛЖ с относительной интактностью перегородки.
Эпидемиология
Заболевание недавно идентифицировано и трудно диагностируется, поэтому его распространенность точно неизвестна, но считается, что может варьировать в пределах от 1:3000 до 1:10 000, соотношение мужчины. женщины составляет 2,5:1. Первые клинические проявления могут возникнуть в юношеском возрасте, редко — старше 40 лет.
Этиология
Точная причина заболевания неизвестна, однако в некоторых семьях существуют несомненные доказательства его наследования. В большинстве семей, где более одного заболевшего, наиболее вероятным типом наследования является аутосомно-доминантный. Описан также по крайней мере один хорошо известный вариант аритмогенной кардиомиопатии ПЖ, который наследуется по аутосомно-рецессивному типу.
Генетическими исследованиями идентифицировано по крайне мере 7 локусов генов, ответственных за развитие заболевания. С аритмогенной кардиомиопатией ПЖ также ассоциируются мутации генов, кодирующих белки вставочных дисков (десмоплакин, плакоглобин со специфическим фенотипом, плакофилин, десмоглеин, десмоколлин). Признаки заболевания могут варьировать даже у членов одной семьи, и патология может проявиться через поколения. Считается, что занятия спортом не могут вызывать аритмогенную кардиомиопатию ПЖ, тем не менее заболевание чаще регистрируют среди спортсменов. Мутации генов рианодиновых рецепторов сердца ^уИ2) ассоциируются с полиморфной желудочковой тахикардией, вызванной физическими нагрузками и ювенильной внезапной смертью.
Патологическая анатомия
При морфологическом исследовании сердца вовлеченным оказывается чаще ПЖ, который имеет пятнистый вид: измененные участки могут быть окружены нормальными тканями. Вовлечение ПЖ может быть регионарным (20%) или диффузным (80%). Миокард ПЖ прогрессивно редуцируется, замещаясь жировой и фиброзной тканью, которая отличается от нефиброзной жировой инфильтрации, возникающей в ПЖ с возрастом. На ранних стадиях заболевания стенки правых отделов сердца утолщаются, но в дальнейшем из-за накопления жировой ткани и появления участков дилатации они становятся более тонкими (рис. 12.1а, б).
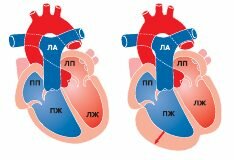
Рис. 12.1.
Аритмогенная кардиомиопатия ПЖ
: а) участки жировой ткани приводят к ослаблению и выбуханию мышечной стенки; б) ПЖ увеличивается
Жировое перерождение миокарда распространяется чаще от эпикардиальных слоев к эндокарду. Миокард поражается преимущественно в области выносящего тракта, верхушки и субтрикуспидальной зоны, которые рассматриваются в качестве «треугольника дисплазии».
При аритмогенной кардиомиопатии ПЖ липоматоз сопровождается преимущественно дилатацией выносящего тракта ПЖ или генерализованной дилатацией. Фибролипоматоз характеризуется наличием фокальной аневризмы ПЖ и выпячиванием в области верхушки, нижней стенки, субтрикуспидальной и инфундибулярной зоны.
По мере прогрессирования фиброзно-жировая дистрофия поражает также ЛЖ и предсердия.
Патогенез
Среди молекулярных механизмов аритмогенной кардиомиопатии ПЖ рассматриваются генетически детерминируемые мутации в десмосомальных протеинах, а также ингибирование сигнальных путей.
Стресс-индуцируемый разрыв десмосомальных связей клеток может запускать процесс апоптоза, вызывать атрофию миокарда и замещение его жировой тканью.
Очаги жирового перерождения и интерстициального фиброза при аритмогенной кардиомиопатии ПЖ не проводят электрические импульсы, вследствие чего дезорганизованная структура сердца обусловливает возникновение беспорядочной электрической активности, электрические импульсы могут становиться рассеянными, вследствие чего, помимо нарушений ритма сердца, могут возникать нарушения его сократимости (рис. 12.2а, б).
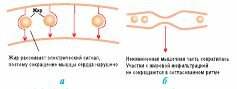
: а) до сокращения; б) после сокращения
Клиническая картина
Основными клиническими симптомами аритмогенной кардиомиопатии ПЖ являются:
• ощущение сердцебиения, перебоев в работе сердца, приступы желудочковой тахикардии;
• повышенная утомляемость, головокружение, обмороки;
• симптомы СН;
• внезапная остановка кровообращения.
Описаны 4 клинические стадии заболевания:
• субклиническая, незначительные желудочковые аритмии могут отмечаться или отсутствовать;
• стадия явных электрических нарушений, правожелудочковые аритмии и риск остановки сердца связаны с морфофункциональными изменениями ПЖ;
• стадия правожелудочковой недостаточности с прогрессирующим вовлечением ПЖ и последующей его глобальной систолической дисфункцией;
• стадия конечной бивентрикулярной СН.
Диагностика
На ЭКГ определяются:
• спонтанные желудочковые тахикардии с изменением комплекса QRS по типу блокады левой ножки пучка Гиса;
• отрицательные зубцы Т в отведениях V на фоне синусового ритма;
• уширение комплекса QRS;
• неполная блокада правой ножки пучка Гиса;
• эктопические тяжелые аритмии: желудочковая экстрасистолия, фибрилляция желудочков, предсердная тахикардия, фибрилляция предсердий.
Приблизительно у И пациентов регистрируется характерная эпсилон-волна и ППЖ.
Методом холтеровского мониторирования можно диагностировать эпизоды желудочковой тахиаритмии. Для оценки прогрессирования заболевания важно проводить регистрацию ЭКГ в динамике.
При эхоКГ-исследовании выявляются:
• дилатация ПЖ и нарушение его сократимости (асинергия, диффузная гипокинезия, снижение ФВ);
• локальная аневризма ПЖ;
• повышенная трабекулярность;
• трикуспидальная регургитация;
• эмболия ЛА;
• увеличение правого предсердия;
• левые отделы сердца чаще не изменены.
С помощью допплер-эхоКГ определяется нарушение диастолической функции ПЖ и трикуспидальная регургитация. Для более точной визуализации ПЖ применяют контрастную эхоКГ миокарда.
Методом МРТ визуализируются участки замещения миокарда жировой тканью, фокальное истончение стенки и локальные аневризмы. Продемонстрирована хорошая корреляция между результатами этого метода и результатами морфологического исследования миокарда.
Для подтверждения диагноза используют рентгенконтрастную вентрикулографию, при которой выявляют дилатацию ПЖ с сегментарными нарушениями его сокращения, выпячивания контура в области дисплазии и повышение трабекулярности.
При эндомиокардиальной биопсии определяют фиброзно-жировую инфильтрацию миокарда ПЖ.
Из-за трудностей и риска проведения биопсии для подтверждения диагноза «аритмогенная кардиомиопатия ПЖ», а также неточностей в оценке структуры и функции ПЖ с помощью неинвазивных тестов Европейским кардиологическим обществом и Международным обществом и кардиологической федерацией разработаны критерии, согласно которым диагноз устанавливают при наличии 2 больших или 1 большого + 2 малых или 4 малых диагностических критериев (СОпаЛо D. й а1. 2000).
Большие диагностические критерии:
• семейный характер заболевания, подтвержденный данными аутопсии или при хирургическом вмешательстве;
• эпсилон-волна или локализованное уширение комплекса QRS (>110 мс) в правых грудных отведениях (У1—У3);
• фибролипоматозное замещение миокарда по данным эндомиокардиальной биопсии;
• значительная дилатация и снижение ФВ ПЖ при отсутствии или минимальном вовлечении ЛЖ;
• локализованная аневризма ПЖ;
• выраженная сегментарная дилатация ПЖ;
Малые диагностические критерии:
• наличие в семейном анамнезе случаев преждевременной внезапной смерти (у лиц в возрасте моложе 35 лет) вследствие предполагаемой аритмогенной кардиомиопатии ПЖ;
• ППЖ на усредненной ЭКГ;
• инвертированный зубец Т в правых грудных отведениях у лиц в возрасте старше 12 лет при отсутствии блокады правой ножки пучка Гиса;
• желудочковая тахикардия с признаками блокады левой ножки пучка Гиса, документированная по ЭКГ или результатам холтеровского мониторирования или во время нагрузочного теста;
• частые желудочковые экстрасистолы (>1000/24 ч при холтеровском мониторировании ЭКГ);
• умеренная глобальная дилатация или снижение ФВ ПЖ при неизмененном ЛЖ;
• умеренная сегментарная дилатация ПЖ;
• регионарная гипокинезия ПЖ.
Лечение
Для выбора антиаритмической терапии необходимо проведение инвазивного ЭФИ и проб с дозированной физической нагрузкой.
Среди антиаритмических препаратов эффективны амиодарон и соталол. Дигоксин применяют при тахисистолической форме фибрилляции предсердий для замедления ЧСС. Для восстановления синусового ритма проводят кардиоверсию.
Диуретики применяют при СН у больных с задержкой жидкости.
Из хирургических методов лечения применяют абляцию, если источник нарушенной электрической активности идентифицирован с помощью электрофизиологических тестов. В случаях если аритмии не контролируются с помощью лекарственных средств или абляции (обширное поражение или наличие множественных аритмогенных очагов), вшивают имплантируемый кардиовертерный дефибриллятор, в некоторых случаях требуется имплантация водителя ритма. Трансплантацию сердца применяют редко, если контроль ритма невозможен другими методами.
Прогноз
Результаты недавно проведенного исследования, включавшего 130 пациентов с аритмогенной кардиомиопатией ПЖ, показали, что сердечно-сосудистая смертность составила 16% (n=24), наиболее частой причиной была внезапная смерть (29%) и СН (59%). Анализ факторов риска выявил самые неблагоприятные — наличие дисфункции ПЖ или ЛЖ и желудочковую тахикардию (Hulot J.S. et al. 2004).