Эндокардит. Причины, симптомы, признаки, диагностика и лечение патологии
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача.
 Эндокардитом называется воспаление эндокарда — внутренней оболочки сердца . Чаще всего оно вызвано инфекционными агентами, но может быть и следствием других заболеваний или патологических состояний. Эндокардит встречается повсеместно на всем земном шаре, но его распространенность неодинакова. В среднем по миру заболеваемость составляет 6 – 10 случаев на 100000 населения. В Европе и на постсоветском пространстве этот показатель несколько выше (до 15 случаев ).
Эндокардитом называется воспаление эндокарда — внутренней оболочки сердца . Чаще всего оно вызвано инфекционными агентами, но может быть и следствием других заболеваний или патологических состояний. Эндокардит встречается повсеместно на всем земном шаре, но его распространенность неодинакова. В среднем по миру заболеваемость составляет 6 – 10 случаев на 100000 населения. В Европе и на постсоветском пространстве этот показатель несколько выше (до 15 случаев ).
Риску заболеть эндокардитом подвержены в равной степени и мужчины, и женщины. Также заболевание встречается в любом возрасте. Несколько выше заболеваемость в раннем детстве (у детей с врожденными пороками сердца ). У пожилых людей несколько ухудшается прогноз инфекционного эндокардита из-за общей слабости организма. В целом среди взрослых людей заболевают в основном люди с различными предрасполагающими факторами, о которых будет рассказано далее.
Смертность от бактериального эндокардита варьирует в широких пределах и составляет от 15 до 45% в зависимости от возбудителя заболевания и от того, насколько своевременно было начато лечение. Болезнь характеризуется признаками интоксикации (при бактериальной форме ) и нарушениями в работе сердца.
Анатомия сердца
 Для правильного понимания процессов, происходящих в организме больного при эндокардите, необходимо знать анатомию и физиологию сердечно-сосудистой системы. Дело в том, что проявления данного заболевания нередко выходят за рамки эндокарда. В самом же сердце могут наблюдаться патологические изменения на самых разных уровнях.
Для правильного понимания процессов, происходящих в организме больного при эндокардите, необходимо знать анатомию и физиологию сердечно-сосудистой системы. Дело в том, что проявления данного заболевания нередко выходят за рамки эндокарда. В самом же сердце могут наблюдаться патологические изменения на самых разных уровнях.
У человека сердечно-сосудистая система включает следующие отделы:
- Собственно сердце. Сердце представляет собой полый орган, строение которого будет подробно рассмотрено далее. В сердечно-сосудистой системе оно играет роль насоса, перекачивающего кровь по организму.
- Малый круг кровообращения. Малым кругом называют сосудистую сеть в легких. Он начинается он правого желудочка, который перекачивает венозную кровь в легкие. Там происходит газообмен, обогащение крови кислородом и ее превращение в артериальную кровь. Заканчивается малый круг кровообращения в левом предсердии.
- Большой круг кровообращения. Большой круг включает в себя сосудистую сеть всех органов и тканей в человеческом теле. Он начинается в левом желудочке, откуда кровь по артериям доставляется ко всем анатомическим областям. После доставки кислорода и газообмена в тканях (тканевого дыхания ) кровь по венам возвращается обратно в сердце. Заканчивается большой круг кровообращения в правом предсердии.
Собственно сердце состоит из следующих отделов:
- правое предсердие;
- правый желудочек;
- левое предсердие;
- левый желудочек.
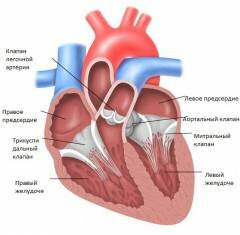
Правое предсердие
Правое предсердие принимает кровь из большого круга кровообращения. Из верхних конечностей, головы и шеи кровь попадает сюда через верхнюю полую вену. Из брюшной полости и от нижних конечностей – через нижнюю полую вену. В месте их слияния образуется небольшая полость, именуемая синусом полых вен.
Из правого предсердия кровь попадает в правый желудочек. При эндокардитах нередко поражается отверстие между этими двумя камерами, а именно трехстворчатый клапан, расположенный в этом месте. Клапан является производным эндокарда – внутренней оболочки сердца. При нарушениях на этом уровне может страдать нормальный ток крови из правого предсердия в правый желудочек. В норме происходит сокращение стенок предсердия и открытие клапана, после чего кровь перекачивается из одного отдела в другой. При сужении в этом месте, которое может образоваться на фоне эндокардита, давление в предсердии повышается, потому что кровь не может полностью покинуть его полость.
Правый желудочек
Правый желудочек принимает кровь через трехстворчатый клапан и перекачивает ее в малый круг кровообращения. Он обладает хорошо развитой мускулатурой, так как должен обеспечивать хорошее давление. Венозная кровь идет отсюда в легочную артерию через клапан легочного ствола. При нормальной работе этого отдела в момент сокращения мышц происходит закрытие трехстворчатого клапана и открытие клапана легочного ствола. Первое не позволяет крови вернуться обратно в правое предсердие. Второе обеспечивает выход крови в легочную артерию.
В правом желудочке эндокард имеет ряд образований. Наибольшее значение имеют так называемые хорды. Они представляют собой тяжи соединительной ткани, которые регулируют работу трехстворчатого клапана. При закрытии клапана хорды натягиваются и не дают створкам вывернуться в полость предсердия. У пациентов с эндокардитом хорды и створки клапана могут быть поражены воспалительным процессом, что нарушает их нормальную работу.
Левое предсердие
Левое предсердие имеет неправильную кубовидную форму. Оно принимает артериальную кровь из четырех легочных вен. Сокращение данного отдела приводит к выбрасыванию крови в полость левого желудочка. Это происходит через левое предсердно-желудочковое отверстие. В нем располагается митральный клапан, регулирующий односторонний ток крови.
Левый желудочек
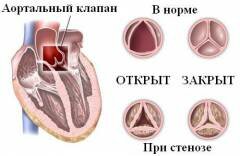
Левый желудочек принимает кровь из левого предсердия через митральный клапан. Эта камера сердца имеет наибольший объем и наиболее толстые стенки. Дело в том, что левый желудочек в норме должен сокращаться настолько сильно, чтобы перегонять артериальную кровь в аорту и разносить ее по всему организму. Во время сокращения его стенок идет закрытие створок митрального клапана и открытие аортального клапана, через которое кровь идет дальше. Изнутри стенки желудочка содержат несколько образований — хорды и сосочковые мышцы. Подобно хордам правого желудочка они удерживают створки митрального клапана от выворачивания в полость предсердия. Так как давление в левом желудочке наиболее высокое, то и хорды здесь более толстые. Обилие соединительной ткани (из нее состоят и хорды, и створки клапанов ) делает данную область очень уязвимой перед инфекцией. При эндокардитах различной этиологии (происхождения ) наиболее часто поражаются именно образования и клапаны в пределах левого желудочка.
Большое значение в строении сердца имеют также следующие слои, из которых состоят его стенки:
- Эндокард. Эндокард состоит из одного слоя эпителиальных клеток. Он покрывает внутреннюю поверхность всех камер сердца, а также створки клапанов, хорды и сосочковые мышцы. Данный слой как бы разделяет собственно поток крови и миокард — сердечную мышцу. При наличии в крови бактерий или других патогенных микроорганизмов, они нередко задерживаются именно на уровне эндокарда, а именно в области хорд и створок клапанов. Воспалительный процесс в этом месте и носит название эндокардита.
- Миокард. Миокард – это сердечная мышца, которая отвечает за сокращение камер и собственно перекачивание крови. Клетки миокарда называются кардиомиоцитами. Они сокращаются под действием импульса, который распространяется по специальным проводящим волокнам. При эндокардите воспалительный процесс может затронуть внутренние слои миокарда или проводящую систему. Это приведет к соответствующим нарушениям в работе сердца и появлению определенных симптомов. В норме толщина миокарда составляет от 0,5 до 2 см (наибольшая – в стенках левого желудочка ). Данный слой очень чувствителен к недостатку кислорода.
- Перикард. Перикард или сердечная сумка представляет собой наружный слой сердечной стенки. Фактически он состоит из двух листков, между которыми есть небольшое пространство. Внутренний листок плотно сращен с миокардом и движется с ним во время сердечных сокращений. Наружный же листок отделяет сердце от соседних органов в грудной полости и облегчает его скольжение при сокращениях.
Причины эндокардита
 Воспалительный процесс в эндокарде может развиться по различным причинам. Их знание необходимо для правильного назначения лечения и профилактики рецидивов (повторных обострений ) болезни.
Воспалительный процесс в эндокарде может развиться по различным причинам. Их знание необходимо для правильного назначения лечения и профилактики рецидивов (повторных обострений ) болезни.
Основными причинами эндокардита являются:
- диффузные болезни соединительной ткани;
- травмы;
- аллергическая реакция;
- интоксикация;
- инфекция.
Диффузные болезни соединительной ткани
Несмотря на то что сам эндокард состоит всего из одного слоя эпителиальных клеток, он тесно контактирует со многими структурами, содержащими соединительную ткань. Вследствие этого воспалительный процесс обычно затрагивает обе эти ткани, независимо от того, какая была поражена первой. Из диффузных болезней соединительной ткани, которые могут вызывать эндокардит, наибольшее значение в медицинской практике имеет ревматизм .
Ревматизм — это инфекционно-аллергическое заболевание, в основе которого лежит воспаление и дезорганизация соединительной ткани. Основной причиной ревматизма считают бета-гемолитический стрептококк группы А. При первом контакте с этим микроорганизмом пациент обычно страдает от тонзиллита или фарингита (в детском возрасте ). Без квалифицированного медикаментозного лечения начальное заболевание проходит в течение 1 – 2 недель. Однако затем наступает наиболее опасная фаза.
Иммунная система человека начинает вырабатывать антитела против возбудителя. В отдельных случаях эта реакция становится чрезмерно сильной (гиперергический иммунный ответ ). У таких пациентов антитела начинают атаковать клетки соединительной ткани (преимущественно в сердечно-сосудистой системе ). Такое воспаление и носит название ревматизма.
При ревматическом эндокардите наиболее часто поражаются следующие структуры сердца:
- митральный клапан;
- аортальный клапан;
- трехстворчатый клапан (обычно в сочетании с другими локализациями );
- сухожильные хорды;
- париетальный (пристеночный ) эндокард;
- глубокие слои миокарда.
Таким образом, при ревматическом эндокардите воспаление носит несколько другой характер, нежели при наиболее распространенной, инфекционной форме. Это объясняет различия в течении болезни и ее проявления. Сходные повреждения сердца могут возникнуть и у пациентов с системной красной волчанкой .
Травмы
Эндокардит вследствие травмы развивается после операций или инвазивных диагностических процедур на сердце и нередко является следствием врачебных ошибок. Обычно он протекает в форме небольших скоплений тромботических масс в области клапанов сердца. Воспалительные явления при этом не выражены. Проблемой может стать лишь постепенная деформация клапана (обычно сужение фиброзного кольца ). Прогноз при своевременном обнаружении травматического эндокардита всегда благоприятный.
Аллергическая реакция
Аллергический эндокардит развивается редко. Его причиной является индивидуальная чувствительность организма к определенным химическим соединениям (аллергенам ) и их попадание в кровяное русло. Нередко в роли аллергенов выступают медикаменты. Пациенты и не подозревают о наличии у них непереносимости какого-либо препарата. В таких случаях эндокардит развивается во время курса лечения другого заболевания. Аллергическая форма эндокардита обычно протекает легко и не имеет серьезных последствий. В будущем пациенту лишь советуют избегать повторных контактов с аллергеном.
Интоксикация
Эндокардит может развиться при некоторых видах интоксикаций. Иногда симптомы этого заболевания наблюдаются при повышении уровня мочевой кислоты (уремия ). Подобное действие могут оказывать и некоторые яды или химикаты, попавшие в кровь. Характерным при этом виде эндокардита является скопление тромботических масс по краю клапанов левого желудочка. Воспалительные явления выражены довольно слабо. В связи с этим многие авторы не рекомендуют даже относить подобные состояния к категории эндокардитов.
Инфекция
Бактериальная инфекция является наиболее частой причиной развития эндокардита по всему миру. Вирусы практически не способны поражать этот слой сердца, а грибковая инфекция встречается довольно редко. Бактерии же попадают на сворки клапанов и хорды в период бактериемии. При этом возбудители болезни циркулируют в крови. Обычно первичным инфекционным очагом являются другие органы и ткани, а на эндокард микробы заносятся из-за неэффективного или поздно начатого лечения. Однако встречаются и случаи, когда эндокардит является единственным проявлением инфекционного процесса.
Наиболее частыми возбудителями бактериального эндокардита являются:
- Зеленящий стрептококк (Streptococcus viridans ) – приблизительно в 35 — 40% случаев. Является наиболее частым возбудителем инфекционного эндокардита.
- Энтерококк (Enterococcus ) – 10 – 15%. Обитает в норме в кишечнике человека, но в определенных условиях может стать патогенным (болезнетворным ).
- Золотистый стафилококк (Staphylococcus aureus ) – 15 – 20%. Может обитать на коже или в носовой полости здоровых людей. Вызывает тяжелый инфекционный эндокардит с серьезным поражением клапанов.
- Streptococcus pneumoniae – 1 – 5%. Данный микроорганизм является возбудителем пневмонии. синусита или менингита у детей. При отсутствии квалифицированного лечения возможно поражение эндокарда.
- Другие стрептококки и стафилококки – 15 – 20%. Данные возбудители вызывают обычно эндокардит с благоприятным прогнозом без серьезного повреждения клапанов.
- Бактерии из группы HACEK (Haemophylus, Actinobacillus actinimycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae ) – 3 – 7%. Данную группу микроорганизмов объединили из-за их высокого тропизма (сродства ) именно к эндокарду сердца. Их общей особенностью являются трудности в диагностике, потому что все бактерии группы HACEK с трудом культивируются на питательных средах.
- Грамотрицательные бактерии – 5 – 14% (Shigella, Salmonella, Legionella, Pseudomonas ). Данные бактерии редко поражают эндокард. Обычно помимо симптомов со стороны сердца присутствуют и нарушения функций других органов и систем.
- Грибковые инфекции – 1 – 5%. Грибковые инфекции также редко поражают эндокард. Проблема у таких пациентов заключается в необходимости длительного лечения противогрибковыми средствами. Из-за опасности осложнений врачи нередко прибегают к хирургическому лечению.
- Другие возбудители. В принципе, эндокардит могут вызывать практически все известные патогенные бактерии (хламидии. бруцеллы. риккетсии и т.д. ). Примерно в 10 – 25% случаев выделить возбудителя болезни не удается, хотя все симптомы и диагностические тесты говорят в пользу инфекционного эндокардита.
- Сочетание нескольких инфекционных агентов (смешанная форма ). Регистрируется редко и ведет, как правило, к тяжелому затяжному течению болезни.
Подобное разнообразие возбудителей инфекционного эндокардита создает серьезные трудности для диагностики и лечения пациентов. К тому же, каждый микроорганизм обладает некоторыми индивидуальными особенностями, что объясняет большое количество различных симптомов и вариантов течения заболевания.
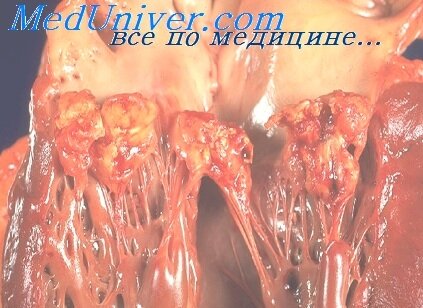
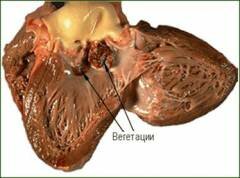
Важной особенностью бактериальных эндокардитов является формирование так называемых вегетаций на створках клапанов. Чаще всего они возникают в левых отделах сердца. Вегетациями называются небольшие скопления микроорганизмов, прикрепленные к створке. Обычно на первом этапе в месте повреждения эндокарда формируется небольшой тромб. Впоследствии именно к нему прикрепляются первые возбудители инфекции. По мере их размножения и усиления воспалительного процесса вегетации могут увеличиваться. Если они имеют плоскую форму и прочно крепятся к створке, то их называют неподвижными. Подвижные вегетации по строению напоминают полипы на ножке. Они как бы болтаются на створке клапана и движутся в зависимости от тока крови. Такие вегетации являются наиболее опасными, так как отрыв этого образования ведет к его попаданию в кровоток и острому тромбозу. Отрыв крупных подвижных вегетаций является довольно частой причиной серьезных осложнений и даже смерти при инфекционном эндокардите. Тяжесть последствий зависит от того, на каком уровне произойдет тромбоз сосуда.
Отдельно следует рассмотреть фибропластический эозинофильный эндокардит Леффлера. Причины его развития неизвестны. При данном заболевании поражается преимущественно пристеночный перикард, что отличает его от других вариантов заболевания. Предполагается, что в развитии эндокардита Леффлера играют определенную роль сложные аллергические реакции.
Виды эндокардита
 Существует множество различных классификаций эндокардита, каждая из которых отражает особенности течения болезни у определенного пациента. Такое разделение было сделано с целью облегчить процесс диагностики и систематизировать большое количество симптомов.
Существует множество различных классификаций эндокардита, каждая из которых отражает особенности течения болезни у определенного пациента. Такое разделение было сделано с целью облегчить процесс диагностики и систематизировать большое количество симптомов.
Инфекционные эндокардиты могут быть разделены на две основные группы:
- Первичный инфекционный эндокардит. Первичной называется форма заболевания, при которой бактерии, циркулирующие в крови, задержались на створках здорового клапана (любого из клапанов ) и вызвали воспаление. Такая форма встречается достаточно редко, потому что здоровый эндокард мало восприимчив к возбудителям болезни.
- Вторичный инфекционный эндокардит. Вторичным называют эндокардит, при котором инфекция попадает на уже поврежденные сердечные клапаны. Такая форма болезни встречается значительно чаще. Дело в том, что сужение клапанов или их неправильная работа нарушают нормальный ток крови. Возникают завихрения, застой крови в определенных камерах сердца или повышение внутреннего давления. Все это способствует микроскопическим повреждениям эндокарда, куда легко проникают бактерии из крови. Дефектами, предрасполагающими к вторичному инфицированию сердечных клапанов, являются ревматический процесс, открытый артериальный проток, дефект перегородки сердца, а также другие врожденные или приобретенные пороки сердца.
По клиническому течению заболевания инфекционный эндокардит может быть разделен на три формы:
- острый;
- подострый;
- хронический (затяжной ).
Острый инфекционный эндокардит
Наиболее часто острая форма эндокардита возникает при стафилококковом сепсисе. когда микроорганизмы из этой группы циркулируют в крови. На створках клапанов быстро появляются изъязвления и вегетации. Воспаление приводит к выделению патологического белка — фибрина. Он закрывает дефекты и изъязвленные участки, но утолщает створки клапанов, что препятствует их нормальной работе. Состояние больных при данной форме эндокардита тяжелое. На протяжении всей болезни высок риск тяжелых осложнений (перфорация клапана, отрыв вегетации и тромбоз ). Выздоровление наступает через 1 – 2 месяца. Как правило, после ликвидации воспалительного очага створки клапанов остаются деформированными, что объясняет остаточные явления после болезни.
Подострый инфекционный эндокардит
Подострый эндокардит длится более 2 месяцев (обычно до 1 – 1,5 лет ). Язвенный процесс в данном случае менее выражен, и разрушение клапанов происходит не так быстро. В редких случаях болезнь может протекать без явного поражения клапанного аппарата. Воспаление ограничивается хордами и пристеночным эндокардом. Симптомы у таких пациентов менее выражены, а общее состояние обычно лучше.
Хронический (затяжной ) инфекционный эндокардит
Данная форма эндокардита появляется на фоне серьезных нарушений в структуре или работе клапанного аппарата (вторичный эндокардит ). Первичный дефект присутствует в 85% случаев и способствует формированию хронического очага инфекции. Это препятствует эффективному лечению и объясняет затяжное течение болезни. В целом затяжной эндокардит наблюдается почти в 40% случаев.
К хроническому течению болезни предрасположены следующие группы пациентов:
- Новорожденные и дети грудного возраста. Распространенность хронического эндокардита у детей объясняется врожденными дефектами клапанов сердца. В этих случаях попадание инфекции и ее развитие на эндокарде обычно является вопросом времени.
- Люди, употребляющие наркотики инъекционным путем. У этой категории людей существует высокая вероятность токсического поражения эндокарда и занесения инфекции. Кроме того, по ходу лечения возможно повторное занесение микробов. Нередко у таких пациентов наблюдаются смешанные инфекции.
- Люди, перенесшие операции на сердце. Диагностические или лечебные манипуляции в полости сердца всегда представляют опасность травматизации эндокарда. В будущем это создает благоприятные условия для формирования инфекционного очага.
При хроническом инфекционном эндокардите обычно наблюдаются периоды ремиссий и рецидивов. Ремиссии представляют собой улучшения состояния пациента и исчезновение острых симптомов. В этот период у больных наблюдаются в основном признаки поражения клапанов, но инфекционный очаг в сердце не ликвидирован. Рецидивом называют резкое ухудшение состояния пациента, связанное с активизацией инфекции и развитием острого воспалительного процесса. Подобное течение наблюдается также при ревматическом эндокардите.
В некоторых странах помимо острой, подострой и хронической формы эндокардита различают еще абортивный вариант течения. Он характеризуется быстрым и стойким выздоровлением (без рецидивов ). Такой исход наиболее благоприятен, так как клапанный аппарат сердца не успевает пострадать из-за воспаления. Абортивное течение наблюдают при инфекционных и токсических эндокардитах, когда болезнь удалось диагностировать на ранней стадии, и было начато своевременное лечение.
Ревматический эндокардит имеет несколько другую классификацию. Она основана не на длительности заболевания (потому что оно всегда затяжное ), а на характере изменений сердечных клапанов. Они позволяют оценить интенсивность воспалительного процесса и назначить правильное лечение.
Ревматический эндокардит подразделяется на четыре вида:
- Диффузный эндокардит. В данном случае происходит изменение структуры соединительной ткани по всей поверхности клапана. Его створки утолщаются, что затрудняет нормальную работу сердца. На поверхности можно обнаружить небольшие гранулемы (обычно появляются со стороны левого желудочка на створках митрального или аортального клапана ). Характерно одновременное поражение соединительной ткани в нескольких местах, в том числе хорд и пристеночного эндокарда. Своевременное лечение такого эндокардита на стадии набухания соединительной ткани помогает избежать необратимых изменений. Если же гранулемы уже появились, высок риск сращения или укорочения створок клапана. Такие изменения называют ревматическим пороком сердца.
- Острый бородавчатый эндокардит. Данная форма болезни характеризуется отслоением поверхностного слоя эндокарда. В месте поражения происходит отложение тромботических масс и фибрина, что ведет к появлению специфических образований, так называемых бородавок. Они имеют вид небольших светло-коричневых или серых бугорков. В некоторых случаях наблюдается резкий рост этих образований с формированием целых конгломератов на створке клапана. В отличие от вегетаций при инфекционном эндокардите эти образования не содержат патогенных микроорганизмов. Тем не менее, в случае циркуляции микробов в крови может произойти инфицирование таких бородавок с развитием вторичного инфекционного эндокардита и ухудшением общего состояния пациента. Если воспаление удается остановить на ранних стадиях, то образования на створках клапанов не увеличиваются. При этом практически нет риска отрыва тромба и серьезного нарушения работы сердца.
- Возвратный бородавчатый эндокардит. Данный тип характеризуется изменениями, похожими на таковые при остром бородавочном эндокардите. Различие состоит в течении заболевания. Образования на створках появляются периодически, во время обострения ревматизма. Стойкие наложения фибрина отмечаются при включении солей кальция. Такие образования хорошо видны при проведении ЭхоКГ (эхокарлиографии ) или рентгенографии, которые помогают подтвердить диагноз.
- Фибропластический эндокардит. Данная форма является финальной стадией трех предыдущих вариантов течения ревматического эндокардита. Для нее характерны выраженные изменения створок клапанов (их укорочение, деформация, сращивание ). Эти изменения уже необратимы и требуют хирургического лечения.
При фибропластическом эозинофильном эндокардите Леффлера заболевание классифицируют по стадиям течения. Для каждого этапа характерны свои изменения в полости сердца и соответствующие симптомы.
При эндокардите Леффлера различают следующие этапы:
- Острая (некротическая ) стадия. Воспалительный процесс затрагивает эндокард обоих желудочков и (реже ) предсердий. Поражается не только поверхностный слой, контактирующий с кровью, но и глубокие слои миокарда. В воспаленной ткани обнаруживается большое количество эозинофилов (вид лейкоцитов ). Длительной этой стадии составляет 5 – 8 недель.
- Тромботическая стадия. На этом этапе воспалительные очаги в эндокарде начинают покрываться тромботическими массами. Из-за этого стенки камер сердца утолщаются и их объем уменьшается. Происходит постепенное огрубение эндокарда, при котором в его толще появляется больше волокон соединительной ткани. Подлежащий миокард утолщается за счет гипертрофии (увеличения в объеме ) мышечных клеток. Главной проблемой на этом этапе является выраженное уменьшение объема желудочков.
- Стадия фиброза. Когда соединительная ткань в эндокарде сформировалась, стенка теряет свои эластические свойства. Наблюдается необратимое уменьшение объема сердца, ослабление его сокращений и поражение сухожильных хорд, что отражается и на работе клапанов. На первый план при этом выходит картина хронической сердечной недостаточности .
Эндокардит инфекционный
Что такое Эндокардит инфекционный —
Инфекционный эндокардит (ИЭ) — это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана. Чаще всего патогенные микроорганизмы поражают ранее измененные клапаны и подклапанные структуры, в том числе у больных с ревматическими пороками сердца, дегенеративными изменениями клапанов, ПМК, искусственными клапанами. Это так называемый вторичный инфекционный эндокардит. В других случаях инфекционное поражение эндокарда развивается на фоне неизмененных клапанов (первичный инфекционный эндокардит).
В последние годы частота первичного ИЭ возросла до 41-54% от всех случаев заболевания. Различают также острое и подострое течение инфекционного эндокардита. Достаточно распространенное в прошлом затяжное течение эндокардита в настоящее время является большой редкостью. Чаще всего поражаются митральный и аортальный клапаны, реже — трикуспидальный и клапан легочной артерии. Поражение эндокарда правых отделов сердца наиболее характерно для инъекционных наркоманов. Ежегодная заболеваемость инфекционным эндокардитом составляет 38 случаев на 100 тысяч населения. причем чаще заболевают лица трудоспособного возраста (20-50 лет).
В последнее десятилетие многие авторы отмечают рост заболеваемости ИЭ, что связывают с широким использованием инвазивной медицинской техники, более частыми опeративными вмешательствами на сердце, ростом наркомании и числа лиц с иммунодефицитными состояниями. Летальность при ИЭ остается на уровне 40-60%, достигая у лиц пожилого и старческого возраста 80%. Эти данные подчеркивают сложности в своевременной диагностике и эффективном лечении заболевания.
Что провоцирует / Причины Эндокардита инфекционного:
Инфекционный эндокардит является полиэтиологичным заболеванием. В настоящее время в качестве возбудителей болезни известны более 128 микроорганизмов. К частым возбудителям ИЭ относят стафилококки, стрептококки, грамотрицательные и анаэробные бактерии, грибы. В странах Евросоюза стафилококки выделяют у 31-37 % больных, грамотрицательные бактерии — у 30-35 %, энтерококки — у 18-22 %, зеленящий стрептококк — у 17-20 %. На преобладание стафилококков, стрептококков и грамотрицательных бактерий в микробном пейзаже заболевания указывают многие американские и канадские авторы.
Исследования, проведенные в 90-е годы в тридцати госпиталях США, показали следующее соотношение возбудителей ИЭ: staрh. aureus — 56 %, str. viridans — 31 %, staрh. epidermidis — 13 %, энтерококки и другие бактерии — 5,6% случаев. По данным отечественных авторов, удельный вес стафилококков составляет — 45-56 %, стрептококков — 13-25 %, энтерококков — 0,5-20 %, анаэробный бактерий — 12 %, грамотрицательных бактерий — 3-8 %, грибов — 2-3 % от положительных гемокультур.
Вид возбудителя во многом определяет летальность от ИЭ. Если в 50-60-е годы преобладал зеленящий стрептококк, то в последние десятилетия 20-го века основными возбудителями инфекционного эндокардита стали эпидермальный и золотистый стафилококк, которые выделяют у 75-80 % больных с положительной гемокультурой. Смертность при ИЭ, вызванном золотистым стафилококком, составляет 60-80 %.
В последние десятилетия среди возбудителей ИЭ вырос удельный вес грамотрицательных бактерий группы НАСЕК (4-21%) и грибов (до 4-7%). В качестве возбудителей чаще выступают дрожжеподобные и истинные грибы (рода Candida, Aspergillus), которые обладают выраженной тропностью к эндокарду. Смертность при грибковом ИЭ достигает 90-100%, а при ИЭ, вызванном грамотрицательной микрофлорой — до 47-82%.
В 80-90-е годы увеличилось количество случаев ИЭ, вызванного анаэробной (8-12%) микрофлорой. Анаэробный эндокардит характеризуется высокой активностью инфекционного процесса, резистентностью к антибактериальной терапии, повышенной госпитальной летальностью (до 46-65%). К особенностям течения анаэробного эндокардита относят частое (41-65%) образование тромбофлебитов, тромбоэмболий в сосуды лёгких, сердца и головного мозга.
Основное значение среди возбудителей ИЭ имеют представители родов Staphylococcus, Streptococcus, Enterococcus, Escherichia, Salmonella, Shigella, Proteus, Klebsiella, Yersinia, Candida, Aspergillus.
ЭТИОЛОГИЧЕСКИЕ ВАРИАНТЫ ЭНДОКАРДИТОВ
В последеене десятилетие наиболее часто встречается ИЭ, вызванный золотистым стафилококком (Staph. aureus). Он значительно отличается от других этиологических вариантов своими характерными клиническими особенностями: как правило, имеет тяжелое течение с высокой активностью процесса и гектической лихорадкой с профузными потами, с появлением множественных очагов метастатической инфекции; большей частью является нозокомиальным (возникает во время пребывания в стационаре при инфицировании сосудистых катетеров, артериовенозных шунтов и фистул); часто развивается перфорация клапана с последующей сердечной недостаточностью; геморрагическая кожная сыпь обширна, часто наблюдается некроз и нагноение высыпаний; типично поражение головного мозга (эмболии церебральных артерий, абсцессы мозга, менингоэнцефалит); селезенка прощупывается редко в связи с мягкой ее консистенцией и незначительным увеличением, однако часто наблюдаются септические инфаркты селезенки и ее разрывы; эндокардит развивается как на поврежденных (ревматические, атеросклеротические, врожденные пороки сердца), так и на интактных клапанах, искусственных клапанах, причем эндокардит искусственных клапанов обычно вызывается коагулазонегативными стафилококками; чаще развивается эндокардит левой половины сердца с одинаковой частотой поражения митрального и аортального клапанов; тяжелое течение заболевания с высокой температурой тела, ознобами, выраженной интоксикацией, быстрой деструкцией клапанного аппарата сердца (наблюдается преимущественно острый пневмококковый эндокардит, реже — подострый); более частое поражение клапана аорты по сравнению с другими клапанами сердца; наличие вегетации крупного размера на пораженном клапане (этот признак диагностируется с помощью ультразвукового исследования сердца); возрастание частоты штаммов пневмококка, резистентных к антибактериальной терапии; частое развитие гнойных очагов (абсцессов мозга, миокарда, эмпиемы плевры); высокая летальность (30-40%).
Существуют некоторые клинические особенности инфекционных эндокардитов, вызываемых различными видами стрептококка. Для эндокардита, вызванного Str. viridaris, характерны: часто медленное, постепенное начало; развитие эндокардита преимущественно на предварительно, измененных клапанах; большая частота развития иммунокомплексной патологии (нефрит, васкулит, артрит, миокардит); летальность около 10%.
Определенные особенности присущи также эндокардиту, вызванному Str. boyis: частое наличие у больных предшествующей патологии желудочно-кишечного тракта (рак желудка или толстого кишечника, язва желудка или двенадцатиперстной кишки, полипоз кишечника); развитие сердечной недостаточности у большинства больных; редкость тромбоэмболических осложнений; высокая летальность (27%). Для эндокардита, вызванного Str. pyogenes, характерны выраженная интоксикация, высокая температура тела, гнойничковые заболевания кожи в периоде, предшествовавшем развитию эндокардита, быстрое поражение клапанов сердца (чаще всего митрального), высокая летальность (18-20%).
Эндокардит, вызванный р-гемолитическим стрептококком, чаще развивается у больных, страдающих сахарным диабетом, хроническим алкоголизмом и имеющих какое-либо предшествовавшее заболевание сердца (например, ревматический порок сердца). Для этого этиологического варианта эндокардита характерны тяжелое течение, тромбоэмболические осложнения (они наблюдаются почти у 1/2 больных). Летальность достигает 11-13%.
Существуют некоторые клинические особенности эндокардита, вызванного Str. agalactiae — представителем группы В стрептококков. Этот микроорганизм является частью нормальной микрофлоры полости рта, урогенитального и желудочно-кишечного тракта. Под влиянием Str. agalactiae в организме больного нарушается синтез фибринолизина, формируются большие вегетации и развиваются системные эмболии. Кроме того, чрезвычайно характерны септические скелетно-мышечные проявления (артриты, миозиты, остеомиелиты). Нередко наблюдается сочетание эндокардита, вызванного Str. agalactiae, со злокачественными новообразованиями толстой кишки.
Микроорганизмы группы НАСЕК
Микроорганизмы группы НАСЕК, являющиеся представителями нормальной флоры ротоглотки и респираторного тракта, вызывают подострый эндокардит предварительно измененных естественных клапанов и эндокардит протезированных клапанов (в этом случае эндокардит развивается чаще через 1 год после протезирования). Эндокардит естественных клапанов, вызванный НАСЕК-микроорганизмами, характеризуется большими вегетациями и частыми системными эмболиями. Микроорганизмы этой группы растут медленно на специальных средах и гемокультура должна инкубироваться 3 недели. Характерная особенность эндокардита, вызванного Haemophilus spp. — развитие заболевания у женщин в возрасте 20-40 лет с преобладающей локализацией процесса на митральном клапане.
Синегнойная палочка
Синегнойная палочка является одним из представителей грамотрицательной флоры, наиболее часто вызывающим эндокардит. При этом вовлекаются интактные и предварительно измененные клапаны как левой, так и правой половины сердца. Течение эндокардита тяжелое с выраженной деструкцией клапанов и развитием сердечной недостаточности. «Входные ворота» инфекции — урогенитальный тракт, инфицированные раны и ожоги. Эндокардит, вызванный синегнойной палочкой, очень трудно поддается лечению в связи с большой резистентностью возбудителя к антибактериальной терапии. Синегнойная палочка часто вызывает инфекционный эндокардит у наркоманов, применяющих наркотики внутривенно, при этом поражается трикуспидальный клапан.
Бруцеллезный эндокардит встречается редко у лиц, контактировавших с сельскохозяйственными животными, больными бруцеллезом. При этом варианте эндокардита чаще поражается аортальный или трикуспидальный клапан, возможно развитие аневризмы синуса Вальсальвы, часто наблюдаются нарушения атриовентрикулярной проводимости, нередко вовлекается перикард. В общем анализе периферической крови обычно обнаруживается лейкопения.
Менингококковый эндокардит в настоящее время встречается очень редко. Он развивается обычно на фоне клиники менингита и, как правило, поражает не поврежденный ранее митральный клапан. Характерные особенности менингококкового эндокардита: высокая температура тела, артралгии, геморрагическая сыпь, большие вегетации на пораженном клапане, геморрагический экссудативный миокардит.
Сальмонеллезный эндокардит является редким вариантом инфекционного эндокардита, поражаются предварительно поврежденные митральный и аортальный клапаны с быстрым развитием их деструкции, частым образованием тромбов в предсердиях. Сальмонеллы поражают также эндотелий сосудов (эндартериит) с развитием аневризм.
Грибковый эндокардит
Обычно развивается у лиц, перенесших операцию на сердце и крупных сосудах, а также у наркоманов, вводящих наркотики внутривенно и у пациентов, болеющих грибковой инфекцией. Способствуют развитию грибкового эндокардита иммунодефицитные состояния различной этиологии, в частности, вследствие цитостатической терапии, ВИЧ-инфекции. Диагностировать грибковый эндокардит трудно, потому что гемокультуры не всегда бывают положительны, особенно при аспергиллезном эндокардите (гемокультуры положительны при аспергиллезном эндокардите у 10-12% больных, при кандидамикозном — в 70-80% случаев), причем необходимо использовать специальную методику культивирования.
Характерными клиническими особенностями грибковых эндокардитов являются: тромбоэмболии в крупные артерии (мозговые, коронарные, желудочно-кишечного тракта, нижних конечностей), причем тромбоэмболии нередко являются первым клиническим проявлением заболевания; признаки хориоретинита или эндофтальмита (выявляются при офтальмоскопическом исследовании); симптомы грибкового поражения слизистых оболочек полости рта, пищевода, мочевыводящих путей, половых органов; большие размеры вегетации на клапанах, достигающих в диаметре 2 см и более (признак определяется при эхокардиографии), при аспергиллезном эндокардите вегетации могут располагаться не на клапанах, а пристеночно, поэтому могут не выявляться при ультразвуковом исследовании; преимущественное поражение клапана аорты (аортальный клапан поражается в 44% случаев, митральный — в 26%, трикуспидальный — в 7% случаев), однако улиц с протезированными клапанами поражение аортального клапана наблюдается в 4 раза чаще по сравнению с митральным клапаном; формирование абсцессов миокарда (более чем у 60% больных, особенно при аспергиллезном эндокардите); тяжелое течение и высокая летальность (превышает 50%).
Патогенез (что происходит?) во время Эндокардита инфекционного:
Патогенез ИЭ довольно сложен и окончательно не изучен. Принципиальную схему патогенеза ИЭ можно представить следующим образом: врождённые, приобрётенные дефекты клапанов сердца увеличение скорости и появление турбулентности трансклапанного потока крови механическое повреждение эндотелия клапанов отложение тромбоцитов и фибрина на повреждённых участках эндокарда формирование хронического неинфекционного эндокардита с тромботическими вегетациями преходящая бактериемия на фоне снижения реактивности организма адгезия и колонизация патогенных бактерий в фибрино-тромбоцитарных вегетациях воспаление эндокарда, формирование микробных вегетаций, разрушение клапанов развитие СН, системного инфекционного процесса с эмболическим, тромбогеморрагическим, иммунокомплексным поражением внутренних органов и тканей (рисунок 1).
В качестве инициальных механизмов патогенеза выделяют повреждение эндокарда, бактериемию, адгезию, размножение, колонизацию патогенных бактерий на клапанах. Основная роль в развитии ИЭ принадлежит деструкции эндокарда, бактериемии. Экспериментальные исследования свидетельствуют о том, что катетеризация сердца в течение нескольких минут вызывает чувствительность эндокарда к микробной агрессии на протяжении многих дней.
Данные электронной микроскопии позволили проследить последовательность формирования патологического процесса. Выяснено, что под воздействием регургитирующего потока крови изменяется форма и структура эндотелиоцитов, увеличивается межклеточная проницаемость, происходит десквамация эндотелия. Между эндотелиоцитами образуются поры, через которые проникают лимфоциты, макрофаги. Увеличение размеров пор, снижение атромбогенных свойств эндокарда усиливает адгезию бактерий. На месте отслоения дистрофически изменённых клеток идёт интенсивное тромбообразование. Эндокард покрывается активированными тромбоцитами, “прошивается” волокнами фибрина.
Повреждение, деэндотелизация эндокарда усиливают адгезию бактерий, образование покрывающего слоя из тромбоцитов, фибрина. Создается недоступная для фагоцитов “зона локального агранулоцитоза”, обеспечивающая выживание, размножение патогенных микроорганизмов. В процессе продолжающейся бактериальной колонизации, нарастания тромбоцитарно-фибринового матрикса формируются микробные тромбы, вегетации, происходит повреждение, разрушение клапана.
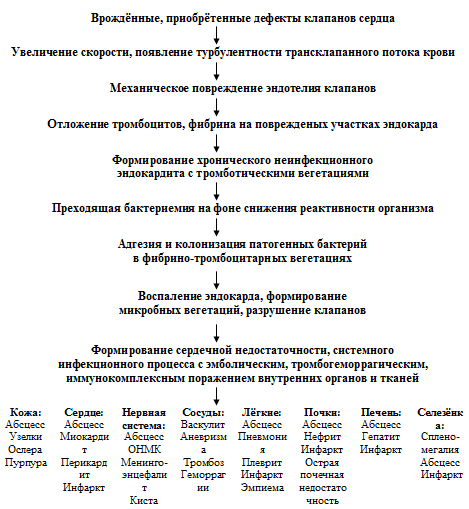
Рисунок 1. Схема патогенеза ИЭ.
Факторы, усиливающие адгезию бактерий к эндокарду, можно условно разделить на местные и общие. В состав местных входят врождённые и приобретённые изменения клапанов, нарушение внутрисердечной гемодинамики. Врождённые пороки увеличивают риск трансформации бактериемии в ИЭ до 92%. Предрасполагающие условия для возникновения заболевания создают механические, биологические искусственные клапаны. К общим факторам относят нарушения резистентности организма, выраженные изменения иммунитета, развивающиеся при проведении иммунносупрессивной терапии, у наркоманов, больных алкоголизмом, людей пожилого возраста и пациентов, имеющих изменения в HLA-системе гистосовместимости.
Формирование ИЭ происходит на фоне бактериемии, травмы эндокарда, снижения резистентности организма. Бактериемии принадлежит ведущая роль. Источниками бактериемии могут быть очаги хронической инфекции, инвазивные медицинские исследования и манипуляции (бронхоскопия, гастроскопия, колоноскопия, хирургические вмешательства), тонзилэктомия, аденоидэктомия, вскрытие и дренирование инфицированных тканей, стоматологические процедуры.
Развитие ИЭ зависит от массивности, частоты, видовой специфичности бактериемии. Риск развития заболевания особенно велик при повторяющихся “минимальных” или “массивной” бактериемии вследствие хирургических операций. Бактериемия staph. aureus является стопроцентным фактором риска ИЭ в связи повышенной адгезией и связыванием пептидогликаном эндокарда этих бактерий. Значительно меньшая вирулентность у эпидермального стафилококка и стрептококков. Вероятность развития ИЭ при пневмококковой бактериемии составляет приблизительно 30 %.
Существуют определённые закономерности в локализации инфекции, обусловленные нарушением внутрисердечной гемодинамики при формировании порока. Такими анатомическими образованиями при недостаточности клапанов являются поверхность МК со стороны левого предсердия, поверхность АК со стороны аорты, хорды. При незаращении межжелудочковой перегородки чаще поражается эндокард правого желудочка в области дефекта.
Персистирующая бактериемия стимулирует иммунитет, запуская иммунопатологические механизмы воспаления. Изменения иммунитета при ИЭ проявляются гипофункцией Т-лимфоцитов, гиперфункцией В-лимфоцитов, поликлоновой продукцией аутоантител. Нарушаются механизмы активации комплемента, образуются циркулирующие иммунные комплексы. В современных исследованиях подтверждается значительная патогенетическая роль увеличения концентрации ЦИК с отложением в органах-мишенях. Несомненного внимания заслуживает увеличение концентрации интерлейкинов 1, 6, 8 и фактора некроза опухоли, провоспалительная активность которых наряду с индукцией острофазового ответа, участвует в развитии системных проявлений ИЭ.
Тромбоэмболии способствуют генерализации инфекционного процесса, формированию инфарктов, некроза органов. У 52-67 % больных ИЭ с преимущественным поражением правых камер сердца развивается тромбоэмболия лёгочной артерии. Обструкция сосуда сопровождается гуморальными нарушениями, возникающими в результате выброса биологически активных веществ из агрегатов тромбоцитов в тромбе (тромбоксан, гистамин, серотонин).
При ТЭЛА образуются “мёртвые” пространства в лёгких (несколько сегментов или доля), не перфузируемые смешанной венозной кровью. Значительно возрастает шунтирование смешанной венозной крови в лёгких. Снижение градиента напряжения углекислого газа между смешанной венозной и артериальной кровью, повышение концентрации углекислого газа в артериальной крови вызывает артериальную гипоксемию.
Увеличение общего сосудистого лёгочного сопротивления кровотоку — один из основных механизмов формирования артериальной лёгочной гипертензии у больных ИЭ. Изменения гемодинамики и реологии крови вызывают неадекватную перфузию сосудистых зон, расстройство газообмена. Снижение доставки кислорода к лёгочной ткани, накопление тканевых метаболитов и токсичных продуктов анаэробных процессов являются причиной развития инфаркта лёгкого.
В развитии хронической СН у больных ИЭ выделяют несколько патогенетических механизмов: формирование недостаточности клапана (ов), септическое поражение миокарда, перикарда, изменения гемодинамики, нарушение ритма, проводимости, задержка жидкости, связанная с нарушением функции почек. Важным звеном патогенеза СН является увеличение постнагрузки при длительном повышении периферического сосудистого сопротивления. Вазоконстрикция обусловливает поддержание системного артериального давления, оптимизирует сниженный сердечный выброс.
Недостаточность МК вызывает дилатацию, гипертрофию левых отделов сердца повышение давления в сосудах малого круга кровообращения декомпенсацию по левожелудочковому типу гипертрофию правого желудочка сердечную недостаточность по большому кругу. Повреждение аортального клапана способствует развитию диастолической перегрузки левого желудочка гипертрофии, дилатации левого желудочка относительной недостаточности МК (“митрализация порока”) гипертрофии, дилатации левого предсердия застою крови в малом круге кровообращения, декомпенсации по левожелудочковому типу гипертрофии, дилатации правых отделов сердца правожелудочковой СН. Выраженная недостаточность трёхстворчатого клапана вызывает дилатацию, гипертрофию правого предсердия дилатацию, гипертрофию правого желудочка вследствие поступления в его полость увеличенного объёма крови из правого предсердия венозный застой в большом круге кровообращения.
При ИЭ изменяются микроциркуляция, реологические свойства крови. Происходит внутрисосудистое свёртывание крови, которое в своём развитии проходит четыре стадии. Первая стадия гиперкоагуляции и компенсаторного гиперфибринолиза начинается в поражённом органе, из клеток высвобождаются коагуляционно-активные вещества, активация коагуляции распространяется на кровь. Вторая стадия нарастающей коагулопатии потребления и непостоянной фибринолитической активности характеризуется уменьшением числа тромбоцитов, концентрации фибриногена в крови. Третья стадия дефибриногенации и тотального, но не постоянного фибринолиза (дефибриногенационно-фибринолитическая), соответствует полному ДВС-синдрому. Четвёртая — стадия остаточных тромбозов и окклюзий.
Причинами нарушения микроциркуляции являются микротромбозы, ремоделирование микрососудов. Изменение геометрии сосудов начинается как адаптивный процесс при нарушении гемодинамики, повышении активности тканевых, гуморальных факторов. В последующем ремоделирование сосудов способствует прогрессированию расстройств кровообращения. Изменения микроциркуляции обусловлены повышенной агрегацией тромбоцитов, эритроцитов. При левожелудочковой СН на фоне периваскулярного отёка происходит агрегация эритроцитов, локальный эритростаз, фрагментация кровотока.
Особая роль отводится повышенной активности плазменного гемостаза. Значение гиперфибриногенемии, как самостоятельного фактора снижения реологических свойств крови и прогрессирования ИЭ, обосновано в клинико-экспериментальных исследованиях. Важное значение в нарушении микрогемодинамики имеет образование микротромбов. Гемореологические изменения вызывают снижение перфузионных свойств крови, усиливают расстройства гемодинамики на периферии. Нарастает тканевая гипоксия, активизируется аэробный метаболизм. Гипоксия тканей при хронической СН снижает сократительную способность миокарда, увеличивает пред- и постнагрузку.
В течении ИЭ различают несколько патогенетических фаз: инфекционно-токсическую (септическую), иммуновоспалительную, дистрофическую. Первая фаза характеризуется транзиторной бактериемией с адгезией патогенных бактерий на эндотелий, формированием микробнотромботических вегетаций. Вторая фаза проявляется полиорганной патологией (эндоваскулит, миокардит, перикардит, гепатит, нефрит, диффузный гломерулонефрит).
Под воздействием эндогенных токсинов происходит декомпенсация органов и систем, нарушается метаболизм, происходит дезинтеграция организма как биологического целого. Во время дистрофической фазы формируются тяжёлые, необратимые изменения внутренних органов.
Указанные патогенетические фазы типичны для всех клинико-морфологических форм и вариантов течения болезни. Тем не менее, патогенез вторичного ИЭ имеет некоторые особенности. Врождённый порок сердца увеличивает функциональную нагрузку на сердечно-сосудистую систему и клапаны, повреждается эндотелий. Функция органов, богатых ретикулоэндотелиальной тканью, подвержена угнетению. Снижается неспецифическая резистентность организма. Преходящая бактериемия вызывает образование первичного инфекционного очага.
На фоне снижения общей резистентности формируется хронический воспалительный процесс. Развивается сенсибилизация организма бактериальными антигенами. Миокард повреждается кардиальными антителами. Во время бактериемии из очагов хронической инфекции происходит адгезия бактерий на изменённых клапанах. Формируется вторичный септический очаг в сердце, являющийся основой для развития вторичного ИЭ.
Инфекционный эндокардит с поражением правых камер сердца развивается после повреждения ТК подключичным катетером, при зондировании сердца, продолжительном стоянии катетера Swan-Ganz, выполнении частых внутривенных инъекций. Широкое применение катетеризации сосудов с целью интенсивной инфузионной терапии увеличивает количество случаев тромбофлебита, тромбоза, инфицирования с последующим развитием сепсиса.
Следует отметить, что 30 % катетеров подключичной вены достигают полости правого предсердия сердца и травмирует створки ТК. Установка эндокардиальных электродов для электрокардиостимуляции в ряде случаев является причиной инфекционного поражения ТК. Причиной развития ИЭ в правых камерах сердца могут быть пули, осколки других огнестрельных снарядов, длительно находящиеся в сердце.
Вторичный ИЭ с поражением правых камер сердца чаще развивается при дефекте межжелудочковой перегородки, открытом артериальном протоке (22%). Развитие ИЭ обусловлено повреждением эндокарда регургитирующим потоком крови. При высоких небольших дефектах межжелудочковой перегородки тонкая струя крови травмирует септальную створку ТК. В случае открытого артериального протока травмируется эндокардиальная поверхность лёгочного ствола в области дефекта. Таким образом, в последние десятилетия наиболее частой причиной развития первичного ИЭ является сеспсис, внутривенная наркомания, а вторичного — врождённые пороки сердца.
Для развития ИЭ у наркоманов типично повреждение эндокарда при частых внутривенных инъекциях. Во время инъекций самостоятельно изготовленных наркотических веществ пузырьки воздуха повреждают эндокард трёхстворчатого клапана в 100 % случаев. Травмируется эндокард, возникает его шероховатость. Повреждённые участки служат местом адгезии, агрегации тромбоцитов с последующим формированием тромбов. Нарушение асептики способствует развитию бактериемии, инфицированию повреждённых участков эндокарда золотистым стафилококком (70-80 %). Причина его тропности к эндокарду ТК у наркоманов не совсем ясна.
Изменения иммунитета, неспецифической резистентности являются ключевыми механизмами патогенеза этой формы болезани. По данным исследования иммунного статуса у больных ИЭ с поражением правых камер сердца выявлено уменьшение Т-хелперов, увеличение Т-супрессоров, снижение активности натуральных киллеров. Эти изменения вызваны угнетением реактивности иммунной системы вследствие истощения функциональных резервов. Зарегистрировано увеличение концентрации ФНО — цитокина, играющего ключевую роль в развитии иммунно-воспалительных реакций организма.
Среди многочисленных эффектов ФНО обращает на себя внимание его действие на коллаген клапанов 1, 3, 4-го типов, составляющий 50-70 % его массы. Фактор некроза опухоли ингибирует транскрипцию гена коллагена, тем самым, снижая синтез последнего фибробластами. Кроме того, ФНО стимулирует продукцию коллагеназы, которая участвует в деградации коллагена клапанов. Денатурированные фрагменты коллагена индуцируют продукцию воспалительных медиаторов макрофагами, индуцируют и поддерживают воспалительный процесс.
Число наркоманов и пациентов, у которых длительно используются катетеры сосудов велико. Однако, не у всех развивается ИЭ. В этой связи изучены генетические аспекты предрасположенности. По данным исследования HLA-фенотипа (по антигенам локусов А, В) наиболее вероятными маркерами генетической предрасположенности к ИЭ с поражением правых камер сердца являются антиген системы HLA В35, гаплотип А2-В35.
Структурной основой изменения реактивности иммунной системы у больных являются нарушения пространственной организации комплекса: Т-клеточный рецептор — иммуногенный пептид — белок главного комплекса гистосовместимости. В развитии заболевания имеет значение сочетание генетической детерминированности дефекта иммунной системы с модификацией антигенов гистосовместимости инфекционными агентами, химическими веществами (наркотики, антибиотики) и другими факторами.
Развитие ИЭ протеза клапана обусловлено многими причинами: травматизацией эндокарда во время операции, бактериемией, снижением резистентности организма, изменением иммунитета. При протезировании искусственных клапанов происходит инфицирование, которое определяется физическими свойствами, химическим составом имплантируемого клапана, адгезией бактерий на шовном материале. Повышенная адгезия стафилококков на внутрисердечных швах определяет состав возбудителей раннего ИЭПК (staphylococcus epidermidis, staphylococcus aureus).
В 50 % случаев раннего ИЭПК источником бактериемии является послеоперационная рана. В патогенезе позднего ИЭПК ключевое значение имеет транзиторная бактериемия, возникающая при интеркуррентных инфекциях (36%), стоматологических манипуляциях (24 %), операциях (12 %), урологических исследованиях (8 %). Дополнительными источниками инфекции являются артериальные системы, внутривенные, уретральные катетеры, сердечные заплаты, эндотрахеальные трубки.
Инфекция начинается с абактериальных тромботических наложений, которые затем инфицируются при транзиторной бактериемии. Большие гемодинамические нагрузки являются причиной развития ИЭ искусственного клапана, находящегося в митральной позиции. Воспаление начинается с манжеты протеза, фиброзного кольца. Далее образуются аннулярные, кольцевые абсцессы, формируются парапротезные фистулы, происходит отрыв протеза.
Таким образом, развитие инфекционного эндокардита обусловлено иммунодефицитом, первичным или вторичным повреждением эндокарда, приходящей бактериемией. Дальнейшее течение болезни опосредовано комплексом патогенетических механизмов, которые формируются в результате системного поражения сосудов, множественных тромбоэмболий, иммунокомплексных реакций, изменения центральной и внутрисердечной гемодинамики, нарушения свёртывающей системы крови.
Симптомы Эндокардита инфекционного:
КЛАССИФИКАЦИЯ
В международной классификации болезней 10-го пересмотра (1995) выделяют:
133.0. Острый и подострый инфекционный эндокардит:
- бактериальный,
- инфекционный без детального уточнения,
- медленно текущий,
- злокачественный,
- септический,
- язвенный.
Для обозначения инфекционного агента используют дополнительный код (В 95-96) перечня бактериальных и других инфекционных агентов. Эти рубрики не используются при первичном кодировании заболевания. Они предназначены для использования в качестве дополнительных кодов, когда целесообразно идентифицировать возбудителя болезней, классифицированных в иных рубриках.
- В 95. Стрептококки и стафилококки как причина болезней, классифицированных в других рубриках:
- В 95.0. Стрептококки группы А как причина болезней, классифицированных в других рубриках.
- В 95.1. Стрептококки группы В как причина болезней, классифицированных в других рубриках.
- В 95.2. Стрептококки группы D как причина болезней, классифицированных в других рубриках.
- В 95.3. Streptococcus pneumoniae как причина болезней, классифицированных в других рубриках.
- В 95.4. Другие стрептококки как причина болезней, классифицированных в других рубриках.
- В 95.5. Неуточненные стрептококки как причина болезней, классифицированных в других рубриках.
- В 95.6. Staphylococcus aureus как причина болезней, классифицированных в других рубриках.
- В 95.7. Другие стафилококки как причина болезней, классифицированных в других рубриках.
- В 95.8. Неуточненные стафилококки как причина болезней, классифицированных в других рубриках.
- В 96. Другие бактериальные агенты как причина болезней, классифицированных в других рубриках:
- В 96.0. Mycoplasma pneumoniae как причина болезней, классифицированных в других рубриках Pleura-pneumonia-like-organism.
- В 96.1. K l ebsiella pneumoniae как причина болезней, классифицированных в других рубриках.
- В 96.2. ; Escherichi ; coli ;как причина болезней, классифицированных в других рубриках.
- В 96.3. Haemophilus influenzae как причина болезней, классифицированных в других рубриках.
- В 96.4. Proteus (mirabilis, morganii) как причина болезней, классифицированных в других рубриках.
- В 96.5. Pseudomonas (aeruginosa, mallei, pseudomallei) как причина болезней, классифицированных в других рубриках.
- В 96.6. ; Bacillus ; fragilis ;как причина болезней, классифицированных в других рубриках.
- Б 96.7. Clostridium perfringens как причина болезней, классифицированных в других рубриках.
- В 96.8. Другие уточненные бактериальные агенты как причина болезней, классифицированных в других рубриках.
В классификации В.П. Тюрина (2001) приведены определения острого, подострого, хронического рецидивирующего (затяжного) вариантов ИЭ по этиологическим и временным критериям. В основу характеристики острого и подострого течения положена высокая активность инфекционно-воспалительного процесса, выраженность клинической картины, степень вирулентности микроорганизмов. Разработаны критерии выздоровления, рецедива, повтороного ИЭ.
Острый (септический) ИЭ — воспалительное поражение эндокарда длительностью до 2-х месяцев, вызванное высоковирулентными микроорганизмами, протекающее с выраженными инфекционно-токсическими (септическими) проявлениями, частым формированием гнойных метастазов в различные органы и ткани, преимущественно без иммунных проявлений, которые не успевают развиться из-за скоротечности болезни. Острый ИЭ — осложнение сепсиса.
Подострый ИЭ — особая форма сепсиса продолжительностью более 2-х месяцев, обусловленная наличием внутрисердечного инфекционного очага, который вызывает рецидивирующую септицемию, эмболии, нарастающие изменения в иммунной системе, приводящие к развитию нефрита, васкулита, синовита, полисерозита. Этот вариант заболевания возникает при маловирулентном возбудителе (энтерококке, эпидермальном стафилококке, гемофилюсе), определённых соотношениях патогенности возбудителя и реактивности организма, а также при недостаточно эффективной антибактериальной терапии.
Затяжной (хронический рецидивирующий) ИЭ является этиологическим вариантом подострого эндокардита. Его вызывают зеленящий стрептококк или близкие к нему штаммы стрептококка. Характеризуется пролонгированным течением (более 6 месяцев), отсутствием гнойных метастазов, преобладанием иммунопатологических проявлений, обусловленных поражением ЦИК.
Выздоровевшим следует считать пациента через один год после завершения лечения по поводу ИЭ, если в течение этого срока сохранялись нормальная температура тела, СОЭ, не выделялся возбудитель из крови. Рецидивы болезни классифицируют на ранние (в течение 2-3-х месяцев после лечения) и поздние (от 3-х до 12-х месяцев). Повторным ИЭ считается развитие заболевания через один год и более после завершения лечения или выделение из крови другого возбудителя в срок до одного года.
Особыми формами ИЭ являются: ИЭ протеза клапана, ИЭ у наркоманов, ИЭ у пациентов с имплантированным электрокардиостимулятором, ИЭ у пациентов с трансплантированным целым органом, ИЭ у пациентов, находящихся на программном гемодиализе, нозокомиальный ИЭ, ИЭ у людей пожилого и старческого возраста.
Современное клиническое течение ИЭ характеризуется: преобладанием острых форм эндокардита; возрастанием числа атипичных вариантов течения заболевания со стертой клинической симптоматикой; преобладанием иммунопатологических проявлений (васкулит, миокардит, гломерулонефрит), иногда выступающих на первый план в клинической картине заболевания. Большинство исследователей отрицают существование особой хронической (затяжной, рецидивирующей) формы инфекционного эндокардита, поскольку рецидивы заболевания — это лишь результат неадекватного лечения больных подострым ИЭ.
Клиническая картина ИЭ отличается большим многообразием симптомов. Помимо типичных клинических проявлений, эндокардит может протекать атипично, под маской других заболеваний, обусловленных иммунопатологическим поражением органов или тромбоэмболическими осложнениями: гломерулонефрита, инфаркта почки, геморрагического васкулита, стенокардии или ИМ, инфаркта легкого, острого нарушения мозгового кровообращения, миокардита, сердечной недостаточности. Лихорадка и интоксикация — это наиболее ранние и постоянные симптомы инфекционного эндокардита, которые наблюдается почти у всех больных. Характер повышения температуры тела может быть самым разнообразным. При подостром эндокардите болезнь чаще начинается как бы исподволь, с субфебрильной температуры, недомогания, головных болей, общей слабости, быстрой утомляемости, снижения аппетита, похудания. Субфебрильная температура сопровождается познабливанием и потливостью.
В этот период кардиальные жалобы отсутствуют, за исключением стойкой синусовой тахикардии, которую часто неверно связывают с повышенной температурой тела. Сама лихорадка и сопутствующие ей симптомы интоксикации нередко расцениваются как проявление туберкулезной интоксикации, хронического тонзиллита, хронического бронхита, вирусной инфекции. Через несколько недель (до 4-8 недель) формируется более или менее типичная клиническая картина. Устанавливается неправильная лихорадка ремиттирующего типа (реже гектическая или постоянная). Температура тела повышается обычно до 38-390С и сопровождается выраженными ознобами. Иногда подъемы температуры сменяются короткими периодами ее снижения до субфебрильных или нормальных цифр.
Выделяется обильный липкий пот с неприятным запахом. Кардиальные симптомы обычно появляются позже, при формировании аортального или митрального порока сердца или/и развития миокардита. На фоне нарастающей интоксикации и повышения температуры тела могут появляться и постепенно прогрессировать следующие симптомы: одышка при небольшой физической нагрузке или в покое; боли в области сердца, чаще длительные, умеренной интенсивности; в более редких случаях боли приобретают острый характер и напоминают приступ стенокардии; стойкая синусовая тахикардия, не зависящая от степени повышения температуры тела. Позже может появляться развернутая клиническая картина левожелудочковой недостаточности.
Инфекционный эндокардит, являющийся полиорганным заболеванием, может манифестировать симптомами, обусловленными поражением не только сердца, но и других органов и систем. В связи с этим на первый план могут выступать следующие симптомы: отеки под глазами, кровь в моче, головные боли, боли в поясничной области, нарушения мочеиспускания (симптомы гломерулонефрита или инфаркта почки); интенсивные головные боли, головокружения, тошнота, рвота, общемозговые и очаговые неврологические симптомы (цереброваскулит или тромбоэмболия мозговых сосудов с развитием ишемического инсульта); резкие боли в левом подреберье (инфаркт селезенки); высыпания на коже по типу геморрагического васкулита; клинические проявления инфарктной пневмонии; внезапная потеря зрения; боли в суставах.
Полиморфизм клинической картины ИЭ определяется полиорганным поражением. Для современного течения заболевания свойственно развитие множества осложнений, которые формируют ведущую органную патологию. Частыми осложнениями ИЭ являются: со стороны сердца — миокардит, перикардит, абсцессы, нарушение ритма и проводимости; почек — инфаркт, диффузный гломерулонефрит, очаговый нефрит, нефротический синдром, острая почечная недостаточность; лёгких — ТЭЛА, инфаркт-пневмония, плеврит, абсцесс, лёгочная гипертензия; печени — гепатит, абсцесс, цирроз; селезёнки — спленомегалия, инфаркт, абсцесс; нервной системы — острое нарушение мозгового кровообращения, менингит, менингоэнцефалит, абсцессы головного мозга; сосудов — васкулит, эмболии, аневризмы, тромбозы. Фатальными осложнениями инфекционного эндокардита являются: септический шок, респираторный дистресс-синдром, полиорганная недостаточность, острая сердечная недостаточность, эмболии в головной мозг, сердце.
В сравнении с серединой 20-го столетия, в последние десятилетия увеличилось количество ТЭО. По-видимому, это обусловлено значительным ростом первичных форм септического эндокардита (до 50-75%). Если ранее ТЭО наблюдали у 25-31 % больных, то в настоящее время — у 75-85%. Эмболии и инфаркты внутренних органов определяются у 35 % больных, множественные эмболические осложнения у — 38 %.
Структура ТЭО при современном течении ИЭ следующая: инфаркт селезёнки — 41 % случаев, эмболии головного мозга — 35 %, эмболии в конечности — 25 %, эмболии в коронарные артерии — 15,5 %, инфаркты лёгких — 8,5 %, эмболии в артерии сетчатки — 2,8 %. В 2-8,5 % случаев ИЭ развиваются эмбологенные инфаркты миокарда, которые в 50-60-е годы выявлялись в 0,8-1 %. Их происхождение обусловлено попаданием в венечные артерии тромботических частиц из МВ и обызвествлённых наложений клапанов.
В последние десятилетия ТЭО церебральных артерий стали наблюдаться значительно чаще (22 %), чем в 50-60-е годы (8-11 %). В 80-90-е годы частота выявления церебральных осложнений у больных ИЭ составила 6,7-41 %, среди них чаще встречались инфаркты головного мозга (24-64,6 %), внутримозговые гематомы (5,6-32 %), интракраниальные микотические аневризмы (17-24 %), менингиты (1-14 %), абсцессы (2,8 %), субарахноидальные кровоизлияния и артерииты (4-7,6 %). Смертность больных ИЭ с церебральными осложнениями достигает 39-74 %.
На развитие ТЭО оказывают влияние вид бактерий, локализация инфекционного очага на клапанах сердца, размер, форма, степень подвижности МВ. Эмболические осложнения чаще диагностируют при стафилококковом (65 %), несколько реже при стрептококковом (34,8 %), энтерококковом ИЭ (33 %). В сравнении с серединой 20-го столетия увеличилось количество инфарктов и абсцессов селезёнки. На современном этапе их удельный вес в патологии селезёнки составляет 12-46 % и 6 % соответственно. Чаще развиваются ишемические (55 %), реже — геморрагические (45 %) инфаркты селезёнки, эмболии артерий почек развиваются у 9-17 % больных. Значительно увеличилось количество эмболий лёгочной артерии, которые выявляют в 44-56 % случаев ИЭ у наркоманов. Как правило, это множественные лёгочные эмболии c клиникой ТЭЛА, осложняющиеся в 12-27 % инфаркт-пневмониями и абсцессами лёгких. Лёгочно-плевральные осложнения развиваются у 75 % больных ИЭ.
В настоящее время гломерулонефрит, являющийся одним из иммунных осложнений ИЭ, встречается реже (40-56 %). Это осложнение диагностируется клинически у 8-32 % больных. Значительно чаще патология почек проявляется умеренным мочевым синдромом (до 67-78 %). Нефротический синдром и острая почечная недостаточность развиваются редко. Спленомегалия регистрируется в 21-67,5 % случаев. Миокардит при современном течении ПИЭ диагностируется клиницистами у 23-54 % больных, а патологоанатомами — у 86 %.
Распространение новых клинических форм болезни (ИЭ протеза клапана, ИЭ у наркоманов) вызвано увеличением числа кардиохирургических операций, эпидемией внутривенной наркомании, иммунодефицитом. Заболеваемость ИЭ у наркоманов составляет 2-6 % в год, что значительно превышает частоту встречаемости ИЭ в общей популяции. Эта группа больных ИЭ характеризуется преимущественным поражением ТК, клапана лёгочной артерии, эндокарда правых предсердия и желудочка.
Выделение в особую форму ИЭ у наркоманов вызвано рядом особенностей: атипичностью клинической картины, поражением лёгких в результате ТЭЛА, выраженностью септических проявлений, ранним развитием сепсиса и полиорганной недостаточности, резистентностью к АБТ.
Наиболее частым возбудителем ИЭ правых камер сердца является золотистый стафилококк, при котором резистентность к АБ возникает у 90 % больных в течение 1-2-х недель. Многие авторы считают золотистый стафилококк специфическим возбудителем ИЭ у наркоманов. Важность акцентирования внимания на этиологическом факторе обусловлена высокой смертностью в этой группе больных — 70-80 %.
Причинами развития ИЭ с преимущественным поражением правых камер сердца могут быть длительные катетеризации вен, внутрисердечные диагностические и лечебные манипуляции (зондирование сердца, длительное использование катетера Svan-Ganz и т.д.). Чаще инфицируются гемодиализные шунты (57-61 %), внутривенные катетеры (21 %) и катетеры Svan-Ganz (18 %), реже — катетеры подключичной и ярёмной вен (10 %), лёгочной артерии (8-8,5 %).
Клиническое течение ИЭ правых камер сердца весьма неспецифично, что обусловливает частые ошибки и трудности в диагностике. Наиболее типично начало заболевания с развития множественных лёгочных инфекционных очагов. Весьма характерна манифестация с “лихорадки неясного генеза”, которая является характерным симптомом и встречается у 90-95 % больных. Появление озноба сопровождается обильным потоотделением без улучшения самочувствия больных. Приблизительно у одной трети пациентов наблюдаются петехии и геморрагическая сыпь. Изменения центральной гемодинамики при разрушении ТК менее выражены, чем при поражении митрального и аортального клапанов, поэтому СН III-IV ФК развивается на поздних стадиях заболевания. Тромбоэмболии лёгочной артерии часто осложняются инфаркт-пневмониями, абсцессами лёгких и двусторонним пневмотораксом.
После хирургического лечения врождённых и приобретенных пороков сердца развивается ИЭПК (11-18 %). Термин ИЭПК характеризует генерализованную реакцию организма и подразумевает воспалительные изменения в эндокарде. Эта форма ИЭ является вариантом ангиогенного сепсиса с первичным очагом в протезе клапана. Риск развития ИЭ в течение первого года после имплантации искусственного клапана составляет 2-4 %, значительно увеличивается у пациентов пожилого возраста. Летальность при этой форме ИЭ составляет 23-80 %.
Частота возникновения ИЭ значительно выше при протезировании АК, что обусловлено продолжительностью операции, большими гемодинамическими нагрузками и турбулентным кровотоком на искусственном клапане. По времени возникновения различают ранний (в течение 60 дней после операции) и поздний (позднее 60 дней) ИЭПК. Деление на ранний и поздний ИЭ вызвано особенностями микробиологических, клинических и диагностических данных, течением и прогнозом заболевания.
За последние 20-30 лет этиология ИЭПК существенно изменилась. Основными возбудителями рассматриваемой формы ИЭ являются эпидермальный и золотистый стафилококк. Всё большее значение приобретает условно-патогенная микрофлора, грамотрицательные аэробы, стрептококки, грибы. Их видовой состав сходен с ИЭ нативных клапанов. Однако количество положительных гемокультур выше: грамотрицательная микрофлора — 20 %, грибы — 10-12 %, стрептококки — 5-10 %, дифтероиды — 8-10 %, другие бактерии — 5-10%.
Смертность при ИЭПК, вызванном staph. aureus составляет 86-90 %, а при ИЭ, вызванном staph. epidermidis — 52-60 %. Инфекционный эндокардит протеза клапана, вызванный грамотрицательными бактериями, встречается в 2-4,6 % случаев. Грамотрицательные аэробы выделяются в 20 % случаев раннего и в 10 % случаев позднего ИЭПК. Спектр грамотрицательных бактерий довольно широк: Hemophilus species, Ech. coli, Klehsiella species, Proteus species, Pseudomoncis species, Serratia, Alcaligenes feacalis, Eikenella corrodens.
Инфицирование во многом определяется физическими свойствами и химическим составом имплантируемого клапана, способностью бактерий к адгезии на шовном материале. Инфицирование может начинаться с абактериальных тромботических наложений при транзиторной бактериемии. За счёт адгезии стафилококков на внутрисердечных швах развивается ранний послеоперационный ИЭПК. Дополнительными периоперационными источниками инфекции являются артериальные системы, внутривенные и уретральные катетеры, сердечные заплаты, эндотрахеальные трубки. При имплантации протеза миокард становится более восприимчивым к инфекции. Воспаление начинается с манжеты искусственного клапана и локализуется в фиброзном кольце.
Далее образуются аннулярные и (или) кольцевые абсцессы, которые вызывают формирование парапротезных фистул, отрыв протеза. Такому осложнению чаще подвержена аортальная позиция. Для этой локализации свойственно распространение абсцесса фиброзного кольца на миокард, вовлечение в патологический процесс проводящих путей сердца. Наибольшая частота ИЭ биопротезного клапана наблюдается в митральной позиции, которая значительно труднее поддаётся консервативному и оперативному лечению. В 13-40 % случаев ИЭПК образуются тромбы на протезе, являющиеся источниками ТЭО.
Частым симптомом ИЭПК является лихорадка, которая встречается у 95-97% больных. Сердечная недостаточность, обусловленная инфекционно-токсическим миокардитом и параклапанными фистулами, формируется у подавляющего большинства больных при раннем и только у трети пациентов — при позднем ИЭПК. Септический шок встречается у 33 % больных с ранним и у 10 % — с поздним ИЭПК. Нарушения атриовентрикулярной проводимости регистрируются на ЭКГ в 15-20 % случаев раннего и в 5-10 % позднего ИЭПК. Спленомегалию отмечают у 26 % пациентов с ранним и у 44 % — с поздним ИЭПК. Частота развития ТЭО составляет 10-32 %. Наиболее характерны ТЭО для течения ИЭПК, вызванного грибами. При раннем ИЭПК частота ТЭО составляет 10-11 %, при позднем — 23-28 %.
Клиническое течение ИЭПК зависит от многих факторов: вида возбудителя, возраста больного, эффективности антибактериальной терапии. При высоковирулентном возбудителе (золотистый стафилококк, грамотрицательная микрофлора) преобладает острое течение с развитием острой сердечной и полиорганной недостаточности, ТЭО. При маловирулентном возбудителе разворачивается классическая картина ”sepsis lentа”, что более характерно для позднего ИЭПК.
По сравнению с серединой 20-го столетия основными возбудителями стали золотистый и эпидермальный стафилококки. В структуре возбудителей вырос удельный вес грамотрицательных, анаэробных бактерий и грибов, которые в большинстве случаев резистентны к антибактериальной терапии. Это способствовало увеличению количества первичного острого ИЭ с развитием множественных тромбоэмболических осложнений.
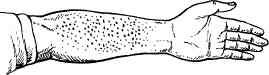
При классическом течении ИЭ общий осмотр позволяет выявить многочисленные неспецифические симптомы: бледность кожных покровов с серовато-желтым оттенком (цвет «кофе с молоком») объясняется характерной для эндокардита анемией, а желтушный оттенок кожи — вовлечением в патологический процесс печени и гемолизом эритроцитов; похудание развивается очень быстро, в течение нескольких недель; изменения концевых фаланг пальцев в виде «барабанных палочек» и ногтей по типу «часовых стекол», выявляющиеся при длительном течении заболевания (около 2-3 месяцев); периферические симптомы, обусловленные васкулитом или эмболией. Петехиальные геморрагические высыпания на коже передней верхней поверхности грудной клетки и на ногах, небольших размеров, не бледнеют при надавливании, безболезненны при пальпации). Со временем петехии приобретают коричневый оттенок и исчезают. Иногда петехиальные геморрагии локализуются на переходной складке конъюнктивы нижнего века — пятна Лукина или на слизистых оболочках полости рта. В центре мелких кровоизлияний в коньюнктиву и слизистые оболочки имеется характерная зона побледнения. Пятна Рота — аналогичные пятнам Лукина мелкие кровоизлияния в сетчатку глаза, в центре также имеющие зону побледнения, которые выявляются при специальном исследовании глазного дна.
Линейные геморрагии под ногтями (Узелки Ослера) — это болезненные красноватые напряженные образования размером с горошину, располагающиеся в коже и подкожной клетчатке на ладонях, пальцах, подошвах. Узелки Ослера представляют собой небольшие воспалительные инфильтраты, обусловленные тромбоваскулитом или эмболией в мелкие сосуды. Появившись в коже или подкожной клетчатке, они достаточно быстро исчезают. Положительная проба Румпеля-Лееде-Кончаловского, которая свидетельствует о повышенной ломкости микрососудов, что нередко может быть связано с вторичным повреждением сосудистой стенки при васкулитах и/или тромбоцитопатии (снижении функции кровяных пластинок).
Проба проводится следующим образом: манжета для измерения АД накладывается на плечо, в ней создается постоянное давление, равное 100 мм рт. ст. Через 5 минут оценивают результаты пробы. При отсутствии нарушений сосудисто-тромбоцитарного гемостаза ниже манжеты появляется лишь небольшое количество петехиальных (мелкоточечных) кровоизлияний (менее 10 петехий в зоне, ограниченной окружностью диаметром 5 см). При повышении проницаемости сосудов или тромбоцитопении число петехий в этой зоне превышает 10 (положительная проба). Признаки сердечной недостаточности, развивающейся вследствие формирования аортальной, митральной или трикуспидальной недостаточности и миокардита: положение ортопноэ, цианоз, влажные застойные хрипы в легких, отеки на ногах, набухание шейных вен, гепатомегалия. ;
Другие внешние проявления болезни, обусловленные иммунным поражением внутренних органов, тромбоэмболиями, а также развитием септических очагов во внутренних органах: нарушения сознания, параличи, парезы и другие общемозговые и очаговые неврологические симптомы, являющиеся признаками церебральных осложнений (инфаркта мозга, развивающегося вследствие тромбоэмболии мозговых сосудов, внутримозговых гематом, абсцесса мозга, менингита); признаки тромбоэмболии легочной артерии (ТЭЛА), нередко выявляющиеся при поражении трикуспидального клапана (особенно часто у наркоманов) — одышка, удушье, боль за грудиной, цианоз; ризнаки тромбоэмболии и септического поражения селезенки — спленомегалия, болезненность в левом подреберье; объективные признаки острого асимметричного артрита мелких суставов кистей рук, стоп.
Пальпация, перкуссия сердца
Ведущими в клинической картине инфекционного эндокардита, наряду с лихорадкой и симптомами интоксикации, являются сердечные проявления заболевания, обусловленные формированием порока сердца, миокардитом и (иногда) поражением коронарных сосудов (эмболии, васкулит). При остром течении инфекционного эндокардита, внезапном разрыве сухожильных нитей митрального или трикуспидального клапанов развивается острая левожелудочковая или правожелудочковая недостаточность. Чаще наблюдается поражение аортального клапана (у 55-65% больных), реже встречается недостаточность митрального клапана (у 15-40% больных). Комбинированное поражение аортального и митрального клапанов выявляется в 13% случаев. Изолированная недостаточность трехстворчатого клапана в целом встречается не столь часто (в 1-5% случаев), хотя у наркоманов преобладает именно эта локализация поражения (у 45-50% больных).
Данные пальпации и перкуссии сердца определяются локализацией инфекционного поражения (аортальный, митральный, трикуспидальный клапаны), а также наличием сопутствующей патологии, на фоне которой развился инфекционный эндокардит. В большинстве случаев наблюдаются признаки расширения ЛЖ и его гипертрофии: смещение влево верхушечного толчка и левой границы относительной тупости сердца, разлитой и усиленный верхушечный толчок.
Аускультация сердца
Аускультативные признаки формирующегося порока сердца обычно начинают проявляться через 2-3 месяца лихорадочного периода. При поражении аортального клапана постепенно начинают ослабевать I и II тоны сердца. Во II межреберье справа от грудины, а также в точке Боткина появляется тихий диастолический шум, начинающийся сразу за II тоном. Шум имеет характер decrescendo и проводится на верхушку сердца. При поражении митрального клапана происходит постепенное ослабление I тона сердца и появляется грубый систолический шум на верхушке, проводящийся в левую подмышечную область. Поражение трехстворчатого клапана характеризуется появлением систолического шума трикуспидальной недостаточности, максимум которого локализуется в V межреберье слева от грудины. Нередко обнаруживают симптом Риверо-Корвалло.
Артериальный пульс, АД
Важно всегда сопоставлять аускультативные данные с исследованием свойств артериального пульса и изменениями АД. При формировании аортальной недостаточности появление диастолического шума обычно ассоциируется с изменениями пульса по типу pulsus celer, altus et magnus, а также со снижением диастолического АД и тенденцией к увеличению систолического АД. При митральной недостаточности имеется слабо выраженная тенденция к уменьшению систолического и пульсового АД.
Органы брюшной полости
Спленомегалия — один из частых признаков инфекционного эндокардита, который выявляется в — всех случаев заболевания. Спленомегалия ассоциируется с генерализованной инфекцией, наличием абсцессов и инфарктов селезенки.
СОВРЕМЕННЫЕ ВАРИАНТЫ ТЕЧЕНИЯ
Острый инфекционный эндокардит
Клиническая картина заболевания имеет свои особенности при разных вариантах течения. Клиника ОИЭ характеризуется тяжёлым течением, выраженными клиническими синдромами и симптомами. На первый план выступают проявления высокой активности инфекционного процесса, дополняемые симптомами СН ; III — IV ;ФК, многочисленными осложнениями, гепатоспленомегалией, нарушением центральной гемодинамики. При ОИЭ проявления осложнений самые выраженные, что обусловлено наибольшей активностью сепсиса и выраженностью СН. Частота встречаемости основных симптомов, синдромов, осложнений ОИЭ представлена в таблице 3.
Таблица 3. Симптомы, синдромы, осложнения острого ИЭ
Подострый септический эндокардит
Подострый септический эндокардит (endocarditis septica lenta). Обычно наблюдается в возрасте 20—40 лет, чаще болеют мужчины.
Клиническая картина и течение. Начало заболевания почти всегда малозаметно. Общее состояние больного постепенно ухудшается, отмечается легкая утомляемость, слабость, неприятные ощущения в области сердца; так как большинство этих больных имеет порок сердца, они не предполагают возникновения новой болезни. В редких случаях болезнь проявляется остро: озноб, резкое повышение температуры, сердцебиение, боли в какой-либо части тела. Эти симптомы зависят от внезапно наступивших эмболий при латентно протекавшем эндокардите.
Общие симптомы связаны с токсемией и бактериемией. Утомляемость, слабость, легкая одышка, потеря аппетита, иногда тошнота — самые частые жалобы. Однако нередко обнаруживается эйфория; самочувствие не соответствует общему серьезному состоянию. Лихорадка — наиболее постоянный симптом, хотя (очень редко) может отсутствовать у стариков. Лихорадка вначале бывает незначительной (типа субфебрилитета), в дальнейшем становится высокой, неправильного типа, ремиттирующей или интермиттирующей. Нередко на фоне субфебрильной температуры нерегулярно появляются отдельные высокие температурные! «свечи» (t° до 39°и более), что весьма характерно для подострого септического эндокардита (Ф. Г. Яновский). При значительных колебаниях температуры бывают профузные поты, часто отмечается познабливание и реже выраженные ознобы. Всегда прогрессирует анемия гипохромного типа — следствие усиленного гемолиза и плохой регенерации красного ростка. Кожа больного бледная, с желтоватым оттенком, бледность может быть мало заметна при значительном цианозе; слизистые оболочки также бледны.
В большинстве случаев имеются признаки приобретенного или врожденного порока сердца, предшествовавшего эндокардиту. Соответственно этому прослушиваются эндокардиальные шумы.
С возникновением эндокардита они изменяются: присоединяются функциональные шумы вследствие вторичного расширения сердца и анемии и прибавляются новые органические шумы вследствие воспалительных вегетаций на клапанах или их перфорации. Характерно, что систолический и диастолический шумы при септическом эндокардите изменчивы, т. е. в течение короткого периода то усиливаются, то появляются новые. Внезапное появление музыкального шума бывает при разрыве хорды или клапана. Створки аортального клапана поражаются при эндокардите чаще всего, поэтому обнаруживаются признаки недостаточности клапана аорты.
Размеры сердца увеличиваются вследствие сопутствующего миокардита (М. И. Теодори). Экстрасистолия отмечается нередко. В части случаев можно обнаружить нарушения проводимости (удлинение интервала P—Q до 0,36 сек.), полная блокада очень редка. Мерцательная аритмия бывает реже, чем при митральном стенозе. Подострый эндокардит обычно возникает у людей с хорошо компенсированным пороком сердца, поэтому вначале редко наблюдаются признаки недостаточности сердца, которая развивается только вместе с прогрессирующим поражением клапанов и сопутствующим миокардитом. Шум трения перикарда обнаруживается очень редко, главным образом при уремии, разрыве перикарда.
Эмболия венечной артерии сердца частицами эндокардиальных разращений сопровождается внезапным появлением ангинозных болей и шоком; такая эмболия быстро приводит к смерти, реже развивается инфаркт миокарда.
Одно из самых характерных проявлений подострого септического эндокардита — эмболии в малые или большие сосуды почек, мозга, селезенки, конечностей или желудочно-кишечного тракта с образованием инфарктов этих органов. Эмболии обусловливают обширную симптоматологию внезапно наступающих осложнений болезни: потеря сознания, параличи конечностей при эмболии мозга; внезапная слепота на один глаз — от закупорки сосуда сетчатки; острые боли в левом подреберье — при эмболии и инфаркте селезенки; резкие боли в пояснице и гематурия — при поражении почек и т. п. Несмотря на длительную бактериемию и частые бактериальные эмболии, нигде в организме не образуется вторичный инфекционный очаг или нагноение, что свидетельствует о высокой иммунизации. Существенную роль играет системное поражение сосудов (артериит и капиллярит) как реакция тканей на септическую инфекцию. Почти во всех случаях можно обнаружить небольшие кровоизлияния, в кожу и изолированные петехии. Нередко петехии имеют белый центр и не возвышаются над уровнем кожи, как это бывает при остром септическом эндокардите. Петехии иногда появляются на коже ног: они могут исчезать и снова появляться. Изредка бывают весьма распространенные кожные кровоизлияния; в некоторых случаях при этом наблюдаются тромбопения, удлинение времени кровотечения. Часты кровоизлияния в конъюнктиву (признак Лукина), чаще нижнего века; могут быть кровоизлияния на слизистой оболочке полости рта, особенно мягкого и твердого неба. Диагностическое значение имеет появление на коже пальцев, ладоней или подошв болезненных цианотично-красных узелков величиной с булавочную головку и более — узелков Ослера; через 2—4 дня узелок рассасывается. Могут появиться кровоизлияния под ногтями в виде геморрагических полосок. Точечные кровоизлияния в кожу можно воспроизвести при повышении венозного и капиллярного давления (путем наложения манжетки или жгута) — признак Кончаловского — Румпеля — Лееде, Хрупкость капилляров обнаруживается также при легкой травме кожи (признак «щипка»), В большинстве случаев пальцы имеют вид барабанных палочек. Выраженные боли в суставах бывают очень редко; обычно они нерезкие и неопределенные.
Альбуминурия и гематурия обнаруживаются почти во всех случаях при повторных исследованиях мочи. Кровянистая моча бывает при более или менее значительной эмболии в сосуды почки; чаще встречаются микрогематурия и наряду с ней цилиндрурия. Вместе с развитием очагового нефрита и особенно подострого диффузного гломерулонефрита прогрессирует недостаточность почек, снижается удельный вес мочи, возможна изостенурия, нарастает азотемия; в части случаев наступает уремия, приводящая больных к смерти.
Почти всегда удается обнаружить увеличенную плотную селезенку, иногда она достигает значительной величины. Боли в области левого подреберья и шум трения брюшины бывают при инфаркте селезенки и перисплените.
Очень часто увеличивается печень. Могут наблюдаться симптомы, вызванные эмболией и инфарктом легких, а также застоем в малом круге кровообращения, очаговой пневмонией; плевральный выпот бывает редко.
Эмболии крупных сосудов мозга вызывают параличи, потерю сознания, наступает внезапная смерть. Иногда в результате множественных бактериальных эмболии и артериита развивается картина диффузного менингоэнцефалита (затемнение сознания, сонливость, головокружения, диплопия, мышечные подергивания).
Гипохромная анемия — постоянный признак эндокардита. Иногда количество эритроцитов падает ниже 3 млн.; в случае успешного лечения антибиотиками количество эритроцитов и гемоглобина нарастает. Количество лейкоцитов в норме или слегка повышено; после эмболий и образования инфарктов наступает лейкоцитоз (около 15 000— 25 000 лейкоцитов) со сдвигом нейтрофилов влево. Нередко наблюдается выраженный моноцитоз и появление в крови макрофагов или гистиоцитов (от 10 до 80 мк в диаметре). Появление этих больших клеток или увеличение их числа после разминания мочки уха перед взятием крови (признак Битторфа — Тушинского) диагностически ценно. РОЭ всегда ускорена. Очень часто положительны формоловая и тимоловая реакции. Гамма-глобулиновая фракция белка сыворотки крови повышена. Реакция Вассермана может быть положительной. В 80% случаев из крови высевается возбудитель болезни (из которых почти в 90% случаев зеленящий стрептококк).
Диагноз эндокардита опирается на следующие важнейшие симптомы: лихорадка, положительный посев крови, порок сердца (чаще аортальный), признаки эмболий.
Всякая лихорадка неясного происхождения или длительная при пороке сердца заставляет подозревать эндокардит и тщательно изучать больного, обращая внимание на изменения кожи, селезенки, почек и других органов.
Большое значение для диагностики имеют результаты посевов крови. Кровь лучше брать в момент познабливания больного. У больных с пороками сердца следует дифференцировать подострый эндокардит от рецидива ревматизма или сопровождающихся температурой осложнений (очаговая пневмония и т. п.). Особые трудности возникают при отсутствии сердечных шумов.
В сомнительных случаях необходимо лечение антибиотиками, которое не может повредить больному другим заболеванием.
Прогноз подострого эндокардита до введения в практику лечения антибиотиками был очень плохой; описаны были только единичные случаи выздоровления. Излечение эндокардита наступает в 55% случаев — по данным Кристи (R. Christie), в 71,3% — по Вагнеру (В. Wagner) и даже в 90% по Шаубу (F. Schaub). Однако почти у 1/3 излеченных от эндокардита развивается недостаточность сердца, от которой больные могут погибнуть. Рецидив болезни может наступить в течение первых четырех недель после прекращения лечения. Несмотря на значительные успехи антибиотикотерапии септического эндокардита, летальность все же превышает 20%. Непосредственной причиной смерти чаще всего бывает недостаточность сердца и кровообращения, затем эмболии, разрыв микотической аневризмы мозга, недостаточность почек и уремия, блокада сердца.
Подострый эндокардит, вызванный зеленящим стрептококком или негемолитическим стрептококком, излечивается почти в 90% случаев, а энтерококком или стафилококком — не более чем в 50% случаев. Прогноз эндокардита в пожилом возрасте всегда тяжелее. Исход болезни тем лучше, чем раньше начато лечение.
Лечение. Рациональное лечение септического эндокардита возможно после выяснения (при посевах крови) возбудителя болезни и его чувствительности к антибиотикам (Н. С. Молчанов и др.). В случаях заболеваний, вызванных зеленящим или негемолитическим стрептококком, проводят лечение большими дозами пенициллина в комбинации со стрептомицином: первый курс в течение не менее 6 недель и затем повторные курсы (малые дозы пенициллина способствуют появлению резистентных к пенициллину штаммов). Можно ориентироваться на следующую схему — 4 млн. ЕЙ пенициллина и 2 г стрептомицина pro die в течение двух недель и последующие 2 недели по 3 млн. ЕД пенициллина и 1 г стрептомицина в сутки. В течение первой недели температура становится нормальной; на пятой неделе проводят посев крови и даже при отрицательном результате применяют те же антибиотики еще в течение одной-двух недель. В резистентных случаях увеличивают дозу пенициллина до 10 млн. ЕД и более в сутки. В случаях энтерококковой и стафилококковой инфекции применяют, кроме пенициллина, антибиотики более широкого спектра: тетрациклин (около 4 г) и эритромицин (около 3 г) в сутки внутрь или сигмамицин (тетрациклин + олеандомицин) внутривенно (капельное вливание раствора или инъекции каждые 4 часа; всего 4 г в сутки). В случаях эндокардита невыясненной этиологии — комбинированные антибиотики в больших дозах (террамицин, тетрациклин, эритромицин, олеандомицин). До применения антибиотиков следует проверить возможность аллергической реакции к ним; чаще всего встречается аллергия к пенициллину. Полноценное питание (обильное количество белка и витаминов), препараты железа обязательны для всех больных; в дальнейшем лечение в санатории и тщательное диспансерное наблюдение. Нередко необходим повторный курс антибиотикотерапии. Хирургическое вмешательство показано при инфекции артериовенозной аневризмы (ее резекция), а также инфекции открытого артериального протока (лигатура и перерезка его).
Профилактика. Больные с приобретенными и врожденными пороками сердца нуждаются в диспансерном наблюдении. Лечение очаговой инфекции (инфицированные зубы, миндалины, придаточные полости и т. п.) необходимо для предупреждения эндокардита, как и устранение всего, что может снизить сопротивляемость организма. При всякого рода оперативных вмешательствах, как и при интеркуррентных заболеваниях (например, тонзиллите), показано тщательное лечение антибиотиками. При тонзиллэктомии, экстракции зубов, искусственном аборте и других вмешательствах необходимо за день до операции и непосредственно после нее в течение не менее двух суток вводить пенициллин и стрептомицин (например, около 1,5 млн. ЕД пенициллина и 0,754 стрептомицина pro die) для ликвидации возникающей бактериемии.